PK WIiTCh GR . 23 Zespół nr 8
|
Ćwiczenie: 2 |
Data : 21.03.2000
|
1. Orzeł Krystyna 2. Trelińska Agnieszka 3. Kmieć Radosław 4. Prokurat Michał
|
Temat: Wyznaczanie ciepła parowania cieczy z pomiarów prężności pary metodą izoteniskopowa. |
Ocena: |
Część teoretyczna.
Temperatura wrzenia jest to temperatura, w której prężność pary nad roztworem równa jest ciśnieniu zewnętrznemu.
Pomiaru prężności pary dokonuje się zazwyczaj dwoma metodami:
a) dynamiczną, w której ustala się w aparaturze określone ciśnienie pary nasyconej, a następnie mierzy się temperaturę wrzenia pod tym ciśnieniem;
b) statyczną, w której przy ustalonej temperaturze mierzymy prężność pary nasyconej. Pomiaru dokonujemy dla różnych temperatur. Metodę tą nazywamy też izoteniskopową.
Rys. Schemat aparatury próżniowej do izoteniskopowego pomiaru prężności pary cieczy:
A - manometr rtęciowy, B - zbiornik buforowy, C - izoteniskop, D - naczynko termostatowe,
E - rurka kapilarna, F - mały zbiornik buforowy, G - chłodnica
Opis wykonania ćwiczenia:
Do zbiorniczka K i manometru M izoteniskopu nalewamy toluenu, tak aby jego poziom był w przyblizeniu taki jak na powyższym rysunku. Zanurzamy izoteniskop w naczynku termostatowym, włączamy obieg wody chłodzącej i ustalamy pierwszą temperaturę pomiarową. Przy zamkniętych kranach 1 i 3 oraz otwartym kranie 2 włączamy pompę, a nastepnie wolno otwieramy kran 1, tak aby słup rtęci w manometrze rtęciowym opadał z nieznaczą szybkością. Przy pewnym ciśnieniu przez toluen w manometrze M izoteniskopu zaczną przedostawać się banieczki powietrza znad poziomu toluenu do zbiorniczka K. Przez regulację kranu 1 można szybkość przedostawania się banieczek ustalić na nieznacznym poziomie. Proces odpowietrzania prowadzimy około 5 minut. Po odpowietrzeniu zbiorniczka K odcinamy próżnię przez zakręcenie kranu 1, wpuszczamy do aparatury niewielką ilość powietrza przez chwilowe otwarcie kranu 3, co spowoduje zmniejszenie „rzucania” toluenu w manometrze M. Kolejne otwarcia kranu 3 doprowadzają do wyrównania się poziomów toluenu w manometrze M. Oznacza to, że cisnienie pary nasyconej nad toluenem w zbiorniczku K jest równe ciśnieniu powietrza w aparaturze. To ostatnie odczytujemy na manometrze rtęciowym, jako różnicę poziomów rtęci w milimetrach. Analogicznie postepujemy przy kolejnych temperaturach. Jeżeli jednak w trakcie wyrównywania poziomów toluenu w manometrze M pęcherzyk powietrza przedostanie się do zbiorniczka K, pomiar rozpoczyna się od początku.
Część obliczeniowa.
W ćwiczeniu wyznaczamy ciepło parowania toluenu:
- masa molowa M=92.14 g/mol
- temperatura wrzenia Twrz=110.62 *C
- gęstość d=0.866÷0.867 g/cm3
- entalpia parowania w temp. wrzenia ΔHwrz=43.47 kJ/mol
Ciśnienie atmosferyczne w dniu wykonywania ćwiczenia wynosiło 742 mmHg, jednak manometr rtęciowy przy aparaturze wyłączonej wskazywał 700 mmHg, w związku z tym przeliczyliśmy według proporcji wskazywane ciśnienie na rzeczywiste.
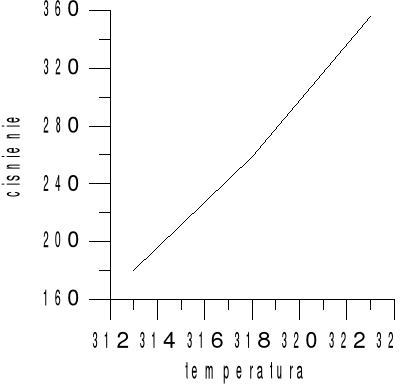
Pomiaru dokonaliśmy dla 3 różnych temperatur:
Lp |
T[K] 313 |
T[K] 318 |
T[K] 323 |
|
p [mmHg] |
p [mmHg |
p [mmHg |
1 |
180 |
259 |
356 |
2 |
184 |
253 |
351 |
3 |
176 |
264 |
358 |
Wykres ciśnienia od temperatury
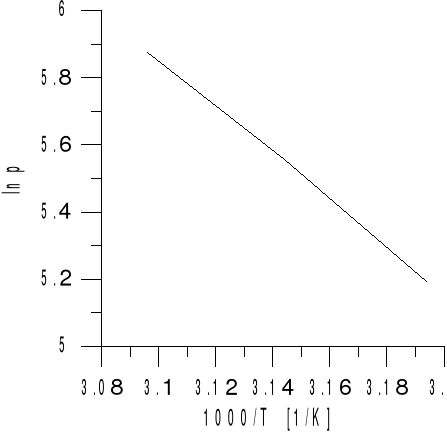
Wykres zależności logarytmu ciśnienia od odwrotności temperatury
Obliczenia na podstawie równania Clausiusa-Clapeyrona:
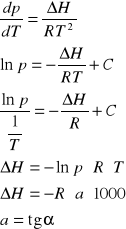
a-kąt nachylenia prostej
Z regresji liniowej powyższego wykresu odczytujemy kąt nachylenia prostej którego tangens jest równy współczynnikowi kierunkowemu prostej wykresu.
a=-4,55
DH=-8,314*1000*(-4,55)
DH=37,86 kJ/mol
Wnioski
Wartość tablicowa ΔH toluenu wynosi 43.47kJ/mol, nasza wyznaczona 37.86kJ/mol, daje to w rezultacie błąd rzędu 12,9%.Na błąd złożyć się mogło kilka powodów (niedokładnie odczytywana: temperatura, różnica poziomów rtęci w U-rurce, niezbyt dobrze oczyszczony po innej substancji izoteniskop, a także przedostanie się pęcherzyków powietrza do zbiorniczka z toluenem).
Wyszukiwarka
Podobne podstrony:
Laborki z miernictwa, Ăw.6 sprawozdanie2, Nr Grupy
Sprawozdania, krioskopia2, Nr grupy 21
Sprawozdanie z ¦cwiczenia nr" Kopia
SPRAWOZDANIE Z WYKONANIA ĆWICZENIA NR 5
Sprawozdanie z wykonanego cwiczenia nr@1
sprawozdanie z laboratorium fizyki nr 28!, Raport elegancki
sprawdzanie 1 prawa kirchhoffa, Nr grupy
sprawko 9, Sprawozdanie z przeprowadzonego ćwiczenia nr 9 -
311, #311, Sprawozdanie z wykonanego ˙wiczenia nr 311
Wyznaczanie ciepła parowania wody na podstawie zależności temperatury wrzenia od ciśnienia
401, MOJE 401, Sprawozdanie z wykonanego ćwiczenia nr 401
metody sieciowe, Model sieciowy - przykład dla studentów, Nr grupy
417, 417MISIE, Sprawozdanie z wykonanego ˙wiczenia nr 417
501, 501JANEK, Sprawozdanie z wykonanego ˙wiczenia nr 501
401, 401A1, Sprawozdanie z wykonania ćwiczenia nr 414
lab fiz sem 5, lab 4d, Nr grupy: 32
więcej podobnych podstron