Data wykonania: 9.03.2010r. |
|
Dr inż. Magdalena Frańska |
Data oddania: 16.03.2010r. |
Ćw. Nr 4; Roztwory buforowe |
Ocena: |
I. Wstęp teoretyczny:
ROZTWORY BUFOROWE - są to roztwory, których wartość pH po dodaniu mocnych kwasów albo zasad, jak i po rozcieńczeniu wodą, zmienia się nieznacznie. Roztworami buforowymi są najczęściej wodne roztwory słabych kwasów albo zasad i ich odpowiednich soli o zbliżonych stężeniach. Rolę mieszanin buforowych spełniają również roztwory wodorosoli.
Roztwory buforowe charakteryzują się określonym stężeniem jonów wodorowych i służą do utrzymania stałej kwasowości roztworów oraz do jej kontroli.
Cechą charakterystyczną roztworów buforowych jest:
praktycznie stałe stężenie jonów wodorowych podczas rozcieńczania roztworu
niewielka zmiana stężenia jonów wodorowych po dodaniu do roztworu niewielkich ilości mocnego kwasu lub mocnej zasady - mniejszych niż stężenie składników buforu (kwasowość roztworu buforowego nie powinna zmienić się więcej niż o jednostkę pH).
POJEMNOŚĆ BUFOROWA (oznaczana symbolem β)
Miarą zdolności roztworu buforowego do przeciwdziałania wpływom zmieniającym jego pH jest zdolność buforowa, wyrażona zwykle liczbą moli mocnego kwasu lub zasady, która wprowadzona do 1 dm3 roztworu buforowego zmienia jego pH o jedność.
Pojemność buforowa jest wprost proporcjonalna do stężenia roztworu buforowego. Optymalne działanie buforujące wykazuje bufor, w którym stężenie kwasu (zasady) jest w przybliżeniu równe stężeniu soli. W takich warunkach bufory są najmniej wrażliwe na dodatek mocnego kwasu lub zasady.
![]()
- Δc- ilość mocnej zasady lub mocnego kwasu (w molach na litr),
- ΔpH - obserwowaną przy tym zmianę wartości pH roztworu
II. Przebieg i opracowanie ćwiczenia.
1. Wpływ dodatku kwasu lub zasady na wartość pH roztworu buforowego i nie buforowego:
Pobrano 30 cm3 roztworu 0,1 M NaCl do zlewki, w której znajdowało się mieszadełko magnetyczne i zmierzono pH. Następnie uruchomiono mieszadło, zanurzono elektrodę i zaczęto dodawać z biurety po 1 cm3 roztworu 0,1 M NaOH notując wskazania pH-metru po każdej porcji dodanego odczynnika. To samo wykonano z próbówką zawierającą 30 cm3 0,1 M CH 3COOH i 0,1 M CH3COONa , zmieszanych w stosunku 1:1
2. Efekt rozcieńczenia:
Roztwór wyjściowy 0,1 M CH 3COOH i 0,1 M CH3COONa rozcieńczono 10x; 100x oraz 1000x. Zmierzono pH roztworu wyjściowego i roztworów rozcieńczonych.
3. Wpływ wzajemnego stosunku molowego składników mieszaniny buforowej na jej wartość pH:
Do kolbek miarowych o pojemności 25 cm3 wprowadzono odpowiednio 5, 10, 15, 20 cm3 0,1 M CH3COOH i uzupełniono do kreski 0,1 M roztworem CH3COONa. Po dokładnym wymieszaniu zawartości kolbek zmierzono pH.
Ilość dodanego NaOH [cm3] |
pH |
1 |
9,5 |
2 |
10,3 |
3 |
10,6 |
4 |
10,7 |
5 |
10,76 |
6 |
10,85 |
Ad. 1
Miareczkowanie 30 cm3 NaCl mocną zasadą NaOH
Początkowe pH NaCl - 6,5
Ilość dodanego NaOH [cm3] |
pH |
1 |
6,10 |
2 |
6,17 |
3 |
6,25 |
4 |
6,35 |
5 |
6,55 |
6 |
6,88 |
Miareczkowanie 30 cm3 buforu CH3COOH i CH3COONa mocną zasadą NaOH
Początkowe pH buforu - 6,07
Aby w roztworze buforowym pH zmieniło jednostkę o 1, należy dodać ok. 8 ml zasady, natomiast aby roztwór NaCl zmienił wartość pH o 1 należy dodać ok. 2,5 ml zasady.
Obliczam w jakim stosunku należy zmierzyć składniki buforu octanowego w celu uzyskania mieszaniny buforowej o pH = 4,45, gdzie pKa = 4,8
Obliczam jakim stężeniom mocnego kwasu (zasady) będą odpowiadały wartości pH równe pH roztworów buforowych.
Obliczam pojemność buforową buforu 0,1M CH3COOH 0,1M CH3COONa
Rozcieńczenie |
pH 0,1M CH3COOH O,1 MCH3COONa |
0x |
6,0 |
10x |
6,38 |
100x |
7,28 |
1000x |
7,40 |
![]()
![]()
![]()
Ad.2
Stężenie CH3COONa |
0,02 |
0,04 |
0,06 |
0,08 |
Stężenie CH3COOH |
0,08 |
0,06 |
0,04 |
0,02 |
pH buforu
|
6,25 |
6,02 |
5,71 |
5,33 |
Obliczanie dla 5 ml składnika I: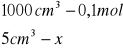
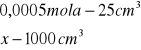
x= 0,0005 mola x=0,02![]()
Obliczanie dla 10 ml składnika I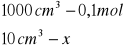
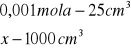
x=0,001 mola x=0,04 ![]()
Obliczanie dla 15 ml składnika I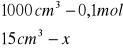

x=0,0015 mola x=0,06![]()
Obliczanie dla 20 ml składnika II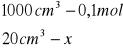
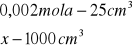
x=0,002 mola x=0,08![]()
30 cm3 - 15cm3 CH3COOH 1 mol NaOH - 40g
1000cm3 - x 0,1 mol CH3COOH - x
x= 500 cm3 x= 4g CH3COOH
1000 cm3 - 4g 40g - 1 mol
500 cm3 - x 2g - x
x=2g NaOH x= 0,05 M CH3COOH
Pojemność buforowa 0,1 M buforu octanowego wynosi 0,05 M NaOH.
III. Wnioski
Z przeprowadzonego doświadczenia wnioskować możemy, iż wprowadzenie 0,1 M NaOH do roztworu soli NaCl znacznie wpływa na zmianę jego pH. Przeciwnie dzieje się jednak podczas wykonywania tej samej operacji z roztworem buforowym. W tym przypadku zauważa się nieznaczną zmianę pH danego buforu jakim jest CH3COONa i CH3COOH. Zmianę pH buforu zauważyć można dopiero przy różnych stężeniach jego składników.
Zaobserwowano wzrost pH podczas rozcieńczania buforu.
Wyszukiwarka
Podobne podstrony:
spraw nr 5, Data wykonania: 8
spraw nr 1, Data wykonania: 8
spraw nr 8 i 9, Data wykonania: 8
spraw nr 6
Kopia-KOKI BEZWLA-A.DOC, DATA WYKONANIA:
mechana, ruch-plaski-wahadlo3, Data wykonania ćwiczenia: 22
SPRAW~10, S P R A W O Z D A N I E nr 1
wyznaczenie charakterystyki stygnięcia kulki, Data wykonania:
I pracownia, Magda, Zespół nr 2
mechana, ruch-plaski-wahadlo, Data wykonania ćwiczenia: 22
Fizyka pomiar czajnik, Data wykonania:
mechana, ruch-plaski-wahadlo, Data wykonania ćwiczenia: 22
Fizyka pomiar czajnik, Data wykonania:
prowadzenia, gimnastyka 4, PROWADZENIE nr Data:
spraw nr 3, Odczyn roztworów wodnych soli
spraw[1]. nr 4, Studia Inż, I semestr inż, Materiały Budowlane
Data wykonania ćw, Transport i Logistyka (AM) 1 (semestr I), Fizyka, fiza laborki (rozwiązania), Cw
spraw.nr.1, Politechnika Lubelska, Studia, semestr 5, Sem V, Sprawozdania, Sprawozdania-dokumenty, M
więcej podobnych podstron