65470 skan0230

Kinetyka chemiczna 233
Przykład 5.15. W kilku temperaturach dla reakcji
*1
H2(g) + l2(g) ^ 2H1(g)
otrzymano wartości stałych szybkości Aą i k2 (indeksy dotyczą numeracji reakcji):
|
temperatura [°C] |
300 |
320 |
340 |
360 |
380 |
400 |
|
kx • 104 [M-1 • s_1 ] |
1,32 |
4,26 |
12,7 |
35,5 |
92,9 |
230 |
|
A'2-106 [M-1 -s-1] |
0,945 |
3,53 |
12,1 |
38,5 |
114 |
316 |
Obliczyć standardową zmianę energii wewnętrznej AU® reakcji oraz wykreślić jej diagram energetyczny.
Rozwiązanie. W celu ułatwienia zapiszemy tę reakcję jako
C + D ^ 2E.
A" 2
W stanie równowragi szybkości reakcji w obu kierunkach są jednakowe:
A'i[C][D] = *2[E]2,
toteż stężeniowa stała rów'nowragi tej reakcji wynosi
[E]2 kY
Zgodnie z równaniem Arrheniusa (5.45) mamy
iz i < Em 1
ln kj — mAj — --—.
Równocześnie, z odpowiednika izobary Van’t Hoffa (3.87),
d\nKt, = AU0 dT ~ RT2 ’
zakładając, że AU® reakcji nie zależy od temperatury, otrzymujemy wyrażenie
ln Kc = -
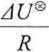
1
—- + const. T
Po wykreśleniu lnAy, lnAą oraz ln Kc w' funkcji \/T (ze względów praktycznych jest to lOOO/E- zob. rys. 5.9) dostajemy linie proste. Z ich nachylenia możemy obliczyć EA(ą oraz A U® .
Wyszukiwarka
Podobne podstrony:
12447 skan0208 Kinetyka chemiczna 211 Rys. 5.1. Wyznaczanie rzędu i stałej szybkości reakcji metodą
skan0218 Kinetyka chemiczna 221 w którym po etapie (1), z szybko ustalającą się równowagą, następuje
skan0228 Kinetyka chemiczna 231 W przybliżeniu stanu stacjonarnego mamy = ki[A]" - *2[L][A] + a
skan0200 (2) Kinetyka chemiczna 203 Szybkość reakcji A B zgodnie z równaniem (5.1) wyraża się
skan0223 226 Kinetyka chemiczna wynosi 37 fis. W tej temperaturze gęstość wody wynosi 0,9970 g ■ cm
skan0242 Kinetyka chemiczna 245 Rozwiązanie. Stopień pokrycia węgla aktywnego etenem, <9, definiu
więcej podobnych podstron