6830719741
Chemia fizyczna - termodynamika molekularna 2009/2010 52
Wykład 13 15.01.2010
1. Opis równowag fazowych.
Typy równowag:
- ciecz - para,
-ciecz -ciałostałe,
- ciecz - ciecz.
2. Równowaga ciecz - para.
Dla czystej substancji związek pomiędzy ciśnieniem a temperaturą (krzywa parowania). Liczne równania stanowiące formę równania Clausiusa-Clapeyrona lub też oparte na równaniu stanu. Bardziej złożony jest opis równowagi ciecz-para w mieszaninach (ze względu na zwiększenie liczby parametrów).
Parametry : T, p, xjtX2,..., yi,y2,... (składy obu faz).
Dla układu dwuskładnikowego: (T, pjciyj).
Dane dzielą się zwykle na izotermiczne albo izobaryczne oraz kompletne (mierzone są wszystkie 4 parametry) i niekompletne - mierzone 3 parametry. Zwykle są to: (p,7=const,;e?, yj) i (p,r=const,*i) oraz (T, p=const, xj, yj) i (T, p=const, xi).
Rezygnacja z pomiaru składu fazy gazowej jest uzasadniona trudnościami eksperymentalnymi i większym błędem pomiarowym tego parametru.
3. Równowaga ciecz-para - opis termodynamiczny.
Wyróżnia się dwie główne metody opisu:
- "gamma-fi"
- równanie stanu
4. Metoda "gamma-fi".
Wychodząc z równości potencjałów chemicznych otrzymuje się układ następujących równań, o następującej postaci dla każdego ze składników mieszaniny
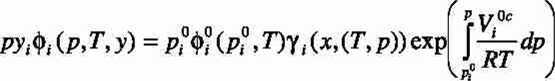
(1)
Stosowalność metody ograniczona jest do niskich i umiarkowanych ciśnień. Wymaga dodatkowej informacji (p° _ prężności pary nasyconej nad czystymi składnikami) oraz wiarygodnego sposobu obliczenia niedoskonałości fazy gazowej (poprzez współczynniki
lotności - <p). W tych warunkach (niskie ciśnienia) współczynniki lotności mogą być oszacowane poprzez drugie współczynniki wirialne. Te z kolei liczy się na podstawie związków korelacyjnych z innymi, podstawowymi parametrami fizykochemicznymi (parametrami krytycznymi, momentem dipolowym, normalną temperaturą wrzenia itp.). Ostatni wyraz w równaniu (1) (eksponencjalny) nosi nazwę ułamka Poyntinga i do swojego obliczenia wymaga znajomości gęstości czystych ciekłych składników.
Podstawowe znaczenie ma znalezienie wiarygodnego związku pomiędzy współczynnikami aktywności a składem fazy ciekłej - Yi(xi,(T,(p))), co jak wiadomo, wiąże się ze znajomością nadmiarowej entalpii swobodnej w funkcji składu (i ewentualnie temperatury). Pozostałe nieznane funkcje - współczynniki lotności i ułamek Poyntinga, mają charakter niewielkiej
Wyszukiwarka
Podobne podstrony:
Chemia fizyczna - termodynamika molekularna 2009/2010 37 Wykład 10 11.12.2009 1. Równania stanu w te
Chemia fizyczna - termodynamika molekularna 2009/2010 32 Wykład 9 4.12.2009 1. Uogólniona funkcja po
Chemia fizyczna - termodynamika molekularna 2009/2010 1 Wykład 1. 2.10.2009 1. Pla
Chemia fizyczna - termodynamika molekularna 2009/2010 42 Wykładll 18.12.2008 1. Roztwór doskonały w
Chemia fizyczna - termodynamika molekularna 2009/2010 11 Wykład 4 23.10.2009 1.
Chemia fizyczna - termodynamika molekularna 2009/2010 15 Wykład 5 30.10.2009 1. Wa
Chemia fizyczna - termodynamika molekularna 2009/2010 19 Wykład 6 5.11.2009 1. Wątpliwość (wyrażona
Chemia fizyczna - termodynamika molekularna 2009/2010 7 6. Przykład z życia. Chcemy znaleźć temperat
Chemia fizyczna - termodynamika molekularna 2009/2010 38 Chemia fizyczna - termodynamika molekularna
Chemia fizyczna - termodynamika molekularna 2009/2010 43 M(xlel roztworu doskonałego jest stosowany
Chemia fizyczna - termodynamika molekularna 2009/2010 48 ln(? = ln#- kT ^ i Wyrażenie na potencjał
Chemia fizyczna - termodynamika molekularna 2009/2010 53 poprawki i często bywają w ogóle pomijane.
Chemia fizyczna - termodynamika molekularna 2009/2010 8 wnętrze Słońca - 2 000 000 K Czy istnieje sz
Chemia fizyczna • termodynamika molekularna 2009/2010 12 4. W stanic rozważanej równowagi, wszystkie
Chemia fizyczna - termodynamika molekularna 2009/2010 16 występujący w róźnic/cc zupełnej energii
Chemia fizyczna - termodynamika molekularna 2009/2010 20 4. Sprawdzamy ekstensywno
Chemia fizyczna - termodynamika molekularna 2009/2010 25 ć)H dH —— = q.
Chemia fizyczna - termodynamika molekularna 2009/2010 29 Chemia fizyczna - termodynamika molekularna
Chemia fizyczna • termodynamika molekularna 2009/2010 33 Konfiguracyjna funkcja podziału będzie równ
więcej podobnych podstron