PORTABLE
FREEWARE
Przekład
Robert Wiśniewski
Gdy znamy masę cząsteczkową substancji, możemy określić jest skład atomowy, pod warunkiem że masa cząsteczkowa jest znana z dokładnością dostateczną dla rozróżniania cząsteczek o takiej samej nominalnej masie molowej.
Aby to wyjaśnić, spójrzmy na bardzo prosty przykład. Załóżmy, ze wiemy, że substancja ma masę molową równą około 28,.. Szybkie obliczenie (przyjmując tylko nominalne masy większości typowych izotopów węgla (12), wodoru (1), tlenu (16) azotu (14) pokazuje, że istnieją 3 substancje mające takie same masy molowe 28: C2H4 (eten), CO (tlenek węgla) i N2 (azot gazowy).
Teraz nie koncentrujmy się na nominalnych masach. Rzeczywiste masy molowe tych pierwiastków wynoszą:
12C = 12.0000
1H = 1.007825037
16O = 15,99491464
14N = 14.003074
Na tej podstawie można łatwo obliczyć rzeczywiste masy cząsteczkowe tych trzech związków o nominalnych masach molowych równych 28:
C2H4 = 28.031300148
N2 = 28.006148
CO = 27.99491464
Najmniejsza różnica między tymi trzema masami ma miejsce między CO i N2 i wynosi 0,0112. Inaczej mówiąc, gdy znamy masę molową z dokładnością do 0,0056 (połowa minimalnej różnicy), możemy łatwo rozróżnić między tymi trzema masami molowymi, a masą nominalną 28.
Ten prosty przykład objaśnia zasadę wyszukiwania składu kompozycji za pomocą spektrometrii masowej. Wystarczy szybko wyznaczyć masę molową z dokładnością dostateczną dla zredukowania liczby możliwych kandydatów do jednej cząsteczki. Oczywiście, w praktyce, interesujące nas masy cząsteczkowe są znacznie wyższe i liczba możliwych kandydatów wzrasta wykładniczo gdy będziemy rozpatrywali różne masy cząsteczkowe.
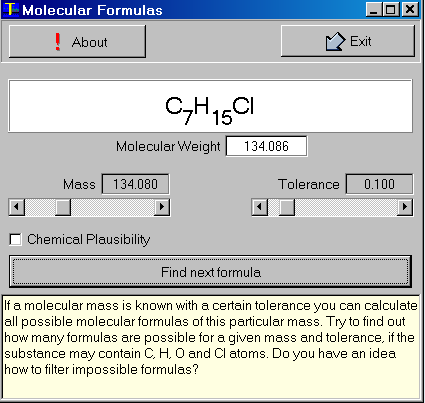
Program MolForm pozwala na obliczanie wszystkich możliwych wzorów cząstek mających określone masy molowe. Użytkownik może ustawiać masy cząsteczkowe i ich tolerancje (dokładności).
Powyższy przykład pokazuje możliwe wzory cząsteczek zawierających atomy nie tylko węgla C, wodoru H, tlenu O i azotu N, ale również atomy chloru Cl.
Wyszukiwarka