Wstęp teoretyczny
Rozkład wody utlenionej w roztworze przyspiesza bardzo wiele jonów, między innymi Cr2O72- oraz Fe3+. Substancje przyspieszające rozkład, katalizatory, tworzą z cząsteczką wody utlenionej produkt przejściowy, który następnie ulega rozkładowi z wydzieleniem pierwotnej postaci katalizatora oraz produktów rozkładu.
Mechanizm tego procesu można przedstawić uproszczonym równaniem:
![]()
(1)
![]()
(2)
gdzie: A - cząsteczka substratu,
K - cząsteczka katalizatora,
M* - cząsteczka substancji przejściowej,
Kc - stała równowagi reakcji (1),
kr - stała szybkości reakcji (2).
Substancja przejściowa M* powstaje w stosunkowo szybkim procesie odwracalnym, a nietrwałe to połączenie rozpada się na produkty reakcji oraz cząsteczkę katalizatora stosunkowo powoli. Ponieważ szybkość reakcji jest określana przez szybkość rozpadu substancji przejściowej można zapisać:
![]()
(3)
Z warunków równowagi natomiast możemy wyliczyć stężenie produktów przejściowych:
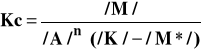
(4)
stąd
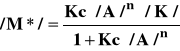
(5)
i ostatecznie
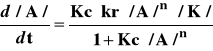
(6)
Wynika z tego, że szybkość reakcji rozkładu jest wprost proporcjonalna do stężenia katalizatora K, a rząd reakcji zależy od wielkości Kc/A/n.
Jeżeli Kc/A/>>1, to równowaga przesunięta jest na stronę tworzenia produktu przejściowego i wówczas rząd reakcji względem stężenia substratów wynosi 0.
![]()
(7)
oraz gdy Kc/A/n<<1, wówczas rząd reakcji względem stężenia substratów wynosi n.
![]()
(8)
Formalny rząd reakcji może zmieniać się od wartości 0 do wartości n i przyjmować wartości ułamkowe. Fakt ten jest w katalizie jednorodnej zjawiskiem powszechnym. Doświadczalnie stwierdzono, że dla reakcji rozkładu wody utlenionej katalizowanej przez jony dwuchromianowe, rząd reakcji zmienia się z temperaturą i przy wzroście temperatury od 0 do 56C wzrasta od wartości 0 - 2.
Wykonanie ćwiczenia
Pomiar szybkości rozkładu H2O2 przy udziale katalizatora K2Cr2O7 dokonywaliśmy w specjalnie przygotowanej aparaturze pomiarowej. Po dodaniu katalizatora do nadtlenku wodoru i szybkim zamknięciu korka odczytywaliśmy poziom wydzielanego tlenu w okresach na początku 2 , na końcu 5 minutowych. Otrzymane wyniki zanotowaliśmy w tabeli pomiarowej.
Obliczenia przykładowe i tabele pomiarowe.
Tabela pomiarowa 1
Lp |
Czas [s] |
Objetość wydzielonego tlenu V [ml] |
Objętość wydzielonego tlenu w warunkach normalnych V0 [ml] |
Ilość moli wydzielonego tlenu nO2 |
Ilość moli H2O2 w roztworze reakcyjnym nH2O2 |
Stężenie H2O2 w roztworze reakcyjnym C H2O2 |
1 |
0 |
0 |
|
|
|
|
2 |
60 |
1 |
|
|
|
|
3 |
120 |
2 |
|
|
|
|
4 |
180 |
6 |
|
|
|
|
5 |
240 |
12 |
|
|
|
|
6 |
300 |
15 |
|
|
|
|
7 |
360 |
18 |
|
|
|
|
8 |
420 |
23 |
|
|
|
|
9 |
480 |
26 |
|
|
|
|
10 |
540 |
32 |
|
|
|
|
11 |
600 |
37 |
|
|
|
|
12 |
660 |
42 |
|
|
|
|
13 |
780 |
50 |
|
|
|
|
14 |
900 |
58 |
|
|
|
|
15 |
1020 |
66 |
|
|
|
|
16 |
1200 |
79 |
|
|
|
|
17 |
1380 |
89 |
|
|
|
|
18 |
1560 |
98 |
|
|
|
|
19 |
1740 |
108 |
|
|
|
|
20 |
1920 |
116 |
|
|
|
|
21 |
2100 |
124 |
|
|
|
|
22 |
2400 |
135 |
|
|
|
|
23 |
2700 |
143 |
|
|
|
|
24 |
3000 |
150 |
|
|
|
|
25 |
3300 |
157 |
|
|
|
|
26 |
3600 |
162 |
|
|
|
|
Tabela pomiarowa 2
L.k. |
Stężenie C H2O2 |
Szybkość dC/dt reakcji |
log C |
log (dC/dt) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Wyszukiwarka