Wydział WEiP |
Imię i nazwisko 1. Michał Musiał 2. Mateusz Nowak |
Rok 2010 |
Grupa II |
Zespół II |
|||
PRACOWNIA FIZYCZNA WFiIS AGH |
Temat: Elektroliza |
Nr ćwiczenia 35 |
|||||
Data wykonania 15.11.2010 |
Data oddania 22.11.2010 |
Zwrot do popr. |
Data oddania |
Data zaliczenia |
OCENA
|
||
Cel ćwiczenia: Wyznaczenie równoważnika elektrochemicznego miedzi oraz stałej Faradaya w doświadczeniu z elektrolizą wodnego roztworu CuSo4.
Aparatura: Elektrolizę siarczanu miedzi CuSo4 przeprowadza się w naczyniu z miedzianymi elektrodami w kształcie równoległych płyt, oddalonych od siebie o kilka centymetrów. Natężenie przepływającego prądu odczytuje się na amperomierzu. Pomiaru przyrostu masy miedzi na katodzie, wymagającego dużej precyzji, dokonuje się na wadze analitycznej.
Wykonanie ćwiczenia: Płytki, które mają być elektrodami oczyszczamy papierem ściernym, opłukujemy wodą destylowaną i suszymy. Dokonujemy pomiaru masy płytek na wadze analitycznej. Zestawiamy obwód elektryczny zgodnie ze schematem przedstawionym na rysunku 1. Następnie włączamy prąd i przeprowadzamy elektrolizę. Czas jej trwania to 30 minut, a natężenie prądu 0,5A. Po tym czasie wyjmujemy elektrody, przemywamy je, suszymy i ponownie ważymy.
Rysunek 1. Schemat obwodu elektrycznego.
Wyniki pomiarów:
Czas elektrolizy t = 30 min = 1800 s
Natężenie prądu I = 0,5 A
Masa katody przed elektrolizą m1 = 133,695 g
Masa katody po elektrolizie m2 = 134,007 g
Masa wydzielonej miedzi m = m2-m1 = 0,312 g
Masa anod przed elektrolizą M1 = 131,586+131,826 = 263,412 g
Masa anod po elektrolizie M2 = 131,578+131,549 = 263,127 g
Zmiana masy anod M = M1-M2 = 0,285 g
Dane określające niepewność przyrządów pomiarowych:
Klasa amperomierza K = 0,5
Używany zakres amperomierza Z = 0,75 A
Niepewność graniczna wagi (znamionowa) Δm = 0,001 g
Opracowanie wyników:
Masa miedzi wydzielonej podczas elektrolizy na katodzie m = 0,312 g
Zmiana masy anod podczas elektrolizy M = 0,285 g
Korzystając z pierwszego prawa elektrolizy Faradaya obliczamy równoważnik elektrochemiczny miedzi k:
![]()
Korzystając z drugiego prawa elektrolizy Faradaya i otrzymanej wartości współczynnika k obliczamy eksperymentalną wartość stałej Faradaya F:
![]()
91693 [C], gdzie A to masa molowa miedzi, a n to wartościowość jonu Cu2+
Korzystając z wyznaczonej stałej Faradaya obliczamy wielkość ładunku elementarnego e:
![]()
, gdzie NA to liczba Avogarda
Obliczanie niepewności pomiarowych:
1.Na niepewność u(m) składa się niepewność od pomiaru masy katody przed i po elektrolizie, tak więc u (m) obliczymy ze wzoru:
u(m)=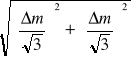
= 0,00082 g
Różnica pomiędzy masą miedzi wydzielonej na katodzie, a ubytku masy na anodach wynosi:
m - M = 0,312 - 0,285 = 0,027 g
Wartość ta nie mieści się w granicach niepewności pomiaru masy elektrod. Ta duża rozbieżność spowodowana jest faktem ze na niepewność pomiaru masy oprócz dokładności wagi składa się jeszcze kilka innych czynników, których nie możemy obliczyć jak np.: skutek przemywania miedzianych płytek wodą destylowaną, niedokładne wysuszenie płytek lub zanieczyszczenie elektrolitu.
2.Obliczamy niepewność ładunku elektrycznego, który przepłynął przez elektrolit. W tym celu obliczamy niepewność pomiaru natężenia prądu:
![]()
Za niepewność pomiaru czasu u(t) przyjmujemy wartość 65 s, jako czas jaki upłynął od momentu włączenia prądu w układzie do momentu maksymalnego zanurzenia elektrod w elektrolicie.
Tak więc niepewność u(Q), gdzie Q=It, obliczymy ze wzoru:
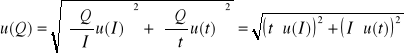
= 33,21 [C]
3.Niepewność wyznaczenia równoważnika elektrochemicznego miedzi u(k) obliczymy ze wzoru:
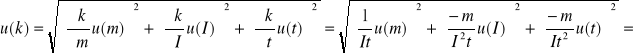
0,000013 ![]()
= 0,013 ![]()
4.Niepewność obliczenia eksperymentalnej stałej Faradaya u(F) obliczymy ze wzoru:
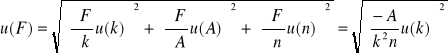
=3438,16 [C], ponieważ wielkości A i n odczytujemy z tablic to za ich niepewność pomiarową przyjmujemy 0.
5.Niepewnośc wyznaczania ładunku elementarnego obliczymy ze wzoru:
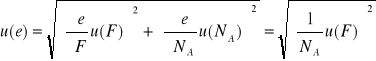
= 0,057*10-19 C, podobnie jak w
pkt. 4 niepewność pomiaru wielkości tablicowej jest równa 0.
Zestawienie uzyskanych wartości z wielkościami tablicowymi:
|
wartość tablicowa |
wartość wyznaczona w doświadczeniu |
różnica |
niepewność |
niepewność rozszerzona |
niepewność względna [%] |
k [mg/C] |
0,3294 |
0,3467 |
0,0173 |
0,013 |
0,026 |
3,95 |
F [C] |
96500 |
91693 |
4807 |
3438,16 |
6876,32 |
3,56 |
e [C*10-19] |
1,60206 |
1,52314 |
0,07892 |
0,057 |
0,114 |
3,56 |
Wnioski:
Wyszukiwarka