4.IV.2003
Zakład Chemii Fizycznej
Laboratorium Studenckie
ĆWICZENIE nr 30
TEMAT:
RÓWNOWAGA CIECZ-PARA DLA UKŁADÓW DWUSKŁADNIKOWYCH.WYZNACZANIE WSPÓŁCZYNNIKÓW AKTYWNOŚCI.
Jacek Zdyb
Inżynieria chemiczna
Grupa III Rok II
Zagadnienia teoretyczne :
Podstawą doświadczalną dla wyznaczania współczynników aktywności ciekłych roztworów nieelektrolitów są głównie badania równowagi międzyfazowej ciecz- para . Poniżej. przedstawione zostały podstawowe zależności termodynamiczne stosowane do opisu danych doświadczalnych. Cząstkowa molowa entalpia swobodna składnika "i" roztworu doskonałego wyraża się wzorem :
Gid(T,p,x,......,x) = Gi0(T,p) + RT lnxi
Gdzie : xi, - ułamek molowy składnika "i" w roztworze,
Gi0- molowa entalpia swobodna czystego składnika
Dla roztworu rzeczywistego zaś mamy.
Gid(T,p,x,......,x) = Gi0(T,p) + RT lnai
gdzie aj - aktywność wyprowadzona z ułamka molowego
ai=xiγi,
γi - współczynnik aktywności
Do opisu termodynamicznego roztworów rzeczywistych używa się między innymi termodynamicznych funkcji nadmiaru ( ekscesu ). Charakteryzują one odchylenia danego roztworu od roztworu doskonałego
zE = z - zd
gdzie : z - wartość danej funkcji termodynamicznej dla roztworu rzeczywistego,
zd- wartość tej samej funkcji dla roztworu traktowanego jako doskonały
Stąd cząstkową, molową nadmiarową entalpię swobodną dla składnika "i" można przedstawić następująco
GiE = Gi - Gid = RT lnγi
Nadmiarowa entalpia swobodna odniesiona do jednego mola roztworu wynosi
gE = ∑xi GiE = RT ∑xilnγi
Do obliczenia nadmiarowej molowej entalpii swobodnej roztworu potrzebna .jest znajomość współczynników aktywności poszczególnych składników. Można je wyznaczyć na podstawie badań równowagi ciecz-para, oznaczając w warunkach T,, p =const. składy równowagowe fazy ciekłej i gazowe.
Ciśnienie cząstkowe (prężność ) składnika "i" nad roztworem doskonałym można obliczyć z prawa Raoulta
pi = p0ixi
gdzie pi - prężność cząstkowa składnika "i" w fazie gazowej,
xi - ułamek molowy składnika "i" w fazie cieklej,
p0i- ciśnienie pary nasyconej nad czystym składnikiem "i" w temperaturze układu,
Prężność cząstkową składnika "i" w fazie gazowej możemy też obliczyć z zależności
pi = pyi
gdzie yi - ułamek molowy składnika "i" w fazie gazowej,
p - ciśnienie całkowite
Porównanie wzorów (7) i (8) prowadzi do następującej zależności pomiędzy składem cieczy i pary nad roztworem doskonałym
p0ixi = pyi
Prawo Raoulta jest prawem granicznym, słusznym dla układów doskonałych. Większość układów rzeczywistych wykazuje bądź dodatnie, bądź ujemne odchylenia od prawa Raoulta.
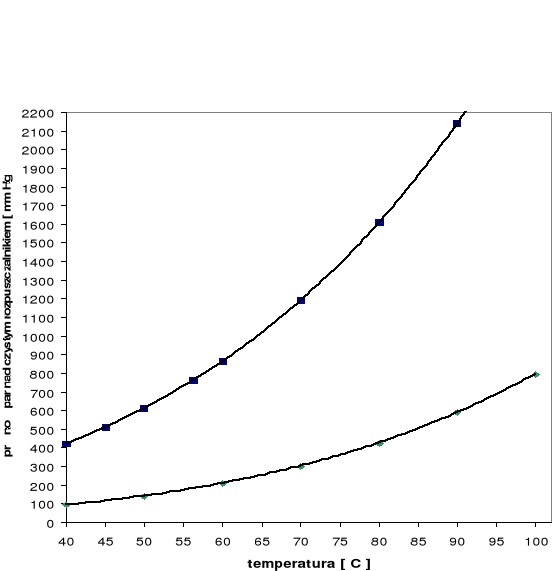
Temperatura T [°C] |
Prężność par acetonu P0A [mm Hg] |
Prężność par n-heptanu P0H [mm Hg] |
40 |
421,5 |
92,05 |
45 |
510,5 |
|
50 |
612,5 |
140,9 |
56,3 |
760,0 |
|
60 |
860,6 |
208,9 |
70 |
1190 |
302,3 |
80 |
1611 |
426,6 |
90 |
2142 |
588,8 |
100 |
|
795,2 |
Zależność prężności pary nad czystym rozpuszczalnikiem od temperatury
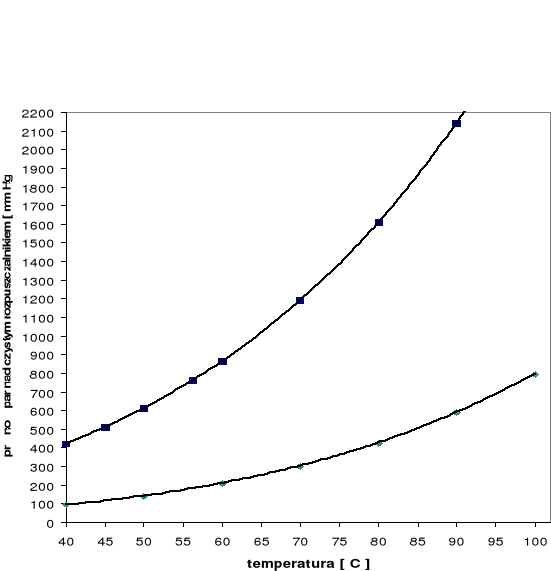
Wykres zależności prężności pary nad czystym rozpuszczalnikiem od temperatury według tabeli
Celem ćwiczenia jest wyznaczenie współczynnika aktywności acetonu i n-heptanu na podstawie badań równowagi ciecz-para .
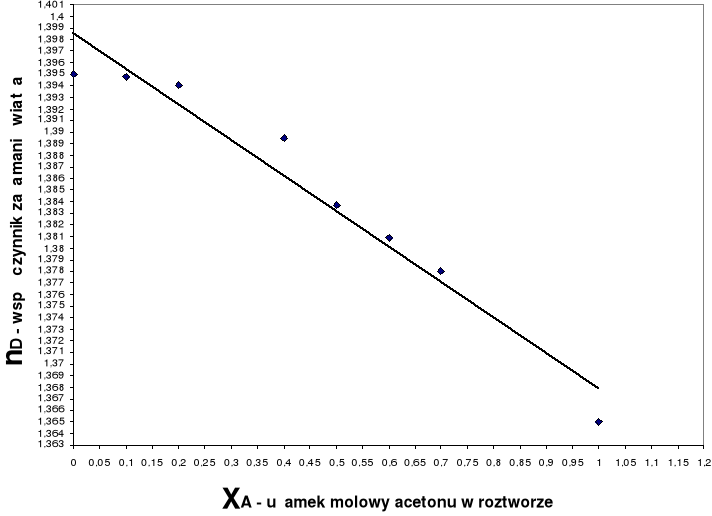
Wykres zależności współczynnika załamania światła od ułamka molowego acetonu nD= f(xA)
xA |
nD |
0 |
1,3950 |
0,1 |
1,3948 |
0,2 |
1,3951 |
0,4 |
1,3895 |
0,5 |
1,3837 |
0,6 |
1,3809 |
0,7 |
1,3780 |
1 |
1,36650 |
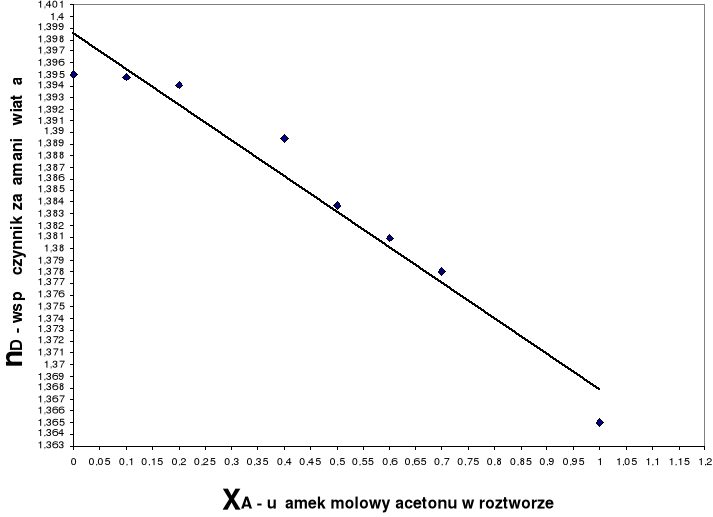
Wyniki pomiarów zestawione w tabeli :
Lp. |
Skład roztworu wyjściowego xA |
Temperatura wrzenia [ 0C] |
Współczynnik załamania światła nD |
Stężenie acetonu |
Stężenie n-heptanu |
||||
|
|
|
Faza ciekła |
Faza gazowa |
Faza ciekła xA |
Faza gazowa yA |
Faza ciekła xH |
Faza gazowa yH |
|
1 |
Aceton |
56,3 |
1,3650 |
1,3891 |
1 |
0 |
- |
- |
|
2 |
n-heptan |
98,4 |
1,3950 |
1,3560 |
- |
- |
1 |
0 |
|
3 |
0,1 |
92,45 |
1,3941 |
1,3878 |
0,151 |
0,355 |
0,849 |
0,645 |
|
4 |
0,2 |
90,4 |
1,3922 |
1,3816 |
0,221 |
0,561 |
0,779 |
0,439 |
|
5 |
0,4 |
64,8 |
1,3896 |
1,375 |
0,278 |
0,762 |
0,722 |
0,238 |
|
6 |
0,6 |
55,7 |
1,3792 |
1,368 |
0,664 |
0,987 |
0,336 |
0,013 |
|
Obliczam współczynnik aktywności acetonu i n-heptanu korzystając ze wzoru :
![]()
p= 768 mmHg
gdzie :
p - ciśnienie barometryczne
poi -prężność czystych składników ( tzn. acetonu i n - heptanu ) w temperaturze wrzenia
poszczególnych roztworów
yi i xi - ułamek molowy składnika i - ( tzn. odpowiednio acetonu i n- heptanu ) w fazie gazowej i
ciekłej
Współczynniki aktywności dla acetonu :
Współczynnik aktywności dla n - heptanu
Współczynniki aktywności dla acetonu wykazują głównie dodatnie odchylenia od prawa Raulta, współczynniki aktywności n-heptanu - ujemne odchylenia .
Obliczanie parametrów A , B z równania van Laara :
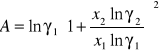
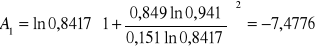
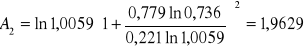
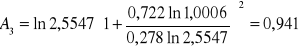
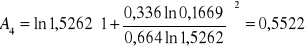
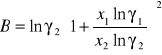
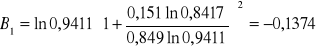
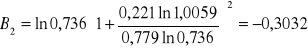
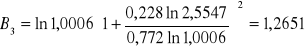
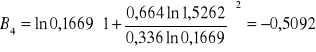
Obliczam nadmiarową molową entalpię swobodną :
T = [ K ]
R = 8, 3143 [ J/mol ⋅ K ]
![]()
GE = 8,3143⋅ 365,45 ( 0,151 ⋅ ln 0,8417 + 0,849 ⋅ ln 0,9411 ) = -235,67 [ J/mol ]
GE = 8,3143 ⋅ 363,4 ( 0,221 ⋅ ln 1,0059 + 0,779 ⋅ ln 0,736 ) = -717,53 [ J/mol ]
GE = 8,3143 ⋅ 337,8 ( 0,278 ⋅ ln 2,5547 + 0,722 ⋅ ln 1,0006 ) = 733.54 [ J/mol ]
GE = 8,3143 ⋅ 328,7 ( 0,664 ⋅ ln 1,5262 + 0,336 ⋅ ln 0,1669 ) = -876,81 [ J/mol ]
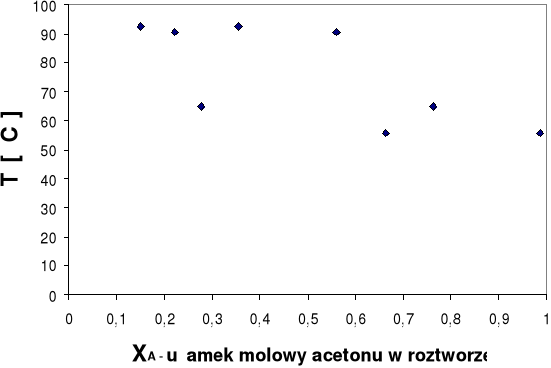
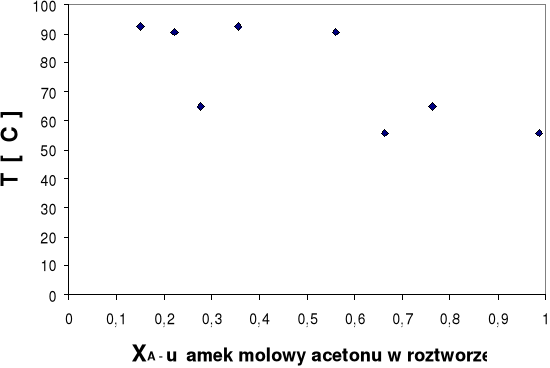
Wykres równowagi fazowej ciecz-para Twrz=f(xA) dla ukł.aceton- n-heptan
Wyszukiwarka