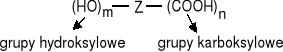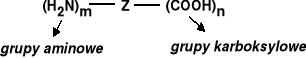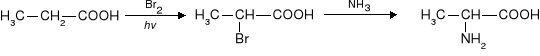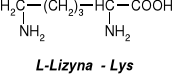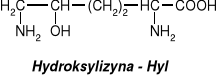związki zawierające w cząsteczkach grupy karboksylowe i hydroksylowe.
|
|
|
|
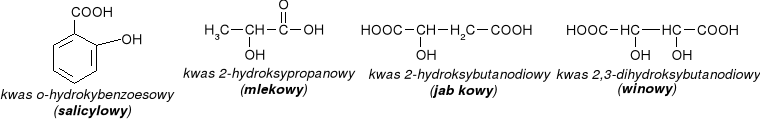
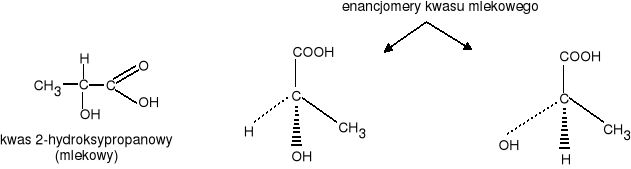
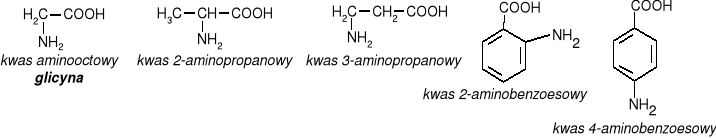
Kwas mlekowy
Kwas mlekowy ma dwa enancjomery:
prawoskrętny (kwas(+)mlekowy) tworzy się w mięśniach podczas pracy fizycznej powodując uczucie bólu mięśni.
lewoskrętny (kwas(-)mlekowy) jest produktem fermentacji niektórych cukrów pod wpływem enzymów wytwarzanych przez bakterie. (znajduje się w zsiadłym mleku, ogórkach kiszonych, kapuście)
|
hydroksykwasy związki w których cząsteczkach grupy OH i COOH są związane z tym samym atomem węgla
hydroksykwasy związki w których cząsteczkach grupy OH i COOH są przy sąsiednich atomach węgla
hydroksykwasy γ gdy rozdzielają je dwa atomy węgla; hydroksykwasy δ gdy rozdzielają je trzy atomy węgla
|
reakcje charakterystyczne:
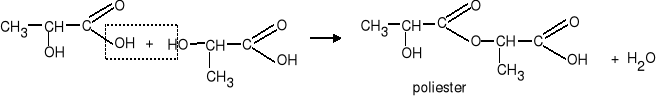
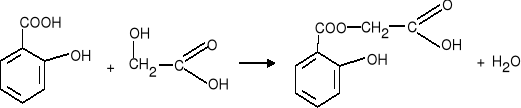
1. Tworzenie poliestrów w reakcji estryfikacji
Obecność grup: hydroksylowej i karboksylowej w cząsteczce powoduje że związki te mogą reagować same ze sobą.
Grupa karboksylowa jednej cząsteczki reaguje z grupą hydroksylową innej cząsteczki tworząc wiązanie estrowe.
Reakcja ta przebiega dalej aż do utworzenia poliestru - związku o długim łańcuchu z rozmieszczonymi w nim regularnie grupami estrowymi.
|
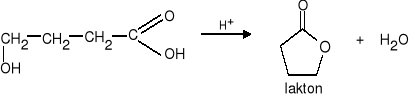
2. Wewnątrzcząsteczkowa reakcja estryfikacji. Reakcja zachodzi w obrębie tej samej cząsteczki (γ i δ hydroksykwasu) dając ester cykliczny zwany laktonem.
|
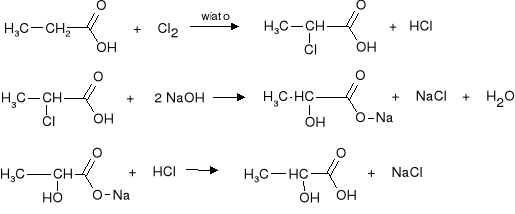
Kwas mlekowy otrzymuje się syntetycznie przez chlorowanie kwasu propanowego a następnie podstawienie atomu chloru grupą hydroksylową. Produktem jest racemat kwasu mlekowego.
|
|
|
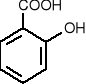
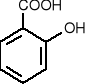
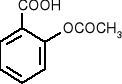
kwas salicylowy - stosowany do odkażania (ma działanie bakteriobójcze).
|
|
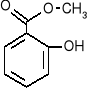
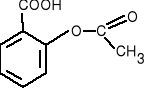
salicylan metylu - składnik maści przeciwreumatycznych.
|
|
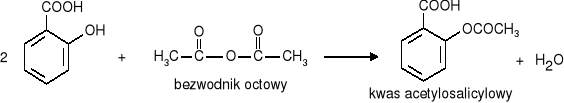
kwas acetylosalicylowy - główny składnik aspiryny.
|
|
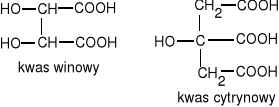
kwas winowy i kwas cytrynowy
- występują w owocach i są stosowane w przemyśle spożywczym
|
Wiele hydroksykwasów występuje w przyrodzie będąc produktami reakcji przebiegających w organizmach żywych głównie komórkowego utleniania węglowodanów.
|
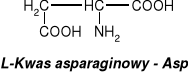
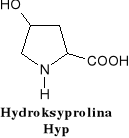
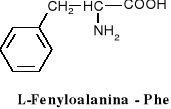
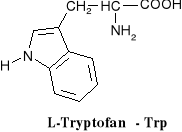
związki dwufunkcyjne zawierające w swych cząsteczkach grupy karboksylowe i aminowe.
|
|
|
|
Właściwości fizyczne aminokwasów:
są związkami krystalicznymi
rozpuszczają się w rozpuszczalnikach polarnych (woda, alkohol etylowy), nie rozp się w rozpuszczalnikach niepolarnych (benzen, eter, heksan)
mają wysokie temp topnienia
|
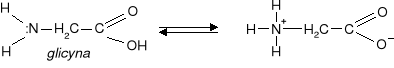
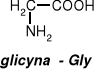
roztwór wodny glicyny jest obojętny ponieważ obecne w cząsteczce grupy: karboksylowa
i aminowa ulegają wewnętrznemu zobojętnieniu.
tworzy się sól wewnętrzna w rezultacie przeniesienia jonu H+ od grupy karboksylowej do aminowej.
|
|
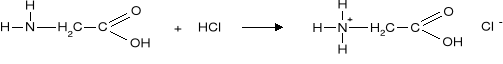
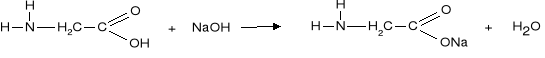
a) Sól taka może reagować zarówno z kwasami jak I z zasadami.
|
|
|
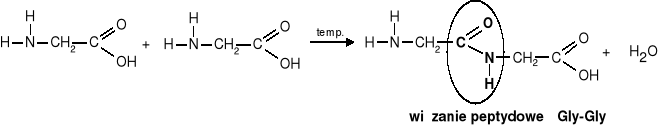
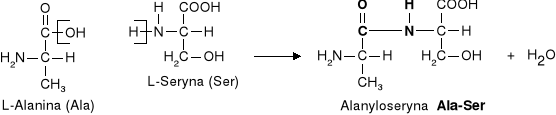
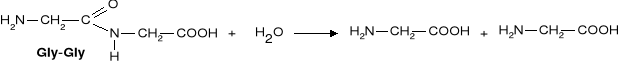
b) Reakcja kondensacji - zachodzi pomiędzy grupą aminową I karboksylową dwóch aminokwasów.
|
|
|
Powstały produkt nadal ma grupę aminową i karboksylową i może reagować dalej w reakcji kondensacji. Związki powstałe w wyniku kondensacji aminokwasów, noszą nazwę peptydów.
|
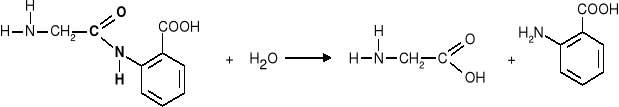
Reakcją odwrotną do redakcji kondensacji jest reakcja hydrolizy
|
|
Za pomocą tej reakcji można ustalić, z jakich aminokwasów składał się peptyd.
|
|
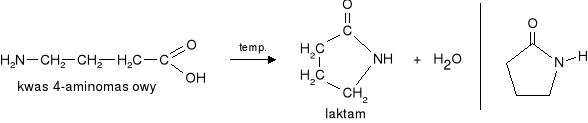
c) Ogrzewanie i δaminokwasów prowadzi do powstania cyklicznych laktamów.
Reakcja kondensacji zachodzi pomiędzy grupą aminową i karboksylową tego samego aminokwasu. - wewnątrzcząsteczkowa reakcja kondensacji.
|
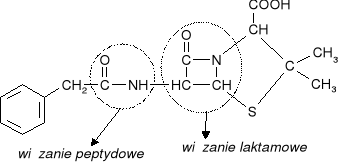
Pierścienie laktamowe są elementami składowymi penicyliny.
Penicylina - antybiotyk odkryty przez Fleminga w 1929 r. z produktów przemiany materii pleśniaka Penicillium notatum. Najczęściej stosowana jest penicylina G (benzylopenicylina).
|
|
1. Reakcja fluorowcopochodnych kwasów karboksylowych z amoniakiem.
|
2. Hydroliza białek i peptydów.
|
a) ze względu na ilość grup karboksylowych i aminowych:
obojętne (1 grupa -NH2 1 grupa -COOH)
kwaśne (1 grupa -NH2 2 grupy -COOH)
zasadowe (2 grupy -NH2 1 grupa -COOH)
obojętne z układem cyklicznym
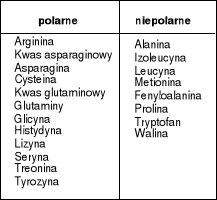
b) ze względu na polarność grup R w sąsiedztwie węgla .
|
|
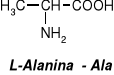
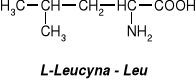
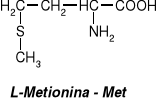
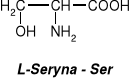
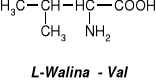
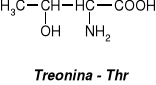
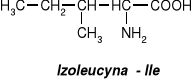
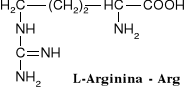
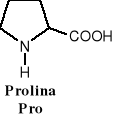
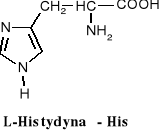
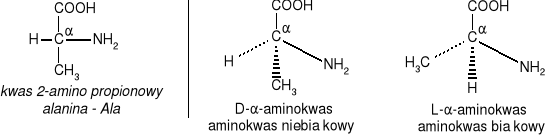
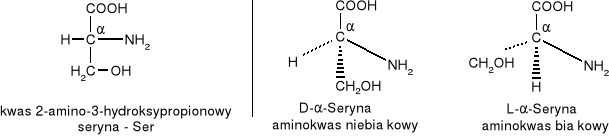
W aminokwasach białkowych jedna grupa aminowa jest związana z tym samym atomem węgla, z którym związana jest grupa karboksylowa oraz atom wodoru. Ten atom węgla określa się jako atom węgla .
Wszystkie aminokwasy białkowe są -aminokwasami. Z atomem węgla związane są cztery różne podstawniki a więc są to cząsteczki chiralne i mogą występować w dwóch odmianach czynnych optycznie (enancjomerach).
Konfiguracja grup związanych z atomem węgla jest dla wszystkich aminokwasów białkowych taka sama i oznacza się ją jako L. Wszystkie aminokwasy białkowe są więc L--aminokwasami.
|
|
|
Peptydy - związki zbudowane z kilku (conajmniej dwóch) reszt aminokwasowych. Peptydy zbudowane z dwóch reszt aminokwasowych to dwupeptydy, z trzech - tripeptydy, z czterech - tetrapeptydy itd.
(Do 10 reszt mają oligopeptydy).
Polipeptydy zawierające więcej niż 100 reszt aminokwasowych noszą nazwę białek.
Naturalne peptydy I białka są zbudowane z reszt aminokwasów białkowych powiązanych wiązaniami peptydowymi.
|
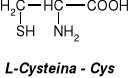
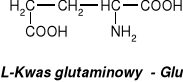
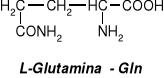
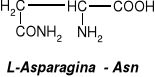
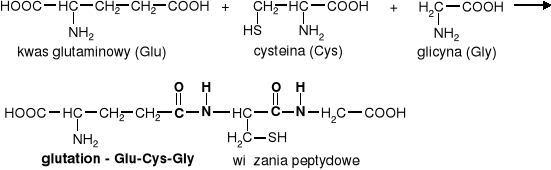
Glutation - tripeptyd zbudowany z reszt trzech aminokwasów: kwasu glutaminowego, cysteiny I glicyny.
Glutation występuje w komórkach wielu tkanek roślinnych i zwierzęcych, gdzie odgrywa zasadniczą rolę w procesach redoks, ponieważ może stabilizować wolne grupy -SH. Biosynteza zachodzi w wątrobie. W komórce występuje w dwóch formach: zredukowanej (GSH) lub utlenionej (GSSG), którą stanowią dwie cząsteczki glutationu połączone mostkiem disulfidowym.
|
|
Skrócone nazwy polipeptydów zapisuje się w taki sposób, że z lewej strony umieszcza się symbol aminokwasu zawierającego wolną grupę aminową, a z prawej karboksylową.
Więc peptyd Glu-Cys-Gly oznacza inny peptyd niż Gly-Cys-Glu.
|
Sekwencja (kolejność) reszt aminokwasowych w łańcuchach peptydowych nosi nazwę struktury pierwszorzędowej peptydów (białek). (Jest utrzymywana za pomocą wiązań peptydowych)
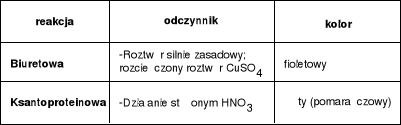
Strukturą drugorzędową nazywa się układ przestrzenny łańcuchów peptydowych, wynikający z występowania wiązań wodorowych i mostków disulfidowych. Wiązania wodorowe występują między grupami:
dwóch różnych wiązań peptydowych:
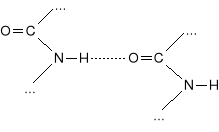
|
Istnieją dwa modele drugorzędowej struktury białka:
struktura - heliksa - (prawoskrętna linia śrubowa), wiązania wodorowe między grupami należącymi do sąsiednich zwojów heliksy
struktura - wiązaniami wodorowymi połączone są dwa wyprostowane łańcuchy położone równolegle obok siebie.
|
Struktura trzeciorzędowa opisuje układ przestrzenny zwiniętego w heliksę łańcucha peptydowego.
(Stabilizują mostki disulfidowe, wiązania wodorowe, siły Van der Waalsa)
Struktura czwartorzędowa opisuje wzajemny układ przestrzenny poszczególnych łańcuchów polipeptydowych w cząsteczkach białek. (Wykazują białka o innym rodzaju wiązań (niesulfidowe i niepeptydowe)
|
substancje o dużej masie cząsteczkowej (>10000 m) składające się z reszt aminokwasowych (ponad 100 reszt aminokwasów) połączonych wiązaniami peptydowymi
|
białka stanowią 50% suchej masy komórki;
wiążą wodę niezbędną do procesów życiowych;
biorą udział w regulacji ciśnienia koloidoosmotycznego;
uczestniczą w utrzymaniu stałego pH;
|
transportują różnego rodzaju związki i jony;
mają udział w procesie krzepnięcia krwi;
decydują o właściwościach odpornościowych organizmu.
|
ze względu na pochodzenie
ze względu na ich funkcje biologiczne
transportowe (hemoglobina, albumina osocza, lipoproteiny)
strukturalne (kolagen, elastyna, keratyna, glikoproteiny)
odpornościowe i ochraniające (g-globulina, fibrynogen)
biorące udział w skurczu (miozyna)
hormony (insulina, glukagon, ACTH, ADH)
|
ze względu na rozpuszczalność i kształt cząsteczki
fibrylarne - nierozpuszczalne w wodzie; o strukturach włóknistych; odporne na działanie kwasów, zasad i proteaz
globularne - rozpuszczalne w wodzie i rozcieńczonych roztworach soli o kształtach kulistych lub elipsoidalnych
ze względu na skład chemiczny (Hoppe - Seyler 1875)
proste (czyste) - w wyniku hydrolizy powstają tylko aminokwasy
skoniugowane (złożone) - w wyniku hydrolizy powstają aminokwasy i inne składniki.
|