Ć W I C Z E N I E Nr 53
MIARECZKOWANIE PEHAMETRYCZNE
Cel ćwiczenia
Celem ćwiczenia jest wyznaczenie ilości kwasów: mocnego oraz mocnego i słabego
w mieszaninie zawierającej oba kwasy, metodą miareczkowania pehametrycznego.
Miareczkowanie pehametryczne polega na pomiarze pH miareczkowanego roztworu po dodaniu kolejnych porcji titranta (odczynnika miareczkującego).
pH jest to ujemny logarytm z aktywności jonów wodorowych, ![]()
: pH = - log ![]()
Wykres zależności pH roztworu miareczkowanego od ilości dodanego titranta nosi nazwę krzywej miareczkowania pehametrycznego.
objętość titranta
Krzywa miareczkowania mocnego kwasu
(roztwór analizowany) mocną zasadą (titrant).
W punkcie równoważnikowym (stechiometrycznym)
pH = 7
objętość titranta
Krzywa miareczkowania słabego kwasu (roztwór analizowany) mocną zasadą (titrant).
Punkt równoważnikowy (punkt stechiometryczny) jest przy pH>7
Miareczkowanie mocnego kwasu mocną zasadą, np. kwasu solnego ługiem sodowym:
HCl(aq) + NaOH(aq) = NaCl (aq) + H2O(c)
Początkowo zmiany pH roztworu miareczkowanego są małe. W miarę dodawania roztworu ługu stopniowo ubywa jonów wodorowych, H+, które są zastępowane jonami Na+.
W pobliżu punktu stechiometrycznego następuje gwałtowna zmiana pH. W tym punkcie stężenie jonów wodorowych jest takie jak w czystej wodzie, a odpowiadające temu stężeniu pH = 7. Po przekroczeniu punktu równoważnikowego dodatek zasady prowadzi do dalszego wzrostu pH roztworu, ze względu na przyrost stężenia jonów OH-.
Miareczkowanie słabego kwasu mocną zasadą
W czasie miareczkowania słabego kwasu, np. kwasu octowego mocną zasadą, np. NaOH, stężenie jonów H+ w roztworze zależy od stopnia dysocjacji tego kwasu. Dodanie titranta przeprowadza część kwasu w sól (czyli według teorii Brønsteda sprzężoną z nim zasadę) zgodnie z reakcją:
CH3COOH(aq) + OH-(aq) = CH3COO-(aq) + H2O
W każdym punkcie miareczkowania ustala się stan równowagi opisanej stałą równowagi Ka:
Ka = 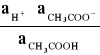
;
Jeśli pominiemy niewielki ubytek stężenia CH3COOH spowodowany jego dysocjacją oraz założymy, że aktywność niezdysocjowanego kwasu, ![]()
, jest równa jego stężeniu
w roztworze, [kwas], a ponadto, że współczynnik aktywności jonów octanowych
w roztworze jest zbliżony do 1, to możemy napisać, że aktywność, ![]()
, jest
w przybliżeniu równa stężeniu jonów octanowych w roztworze, [sól]. Stąd mamy
Ka ![]()
; oraz ![]()
Logarytmując ostatnie równanie i zmieniając znak po obu stronach dochodzimy do równania Hendersona-Hasselbacha:
pH = pKa - log![]()
; gdzie: pKa = - log Ka
W połowie drogi miareczkowania, gdy zobojętniona jest połowa wyjściowej ilości kwasu, stężenia kwasu i zasady są sobie równe, wtedy pH ![]()
pKa. W punkcie równoważnikowym ilość dodanej zasady odpowiada wyjściowej ilości kwasu. W punkcie tym roztwór ma odczyn zasadowy. Dodanie następnych porcji zasady powoduje dalszy wzrost pH roztworu badanego. Położenie punktu równoważnikowego wyznacza się określając punkt przegięcia na krzywej miareczkowania, w którym przyrost pH jest najszybszy. Dokładniej punkt ten można wyznaczyć rysując krzywą pochodną
![]()
której maksimum określa równowagową objętość dodanego ługu, (VNaOH)równ.
Zasada pomiaru pH. Do pomarów pH wykorzystuje się ogniwo zbudowane z elektrody pomiarowej, którą jest elektroda szklana i elektrody odniesienia, którą jest elektroda kalomelowa. Elektrody zanurzone są w roztworze badanym o nieznanym stężeniu jonów wodorowych. Potencjał elektrody szklanej wyrażony wzorem:
Eszkl = A + ![]()
jest liniową funkcją aktywności jonów wodorowych, a potencjał elektrody odniesienia jest stały, niezależny od pH roztworu. Siła elektromotoryczna takiego ogniwa wynosi:
E = Ekal - Eszkl = Ekal - A - ![]()
= Ekal - A + 0,059 pH
ponieważ w temperaturze 25oC iloraz 2,3 ![]()
= 0,059, jeśli przyjmiemy ponadto, że: b = Ekal - A, to
E = b + 0,059 pH
Zgodnie z powyższym równaniem E jest liniową funkcją pH. Zmiana pH o jednostkę wywoła zmianę SEM tego ogniwa o 0,059 V. Przyrządy używane do pomiarów pH nazywane pehametrami są bezpośrednio wyskalowane w jednostkach pH. Ze względu na to, że parametr A we wzorze na potencjał elektrody szklanej zależy od jej budowy, a także zmienia się w czasie, konieczne jest kalibrowanie pehametru przy pomocy roztworów buforowych, do tego celu może być stosowany np. 0,05 M kwaśny ftalan potasu, który
w temp. 25oC ma pH = 4,00.
Wykonanie ćwiczenia
Pobrać dipol magnetyczny do mieszadła. Przygotować pehametr do pomiarów pH (nacisnąć czerwony przycisk sieć, oraz przycisk pH). Wykalibrować przyrząd nalewając do zlewki około 50 ml buforu ftalanowego o pH = 4,00. Ostrożnie wrzucić dipol magnetyczny i nałożyć pokrywkę z elektrodami szklaną i kalomelową. Włączyć mieszadło na kilka minut. Po wyłączeniu mieszadła ustawić wskazania pehametru na pH = 4,00 przy pomocy pokrętła kalibracji. Położenia tego pokrętła nie zmieniamy
w trakcie pomiarów.
Po kalibracji pehametru bufor wlać ponownie do butelki (może być używany wielokrotnie). Elektrody opłukać wodą destylowaną. Przygotować roztwór zawierający: 10 ml roztworu mocnego kwasu, 20 ml acetonu i 20 ml wody destylowanej.
Biuretę napełnić roztworem NaOH o stężeniu 0,2 mol/dm3. Roztwór z biurety dodawać do roztworu kwasu porcjami początkowo po 0,5 ml, później po 0,2 ml, a w pobliżu punktu równoważnikowego po
0,1 ml. Po dodaniu każdej porcji mieszać roztwór przez około 5 min, a następnie po wyłączeniu mieszadła, zmierzyć pH.
Wyniki pomiarów pH i odpowiadające im objętości zużytego do miareczkowania NaOH zapisać w tabeli. Wyjąć dipol magnetyczny, wylać roztwór ze zlewki, a elektrody przemyć wodą destylowaną.
Przygotować nową próbkę o składzie: 10 ml mocnego kwasu, 10 ml słabego kwasu, 20 ml acetonu
i 10 ml wody destylowanej. Wykonać miareczkowanie jak w pkt 3. Wyniki pomiarów pH i odpowiadające im objętości zużytego do miareczkowania NaOH zapisać w tabeli. Po zakończeniu pomiarów wyłączyć pehametr, elektrody przemyć wodą destylowaną i pozostawić zanurzone w wodzie destylowanej. Uporządkować stanowisko pracy.
Opracowanie wyników
Sporządzić wykres I przedstawiający zmiany pH podczas miareczkowania roztworu mocnego kwasu od objętości dodanej zasady, VNaOH
pH = f(VNaOH) (wykres I)
Punkt przegięcia krzywej miareczkowania (punkt równoważnikowy, stechiometryczny) odpowiada objętości roztworu zasady potrzebnej do zobojętnienia całego kwasu, (VNaOH)równ
W celu dokładnego wyznaczenia (VNaOH)równ sporządzić wykres II przedstawiający pochodną krzywej miareczkowania od objętości dodanej zasady, VNaOH
![]()
(wykres II)
Obliczyć liczbę moli mocnego kwasu w próbce oraz stężenie molowe roztworu wyjściowego kwasu.
Sporządzić wykres III przedstawiający zmiany pH podczas miareczkowania roztworu mocnego i słabego kwasu od objętości dodanej zasady, VNaOH.
pH = f(VNaOH) (wykres III)
Pierwszy punkt przegięcia krzywej miareczkowania na tym wykresie odpowiada objętości (VNaOH) równ zasady potrzebnej do zobojętnienia mocnego kwasu, drugi punkt przegięcia - zobojętnieniu słabego kwasu.
W celu dokładnego wyznaczenia (VNaOH)równ obu punktów równoważnikowych sporządzić wykres IV przedstawiający pochodną krzywej miareczkowania
![]()
(wykres IV)
Obliczyć liczbę moli obu kwasów oraz stężenia molowe wyjściowych roztworów kwasów.
W oparciu o dane literaturowe uzasadnić cel miareczkowania mieszaniny kwasów mocnego i słabego
w obecności acetonu.
Wyszukiwarka