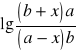Robert Maniura
Sprawozdanie z ćwiczenia nr 29: Stała szybkości reakcji jodowania acetonu.
Wstęp teoretyczny:
Katalizatorami nazywamy substancje przyśpieszające reakcje chemiczne, pozostające w niezmienionej ilości po zakończeniu reakcji. Charakterystyczne jest przy tym, że bardzo małe ilości substancji katalitycznej, w porównaniu z ilościami substratów, mogą mieć silny wpływ na szybkość reakcji.
Dość rozpowszechnione są reakcje, w których produkt jest katalizatorem. Na przykład w reakcji jodowania acetonu jednym z produktów jest jodowodór, który jako mocny kwas - przyspiesza enolizację acetonu; dopiero forma enolowa acetonu podlega reakcji jodowania. Ogólne wyrażenie na szybkość reakcji autokatalitycznej ma postać:
![]()
gdzie k1 jest stałą szybkości reakcji bez katalizatora, a k2 stałą szybkości z udziałem katalizatora; przy czym p jest liczbą cząsteczek produktu uczestniczących w elementarnej przemianie katalitycznej, n jest rzędem reakcji, a - stężeniem początkowym reagenta (dla prostoty założono tylko jeden reagent), x - stężeniem produktu. Najczęstszym przypadkiem jest taki, gdy p = 1, a k1 jest bardzo małe, tzn. reakcja bez katalizatora przebiega bardzo powoli. Jest to przypadek tzw. prostej autokatalizy.
Równanie kinetyczne ma wówczas postać:
![]()
W konkretnym przypadku jodowania acetonu reakcja jest pierwszego rzędu, tzn. jej szybkość zależy tylko od stężenia acetonu
![]()
Całkowanie tego równania prowadzi do następującego równania kinetycznego:
![]()
gdzie x0 oznacza stężenie produktu w chwili rozpoczęcia pomiarów. Jeżeli na początku reakcji dodamy do roztworu pewną ilość mocnego kwasu(niech jego stężenie wyniesie b), to równanie kinetyczne ma postać:
![]()
Po scałkowaniu otrzymujemy ostateczne wyrażenie, często wykorzystywane w praktyce lub po przeliczeniu na logarytm dziesiętny;
![]()
⇒ ![]()
Reakcja autokatalityczna w swym okresie początkowym tzw. indukcyjnym przebiega bardzo powoli, i dopiero w miarę tworzenia się produktu, jej szybkość zaczyna wzrastać. Szybkość reakcji katalitycznej w okresie początkowym można zwiększyć, wprowadzając do układu pewną ilość produktu katalizującego reakcję. Przykładami reakcji katalitycznych są: zmydlanie estru etylowego kwasu octowego w roztworze obojętnym katalizowane powstającym kwasem octowym, utlenianie nadmanganianem katalizowane powstającym Mn2+.
Opracowanie wyników:
Aby obliczyć stałą szybkości reakcji autokatalizy acetonu korzystam z następującej zależności:
![]()
gdzie: b - stężenie początkowe kwasu (wzięto1n HCl, który został rozcieńczony 10 - krotnie, a więc b = 0,1 mol/dm3 ); a - stężenie początkowe acetonu: gęstość acetonu w temperaturze 22oC= 0,7844 g/cm3; objętość acetonu = 4 cm3; Macetonu = 58,08 g/mol
d = m./V ⇒ m.= d * V
m.= 0,7844g/cm3* 4cm3 = 3,1376 g
C mol = n / V = m / (M*V) = 3,1376/(58,08 * 0,25) = 0,2161 [mol/dm3]
A więc wartość „a”: a = 0,2161 mol/dm3
Stężenie przereagowanego acetonu obliczam z zależności:
![]()
gdzie: V0 - objętość roztworu Na2S2O3 użytego do odmiareczkowania jodu na początku reakcji; Vt - objętość roztworu Na2S2O3 użytego do odmiareczkowania jodu po upływie czasu „t” od rozpoczęcia reakcji; N - normalność roztworu Na2S2O3 - ( 0,01n).
Na podstawie podanych zależności obliczam stężenie oraz stałą szybkości reakcji jodowania acetonu. Rezultaty obliczeń zostały umieszczone w tabeli.
t [min] |
t [s] |
V Na2S2O3 [cm3] |
x [mol/dm3] |
|
k [s-1] |
0 |
0 |
24,7 |
0,000000 |
|
|
7,3 |
450 |
23,25 |
0,000290 |
4,24E-03 |
6,86E-05 |
19 |
1140 |
21,1 |
0,000720 |
1,05E-02 |
6,72E-05 |
32 |
1920 |
19,15 |
0,001110 |
1,62E-02 |
6,14E-05 |
51 |
3060 |
15 |
0,001940 |
2,82E-02 |
6,72E-05 |
78 |
4680 |
10,5 |
0,002840 |
4,12E-02 |
6,42E-05 |
107 |
6420 |
4,6 |
0,004020 |
5,82E-02 |
6,60E-05 |
121 |
7260 |
2,05 |
0,004530 |
6,55E-02 |
6,57E-05 |
Na podstawie uzyskanych rezultatów obliczam wartość średnią szybkości reakcji. Wartość średnia szybkości reakcji: kśr = 6,50![]()
[s-1]
W przypadku małej liczby pomiarów średnia może różnić się dość znacznie od wartości prawdziwej. Dlatego wygodniej jest wtedy określić przedział, w którym wartość rzeczywista znajduje się z dużym prawdopodobieństwem. Taki przedział nazywamy przedziałem ufności.
Wyznaczam przedział ufności dla prawdopodobieństwa 95% (p = 0,95 ; α = 0,05)
μ = X + t * s gdzie: X - średnia arytmetyczna; t - wartość funkcji Studenta, wartość współczynnika „t” dla prawdopodobieństwa 95% (dla 7 pomiarów).
t = 2,447 dla K = n - 1 = 7 - 1 = 6
s - odchylenie standardowe średniej arytmetycznej, obliczane ze wzoru:
s = 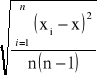
gdzie: xi - kolejne wyniki; x - średnia arytmetyczna wyników; n - ilość wyników (n=5).
s = ![]()
![]()
Obliczony przedział ufności dla stałej szybkości reakcji jodowania acetonu:
k = ![]()
[ s-1]
Następnie wykreślam wykres zależności ![]()
od czasu t [s].
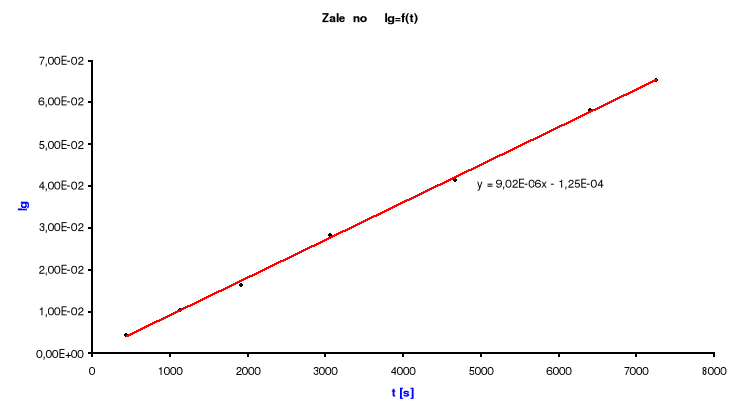
Metodą regresji liniowej wyznaczam k:
y = a1x + b1 a1 =![]()
b1 = ![]()
Błędy :
x=t[s] |
y= |
x2 |
y2 |
450 |
4,24E-03 |
202500 |
1,8E-05 |
1140 |
1,05E-02 |
1299600 |
1,1E-04 |
1920 |
1,62E-02 |
3686400 |
2,6E-04 |
3060 |
2,82E-02 |
9363600 |
8,0E-04 |
4680 |
4,12E-02 |
21902400 |
1,7E-03 |
6420 |
5,82E-02 |
41216400 |
3,4E-03 |
7260 |
6,55E-02 |
52707600 |
4,3E-03 |
![]()
= 24930; ![]()
= 0,224; ![]()
= 130378500; ![]()
= 6,2![]()
; ![]()
= 1173,3715;
a'=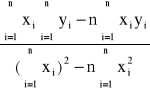
= 9,02![]()
; b'=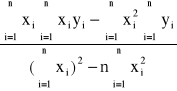
= -1,25![]()
yi' |
d = (yi - yi') |
d2 |
0,00394 |
-0,00030 |
9,18E-08 |
0,01016 |
-0,00035 |
1,22E-07 |
0,01720 |
0,00101 |
1,02E-06 |
0,02749 |
-0,00074 |
5,55E-07 |
0,04211 |
0,00087 |
7,61E-07 |
0,05781 |
-0,00038 |
1,47E-07 |
0,06539 |
-0,00010 |
1,05E-08 |
![]()
=2,71E-06;
Sb' =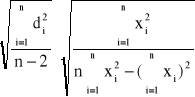
Sb' = 4,93![]()
Sa' =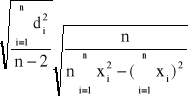
Sa' = 1,14![]()
Obliczam k z zależności k od współczynnika a, który mam z zależności liniowej y = a1x +b a1 =![]()
![]()
![]()
= kt (a + b) z tego wynika, że 2,303a1 = k(a + b)
k = 2,303a1/(a + b) (gdzie a - stężenie HCl; b - stężenie acetonu), czyli:
k = ![]()
/(0,2161 + 0,1) = 6,57![]()
[s-1]
Wnioski:
Przeprowadzone doświadczenie miało na celu sprawdzenie czy reakcja jodowania acetonu ma charakter autokatalityczny. Uzyskane wyniki potwierdzają tezę, iż reakcja jodowania acetonu ma autokatalityczny charakter i jest katalizowana kwasem oraz, że pierwszym etapem przemiany jest enolizacja acetonu (pod wpływem kwasu). Graficzny obraz reakcji jodowania acetonu wskazuje na liniową zależność, co potwierdza powyższe wnioski. Głównym źródłem błędów były niedokładności związane z pomiarem objętości cieczy, czy to użytego do przeprowadzenia reakcji roztworu jodku potasu, acetonu i kwasu solnego jak również użytego do miareczkowania roztworu tiosiarczanu sodu.
Stałą szybkości jodowania acetonu wyznaczyłem dwoma sposobami: wartość obliczona k = ![]()
[ s-1 ] i wartość wyznaczona metodą regresji liniowej k = 6,57![]()
0,01![]()
[s-1]. Wyznaczone w różny sposób stałe szybkości reakcji jodowania acetonu różnią się nieznacznie, co dodatkowo świadczy o słuszności zastosowanej metodyki pomiarowej.
1
Wyszukiwarka