1. Dlaczego etery są silniejszymi zasadami od ketonów? (2)
2. Dlaczego trifluorek boru (BF3) jest silniejszym kwasem Lewisa od trimetyloboranu [(CH3O)3B]? (3)
3. Dlaczego piperydyna jest znacznie silniejszą zasadą od pirydyny? (3)
4. Wyjaśnij dlaczego tetrametyloguanidyna jest znacznie silniejszą zasadą (pKaH ≈ 12) od N,N-dimetyloacetamidu (pKaH ≈ -0.5). (3)
5. Dlaczego kwas pikrynowy (2,4,6-trinitrofenol) powoduje uwolnienie CO2 z wodnego roztworu Na2CO3, a fenol nie? (2)
6. Uszereguj poniższe związki według wzrastającej kwasowości, biorąc pod uwagę zaznaczone protony w poniższych związkach (3):
7. Który, bądź które, z protonów są najbardziej kwasowe w poniższych strukturach: (3)
8. Dlaczego o-chloroanilina jest słabszą zasadą od p-chloroaniliny? (2)
9. Ustaw poniższe związki w kolejności od najsłabszego do najsilniejszego kwasu biorąc pod uwagę zaznaczone atomy wodoru. Podaj uzasadnienie. (3)
10. Dlaczego kwas p-toluenosulfonowy (pKa ≈ -6) jest znacznie silniejszym kwasem od kwasu p-metylobenzoesowego (pKa ≈ 5)? (2)
11. W każdej z poniższych cząsteczek określ, który z wodorów jest najbardziej kwasowy. (2)
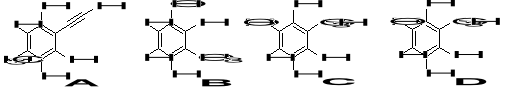
12. Ustaw w kolejności od najsłabszego do najsilniejszego kwasu poniższe związki, biorąc pod uwagę zaznaczone atomy wodoru. Podaj uzasadnienie. (3)
13. Wartości pKa dla aminokwasu cysteiny wynoszą 1.8, 8.3 i 10.8. Przypisz te wartości grupom funkcyjnym cysteiny. (3)
14. Zidentyfikuj najbardziej kwasowy proton w poniższych związkach. (3)
a. 3-pentanon
b. 1,1,1-trifluoropropan
c. 4-chlorobutanol
15. W jaki sposób rozdzielisz naftalen, N,N-dimetyloanilinę [PhN(CH3)2] i kwas benzoesowy (PhCOOH) wykorzystując ich właściwości kwasowo-zasadowe? (2)
16. Wskaż i uzasadnij który ze związków w parach jest słabszą zasadą. (3)
Wyszukiwarka