
Anna Kołodziej |
Rok III |
Wyznaczanie stałej dysocjacji kwasu mlekowego metodą potencjometryczną |
12. 11. 2004 |
Podpis i uwagi:
|
Oddanie sprzętu
|
Część teoretyczna
Pierwsze pojęcie kwasu zawdzięczamy Boyle'owi który określił że kwasem jest substancja, której wodny roztwór ma kwaśny smak. W myśl klasycznej teorii Arrheniusa kwaśny smak spowodowany jest tym, że w roztworze wodnym jest więcej jonów hydroniowych niż wodorotlenowych, a więc zgodnie z tą teoria jako kwasy uważano substancje, które w roztworze wodnym odczepiają jony hydroniowe, a jako zasady- substancje, które odczepiają jony wodorotlenowe:
HA ↔ H+ + A-
BOH ↔ B+ + OH-
Teoria Arrheniusa okazała się niewystarczająca, aby wytłumaczyć zasadowe właściwości związków, które nie posiadają grupy wodorotlenowej. Dopiero Bronsted i Lowry zaproponowali protonową teorię kwasów i zasad. Zgodnie z tą teorią kwasem jest substancja odczepiająca proton, zasadą - substancja przyłączająca proton. Cząsteczka kwasu która oddała proton staje się zasadą, zasada zaś, która przyłączyła proton staje się kwasem:
Kwas ↔ zasada + H+
Protony nie występują w roztworach w stanie swobodnym dlatego jonizacja kwasu może nastąpić tylko wtedy gdy obok kwasu obecna jest zasada zdolna do przyłączenia protonu oddanego przez kwas. Równanie reakcji jonizacji kwasu w obecności zasady przybiera zatem postać:
Kwas1 + zasada2 ↔ kwas2 + zasada1
HB1 + B2 ↔ B2H+ + B1-
Rolę zasady może przejąć rozpuszczalnik S o własnościach protonoakceptorowych zwany protolitycznym. W takim przypadku, przebieg reakcji jonizacji kwasu HA można zapisać;
HA + S ↔ SH+ + A-
Stała równowagi Ka powyższej reakcji nosi nazwę stałej dysocjacji kwasowej I wyraża się wzorem:

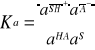
(1)
gdzie ai - aktywność reagenta
W roztworach rozcieńczonych można przyjąć aktywność rozpuszczalnika za równą jedności (aS = 1) niezależnie od stężania elektrolitu i wówczas równanie (1) upraszcza się do postaci:
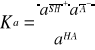
(2)
Analogiczne rozumowanie prowadzi do wniosku, że jonizacja zasady B nastąpić może, gdy rozpuszczalnik jest zdolny do odszczepienia protonów. Proces jonizacji przebiega wówczas zgodnie z równaniem:
B + SH ↔ BH+ + S-
Stała równowagi procesu jonizacji zasady wyraża się wzorem:
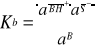
(3)
Budowa cząsteczki wody wskazuje na możliwość wymiany protonu w samej wodzie. Cząsteczka wody może być zarówno akceptorem, jak i donorem protonu. Stała równowagi tej reakcji zwanej autojonizacją wody w temperaturze 298 K wynosi Kw = 1 10-14 i nosi nazwę iloczynu jonowego wody:
![]()
(4)
Kwas mlekowy należy do elektrolitów słabych i w roztworze wodnym dysocjuje na jony zgodnie z równaniem:
CH3CHOHCOOH + H2O ↔ CH3CHOHCOO- + H3O+
Równanie dysocjacji zasady sprzężonej z tym kwasem można zapisać następująco:
CH3CHOHCOO- + H2O ↔ CH3CHOHCOOH + OH-
Odpowiednie stałe dysocjacji kwasu mlekowego - kwasową Ka i zasadową Kb wyrażają poniższe wzory:
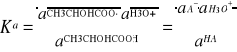
(5)
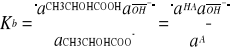
(6)
Są to termodynamiczne stałe równowagi. Można wykazać, ze między stałą dysocjacji kwasu a stałą dysocjacji sprzężonej zasady istnieje ścisła zależność liczbowa. Iloczyn obu tych stałych jest równy iloczynowi jonowemu wody:
![]()
(7)
W postaci logarytmicznej równanie (7) przybiera postać
![]()
(8)
Można też zapisać w postaci
![]()
(9)