REDOKSYMETRIA
REAKCJE UTLENIANIA I REDUKCJI:
REAKCJA REDUKCJI - reakcja przyłączenia elektronów:
REAKCJA UTLNENIENIA - reakcja odłączenia elektronów:
OGÓLNE RÓWNANIE REAKCJI REDOKS:
UKŁAD REDOKS - układ zawierający 2 jony, w których ten sam pierwiastek ma różne stopnie utlenienia.
SPRZĘŻONA PARA REDOKS - układ erdoks, w którym postać utleniona jest związana z postacią zredukowaną tylko wymiana elektronów. (np. Fe3+/Fe2+, Sn4+/Sn2+).
POTENCJAŁ REDOKS - potencjał elektrodowy. Charakteryzuje powinowactwo postaci utlenionej układu do elektronów. Im wyższy potencjał tym silniejszym utleniaczem jest dany układ.
POTENCJAŁ NORMALNY - potencjał w warunkach normalnych. Gdy E° > 0 postać utleniona ma silniejsze właściwości utleniające niż jony wodorowe lub postać zredukowana wywiera słabsze działanie redukujące niż wodór elementarny (reakcja przebiega w prawo).
POTENCJAŁ FORMALNY - potencjał układu redoks w przypadku, gdy analityczne stężenia postaci zredukowanej i utlenionej sa równe. Jest charakterystyczny dla danej reakcji w określonym środowisku (pH, c).

KRZYWA MIARECZKOWANIA REDOKS - wykres zmian potencjału erdoks zachodzących w czasie miareczkowania na skutek zmian stosunku stężeń postaci utlenionej i zredukowanej.
PRZYKŁAD: miareczkowanie soli Fe2+ roztworem KMnO4,
ETAP I - potencjał roztworu przed osiągnięciem PR zależy tylko od potencjału układu Fe3+/Fe2+ (dodane jony MnO4- zostały prawie całkowicie zredukowane do Mn2+):
Potencjał zależy od stosunku
, rozcieńczenie nie ma na niego wpływu.
ETAP II - PR - w punkcie równoważności następuje zrównanie potencjałów obu układów:

Z równania reakcji:
Wynika, że w PR:
Więc:
ETAP III - potencjał roztworu po przekroczeniu PR zależy wyłącznie od stosunku stężeń MnO4-/Mn2+ (jony Fe2+ zostały prawie całkowicie utlenione do Fe3+).
Wielkość skoku miareczkowania zależy od różnicy potencjałów reagujących układów i różnicy stężeń ich roztworów.
WSKAŹNIKI REDOKS - substancje barwne, które tworzą układy erdoks, przy czym postać utleniona wskaźnika jest inaczej zabarwiona niż postać zredukowana.
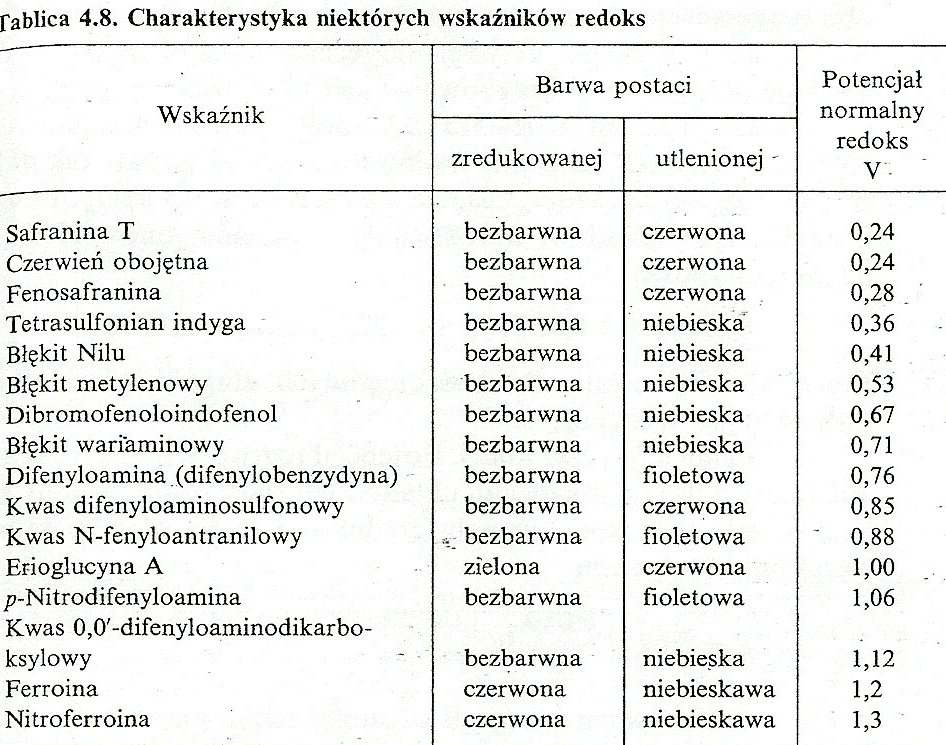
Zakładając że oko ludzkie odróżnia tylko stężenia różniące się min. 10 razy, obszar zmiany barwy wskaźnika występuje w granicach zmiany wartości potencjału redoks:
Wskaźnik można dobrać tak, aby obszar zmiany jego barwy przypadał na wartość potencjału punktu równoważności miareczkowania.
PRZYKŁAD:
Jeśli założy się, że błąd miareczkowania < 0,01%, to:
Więc wskaźnik powinien zmieniać barwę w zakresie potencjałów 0,93-1,27 V. kwas 0,0'-difenyloaminodikarboksylowy.
Oprócz wskaźników odwracalnych są także nieodwracalne, które ulegają nieodwracalnej reakcji utlenienia z równoczesna zmiana barwy (np. oranż metylowy używany do miareczkowania Sb3+ za pomocą KBRO3 - nadmiar bromianu powoduje nieodwracalne odbarwienie wskaźnika).
MANGANOMETRIA - dział oksydymetrii, w którym oznaczanie substancji prowadzi się za pomocą miareczkowania roztworem nadmanganianu potasu. Przebieg redukcji nadmanganianu zależy od pH środowiska:
W roztworze kwaśnym (0,05M H2SO4):
,
W roztworze lekko kwaśnym lub obojętnym:
,
W roztworze zasadowym (1M NaOH):
PRZYGOWANIE I MIANOWANIE - nadmanganianu potasu nie można otrzymać w postaci wystarczająco czystej, gdyż jest zanieczyszczony MnO2, a roztwory KMnO4 zmieniają miano Poczałkowo szybko, wskutek utleniania śladowych substancji organicznych na ściankach naczynia i w płynie, a polem powoli. Ponadto nadmanganian ulega rozkładowi:
Dlatego należy usunąć tlenek i substancje organiczne, gotując KMnO4 przez 30-60 min, w celu przyspieszenia redukcji. Następnie roztwór sączy się by oddzielić wydzielony tlenek. Roztwór należy chronić przed zanieczyszczeniami i światłem. Do mianowania oczyszczonego nadmanganianu stosuje się szczawian sodu (nietrwały, sporządza się go tuz przed miareczkowaniem).
Reakcja przebiega wolno, prowadzi się ja w 80°C, ale jony Mn2+ przyśpieszają proces, więc potem przyspiesza. Analit otrzymuje się przez rozpuszczenie Na2C2O4 w wodzie destylowanej i dodanie H2SO4 oraz ogrzewanie do 70°C. Miareczkuje się, aż do uzyskania trwałego, różowego zabarwienia.
MANGANOMETRYCZNE OZNACZANIE ŻELAZA - utlenienie jonów Fe2+ do Fe3+ nadmanganianem w środowisku kwaśnym.
Oznaczanie musi być poprzedzone redukcją jonów Fe3+ obecnych w próbce. Używa się SnCl2. Roztwór soli Fe3+ zakwasza się HCl i wkrapla na gorąco SnCl2, aż do odbarwienia roztworu.
Mały nadmiar chlorku należy usunąć, gdyż byłby utleniany nadmanganianem.
Należy unikać dużego nadmiaru chlorku, bo chlorek rtęci może zredukować się do wolnej rtęci, która zredukuje nadmanganian.
Pozostałe w roztworze chlorki także mogą redukować nadmanganian, więc dodaje się nadmiaru soli manganu (II), która katalizuje reakcje nie dopuszczając do zużycia titr anta na chlorki. Żółte zabarwienie powstający w wyniku tworzenia jonów Fe3+ usuwa się dodając H3PO4 (roztwór Zimmermanna-Reinhardta), który wiąże jony w bezbarwny kompleks.
CHROMIANOMETRIA - metoda oznaczania substancji za pomocą miareczkowania mianowanym roztworem dwuchromianu potasu, który ma właściwości pierwotnej substancji wzorcowej i tworzy trwałe roztworu. Dwuchromian jest słabszym utleniaczem niż nadmanganian (ma niższy potencjał). Główną zaleta dwuchromianu jest to, że nie utlenia chlorowodoru, używanego to rozpuszczania stopów i rud.
,
CHROMIANOMETRYCZNE OZNACZANIE ŻELAZA - tak jak nadmanganianem, do fioletowego zabarwienia.
Wyszukiwarka