Gr.30
Sprawozdanie
Temat: Pomiar ciepła spalania za pomocą bomby kalorymetrycznej.
1.Cel ćwiczenia:
Celem ćwiczenia laboratoryjnego było wyznaczenie ciepła spalania próbki paliwa stałego w postaci pastylki kwasu benzoesowego C7H6O2 w bombie kalorymetrycznej.
2. Schemat stanowiska:
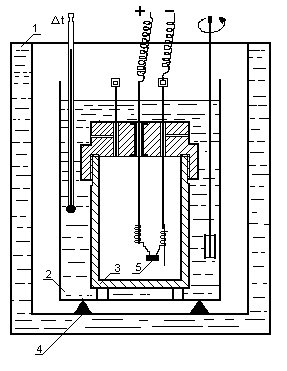
3. Dane i wyniki pomiarów:
Dane:
S=13337 J/K - stała kalorymetru
Qsd=6698,90 KJ/kg - ciepło spalania drutu
Wyniki pomiarów:
mdp=0,00765g - masa drutu oporowego przed spaleniem
mpid=1,37890g - masa pastylki paliwa z drutem oporowym
mp=mpid- mdp= 1,37890g - 0,00765g = 1,37125g - masa paliwa
temperatura w płaszczu - 20,5 [0C]
temperatura wody w naczyniu - 19,5 [0C]
t1 = 19,030 [0C]
t2 = 19,056 [0C]
t3 = 21,822 [0C]
t4 = 21,816 [0C]
x = 11- czas w minutach w ciągu którego następował wzrost temperatury po zapłonie
4. Obliczenia:
poprawka temperaturowa
poprawka uwzględniająca ciepło wydzielone przy spalaniu drutu
Δmsd = masa drutu oporowego, która uległa spaleniu
mdp = masa początkowa drutu
mdk= masa drutu po procesie spalania
Qdd - ciepło powstałe w wyniku spalania drutu
Qsd - ciepło spalania drutu
ciepło spalania paliwa
Równanie bilansowe
Qp - ciepło uzyskane ze spalania
Qs - ciepło ze spalania paliwa
Qdk - ciepło wydzielone przy tworzeniu kwasu siarkowego
Qs- ciepło spalania paliwa , czyli ciepło powstałe w wyniku całkowitego i zupełnego spalania kwasu benzoesowego
porównanie wyniku z wartością tablicową oraz obliczenie błędu względnego
Qst - ciepło spalania kwasu benzoesowego według tablic
ε - błąd względny pomiaru
5.Wnioski:
Pomiar polega na całkowitym spaleniu próbki paliwa w atmosferze tlenu pod
ciśnieniem w bombie kalorymetrycznej zanurzonej w wodzie i na pomiarze przyrostu
temperatury tej wody. Między naczyniem kalorymetrycznym a termostatem zachodzi
wymiana ciepła poprzez promieniowanie, przewodzenie i konwekcję. Wymianę tę
uwzględnia się w obliczeniach w postaci tzw. poprawki na przekazywanie ciepła.
W płaszczu kalorymetru znajduje się mieszadło ręczne służące do wyrównania temperatury wody. Pomiar przyrostu temperatury dokonywany jest za pomocą specjalistycznego i precyzyjnego czujnika umieszczonego w naczyniu kalorymetrycznym.
Po wyjęciu bomby z kalorymetru należy sprawdzić czy spalanie było zupełne, tj. czy pastylka paliwa spaliła się w całości.
Podczas przeprowadzania ćwiczenia, pomimo zachowania wszelkich środków ostrożności i stosowania się do ściśle określonych zasad jego wykonywania, pomiary obarczone są błędami, np.:
niecałkowite spalenie pastylki;
niejednakowa intensywność parowania wody z naczynia kalorymetrycznego;
różnice w warunkach prowadzenia pomiarów z warunkami wyznaczania ciepła spalania paliwa;
Pomimo obecności tych błędów, użycie bomby kalorymetrycznej zalicza się do jednej z najdokładniejszych metod pomiarowych w technice cieplnej. Potwierdza to również uzyskany przez nas wynik, który odbiega od wzorca o niespełna 2%.
1 - płaszcz kalorymetru wypełniony wodą
2 - naczynie kalorymetryczne z wodą
3 - bomba kalorymetryczna
4 - izolująca podstawa
5 - pastylka
Wyszukiwarka