WIEiK Grupa 12 |
Szymon Łukasik |
Zespół nr 9 |
Data wykonania: 23.03.2001 |
Nr ćwiczenia: 11 |
Wyznaczanie równoważnika elektrochemicznego wodoru
|
Ocena: |
Podpis: |
1. Wprowadzenie
Elektrolitem nazywamy przewodnik elektryczny zawierający ruchome jony - są nimi roztwory (najczęściej wodne) soli, kwasów i zasad oraz roztopione kryształy jonowe np. sól kuchenna. Elektrolizą nazywamy proces przepływu prądu przez elektrolit wraz z towarzyszącymi reakcjami chemicznymi - rozkładem kwasów, soli i zasad na składowe związki chemiczne - substancje te wydzielają się na elektrodach.
Prąd elektryczny, przepływając przez elektrolit, wydziela na elektrodach produkty dysocjacji elektrolitycznej . I prawo Faraday`a mówi, że masa jonów m wydzielona na elektrodzie jest proporcjonalna do przepływającego ładunku :
![]()
gdzie stałym współczynnikiem proporcjonalności jest k - równoważnik elektrochemiczny . Jest on liczbowo równy masie substancji wydzielonej przy przepływie przez elektrolit ładunku 1C.
II Prawo Faraday`a mówi z kolei, że masy substancji wydzielonych na elektrodach przy przepływie tego samego ładunku są proporcjonalne do odpowiednich równoważników chemicznych
![]()
równoważnikiem chemicznym nazywamy iloczyn masy atomowej substancji i wartościowości jonu.
![]()
(3)
Jako stałą Faraday`a definiujemy stosunek równoważnika chemicznego do równoważnika elektrochemicznego danej substancji:
![]()
(4)
Przepływ ładunku o takiej wartości przez elektrolit powoduje wydzielenie 1 równoważnika chemicznego substancji.
Stałą Faraday`a można również wyrazić wzorem:
![]()
(5)
gdzie qj - ładunek jonu , NA - liczba Avogadra
Rys.l. Schemat układu pomiarowego z woltametrem
2. Metoda pomiaru i obliczenia
Wyznaczania równoważnika elektrochemicznego wodoru,stałej Faraday`a i ładunku jonu wodorowego
Do tego celu używamy woltametru wodnego. Są to trzy szklane naczynia połączone ze sobą (rys.l). W dwóch biuretach, zaopatrzonych w szczelne korki, zbierają się gazowe produkty elektrolizy. Platynowe płytki, zamocowane w gumowych korkach zamykających od dołu biurety, służą jako elektrody. Środkowa rurka, zakończona otwartą bańką, służy do zbierania wypieranej cieczy i daje możliwość pomiaru ciśnienia hydrostatycznego wywieranego przez elektrolit na gazy.
Woltametr zasilany jest z zasilacza prądu stałego (12 V) poprzez regulowany opornik R, służący do ustalania stałej wartości prądu (pomiędzy 0,2 a 1,0 A). Woltametr wypełniony jest 10% roztworem kwasu siarkowego (H2 SO4 ). Podczas elektrolizy na elektrodzie dodatniej wydziela się tlen, a na ujemnej wodór. Możemy jednak wyznaczyć tylko równoważnik elektrochemiczny wodoru, ponieważ tlen w znacznym stopniu rozpuszcza się w roztworze.
wartość równoważnika elektrochemicznego wyznaczamy dla 3 różnych natężeń prądów zgodnie ze wzorem :
![]()
masa wodoru znajdująca się we wzorze (1) wyliczana jest z równania stanu gazu i zależności m=ρV:
![]()
Ciśnienie suchego wodoru obliczamy jako sumę ciśnienia atmosferycznego p1,ciśnienia hydrostatycznego p2=ρrhg pomniejszoną o ciśnienie p3 nasyconej pary wodnej w biurecie przy danej temperaturze.
z tablic odczytano :
gęstość roztworu (ρr): |
1,07*103 |
kg/m3 |
gęstość wodoru (ρ0): |
0,0897 |
kg/m3 |
ciśn . normalne p0 |
1,01*105 |
Pa |
temp. normalna T0 |
273 |
K |
g |
9,81 |
m/s2 |
a dla obliczenia stałej Faraday`a(wg. wzoru 6) i ład jonu wodorowego (ze wzoru 7) dodatkowo:
wartościowość jonów z : |
1 |
|
masa atomowa substancji A: |
1,008*10-3 |
kg/mol |
liczba Avogadra NA |
6,02*1023 |
mol-1 |
OTO OTRZYMANE WYNIKI - obliczenia dla 2-go pomiaru na str. 8 :
LP: |
I[A] |
t[s] |
h1[m.] |
h2[m.] |
h[m] |
p3[Pa] |
p2=qrhg[Pa] |
p1[hPa] |
p=p1+p2-p3[Pa] |
T[0C] |
V[cm3] |
wyznaczone k[kg/As] |
stała Faradaya[C/mol] |
ładunek jonu[C]: |
1 |
0,240 |
758,2 |
0,239 |
0,514 |
0,275 |
3,35*103 |
2,88*103 |
985 |
9,80*104 |
260 |
24,9 |
1,09*10-8 |
9,27*104 |
1,54*10-19 |
2 |
0,310 |
686,2 |
0,219 |
0,514 |
0,295 |
3,99*103 |
3,09*103 |
985 |
9,76*104 |
290 |
24,9 |
1,02*10-8 |
9,88*104 |
1,64*10-19 |
3 |
0,350 |
594,6 |
0,236 |
0,513 |
0,277 |
4,48*103 |
2,90*103 |
985 |
9,69*104 |
310 |
25,0 |
9,28*10-9 |
1,09*105 |
1,80*10-19 |
niedokładność pomiaru: |
0,001 |
0,1 |
0,0005 |
0,0005 |
wzór (11) |
odczyt z tablic |
wzór(10) |
1 |
wzór(9) |
0,50 |
0,25 |
wzór(8) |
- |
- |
t - czas elektrolizy
I - natężenie prądu
h1,h2,h - wysokości (zgodnie z rys.1)
V - objętość wydzielonego wodoru
T - temperatura roztworu
OKREŚLENIE BŁĘDU POMIAROWEGO PRZY WYZNACZANIU RÓWNOWAŻNIKA ELEKTROCHEMICZNEGO WODORU DLA JEDNEGO Z POMIARÓW:
Nie jesteśmy w stanie wyznaczyć niepewności przypadkowych więc korzystamy ze wzoru na max. niepewność względną wielkości wyrażonej za pomocą iloczynu potęg wielkości prostych:
(8) 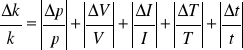
gdzie jako niepewności V,I,T,t - przyjmujemy niepewności systematyczne - połowę działki przyrządu pomiarowego.
Zaś niepewność wyznaczania ciśnienia p uzyskujemy ze wzoru:
(9)![]()
gdzie: ![]()
- połowa działki barometru znajdującego się w pracowni a ![]()
wyliczone zostało ze wzoru:
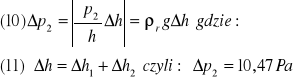
czyli podsumowując maksymalna niepewność względna przy wyznaczaniu równoważnika el.-chem. wodoru liczymy ze wzoru:
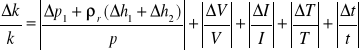
co dla pomiaru pierwszego daje max. błąd względny:
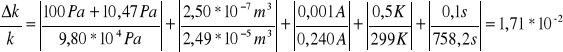
niepewność procentowa wynosi więc:
![]()
a błąd maksymalny:
![]()
czyli wyznaczone k:
![]()
wartość tablicowa:
![]()
3. Wnioski
W doświadczeniu wyznaczono wartości równoważnika dla 3 natężeń prądów: 0,24A , 0,31A , 0,34 A - wynoszą one odpowiednio 0,0109*10-6kg/As | 0,0102*10-6kg/As | 0,00928*10-6kg/As - określiłem błąd przy pierwszym pomiarów jako 0,000186*10-6kg/As. Wartość tablicowa wynosi 0,0104*10-6kg/As - najbliższy niej jest wynik z drugiego pomiaru. Wynik tablicowy nie mieści się w oszacowanym marginesie niepewności pomiarowej - wynika to najprawdopodobniej z niemożności uwzględnienia w obliczeniach niepewności przypadkowej [zbyt mała liczba pomiarów] - rachunek błędu opiera się na określeniu niepewności systematycznej.
W wyniku doświadczenia uzyskaliśmy także wartość stałej Faraday`a równą: 9,27*104 C | 9,88*104 C | 1,09*105 C - wartość tablicowa wynosi : 9,65*104C, a także ładunek jonu wodorowego : 1,54*10-19C | 1,64*10-19C | 1,80*10-19C - wartość tablicowa wynosi : 1,60*10-19C.
OBLICZENIA dla 2-go pomiaru:
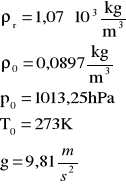
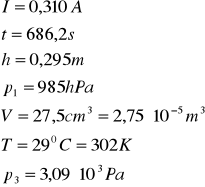
więc:
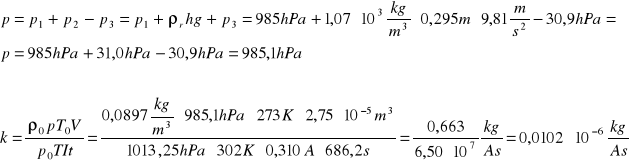
ostatecznie:
![]()
STAŁA FARADAY`A:
z = 1
A = 1,008*10-3 kg/mol
co daje po podstawieniu do wzoru na stałą Faraday`a:
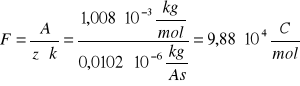
ŁADUNEK JONU WODOROWEGO:
NA = 6,02*1023 mol-1
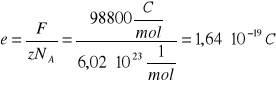
1
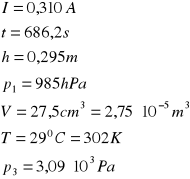
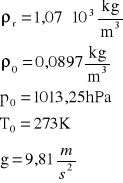
Wyszukiwarka