Monika Paździor
Gr. 5
budownictwo
Ćwiczenie 24
Temat: Wyznaczanie ciepła topnienia lodu
Topnienie jest przemianą fazową polegającą na przejściu ciała stałego w ciecz. Topnienie jest więc związane ze zmianą stanu skupienia substancji. Procesem odwrotnym do topnienia jest krzepnięcie. Topnienie ciał krystalicznych zachodzi zawsze w określonej temperaturze, zwanej temperaturą topnienia.
Temperatura topnienia zależy od ciśnienia. Dla większości ciał, które zwiększają swoją objętość podczas topnienia, ze wzrostem ciśnienia wzrasta temperatura topnienia. W przypadku ciał, które zmniejszają swoją objętość podczas topnienia ( np. lód) zależność ta ma przeciwstawny charakter.
Proces topnienia jest związany z pobieraniem ciepła. Celem niniejszego ćwiczenia jest pomiar ciepła topnienia lodu. Ciepłem topnienia jest to ilość ciepła, jaką należy dostarczyć jednostce masy ciała stałego, znajdującego się w temperaturze topnienia, aby zmieniło się ono w ciecz o tej samej temperaturze. Jeśli w celu stopienia ![]()
kilogramów ciała dostarczono ciepła w ilości Q, to ciepło ![]()
można wyrazić wzorem
![]()
Ponieważ w układzie SI ilość ciepła, jak każdy rodzaj energii, mierzymy w dżulach [J], więc jednostką ciepła topnienia jest J/kg.
W celu wyznaczenia ciepła topnienia lodu wprowadzimy określoną ilość lodu, o temperaturze topnienia, do kalorymetru z wodą o temperaturze początkowej ![]()
, nieco wyższej od temperatury otoczenia. Kalorymetr jest to naczynie o podwójnych, odizolowanych ściankach i małej pojemności cieplnej; najczęściej kalorymetry wykonane są z aluminium. Kalorymetr powinien chronić ciała znajdujące się w nim przed wymianą ciepła z otoczeniem. Wskutek różnicy temperatur między lodem i wodą znajdującą się w kalorymetrze, lód pobiera ciepło od wody i kalorymetru , co powoduje jego topnienie. Woda powstała z lodu, mająca w chwili początkowej temperaturę topnienia, również pobiera ciepło od kalorymetru i zawartej w nim wody. Proces przepływu ciepła kończą się w chwili wyrównania się temperatur - ustala się wówczas pewna temperatura końcowa ![]()
.W celu wyznaczenia ciepła topnienia lodu wykorzystujemy wzór:
![]()
gdzie:
![]()
![]()
masa kalorymetru, wody, lodu.
![]()
temperatura początkowa, końcowa, topnienia.
![]()
ciepło właściwe kalorymetru, wody.
Tabela pomiarowa
Numer pomiaru |
I |
II |
III |
||
Masa pustego kalorymetru z mieszadłem |
mk |
[kg] |
0,08072 |
||
Ciepło właściwe kalorymetru |
ck |
[J/kg] |
896 |
||
Ciepło właściwe wody |
cw |
[J/kg] |
4,19*10 5 |
||
Masa kalorymetru z wodą |
m1 |
[kg] |
0,30174 |
0,266 |
0,276 |
Masa wody w kalorymetrze |
mw |
[kg] |
0,22102 |
0,171 |
0,181 |
Temp. początkowa wody i kalorymetru |
t0 |
[˚C] |
29,6 |
29,5 |
28,4 |
Temperatura końcowa układu |
tk |
[˚C] |
7,6 |
24,5 |
24,3 |
Masa kalorymetru z wodą i stopionym lodem |
m2 |
[kg] |
0,36886 |
0,271 |
0,284 |
Masa stopionego lodu |
ml |
[kg] |
0,06712 |
0,012 |
0,008 |
Ciepło topnienia lodu |
l |
[J/kg] |
|
|
|
Średnie ciepło topnienia lodu |
l śr |
[J/kg] |
|
||
Wartość tablicowa ciepła topnienia lodu |
l tab |
[J/kg] |
3,32*10 5 |
||
Błąd bezwzględny wartości tablicowej |
Δl tab |
[J/kg] |
|
||
Błąd względny wartości tablicowej |
Δl tab/ltab |
[%] |
|
||
Zmiana entropii układu |
ΔS |
[J/K] |
|
||
Obliczenia :
Pierwszy pomiar:
mw = 0, 30174kg - 0,08072 kg = 0,22102 kg
ml = 0,36886 kg - 0, 30174 kg = 0,06712 kg
![]()
![]()
![]()
[J/kg]
l1= {[0,08072kg * 896J/(kg*K) + 0,22102kg * 4190 J/(kg*K)]*(29,6˚C-7,6˚C) - 0,06712kg * 4190 J/(kg*K) * (7,6˚C -0˚C)} / 0,06712 kg = 2,954*10 5 J/kg
Drugi pomiar:
mw = 0,31366 kg - 0,08072 kg = 0,23294 kg
ml = 0,38925 kg - 0, 31366 kg = 0,07559 kg
![]()
![]()
![]()
[J/kg]
l2= {[0,08072kg * 896J/(kg*K) + 0,23294kg * 4190J/(kg*K)]*(33˚C-8,4˚C) - 0,07559kg * 4190 J/(kg*K) * (8,4˚C -0˚C)} / 0,07559 kg = 3,05922*10 5 J/kg
Trzeci pomiar:
mw = 0,28362 kg - 0,08072 kg = 0,2029 kg
ml = 0, 33092kg - 0, 28362 kg = 0,0473 kg
![]()
![]()
![]()
[J/kg]
l3= {[0,08072kg * 896J/(kg*K) + 0,2029kg * 4190J/(kg*K)] * (32,4˚C-14,8˚C) - 0,0473kg * 4190J/(kg*K) * (14,8˚C -0˚C)} / 0,0473 kg = 2,81235*10 5 J/kg
lśr = [2,954*10 5 J/kg 5 3,05922*10 5 J/kg + 2,81235*10 5 J/kg] / 3 = 2,9419*10 5 J/kg
Zmiana entropii układu ( na podstawie III pomiaru)
ΔS1 = (0,06712 kg * 2,954*10 5 J/kg) /273,15 K = 72,5874J/K
ΔS2 = 0,06712 kg * 4190 J/(kg*K) * ln (280,75 K / 273,15 K) =7,718 J/K
ΔS3 = [0,2029 kg * 4190 J/(kg*K) + 0,08072 kg n* 896 J/(kg*K)]*ln (280,75 K / 305,55 K) =-78,0865 J/K
ΔS = ΔS1 + ΔS2 + ΔS3 = 2,2189 J/K
Rachunek błędów
Błąd wyniku końcowego obliczamy na podstawie znanych błędów pomiarów pośrednich, posługując się metodą różniczki zupełnej.
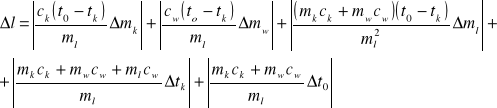
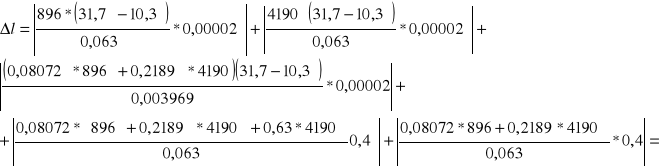
Przyjmujemy, że :
- ∆mk = ∆mw = ∆ml = 2∆m, gdzie ∆m oznacza dokładność ważenia
- ∆tk = ∆t0 równe jest wartości najmniejszej podziałki na termometrze.
∆m = 0,00001 kg
∆t = 0,4˚C
Błąd względny względem wartości tablicowej:
(Δltab / ltab )*100% =
Wnioski
Na zróżnicowane wyniki poszczególnych pomiarów wpływ miały następujące czynniki:
- różne temperatury początkowe układów,
-różne wielkości użytych kostek lodu,
-nieszczelny lub niedokładnie izolowany kalorymetr.
4
Wyszukiwarka