ZAKŁAD CHEMII FIZYCZNEJ
ĆWICZENIE NR 21
KINETYKA AUTOKATALITYCZNEJ REAKCJI JODOWANIA ACETONU
APARATURA:
- TERMOSTAT
- TERMOMETR CYFROWY
- 2 KOLBY MIAROWE O POJ. 250 ML
- 2 PROBÓWKI
- 4 KOLBY STOŻKOWE
- BIURETA
- PIPETA
ODCZYNNIKI:
- 4% ROZTWÓR KJ
- 1 n ROZTWÓR HCl
- 0.1 n ROZTWÓR NaHCO3
- 0.01 n ROZTWÓR Na2S2O3
- ROZTWÓR SKROBII
CEL ĆWICZENIA:
Celem ćwiczenia jest wyznaczenie stałej szybkości reakcji jodowania acetonu w oparciu o pomiary stężeń jodu w funkcji czasu podczas jodowania acetonu w środowisku kwaśnym. Stężenie jodu wyznacza się metodą miareczkowania tiosiarczanem sodowym, który ma właściwości redukujące jod.
Reakcja przebiega zgodnie z równaniem:
2 Na2S2O3 + J2 → Na2S4O6 + 2 NaJ
WYKONANIE ĆWICZENIA:
Do dwóch kolb miarowych wprowadza się 0,1m roztwór jodu w 4% KJ. Do każdej z kolb dodaje się 1 n roztworu kwasu solnego i wodę. Kolby z roztworem umieszcza się w termostacie w temp. 30oC. W termostacie umieszcza się również dwie zamknięte probówki z acetonem. Podczas termostatowania próbek należy wykonać tzw. „ślepą próbę” w celu wyznaczenia stężenia początkowego jodu. W tym celu do kolby miarowej wprowadza się niewielką objętość roztworu jodu o takim samym stężeniu jak w reakcji, dopełnia się wodą destylowaną i miareczkuje mianowanym roztworem tiosiarczanu sodowego. Początkowo miareczkowany roztwór robi się ciemno brązowy, a pod koniec miareczkowania lekko żółty.
Wówczas dodajemy kilka kropli skrobi, w wyniku czego roztwór staje się granatowy. Miareczkujemy dalej aż do zupełnego odbarwienia się roztworu.
Po 10-15min. Termostatowania wlewa się aceton do roztwory jodu, notuje czas dodania jako moment rozpoczęcia reakcji, uzupełnia kolby wodą destylowaną i miesza. Następnie pobiera się próbki do analizy i wprowadza je do kolbek z 0,1 n roztworem NaHCO3, notując czas przerwania reakcji i miareczkuje się próbki 0,01 n roztworem tiosiarczanu sodowego w obecności skrobi. Notujemy objętość tiosiarczanu zużytego do miareczkowania. Kolejne próbki roztworu reakcyjnego należy pobierać w odstępach, co 15min. I miareczkować jak poprzednio.
OBLICZENIA
Stężenie początkowe jodu:
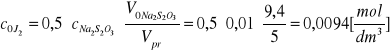
gdzie: c Na2S2O3 - stężenie roztworu Na2S2O3 [gR/dm3]
V0 Na2S2O3 - objętość roztworu Na2S2O3 zużytego na analizę ślepej próby
[cm3]
Vpr - objętość próbki wziętej do analizy [cm3]
Stężenie aktualne jodu:
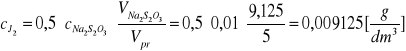
gdzie: V Na2S2O3 - objętość roztworu Na2S2O3 zużytego na analizę próbki
po czasie t [cm3]
Zmiana stężenia jodu po czasie t (ubytek stężenia acetonu):
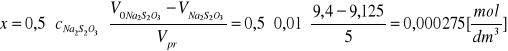
Stężenie początkowe acetonu:
![]()
gdzie: Vac -objętość acetonu wziętego do reakcji [cm3]
ρac - gęstość acetonu [g/cm3]
Mac - masa cząsteczkowa acetonu [g/mol]
Vkol - objętość mieszaniny reakcyjnej (kolby) [cm3]
Stężenie początkowe jonów wodorowych:
![]()
gdzie: VHCl - objętość dodanego HCl [cm3]
cHCl - stężenie roztworu HCl [mol/dm3]
Równanie:
![]()
Opracowane wyniki:
Nr pomiaru |
Godzina pomiaru |
Czas trwania reakcji t [min] |
Objętość V [cm3] |
Stężenie jodu mol/cm3 |
Ubytek stężenia acetonu mol/cm3 |
y |
|
|
|
|
|
|
|
0 |
13.00 |
0 |
9,4 |
0,009400 |
0,000000 |
0,000000 |
1 |
13.15 |
15 |
9,125 |
0,009125 |
0,000275 |
0,006094 |
2 |
13.30 |
45 |
8,275 |
0,008275 |
0,001125 |
0,022717 |
3 |
13.45 |
60 |
7,275 |
0,007275 |
0,002125 |
0,039057 |
4 |
14.00 |
75 |
6,275 |
0,006275 |
0,003125 |
0,052921 |
∑195 ∑0,1208
Wyznaczanie współczynnika kierunkowego prostej y=f(t) metodą najmniejszych kwadratów
![]()
![]()
![]()
![]()
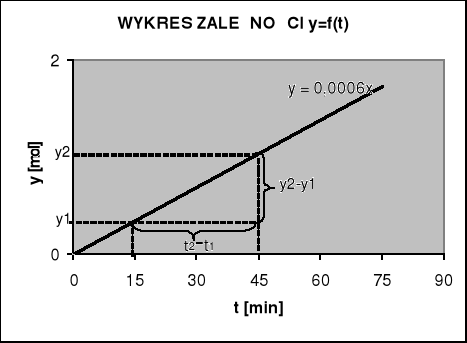
Wyznaczanie współczynnika kierunkowego prostej metodą graficzną
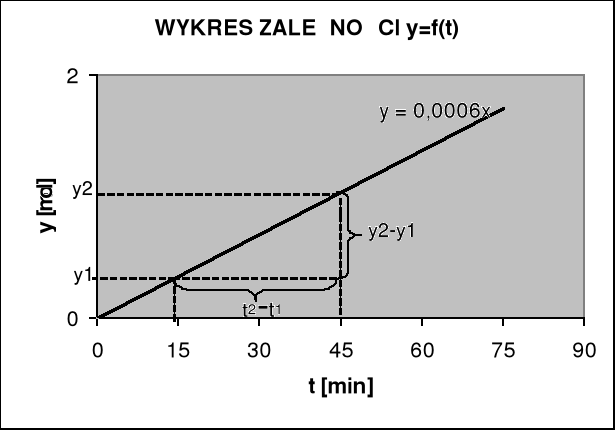
t1=15 t2=45
y1=0,009 y2=0,027
![]()
![]()
![]()
Wyszukiwarka