![]()
- standardowe potencjały chemiczne składnika 3 w fazach I i II,
GRUPA NR: 24. ZESPÓŁ: 2. |
ĆWICZENIE NR: 7
Współczynnik podziału słabego kwasu pomiędzy fazą wodną a organiczną.
|
DATA WYKONANIA ĆWICZENIA: 04.05.2004 r. |
ZESPÓŁ:
|
|
OCENA:
|
1. WSTĘP TEORETYCZNY:
Rozważając układ izotermiczno - izobaryczny złożony z dwóch praktycznie nie mieszających się cieczy 1 i 2 otrzymujemy układ 2 - fazowy ciekły, a wytworzone fazy nazwać można fazą I i II.
Faza I jest nasyconym roztworem składnika 2 w 1, faza II jest nasyconym roztworem składnika 1 w 2. Wprowadzając do jednej z tych faz substancję 3 (słaby kwas organiczny) rozpocznie się proces przenoszenia przez granicę faz substancji 3. Proces ten będzie trwał do chwili ustalenia się równowagi termodynamicznej. Zgodnie z zasadą termodynamiki dla układów wielofazowych w stanie równowagi potencjały chemiczne składnika 3 muszą być jednakowe dla obu faz.
![]()
- standardowe potencjały chemiczne składnika 3 w fazach I i II,
a zatem:
![]()
- ![]()
-odpowiednia aktywność składnika 3 w fazach I i II
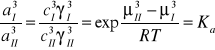
Stan standardowy wybrano tak, że współczynniki aktywności są równe jedności w roztworach nieskończenie rozcieńczonych.
Dla realnych stężeń określa się tzw. współczynnik podziału Nernsta wyrażany przy pomocy stężeń:
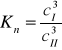
Współczynnik podziału Nernsta jest to stosunek stężeń składnika występującego w obu fazach w postaci cząsteczek jednego typu.
Tak zdefiniowany współczynnik podziału zmienia się ze stężeniem dlatego, że roztwory nie są doskonałe.
W szczególnym przypadku składnik 3 jest w fazie I częściowo zdysocjowany, a w fazie II częściowo zasocjowany.
2. CEL ĆWICZENIA:
Na podstawie miareczkowania kwasu w fazie ksylenowej należy wyznaczyć graficznie współczynnik podziału kwasu między fazą wodną, a ksylenową oraz stałą równowagi asocjacji kwasu w fazie ksylenowej. Do dyspozycji dany jest układ trójskładnikowy dwufazowy kwas benzoesowy - woda - ksylen.
3. ZADANE PARAMETRY:
Dane są trzy naważki kwasu benzoesowego, odpowiednie objętości cieczy, tzn. ksylenu i wody. Doświadczenie prowadzi się w stałej temperaturze otoczenia. Te dane początkowe determinują zarówno stężenia każdego składnika w mieszaninie trójskładnikowej, jak i odpowiednie stężenia w fazach I i II po procesie dyfuzji przez granicę faz. W funkcji tych danych można wyznaczyć poszukiwane parametry, tzn. współczynnik podziału oraz stałą równowagi asocjacji - będące celem ćwiczenia.
4. SPOSÓB WYKONANIA ĆWICZENIA:
Przygotowanie trzech kolejnych naważek kwasu benzoesowego.
Rozpuszczenie naważek w trzech porcjach 25 ml ksylenu, w trzech kolbach Erlenmayer'a.
Przelanie roztworów do trzech szczelnych rozdzielaczy, zadanie każdego roztworu 35 ml wody.
Wytrząsanie trzech mieszanin, każdą w czasie minimum 20 minut, w celu dokładnego wymieszania i dyfuzji składnika 3 do dwóch faz, które się wytworzyły.
Pozostawienie rozdzielaczy w stanie stabilnym, każdy minimum po 30 minut, tak, aby nastąpiło dokładne rozwarstwienie dwóch faz i ich wzajemne oczyszczenie.
Pobranie próbek 5-mililitrowych z fazy wodnej (o większej gęstości, a więc znajdującej się u podstawy rozdzielacza) - z każdego rozdzielacza po dwie próbki.
Miareczkowanie każdej próbki w stałej temperaturze otoczenia, za pomocą 0,01M NaOH, w obecności fenoloftaleiny, aż do pojawienia się lekko różowego zabarwienia nie zanikającego po kilku sekundach.
Należy przeprowadzić sześć miareczkowań - po dwa dla każdego zestawu próbek z trzech rozdzielaczy.
5. WYNIKI POMIARÓW:
ZESTAWIENIE DANYCH DOŚWIADCZALNYCH |
||||||||
TEMPERATURA: |
||||||||
OBJĘTOŚĆ WODY / FAZY WODNEJ: |
||||||||
OBJĘTOŚĆ KSYLENU / FAZY KSYLENOWEJ: |
||||||||
OBJĘTOŚĆ PRÓBKI FAZY WODNEJ |
||||||||
STĘŻENIE ZASADY |
||||||||
MASA MOLOWA KWASU: |
||||||||
STAŁA DYSOCJACJI KWASU: |
||||||||
L.P. |
m |
|
|
|
|
|
|
|
|
[g] |
[-] |
[-] |
[-] |
[-] |
[-] |
[-] |
|
1 |
0.75 |
0.0169 |
0.2222 |
0.0597 |
0.0159 |
13.1479 |
13.9748 |
8.45 |
2 |
0.85 |
0.0184 |
0.2529 |
0.0573 |
0.0173 |
13.7446 |
14.6185 |
9.20 |
3 |
0.95 |
0.0195 |
0.2842 |
0.0557 |
0.0184 |
14.5744 |
15.4457 |
9.75 |
Przeliczenie stężenia ![]()
- całkowitego stężenia w fazie wodnej:
W momencie odmiareczkowania kwasu zawartego w fazie wodnej zasadą sodową o konkretnym stężeniu (gdy roztwór się nie odbarwia) można zapisać równość:
![]()
.
W związku z tym można zapisać zależność na stężenie kwasu w fazie wodnej:
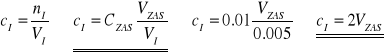
.
Z kolei stężenie ![]()
- całkowite stężenie w fazie ksylenowej, określa się na podstawie bilansu składnika rozpuszczonego:
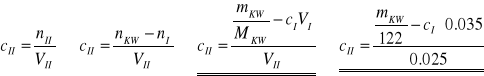
Stopień dysocjacji liczy się w oparciu o wyrażenie na stałą dysocjacji kwasu:
![]()
OPRACOWANIE DANYCH DOŚWIADCZALNYCH:
Dla układu trójskładnikowego dwufazowego kwas benzoesowy - woda - ksylen można zapisać równanie łączące charakterystyczne wielkości zadane i szukane:
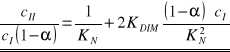
Jest to zarazem równanie prostej y = a x + b, jeżeli przyjmie się następujące założenia:
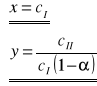
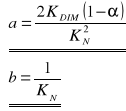
W związku z tym można obliczyć wartości dwóch stałych charakterystycznych:
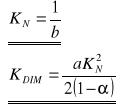
Należy jeszcze określić metodą regresji liniowej współczynniki prostej, a i b:
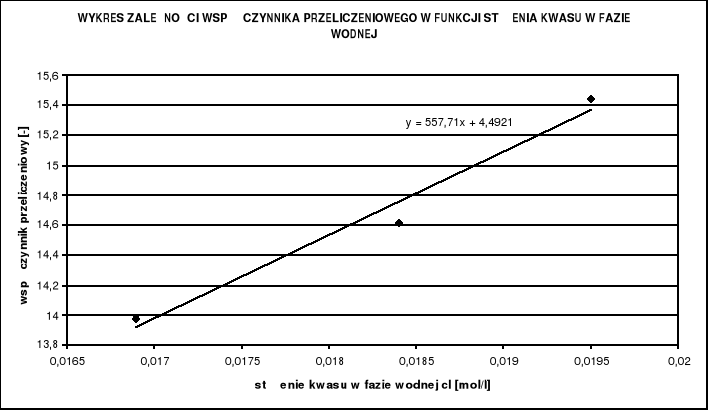
Stałe wynoszą odpowiednio:
![]()
![]()
Przyjęte zostało założenie, że stopień dysocjacji w tak niewielkim przedziale stężeń i przy niezmiennych warunkach układu wykazuje niewielkie fluktuacje, więc do obliczenia stałej można przyjąć wartość średnią z trzech wartości cząstkowych:
![]()
6. DYSKUSJA WYNIKÓW:
Otrzymane wyniki mogą w istotnym stopniu różnić się od wartości tabelarycznych otrzymanych teoretycznie lub w wyniku przeprowadzenia bardziej precyzyjnych badań. Do zwiększenia poprawności wyników obliczeń mogłoby się przyczynić zwiększenie liczby pomiarów, zakresu stężeń i innych wielkości charakteryzujących układ badawczy.
7. WNIOSKI KOŃCOWE:
Aby uzyskać wartości liczbowe stałych charakteryzujących układy wieloskładnikowe wielofazowe ciekłe o ograniczonej rozpuszczalności, dodatkowo z obecnością rozpuszczonego składnika stałego, należy określić warunki panujące w takim układzie. Trzeba więc przeprowadzić bilans składników po ustaleniu się stanu równowagi, przewidzieć rodzaj wzajemnych oddziaływań cząsteczek stanowiących układ, a także ustalić zależność parametrów układu od czynników zewnętrznych. Odpowiednia liczba równań pozwala na wyznaczenie poszukiwanych wartości stałych.
Przyczyny trudności i ewentualnych błędów:
Podstawowym problemem było ustalenie równowagi w układzie, gdyż wytrząsanie zachodziło w ograniczonym przedziale czasu, więc nie zaszła pełna dyfuzja kwasu z fazy organicznej do fazy wodnej, aby ustalił się pełny stan równowagi potrzeba - oprócz nieskończonego przedziału czasu - także nieskończonej powierzchni styku faz, co w warunkach laboratoryjnych jest oczywiście niewykonalne.
Czas rozwarstwiania dwóch faz w stabilnych rozdzielaczach także mógł być zbyt krótki.
Na dokładność miareczkowania mógł mieć wpływ tzw. błąd kropli oraz niemożność dokładnego uchwycenia momentu zobojętnienia kwasu, gdyż mogły wystąpić w kolbie lokalne odstępstwa od izotropowego rozkładu stężeń roztworu, a tym samym potrzeba było minimalnie różnej ilości zasady.
1