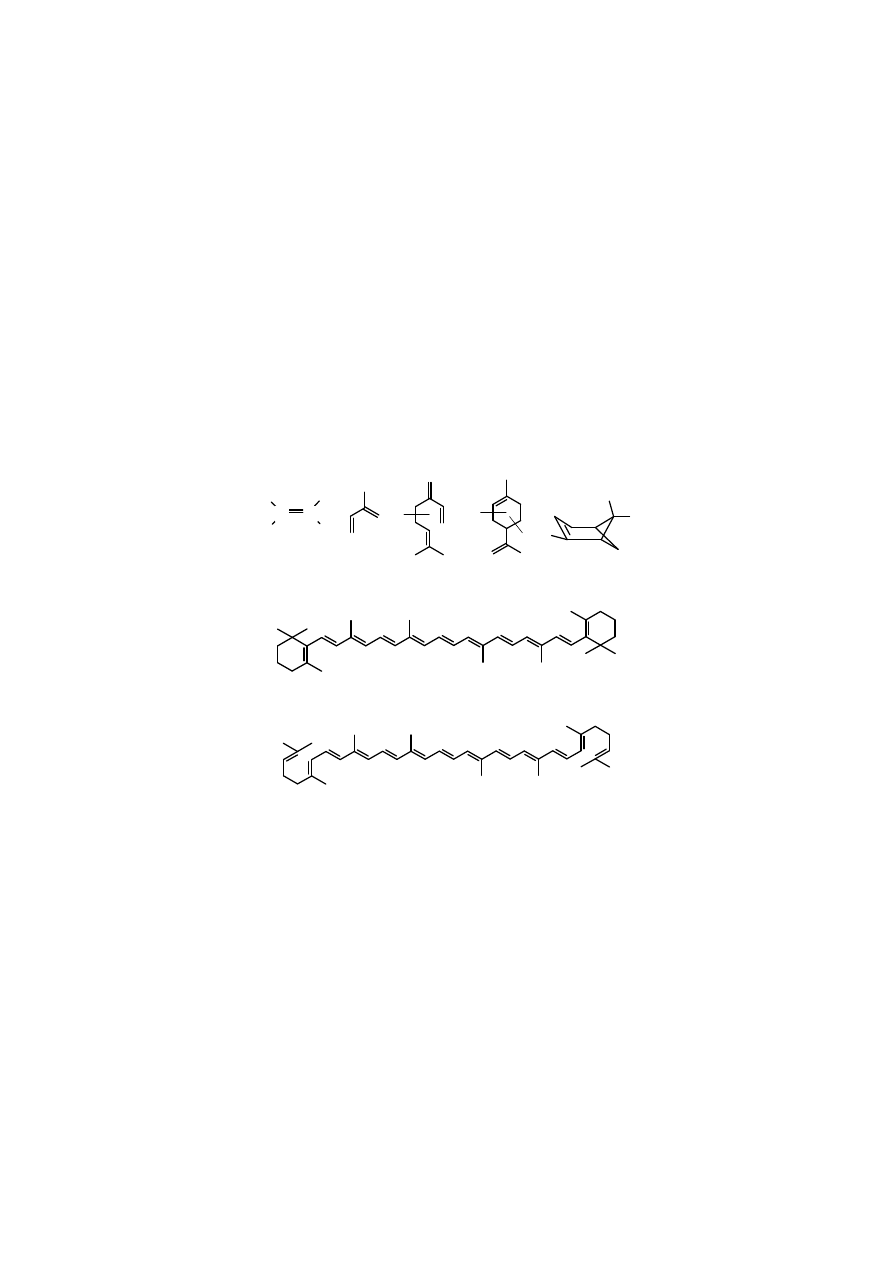
A L K E N Y
Węglowodory o wzorze sumarycznym C
n
H
2n
mogą być alkenami, jeżeli zawierają jedno
podwójne wiązanie C=C lub cykloalkanami. Alkeny zaliczane są do węglowodorów
nienasyconych, zaś cykloalkany do nasyconych. Węglowodory cykliczne też mogą być
nienasycone, jeżeli zawierają wiązania wielokrotne, np. te z jednym wiązaniem podwójnym mają
wzór sumaryczny C
n
H
2n-2
. Znane są również węglowodory i inne związki, w których jest więcej
niż jedno nienasycone podwójne wiązanie C=C; noszą one nazwę polienów. Alkeny i polieny
występują często w naturze.
Eten
– CH
2
=CH
2
jest hormonem roślinnym przyspieszającym
dojrzewanie owoców. Znane barwniki roślinne, np. rodzina karotenów, a pośród nich, np.
β
-
karoten
– czerwonobrązowy – występujący, np. w marchwi czy
likopen
– czerwony – nadający
barwę pomidorom. Karoteny są prowitaminami witaminy A, a
likopen
ma silne działanie
przeciwnowotworowe. Terpeny (np.
mircen,
limonen
,
pineny
) jako oligomery
izoprenu
też
należą do nienasyconych związków, zaś
kauczuk
stanowiący typowy przykład naturalnego
polienu jest również polimerem
izoprenu
. Dawniej alkeny nazywano również olefinami.
H
H
H
H
C
C
eten izopren mircen limonen (+)-
α
αα
α
-pinen
ββββ
-karoten
likopen
(
γ
,
γ
-karoten)
Rys.4.1. Przykłady naturalnych alkenów i polienów
W ropie naftowej alkeny i polieny występują w małych ilościach. Dużo ich znajduje się w
produktach
przeróbki
ropy
naftowej,
pochodzących
szczególnie
z
procesów
wysokotemperaturowych. Wiele z nich wytwarza się specjalnie w reakcjach krakingu.
Nomenklatura
Najpopularniejsze alkeny posiadają nazwy zwyczajowe, które można uznać za nazwy
półsystematyczne, ponieważ są powszechnie stosowane, np.
etylen
(CH
2
=CH
2
),
propylen
(CH
3
CH=CH
2
),
butylen
,
izobutylen
czy
izopren
. Nazwy alkenów wg zasad IUPAC tworzy się
zamieniając końcówkę „an” w nazwie alkanu o takiej samie liczbie atomów węgla na końcówkę
„en”. W ten sposób otrzymujemy nazwy
eten
,
propen
,
buten
, itd. Najpopularniejsze nazwy
zwyczajowe, wymienione powyżej jako od dawna zakorzenione są akceptowane przez UIPAC.
Jako lokant podwójnego wiązania przyjmuje się niższy numer atomu węgla w łańcuchu:

CH
2
=CHCH
2
CH
2
CH
3
CH
3
CH=CHCH
2
CH
3
CH
3
CH
2
CH
2
CH=CH
2
1 2 3 4 5
1 2 3 4 5
5 4 3 2 1
pent-1-en pent-2-en
też
pent-1-en
Dla węglowodorów zawierających 2 lub więcej podwójnych wiązań zamiast końcówki „en”
wprowadza się odpowiednio końcówkę „adien” (dla dwóch C=C), „atrien”, itd., przy czym
lokanty wskazujące miejsce podwójnych wiązań w łańcuchu umieszcza się pomiędzy literę „a” i
resztą tej końcówki:
CH
2
=CHCH
2
CH=CHCH
2
CH
3
CH
3
CH=CHCH=CHCH=CH
1 2 3 4 5 6 7
7 6 5 4 3 2 1
hepta-1,4-dien hepta-1,3,5-trien
Zasada najniższego zestawu lokantów
Atomy węgla w łańcuchu numeruje się w ten sposób, żeby uzyskać najniższy zestaw lokantów,
tzn. taki, żeby wartości kolejnych lokantów w wzrastającym szeregu były najniższe, np.
zestaw lokantów 2,3,6,8, jest niższy niż 3,4,6,8 lub 2,4,5,7.
W węglowodorach rozgałęzionych lokalizuje się jako główny najdłuższy łańcuch węglowy
zawierający podwójne wiązanie:
C-C=C-C
C-C=C-C
C-C-C-C-C-C-C-C-C-C-C-C
C-C-C-C-C-C-C-C-C-C-C-C
11 10 9 8 7 6 5
1 2 3 4 5 6 7 8 9 10 11 12
4 3 2 1
5-(n-but-2-enylo)undek-2-en
łańcuch główny
(lokanty dobrane prawidłowo)
nieprawidłowo wybrany
W węglowodorach pierścieniowych numeracje atomów węgla zaczyna się od podwójnego
wiązania:
Et
3-etylocykloheksen 3,5-dimetylocykloheksen 3,5-dimetylocyklo-
hepta-1,3-dien
Reszta CH
2
=CH
−−−−
nazywana jest winylen, a CH
2
=CH
−−−−
CH
2
−−−−
allilem.
CH=CH
2
CH
2
-CH=CH
2
CH
2
=CH-CH-CH
2
-CH=CH-CH-CH
2
-CH=CH-CH
3
7-allilo-3-winyloundeka-1,5,9-trien
W alkenach jest możliwość występowania izomerii cis/trans (Z/E). W izomerze cis podstawniki
starsze usytuowane są po tej samej płaszczyźnie pierścienia, a w izomerze trans po przeciwnych
stronach:

C
H
3
H
CH
2
CH
3
H
C
H
3
H
H
CH
2
CH
3
C
C
C
C
cis-pent-2-en trans-pent-2-en
[
(Z)-pent-2-en) (E)-pent-2-en
]
Starszeństwo podstawników wyznacza się na takich samych zasadach jak przy ustalaniu
starszeństwa przy określeniu konfiguracji absolutnej.
C
H
3
CH
2
CH
2
CH
2
CH
2
CH
3
Br
Br
H
Cl
F
C
C
C
C
1
2
1
2
Et>Me
Br>Pr
Br>H
Cl>F
1
2
1
2
(Z)-4-bromohept-3-en (Z)-2-bromo-1-chloro-1-fluoroeten
Właściwości fizyczne, fizykochemiczne i fizjologiczne alkenów
Temperatura wrzenia i topnienia
Niższe alkeny podobnie jak alkany o zbliżonej masie cząsteczkowej są gazami, wyższe cieczami,
a te o wysokiej masie cząsteczkowej nie topnieją w temperaturze pokojowej. Wartości temperatur
wrzenia i topnienia monoenów i alkanów są zbliżone, np.
Porównanie tw. i tt. alkenów z alkami i pomiędzy izomerami Tabela 4.1.
tw.
o
C
tt.
o
C
etan
-89
-183
eten
-104
-165
propan
-42
-188
propen
-48
-185
butan
-0,5
-138
but-1-en
-6,5 <-190
(Z)-but-2-en
3,7 139
(E)-but-2-en
1
-106
Pomiędzy izomerami różnice są wyraźnie, często znaczne.
β
-Karoten
jest ciałem stałym, krystalicznym o tt. 183
o
C.
Rozpuszczalność
Podobnie jak alkany, alkeny są hydrofobowe, nierozpuszczalne w wodzie, dobrze rozpuszczalne
w niepolarnych rozpuszczalnikach organicznych.
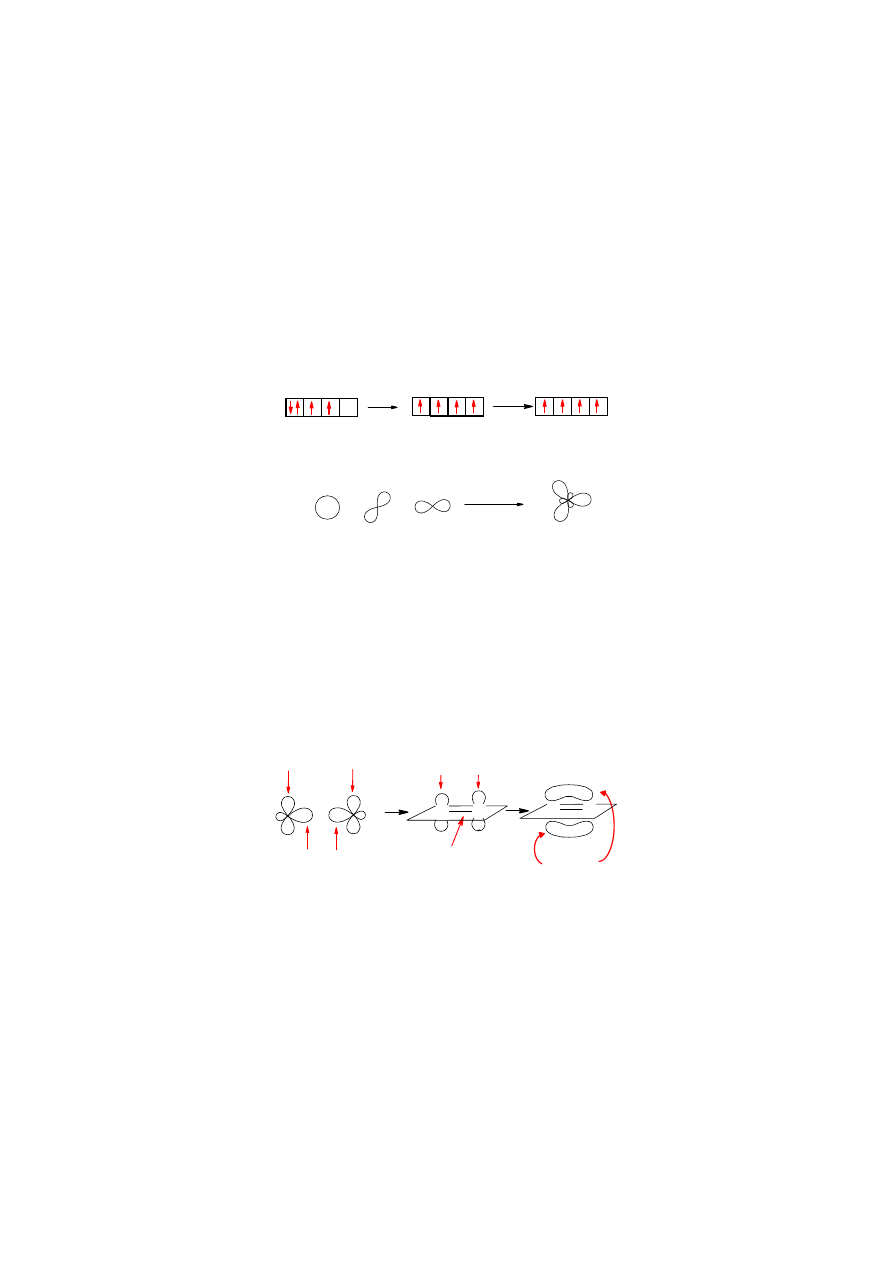
Palność
Są łatwopalne. Lotne alkeny tworzą mieszanki wybuchowe z powietrzem.
Zapach
Zapach alkenów jest znacznie bardziej intensywny niż alkanów, ostry, raczej nieprzyjemny.
Elektronowa struktura wiązania C=C
Wiązanie podwójne C=C powstaje w wyniku nałożenia się orbitali atomów węgla, których
elektrony walencyjne uległy hybrydyzacji sp
2
, co oznacza że hybrydyzacji uległ elektron s i dwa
elektrony p.
+
+
2s
2p
x
2p
y
hybrydyzacja
sp
2
wzbudzenie
hybrydyzacja
2s
2
2p
x
2p
y
sp
2
2p
z
2s 2p
x
2p
y
2p
z
14743
2p
z
Rys.4.2. Hybrydyzacja sp
2
atomu C
Leżące na jednej płaszczyźnie osie trzech orbitali sp
2
przecinają się pod kątem 120
o
, a
prostopadle do tej płaszczyzny znajduje się orbital 2p
z
obsadzony przez 1 elektron.
Atom węgla, zhybrydyzowany sp
2
może z drugim takim samym atomem utworzyć wiązanie
podwójne C=C. Składa się ono z wiązania
σ
powstałego w wyniku osiowego nałożenia się 2
orbitali sp
2
i wiązania
π
w wyniku nałożenia się 2 orbitali p, których osie są prostopadle do
płaszczyzny tworzonej przez osie orbitali sp
2
.
+
C
C
wi
ą
zanie
σ
2 elektrony na
orbitalach 2p
z
C
C
orbital
π
sp
2
sp
2
2p
z
2p
z
Rys. 4.3. Wiązanie podwójne C=C składa się z wiązania
σ
i wiązania
π
Wiązanie
ππππ
powstaje w wyniku nałożenia się dwóch orbitali p, które są osiowo równoległe do
siebie. Tylko w tym układzie jest możliwe utworzenie takiego wiązania. Obrót atomów C wokół
wiązania
σσσσ
jest swobodny, w przypadku C=C wymaga dostarczenia dużej energii i prowadzi do
zerwania wiązania
ππππ
. Brak swobodnego obrotu wokół wiązania podwójnego C=C jest przyczyną
występowania izomerii cis/trans.
Otrzymywanie alkenów
Głównym źródłem alkenów są procesy petrochemiczne, wykorzystujące ropopochodne surowce.
Najczęściej w wysokiej temperaturze długie łańcuchy węglowodorowe pękają tworząc mniejsze

fragmenty, pośród których znajdują się alkeny. Tego typu reakcje nazywają się krakingiem.
(ang. crack – pękać). W temperaturze 800-900
o
C wiązania C-C pękaja 8-9 razy szybciej niż C-
H. Piroliza czyli rozkład węglowodorów wyłącznie pod wpływem wysokiej temperatury nazywa
się krakingiem termicznym. Są jeszcze innego rodzaju krakingi, np. katalityczne (z użyciem
katalizatorów) czy hydrokraking, z udziałem wodoru w obecności katalizatorów. Podczas
hydrokrakingu nie powstają alkeny, ponieważ ulegają one uwodornieniu.
W uproszczeniu reakcje krakingu można zapisać jako rozkład długiego łańcuchu alkanu na dwa,
jeden alkanu i drugi alkenu:
C
n
H
2n+1
C
m
H
2m+1
∆
C
n
H
2n+2
+ C
m
H
2m
alkan alkan alken
W rzeczywistości jest to reakcja bardzo skomplikowana, ponieważ produkty ulegają dalszym
przemianom i powstaje złożona mieszanina, zawierająca zwykle 10-20%
metanu
(wagowo),
alkany i alkeny gazowe i ciekłe oraz stałe, a także koks (węgiel pierwiastkowy). Alkeny tworzą
się podczas każdej pirolizy węglowodorów, a proces można tak prowadzić, żeby wybrany z nich,
np.
eten
,
propen
,
buteny
,
butadien
czy
izopren
stanowił główny produkt.
Pośród wszystkich surowców organicznych
eten
jest produkowany na największą skalę –
kilkadziesiąt mln ton rocznie. Kraking można tak prowadzić, żeby zawartość
etenu
w produktach
gazowych przekraczała 30%.
Laboratoryjne syntezy alkenów
Alkeny otrzymuje się w reakcjach eliminacji małych cząstek, np. halogenowodorów, wody,
amoniaku czy wodoru.
CH
3
CH
2
CH
2
CH
2
Cl
KOH
CH
3
CH
2
CH=CH
2
+ KCl
1-chlorobutan but-1-en
Cl
KOH
CH
3
CH=CHCH
2
CH
3
CH
2
CH=CH
2
+
but-2-en
but-1-en
80%
20%
CH
3
CH
2
CHCH
3
Właściwości chemiczne alkenów
Charakterystyczna reakcją alkenów jest addycja elektrofilowa (przyłączenie elektrofilowe). Do
podwójnego wiązania przyłączyć się mogą reagenty symetryczne, np. wodór (H
2
) czy halogeny
(X
2
) lub niesymetryczne, np. halogenowodory (HX), woda, tiole (RSH) i inne reagenty
elektrofilowe.
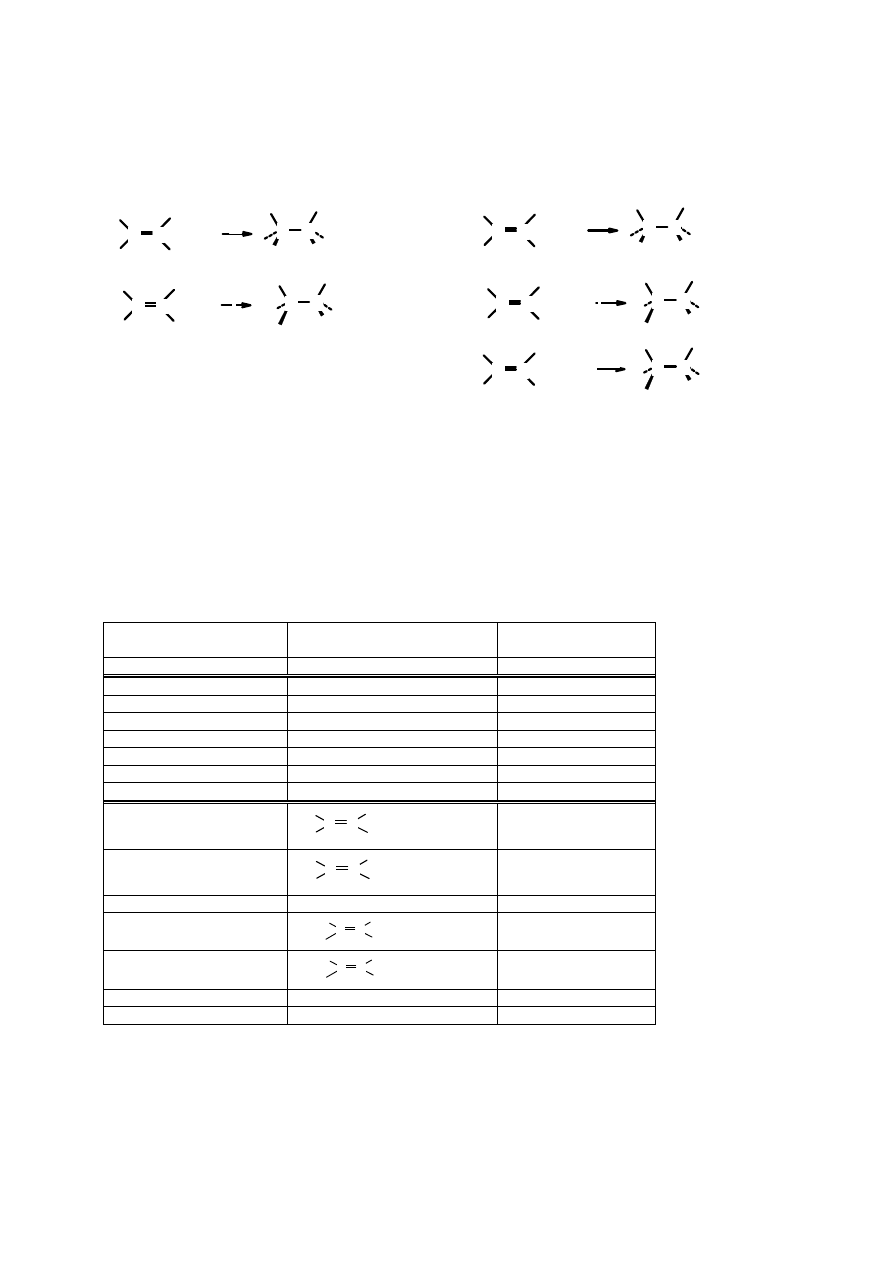
Addycja reagentów symetrycznych
Addycja reagentów symetrycznych
H
H
Br
Br
C
C
+ H
2
C
C
Pt
alkan
C
C
+ Br
2
C
C
vic-dibromoalkan
katalizator
H
Cl
H
OH
Br
OH
C
C + H-Cl
C
C
chloroalkan
C
C + H-OH
C
C
alkohol
C
C + H-OH
C
C
Br
2
halohydryna
Uwodornienie
Uwodornienie alkenów polega na przyłączeniu cząsteczki wodoru do podwójnego wiązania. Jest
reakcją egzotermiczną, ponieważ tworzące się dwa nowe wiązania C
−−−−
H typu
σσσσ
są mocniejsze od
rozrywanych wiązań H
−−−−
H (
σσσσ
) i C
−−−−
C typu
ππππ
. Ilość wydzielone ciepła (wartość bezwzględna
∆∆∆∆
H)
w wyniku uwodornienia 1 mola alkenu nazywa się ciepłem uwodornienia alkenu (ciepłem
hydrogenacji). Średnia wartość ciepła uwodornienia jednego mola C=C wynosi 126 kJ/mol (30
kcal).
Molowe ciepło uwodornienia alkenów Tabela 4. 2.
Alken
Wzór
Ciepło uwodornienia
[kJ/mol (kcal/mol)]
eten
CH
2
=CH
2
137 (33)
propen
CH
3
CH=CH
2
126 (30)
but-1-en
CH
3
CH
2
CH=CH
2
127 (30)
pent-1-en
CH
3
CH
2
CH
2
CH=CH
2
126 (30)
heks-1-en
CH
3
CH
2
CH
2
CH
2
CH=CH
2
127 (30)
3-metylobut-1-en
CH
3
CH(CH
3
)CH=CH
2
127 (30)
3,3-dimetylobut-1-en
(CH
3
)
3
CCH=CH
2
127 (30)
4,4-dimetylopent-1-en
(CH
3
)
3
CCH
2
CH=CH
2
124 (29,5)
cis-but-2-en
H
C
H
3
H
CH
3
C
C
120 (29)
trans-but-2-en
H
C
H
3
CH
3
H
C
C
116 (28)
2-metylopropen
(CH
3
)
2
C=CH
2
119 (28)
cis-pent-2-en
H
CH
3
CH
2
H
CH
3
C
C
120 (29)
trans-pent-2-en
H
CH
3
CH
2
CH
3
H
C
C
116 (28)
2-metylo-but-2-en
CH
3
CH=C(CH
3
)CH
3
113 (27)
2,3-dimetylobut-2-en
(CH
3
)
2
CH=C(CH
3
)CH
3
111 (27)
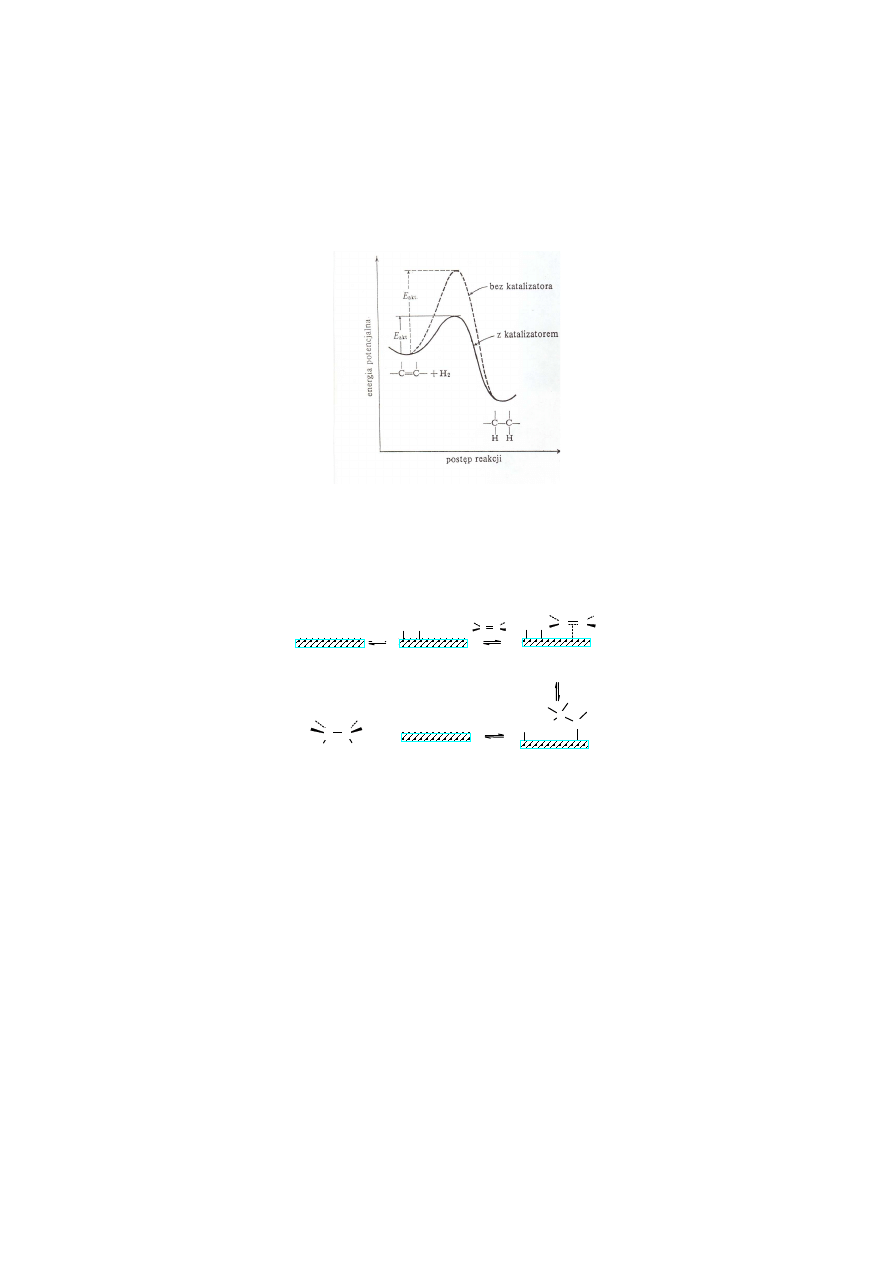
Alkeny nie reagują z wodorem po zmieszaniu. Do addycji H
2
do C=C (uwodornienia) dochodzi
w obecności katalizatora. Katalizator obniżając energię aktywacji dowolnej reakcji zwiększa jej
szybkość ponieważ większa populajca cząsteczek substratu jest w stanie pokonać barierę
energetyczną wyznaczoną przez energią aktywacji.
Rys. 4.4. Zmiany energii potencjalnej podczas reakcji uwodornienia alkenu bez katalizatora i z katalizatorem
W cząsteczkach zaadsorbowanych na powierzchni katalizatora dochodzi do rozluźnienia wiązań
σ
w H
−−−−
H i
ππππ
w C=C, a tym samym ich rozerwanie i utworzenie nowych wiązań C
−−−−
H staje się
łatwiejsze.
H H
H H
H
H
H
H
C
C
powierzchnia
katalizatora
H
2
C
C
+
C
C
C
C
wodór zaadsorbowany
na powierzchni katalizatora
kompleks alkenu
z katalizatorem
alkan aktywny katalizator przyłączenie H do C=C
Rys. 4.5. Zasada działania katalizatora w reakcja uwodornienia alkenów
Ciepło uwodornienia alkenów, a ich trwałość
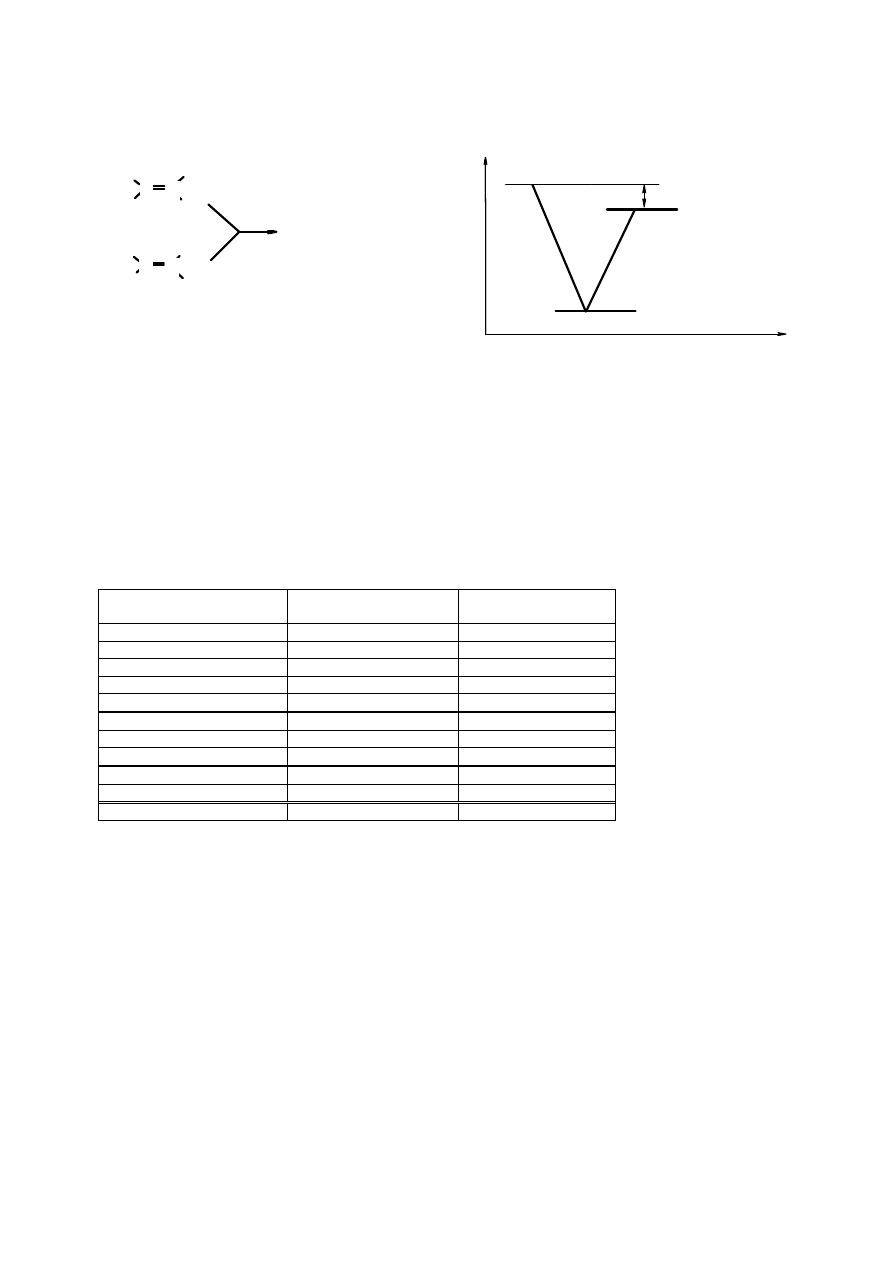
Ilość ciepła wydzielanego podczas uwodornienia jest zależna od trwałości reagującego związku;
im bardziej trwały tym mniej wydzieli się energii cieplnej podczas przejścia od substratu do
produktu.
Z dwóch izomerów
but-2-enu
(trans i cis) w wyniku uwodornienia powstaje ten sam produkt –
n-
butan
i zostaje zużyta taka sama ilość wodoru/mol substratu. W reakcji uwodornienia
cis-but-2-
enu
wydziela się 119,7 kJ/mol (28,6 kcal/mol), a
trans-but-2-enu
115,5 kJ/mol (27,6 kcal/mol),
co oznacza, że izomer trans jest trwalszy od cis o 4,2 kJ/mol.
C
H
3
H
CH
3
H
C
H
3
H
H
CH
3
C
C
C
C
cis-but-2-en
trans-but-2-en
H
2
/kat
CH
3
CH
2
CH
2
CH
3
n-butan
E
kJ/mol
cis-CH
3
CH=CHCH
3
trans-CH
3
CH=CHCH
3
4,2 kJ
-119,7
-115,5
Rys. 4.6. Zależność wielkości ciepła uwodornienie od trwałości substratu
Podczas uwodornienia
cis-pent-2-enu
wydziela się 119,7 kJ/mol (28,6kcal/mol), a jego izomeru
trans 115,5 kJ/mol (27,6 kcal/mol). Różnica, która świadczy o większej trwałości izomeru
trans
wynosi podobnie jak w przypadku butenów 4,2 kJ/mol (1kcal/mol).
Pośród
pentenów
istnieje większa różnorodność izomerów (6 izomerów) niż
butenów
(2). Ciepło
ich uwodornienia, świadczy o ich trwałości. Można na tej podstawie wnioskować o zależności
trwałości cząsteczki od jej budowy, w przypadku
pentenów
od położenia podwójnego wiązania w
łańcuchu i liczby podstawników alkilowych wokół C=C.
Ciepło uwodornienia butenów Tabela 4. 3.
Nazwa
Wzór
Ciepło uwodornienia
kJ(kcal)/mol
eten
CH
2
=CH
2
137 (32,8)
propen
CH
3
CH=CH
2
126 (30,1)
but-1-en
CH
3
CH
2
CH=CH
2
126 (30,1)
pent-1-en
CH
3
CH
2
CH
2
CH=CH
2
126 (30,1)
3-metylobut-1-en
CH
3
CH(CH
3
)CH=CH
2
127 (30,3)
2-metylopropen
(CH
3
)
2
C=CH
2
119 (28,4)
cis-pent-2-en
CH
3
CH
2
CH=CHCH
3
120 (28,6)
trans-pent-2-en
CH
3
CH
2
CH=CHCH
3
116 (27,6)
2-metylobut-1-en
CH
3
CH
2
C(CH
3
)=CH
2
119 (28,5)
2-metylobut-2-en
(CH
3
)
2
C=CHCH
3
113 (26,9)
2,3-dimemetylo-but-2-en
(CH
3
)
2
C=C(CH
3
)
2
111 (26,6)
Z podanych wartości ciepła uwodornienia izomerów wynika, że im więcej grup alkilowych
wokół C=C, tym trwalszy izomer. Na podstawie tego wniosku można ułożyć szereg trwałości
alkenów:
Szereg trwałości alkenów:
R
2
C=CR
2
>R
2
C=CHR >R
2
C=CH
2
>RCH=CHR >RCH=CH
2
>CH
2
=CH
2
Trwałość substratów wpływa na orientację w reakcjach dehydratacji i dehydrohalogenacji –
eliminacja cząsteczki H
2
lub HOH prowadzi do trwalszego alkenu.
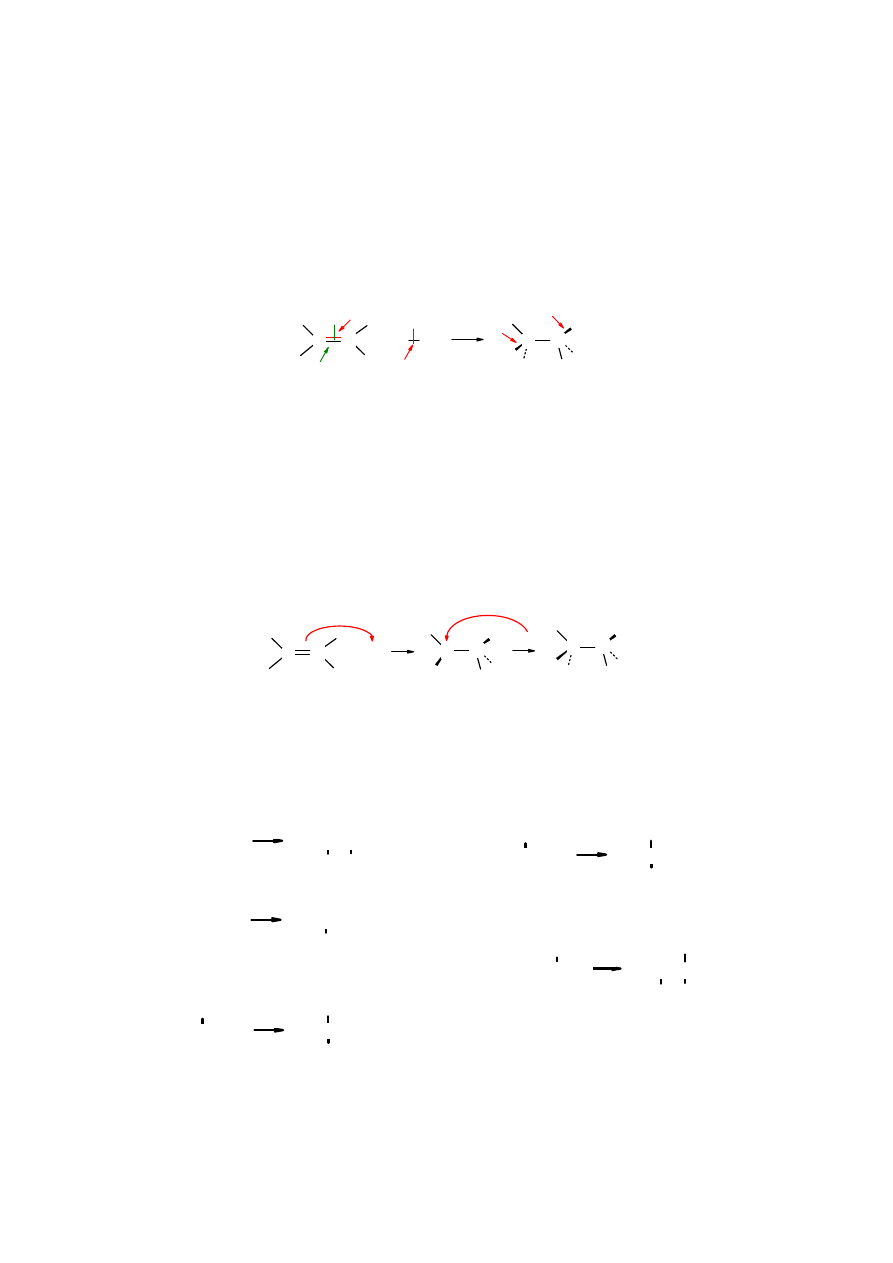
Addycja elektrofilowa
W trakcie reakcji addycji do podwójnego C=C wiązania dochodzi do rozerwanie wiązania
ππππ
układu C=C, rozerwania wiązania
σσσσ
w cząsteczce, która zostaje przyłączona, np. X
−−−−
Y i zamiast
tych wiązań powstają dwa nowe wiązania
σσσσ:
C
−−−−
X oraz C
−−−−
Y.
X Y
X
Y
C
C
σ
π
+
σ
C
C
σ
σ
rozerwane wiązania
π σ
utworzone wiązania
σ σ
Rys. 4.6. Etapy addycji elektrofilowej
Rozerwanie wiązania
ππππ
układu C=C następuje pod wpływem ataku cząsteczki X
−−−−
Y
przyłączającej się do podwójnego wiązania. Wiązanie C=C jest miejscem o wysokiej gęstości
elektronowej, wobec czego wykazuje powinowactwo do czynników elektrofilowych – „
lubiących
elektrony
”. Do takich czynników należą kwasy Lewisa: H
+
, BF
3
, Hg
+2
, Br
+
i inne. Reakcja
addycji zaczynająca się od ataku elektrofila nazywana jest
addycją elektrofilową
. Alken po
przyłączeniu elektrofila zostaje przekształcony w karbokation, który następnie stabilizuje się
przez przyłączenie anionu:
X
H
Cl
H
C
C
+
H
+
C
C
+
C
C
Cl
-
alken karbokation chloroalkan
Orientacji w reakcjach addycji elektrofilowej
W produktach reakcjach addycji cząsteczki X
−−−−
Y do alkenu przeważa jeden z możliwych
izomerów:
Cl H
CH
3
-CH-CH
2
CH
3
Cl
CH
3
CH
3
H
Cl
CH
3
OSO
3
H
CH
3
OH
CH
3
CH
3
-CH=CH
2
HCl
chlorek izopropylu
CH
3
-CH=CH
2
HCl
chlorek tert-butylu
propen
CH
3
-C-CH
3
2-metylopropen
CH
3
-CH=C-CH
3
HCl
2-chloro-2-metylobutan
CH
3
-CH-C-CH
3
2-metylobut-2-en
CH
3
-CH=CH
2
H
2
SO
4
wodorosiarczan
izopropylu
propen
CH
3
-CH-CH
3
CH
3
-CH=CH
2
H
+
/HOH
alkohol tert-butylowy
CH
3
-C-CH
3
2-metylopropen
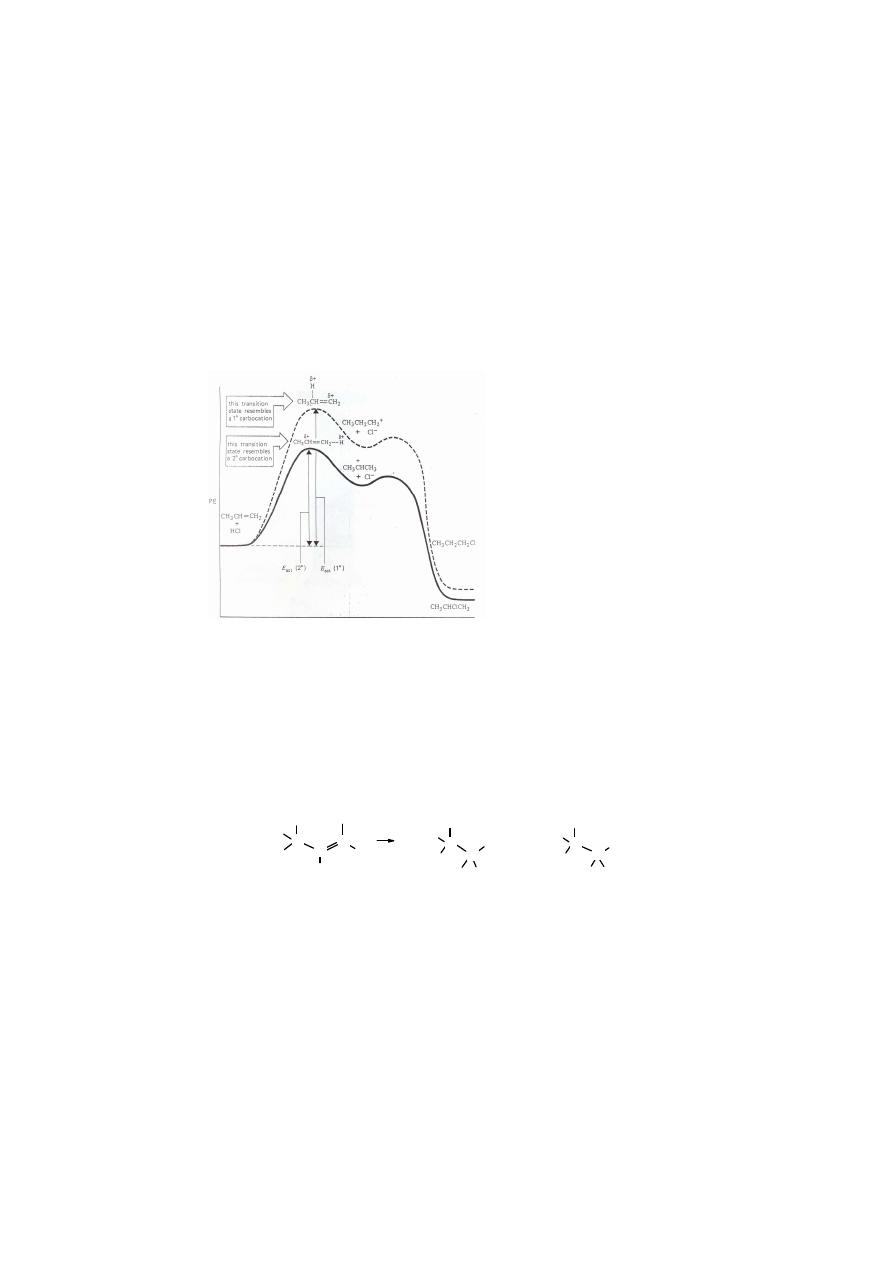
Reguła Markownikowa,
(1837-1904), prof. w Kazaniu, Odessie i w Moskwie, doktorat u Butlerowa)
Na podstawie obserwacji produktów wielu reakcji addycji elektrofilowej Włodzimierz
Markownikow zaproponował w 1869 r. następującą regułę: w reakcji addycji jonowej H-X do
podwójnego wiązania C=C w alkenach atom wodoru przyłącza się do tego atomu węgla, przy
którym znajduje się więcej atomów wodoru (mniej podstawników alkilowych), zaś X do
drugiego atomu C podwójnego wiązania.
Uzasadnienie reguły Markownikowa
Rys. 4.7. Wykres zmian energii potencjalnej w reakcji addycji HCl do propenu. Niższa wartość energii aktywacji
E
act
(2
o
) niż E
act
(1
o
) preferuje taki stan przejściowy, z którego powstaje produkt zgodnie z regułą Markownikowa
(chlor przyłącza się do wyżej rzędowego atomu węgla - 2
o
)
W wyniku przyłączenia się H
+
do C=C powstaje najbardziej trwały karbokation, czyli
karbokation najbardziej rozgałęziony.
Przegrupowania towarzyszące niektórym reakcjom addycji potwierdzają jonowy mechanizm tych
reakcji:
H
C
H
3
C
H
3
H
H
H
H
C
H
3
C
H
3
Cl
CH
3
Cl
C
H
3
C
H
3
H
CH
3
H
H
C
C
C
HCl
C
C
C
C
+
3-metylobut-1-en 2-chloro-3-metylobutan 2-chloro-2-metylobutan
(~50%) (~50%)
Po przyłączeniu się protonu do
3-metylobut-1-enu
tworzy się 2
o
karbokation, który ma
możliwość przegrupowania się do bardziej stabilnego karbnokationu 3
o
. W drugim etapie reakcji
jon Cl
-
reaguje zarówno z 2
o
, jak i 3
o
karbokationem i powstają w rezultacie dwa produkty.

H
C
H
3
C
H
3
H
H
H
H
C
H
3
C
H
3
CH
3
CH
3
C
H
3
H
CH
3
H
H
H
C
H
3
C
H
3
Cl
CH
3
Cl
C
H
3
C
H
3
H
CH
3
H
H
C
C
C
H
+
C
C
C
C
+
+
karbokation 2
o
karbokation 3
o
C
C
C
C
Cl
-
Cl
-
3-metylobut-1-en
2-chloro-3-metylobutan 2-chloro-2-metylobutan
Migracji może ulec nie tylko jon wodorkowy H- jak w powyższym przykładzie, ale również cała
grupa metylowa:
CH
3
CH
3
CH
3
CH
3
CH
3
CH
3
CH
3
CH
3
CH
3
Cl
Cl
H-Cl
CH
3
-
C
-
CH=CH
2
CH
3
-
C
-
CH
-
CH
3
CH
3
-
C
-
CH
-
CH
3
+
+
Cl
-
Cl
-
CH
3
-
C
-
CH
-
CH
3
CH
3
-
C
-
CH
-
CH
3
H
3
C
3,3-dimetylobut-1-en
3-chloro-2,2-dimetylobutan 2-chloro-2,3-dimetylobutan
Reguła Markownikowa nie zawsze przewiduje właściwy produkt. Odnosi się ona tylko do
reakcji biegnących mechanizmem jonowym. Przyłączenie bromowodoru (nie HCl ani HI) do
propenu
w obecności rodników lub/i w podwyższonej temperaturze prowadzi do
1-
bromopropanu
, podczas gdy w wodzie HBr przyłącza się zgodnie z regułą Markownikowa.
Br
Br
CH
3
-CH=CH
2
HBr
bromek izopropylu
propen
HOH
CH
3
-CH=CH
2
HBr
bromek n-propylu
propen
CH
3
-CH-CH
3
ROOR/
∆
CH
3
-CH
2
-CH
2
zgodnie z regułą Markownikowa
niezgodnie z regułą Markownikowa
Przyczyną tej różnicy jest inny elektrofil w obu reakcjach. W wodzie reakcja biegnie
mechanizmem jonowym i proton jest tym reagentem (elektrofilem), który rozpoczyna addycję
tworząc najbardziej trwały karbokation. W obecności nadtlenków lub w podwyższonej
temperaturze z bromowodoru powstają rodniki i rodnik Br
.
rozpoczyna reakcję przeprowadzając
alken w najbardziej trwały karborodnik – rodnik z atomem C
.
o najwyższej rzędowości.
Szereg trwałości rodników: H
3
C
.
< RH
2
C
.
< R
2
HC
.
< R
3
C
.

:Br
.
..
..
:Br
.
..
..
Br
-
CH
2
-
CH
-
CH
3
.
Br
-
CH
2
-
CH
-
CH
3
.
R
-
O
-
O
-
R
∆
2 R
-
O
.
∆
H = +35 kcal/mol
R
-
O
.
+ H
-
Br
R
-
O
-
H + Br
.
∆
H = -23 kcal/mol i
niska energia aktywacji
+ CH
2
=CH
-
-
-
-
CH
3
2
o
karborodnik
+ H
-
Br
BrCH
2
CH
2
CH
3
+
1-bromopropan
Bromowodór przyłącza się do alkenów niezgodnie z regułą Markownikowa wówczas, kiedy
reakcja biegnie mechanizmem rodnikowym.
Przykłady:
Br
CH
3
(CH
2
)
5
CH=CH
2
+ CBr
4
R
.
CH
3
(CH
2
)
5
CHCH
2
-
CBr
3
okt-1-en tetrabromek węgla 1,1,1,3-tetrabromononan
Inicjator rodnikowy R
.
w reakcji z
bromoformem
generuje rodnik
.
CBr
3
, który jako czynnik
elektrofilowy przyłącza się do alkenu w ten sposób, żeby powstał najtrwalszy rodnik i dalej
reakcja biegnie łańcuchowo:
Br
R
.
+ Br
-
CBr
3
R
-
Br +
.
CBr
3
CH
3
(CH
2
)
5
CH=CH
2
+
.
CBr
3
.
CH
3
(CH
2
)
5
CHCH
2
-
CBr
3
.
+ Br
-
CBr
3
CH
3
(CH
2
)
5
CHCH
2
-
CBr
3
+
.
CBr
3
Ć
wiczenia:
nadtlenki
CH
3
CH
2
CH
2
CH=CH
2
+ HCCl
3
→
→
→
→
nadtlenki
(CH
3
)
2
C=CH
2
+ CH
3
CH
2
SH
→
→
→
→
?
CH
3
+ HBr
eter
?
nadtlenki
CH
3
CH
2
C(CH
3
)=CH
2
+ CCl
4
→
→
→
→
?
nadtlenki nadtlenki
n CH
2
=CH
2
→
→
→
→
? n CH
2
=CH
−−−−
Cl
→
→
→
→
?
Addycja fluorowców
Chlor, brom i jod łatwo ulegają do podwójnego wiązania C=C dając dihalogenoalkany:
CH
2
=CH
2
+ Cl
2
CH
2
ClCH
2
Cl
eten 1,2-dichloroetan
Reakcja addycji bromu do C=C jest prostym testem na obecność nienasyconych wiązań w
badanym związku organicznym. Liczba jodowa stosowana do określania udziału nienasyconych
kwasów tłuszczowych w danym tłuszczu jest wartością (w procentach) określającą ilość
przyłączonego jodu do próbki tłuszczu.
Przyłączenie cząsteczki halogenu, np. bromu do podwójnego wiązania C=C może następować w
ten sposób, że oba atomy bromu zostaną przyłączone z tej samej strony wiązania podwójnego lub
po przeciwnych stronach:
C
C
Br
Br
C
C
Br
Br
W reakcji z niesymetrycznymi alkenami, w zależności od sposobu tego przyłączenia addycja Br
2
mogą powstać różne produkty, np. w reakcji bromu z
trans-1-fenylopropenem
można spodziewać
się dwóch produktów erytro lub treo.
CH
3
H
Ph
H
H
Br
Ph
H
CH
3
Br
Br
H
Ph
H
CH
3
Br
Br
H
Ph
Br
CH
3
H
H
Br
Ph
Br
CH
3
H
C
C
Br
2
Br
2
(
SR)
(RR)
Biorąc pod uwagę, że przyłączenie z jednej strony może nastąpić od dołu lub bod góry, a z
dwóch stron od góry przy jednym atomie C i dołu przy drugim i odwrotnie produktami takiej
reakcji mieszanina (SR) i (RS) – erytro - oraz (RR) i SS) – treo.
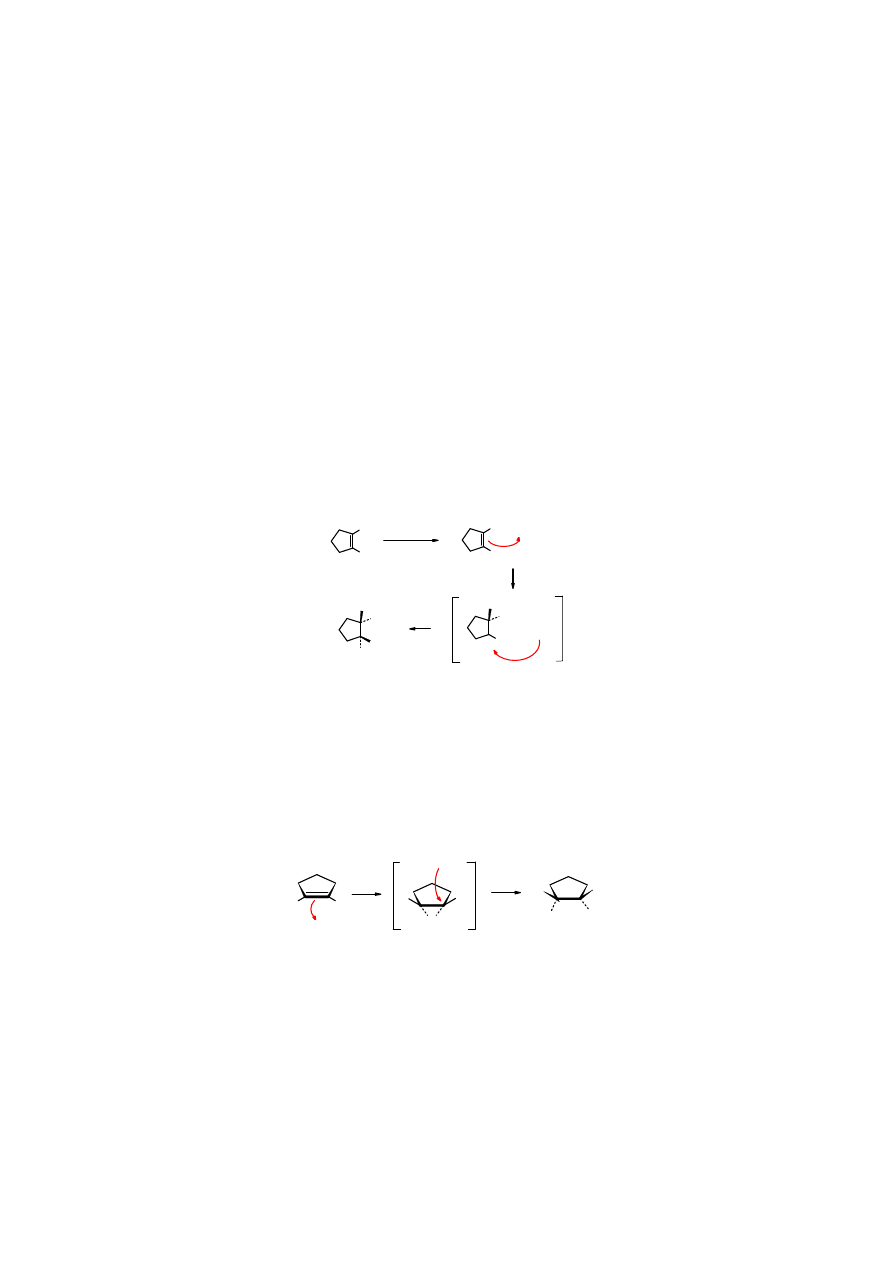
Jak jest w rzeczywistości? Na to pytanie odpowiedź dało poznanie mechanizmu addycji bromu
do C=C.
Mechanizm addycji halogenów do podwójnego wiązania
Cząsteczka halogenu w pobliżu podwójnego wiązania ulega polaryzacji, a następnie jonizacji pod
wpływem elektronów
π
:
δδδδ
−−−−
δ
δ
δ
δ
++++
Br : Br
→
→
→
→
Br: Br
→
→
→
→
Br:
-
+ Br
+
polaryzacja jonizacja
Kation bromkowy Br
+
przyłącza się do jednego z atomów sp
2
tworząc karbokation, do którego
z kolei przyłącza się anion bromkowy. Atak anionu bromkowego następuje z przeciwnej strony
do obecnego już w cząsteczce atomu bromu.
H
H
H
H
H
H
Br
:Br:
..
..
-
H
Br
Br
H
Br
2
w CCl
4
Br :Br
δ
++++
δ
−
+
cyklopenten
trans-1,2-dibromocyklopentan
Rys. 4.8. Jonowy mechanizm addycji bromu do alkenu
Fakt, że w wyniku addycji bromu do C=C tworzy się wyłącznie izomer trans tłumaczy
powstawanie przejściowo nieklasycznego jonu bromoniowego, który tworząc trójcykliczny
pierścień z dwoma atomami węgla umożliwia atak jonu bromkowgo Br
-
jedynie z przeciwnej
strony.
H
H
Br
H
H
Br
H
H
Br
Br :Br
+
:Br:
..
..
-
cyklopenten jon bromoniowy trans-1,2-dibromocyklopentan
Za otrzymanie trwałych cyklicznych kationów bromoniowych i udowodnienie ich budowy G.
Olah otrzymał w 1994 r. nagrodę Nobla.
George Andrew Olah
(ur. 1927 na Węgrzech), doktorat w 1949 r. w Budapeszcie, prof. w Univ. Nord Caroline,
USA.
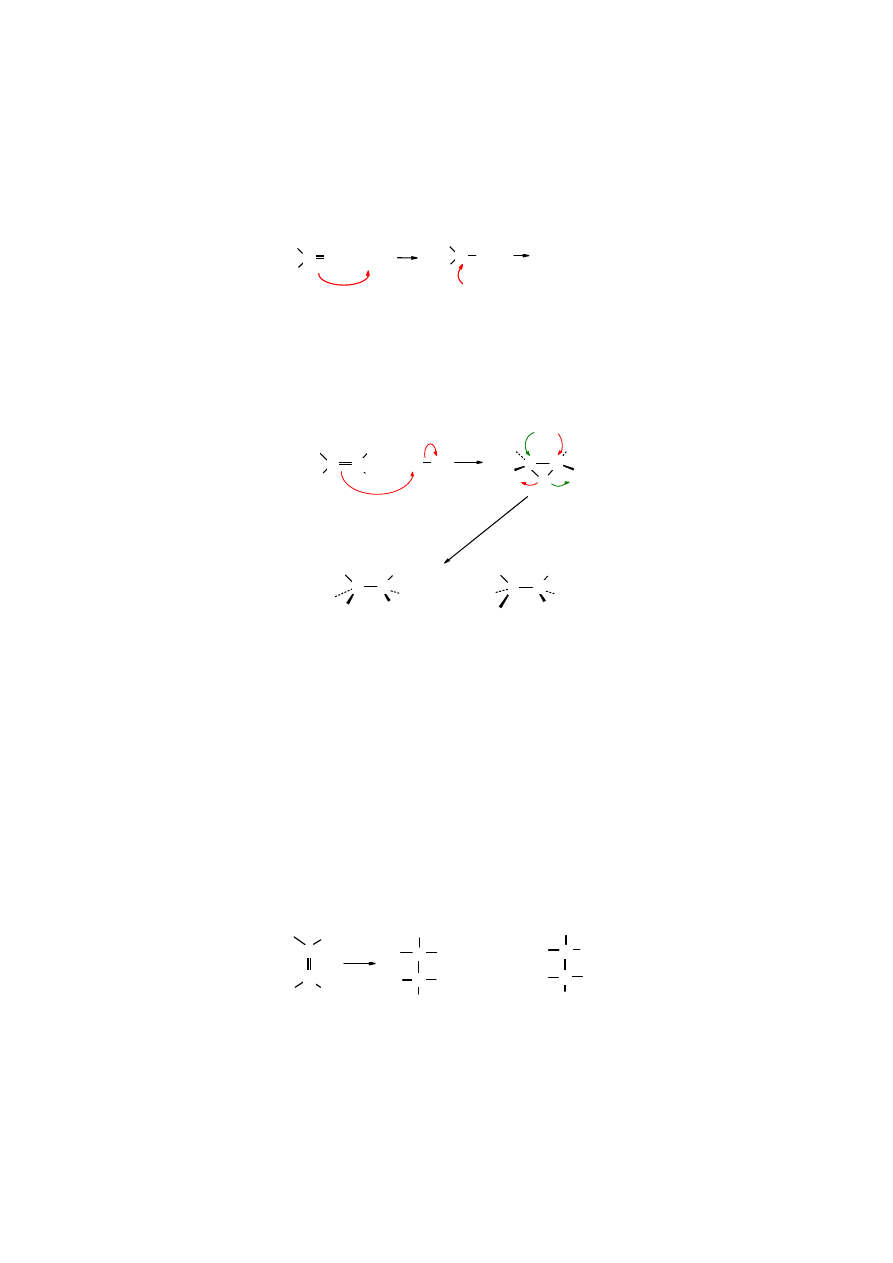
Jonowy mechanizm addycji do C=C widoczny jest w reakcji alkenów z chlorkiem jodu I
−−−−
Cl.
Chlorek jodu jest spolaryzowany, dlatego jego addycja do podwójnego wiązania zachodzi
szybko:
CH
2
C
H
3
C
H
3
CH
2
-I
C
H
3
C
H
3
C
+ I
-
Cl
δ
++++
δ
−
C
+
:Cl:
-
..
..
(CH
3
)
2
CClCH
2
I
izobuten 2-chloro-1-jodo-2-metylopropan
Ten sam mechanizm – addycji elektrofilowej i tworzenie się przejściowo kationu bromoniowego
– jest przyczyną powstawania różnych stereoizomerów w wyniku przyłączenia się cząsteczki
bromu do trans- lub cis-alkenu.
H
5
C
2
CH
3
H
H
Br
+ Br
H
5
C
2
CH
3
H
H
Br
Br
Br
H
5
C
2
H
H
CH
3
Br
Br
H
CH
3
H
5
C
2
H
C
C
C
C
+
Br
-
trans-pent-2-en
kation
bromoniowy
:
:
..
..
C
C
(2R,3S)-2,3-dibromopentan
C
C
(2S,3R)-2,3-dibromopentan
+
W wyniku przyłączenia bromu do układu trans- powstaje
racemat (R,S) i (S,R),
↑
zaś produktem przyłączenia do izomeru cis- jest
racemat (R,R) i (S,S).
↓
Et
H
C
H
3
H
Br
H
H
Br
CH
3
Et
H
Br
Br
H
CH
3
Et
C
C
Br
2
C
C
+
C
C
(2R,3R)-2,3-dibromopentan (2S,3S)-2,3-dibromopentan
Reakcje hydroborowania
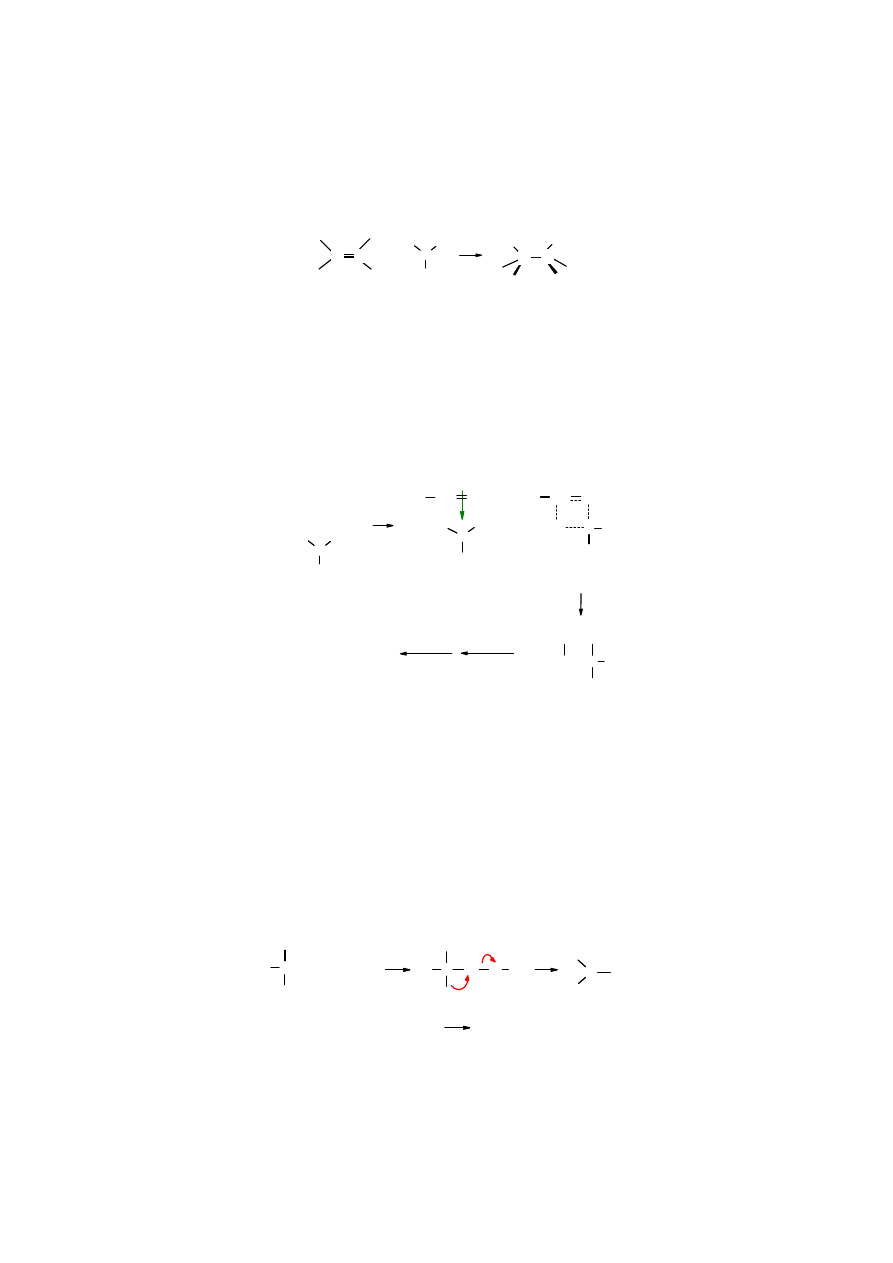
Borowodór (B
2
H
6
) przyłącza się do podwójnego wiązania tworząc addukty zwane boranami.
Jest to ważna reakcja, ponieważ poprzez przekształcenie boranów można wprowadzić inne grupy
funkcyjne. Dla uproszczenia cząsteczka borowodoru będzie zapisywana w postaci BH
3
.
H
B
H
H
H
BH
2
C
C
+
C
C
alken boran alkiloboran
W ten sposób kolejno wszystkie trzy atomy wodoru w boranie mogą zostać podstawione resztami
organicznymi, tak więc w reakcji
etenu
z boranem powtaje
trietyloboran
:
H
2
C=CH
2
+ BH
3
→
→
→
→
B(CH
2
CH
3
)
3
trietyloboran
Reakcja alkenów z boranem biegnie poprzez kompleks
ππππ
i stan przejściowy etapami, aż do
wyczerpania atomów wodoru przy atomie boru.
H
B
H
H
H
B
H
H
H
B
H
H
H
B
H
H
C
H
3
CH CH
2
C
H
3
CH CH
2
CH
3
-
CH=CH
2
+
kompleks
π
stan przejściowy
CH
3
-
CH
-
CH
2
CH
3
-
CH=CH
2
CH
3
-
CH=CH
2
(CH
3
CH
2
CH
2
)
3
B
tri-n-propyloboran
Reakcje trialkiloboranów
Z alkenów poprzez trialkiloborany można otrzymywać alkohole. Reakcja polega na utlenianiu
boranów nadtlenkiem wodoru w środowisku alkalicznym:
H
2
O
2
R
3
B
→
→
→
→
3 ROH + Na
3
BO
3
NaOH
Mechanizm reakcji:
R
B
R
R
R
B
R
R
O O H
R
B
R
OR
+
-
O
-
O
-
H
- OH
3 B(OR)
3
+ 3
-
OH
3 ROH + BO
3
3-
Kwaśna hydroliza boranów prowadzi do alkanów. Jest to więc alternatywny sposób redukcji
alkenów do alkanów:
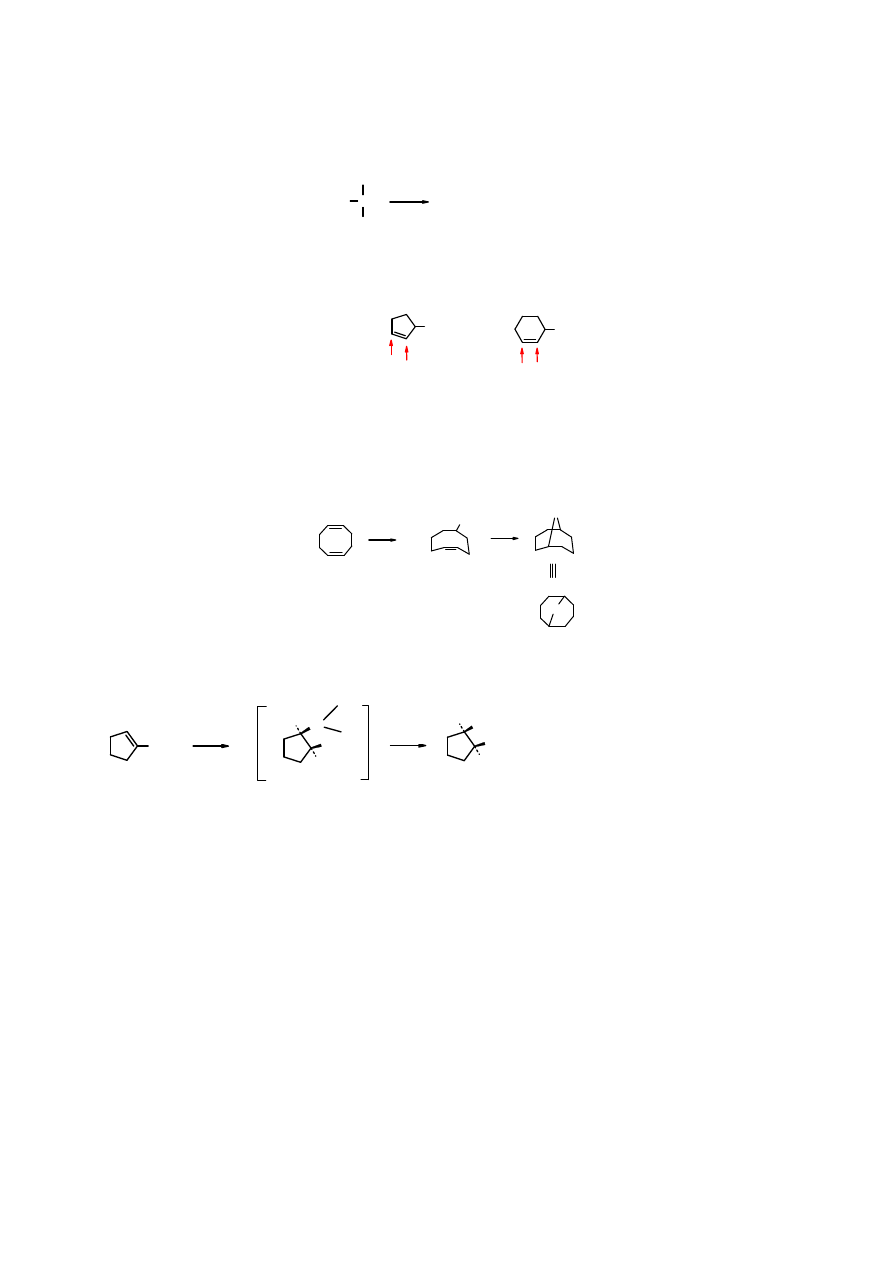
R
B
R
R
AcOH
∆
3 R-H + (AcO)
3
B
Addycja boranu do
3-metylocykloheksenu
nie jest regiospecyficzna; otrzymuje się produkty
przyłączenia w pozycji 2 i 3 w stosunku 1:1.
CH
3
CH
3
BH
3
9BBN
55 45 50 50
%
%
78 22 80 20
Natomiast za pomocą 9BBN –
9-borobicyklo[3.3.1]nonanu
,
który jest rozbudowanym cyklicznie
boranem można prowadzić reakcje stereoselektywne. 9BBN otrzymuje się w reakcji z
cyklookto-
1,5-dienem
:
BH
2
B
BH
BH
3
THF
H
9-borabicyklo[3.3.1]nonan
Borany przyłączają się selektywnie w przypadku natrafienia wokół C=C na zawadę przestrzenną,
np. w postaci grupy metylowej.
CH
3
H
CH
3
H B
H
CH
3
H OH
BH
3
THF
H
2
O
2
-
OH
1-metylocyklopenten alkiloboran trans-2-metylocyklopentanol
(85%)
produkt pośredni
Otrzymany w tej reakcji alkohol jest inny od tego jaki powstaje w wyniku uwodnienia
1-
metylocyklopentenu
w środowisku kwaśnym czy produkt oksyrtęciowania tego samego
substratu.
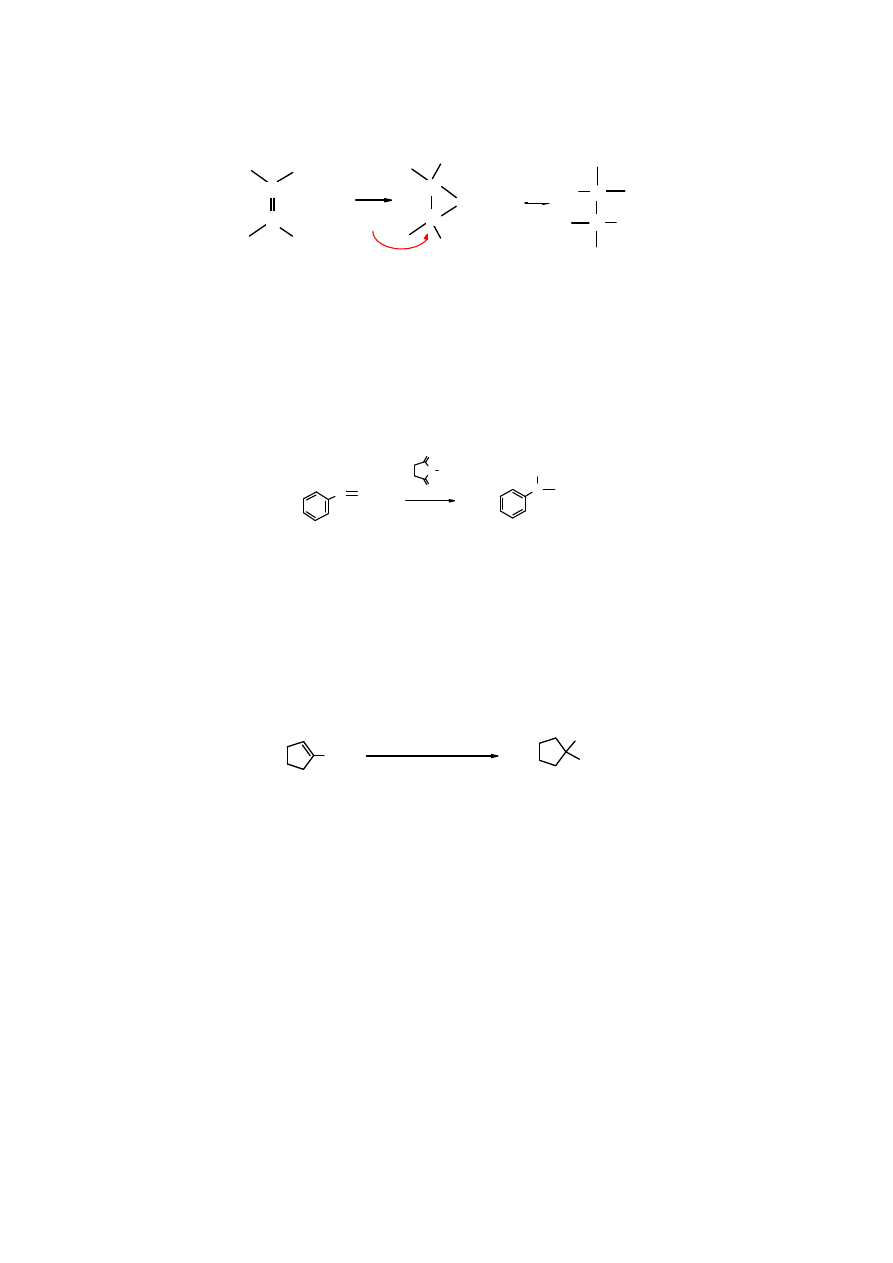
Halohydryny – produkty addycji halogenów do alkenów w wodnym środowisku
W obecności wody produkt addycji kationu bromkowego –
kation bromoniowy
– reaguje z
cząsteczkami wody tworząc halohydryny (vic-halogenohydroksyalkany). Jeżeli stężenie wody
wielokrotnie przekracza stężenie halogenu, głównym produktem są halohydryny.
X
X
O-H
C
C
+ X
2
C
C
+
HOH
..
..
+ X
-
C
C
- H
+
X: Cl, Br halohydryna
Alkeny nie rozpuszczają się w wodzie, dlatego reakcje z nimi należy prowadzić z dodatkiem
organicznych rozpuszczalników polarnych, które zwiększają rozpuszczalność substratów
hydrofobowych w wodzie. Należą do nich
acetonitryl
, DMF i DMSO.
Zamiast bromu stosuje się
N-bromoimid kwasu bursztynowego
(NBS), który rozkładając się w
ś
rodowisku reakcji uwalnia stopniowo brom.
C
H
CH
2
N Br
O
O
C
H
CH
2
Br
OH
HOH/DMSO
styren 2-bromo-1-fenyloetanol
(76%)
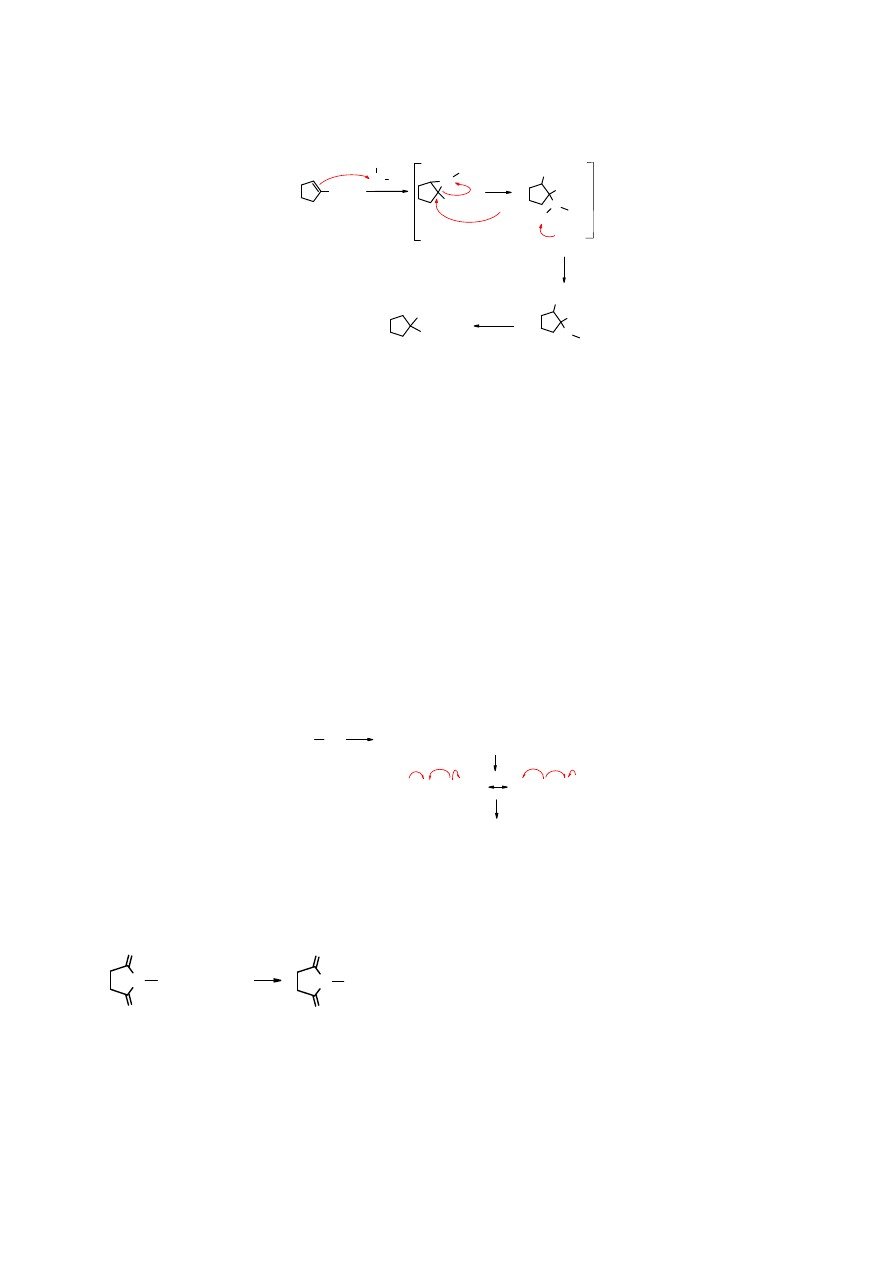
Oksyrtęciowanie
Oksyrtęciowanie prowadzi do uwadniania alkenów. Jest alternatywnym sposobem otrzymywania
alkoholi z alkenów w porównaniu z addycją HOH w środowisku kwaśnym i utlenianiem
alkiloboranów. Addycja wody do podwójnego wiązania C=C biegnie w wysokiej temperaturze
(>250
o
C). Octan rtęci natomiast ulega przyłączeniu do alkenów w temperaturze pokojowej, a
produkt reakcji można zredukować do alkoholu, najłatwiej za pomocą tetrahydroboranu sodu.
CH
3
OH
CH
3
1.
Hg(OAc)
2
, HOH/THF
2.
NaBH
4
1-metylocyklopenten 1-metylocyklopentanol
(92%)
mechanizm reakcji:
CH
3
OH
CH
3
OAc
OAc
Hg
Hg
CH
3
OAc
HgOAc
CH
3
O
H
H
HgOAc
CH
3
O
H
-
-
OAc
HOH
..
..
-
OAc
- ACOH
NaBH
4
1-metylocyklopenten
jon
merkurionowy
1-metylocyklopentanol
rtęcioorganiczny produkt pośredni
Mechanizm oksyrtęciowania jest zbliżony do mechanizmu reakcji tworzenia halohydryn.
Halogenowanie w pozycji allilowej
W reakcji
propenu
w chlorem w podwyższonej temperaturze lub przy niskim stężeniu chloru
zamiast addycji następuje podstawienie atomu H w pozycji
β
. W niskich temperaturach i przy
dużym stężeniu chloru przeważa produkt addycji –
1,2-dichloropropan
:
∆
∆
∆
∆
CH
3
-CH=CH
2
+ Cl
2
→
→
→
→
Cl-CH
2
-CH=CH
2
propen 3-chloropropen
Reakcja ta biegnie mechanizmem rodnikowym. Rodnik chlorkowy przekształca
propen
w
mezomerycznie stabilizowany rodnik allilowy, który z chlorem tworzy
chlorek allilu
i rodnik
chlorkowy.
Cl
Cl
∆
2
.
Cl
.
Cl + H-CH
2
-CH=CH
2
CH
2
-CH=CH
2
CH
2
=CH-CH
2
.
.
Cl
2
Cl-CH
2
-CH=CH
2
+
.
Cl
Dobrym odczynnikiem do bromowania w pozycji allilowej jest
N-bromosukcynoimid
(NBS). W
obecności HBr uwalnia się z niego brom cząsteczkowy, który łatwo ulega rozszczepieniu na
rodniki.
N
O
O
Br
N
O
O
H
+ HBr
+ Br
2
N-bromosukcynoimid
imid kwasu bursztynowego
(sukcynoimid)
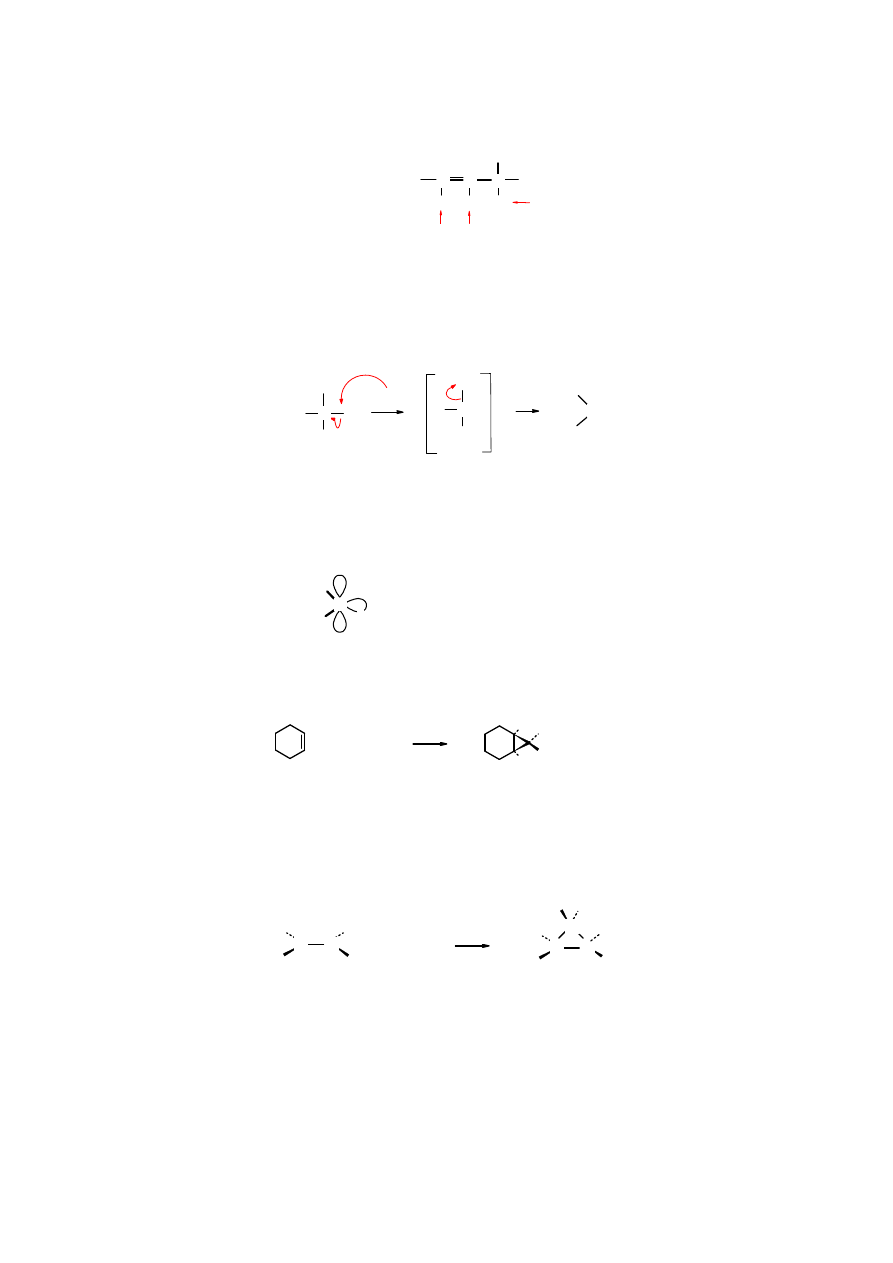
Atomy wodoru w pozycji allilowej (
β
do C=C) są bardzo reaktywne (ruchliwe) i ulegają łatwo
podstawieniu. Najmniej reaktywne są winylowe atomy wodoru:
H
H
H
C
C
C
atomy wodoru
winylowe, mało
raktywne
allilowy,
bardzo
reaktywny
Addycja karbenów do podwójnego wiązania C=C
Karben jest bardzo reaktywnym ugrupowaniem o wzorze R
2
C, powstającym najczęściej w
wyniku oderwania przez silną zasadę atomu wodoru i atomu chloru:
Cl
Cl
H
Cl
Cl
Cl
Cl
Cl
Cl
C
KOH
..
..
C :
- H
+
-
- Cl
-
C:
chloroform
anion trichlorometylowy
dichlorokarben
Atom węgla w karbenie jest płaski i ma hybrydyzację sp
2
. Wolna para elektronów zajmuje orbital
sp
2
, a p jest nieobsadzony:
Cl
Cl
C
:
sp
2
p
hybrydyzacja atomu C
w karbenach - sp
2
Karben przyłącza się do alkenów stereospecyficznie (powstaje jeden z możliwych
stereoizomerów), powstaje przy tym trójczłonowy układ cykliczny:
Cl
Cl
H
H
+ CHCl
3
+ KCl
KOH
60%
cykloheksen chloroform 7,7-dichlorobicyklo[4.1.0]heptan
Pierścień trójczłonowy może utworzyć się wyłącznie po jednej stronie pierścienia
cykloheksanowego, a zatem atomy wodoru zajmuję pozycje z przeciwnej strony. Karben tworzy
się z chloroformu
in situ w reakcji z KOH.
H
Et
H
Me
H
Et
H
Me
Cl
Cl
C
C
+ CHCl
3
KOH
C
C
C
cis
-pent-2-en chloroform 1,1-dichloro-2-etylo-3-
metylocyklopropan
(65%)
Utlenienie podwójnego wiązania C=C
Hydroksylowanie podwójnego wiązania C=C
Formalnie hydroksylowanie alkenów, tj. przyłączenie cząsteczki
HOH do podwójnego wiązania
C=C nie jest reakcją utlenienia, pomimo wprowadzenia tlenu do cząsteczki organicznej,
ponieważ nie zmienia się stopień utlenienia cząsteczki. Stopień utlenienia jednego atomu
C
wzrasta o jednostkę poprzez przyłączenie grupy
–OH, ale drugiego atomu C zmniejsza się o
jednostkę w wyniku utworzenia wiązania
C–H.
O
H
H
C
C
+ HOH
H
+
C
C
Utlenieniem są natomiast reakcje otrzymywania vic
-glikoli, czyli
α,β
-dihydroksyzwiąków w
wyniku reakcji
alkenów z nadmanganianem potasu lub tetratlenkiem osmu. Ten sam efekt, ale
stereochemicznie różny można uzyskać poprzez utlenienie
alkenów do oksiranów i ich
hydrolizę.
O
H
H
OH
H
O
H
H
CH
3
COOOH
HOH/H
+
cyklopenten 6-oksabicyklo[3,0,0]heksan trans-1,2-dihydroksy-
cyklopentan
O O
Mn
O
O
O
Mn
O
O
O
H
O
H
OH
H
MnO
4
-
OsO
4
-
cyklopenten
cis-1,2-dihydroksy-
pentan
Ozonoliza
Ozonoliza oznacza reakcję rozkładu pod wpływem
ozonu. Ozon przyłącza się do alkenów, a w
ś
rodowisku redukującym z tego połączenia powstają aldehydy lub ketony. Pierwszym, bardzo
nietrwałym produktem addycji ozonu do
C=C są tzw. molozonki, które szybko ulegają
przegrupowaniu i przekształcają się w ozonki:
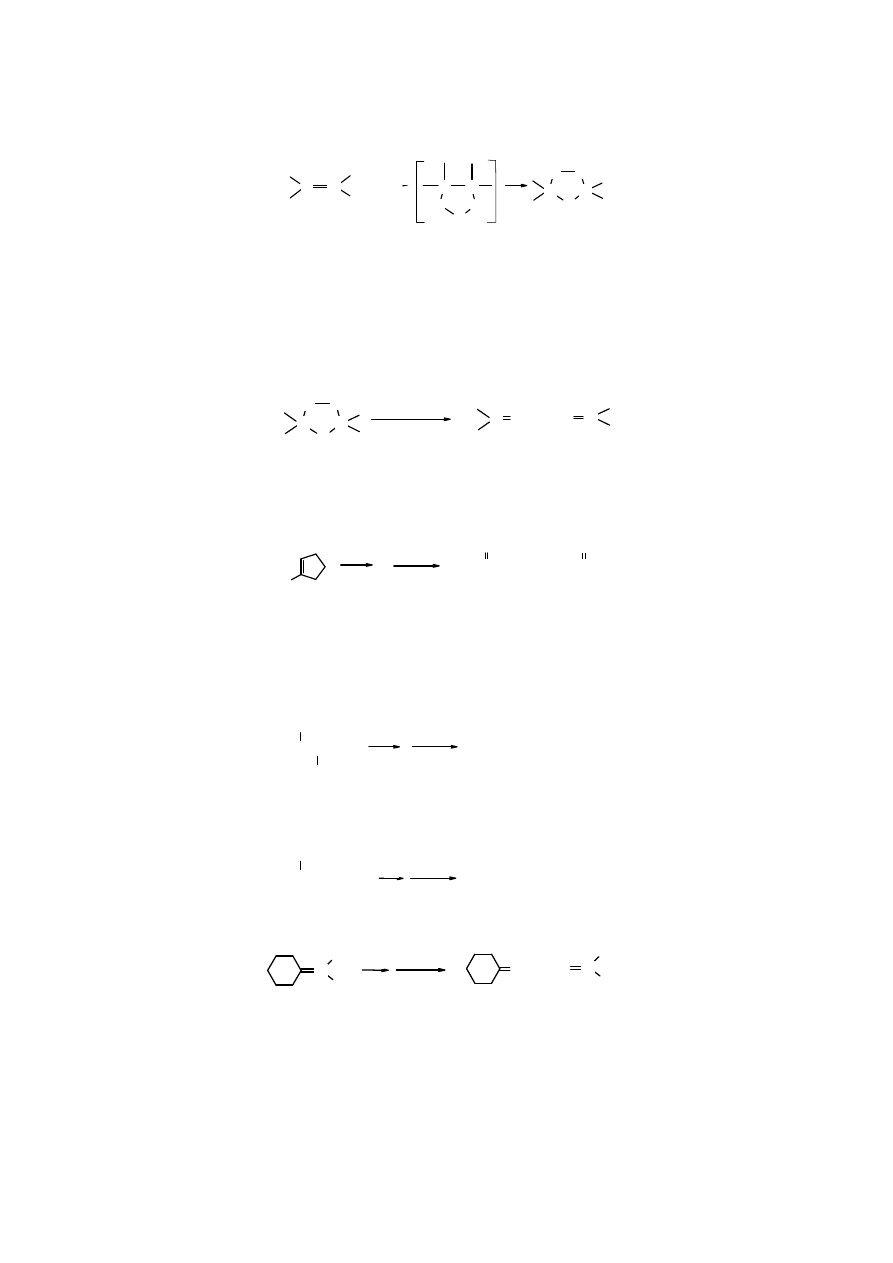
O
O
O
O
C
C
O
O
C
C
O
3
, - 78
o
C
CH
2
Cl
2
C
C
alken molozonek ozonek
Ozonki w wodnym redukującym środowisku (Zn/H
+
) rozpadają się na dwie części, z których
powstają dwa związki karbonylowe (aldehydy lub ketony), przy czym grupy karbonylowe (
C=O)
tworzą się w miejscu podwójnego wiązania (
C=C). Ozonki niższych alkanów są wybuchowe i
nie powinno się ich izolować. Środowisko redukujące chroni powstające aldehydy przed dalszym
utlenieniem do kwasów karboksylowych.
O
O
O
C
C
O
O
Zn/AcOH/HOH
C
C
+
Reakcja ozonolizy powoduje rozpad wiązania podwójnego
C=C, a w jego miejscu pojawiają się
dwie grupy karbonylowe. Jeżeli podwójne wiązanie było częścią pierścienia następuje
przekształcenie związku pierścieniowego w łańcuchowy:
C
H
3
O
O
O
3
H-C-CH
2
CH
3
CH
3
-C-CH
3
Zn/HOH
1-metylocyklopenten heks-1-al-5-on
Keton (
R
2
C=O) powstaje, gdy na atomie węgla sp
2
są dwie grupy alkilowe (
R), natomiast w
przypadku, kiedy atom
C tworzący podójne wiązanie jest połączony z atomem wodoru i grupą
alkilowa to tworzy się aldehyd (
RCH=O):
CH
3
H
O
3
Zn/HOH
CH
3
-C=C-CH
3
(CH
3
)
2
C=O + O=CHCH
3
2-metylobut-2-en aceton acetaldehyd
CH
3
O
3
Zn/HOH
CH
3
-CH-CH=CH
2
(CH
3
)
2
CH-CH=O + O=CH
2
3-metylobut-1-en 2-metylopropanal formaldehyd
CH
3
CH
3
O
CH
3
CH
3
O
O
3
Zn/HOH
C
C
+
izopropylidenocykloheksan cykloheksanon
84%
aceton
Polimeryzacja rodnikowa alkenów
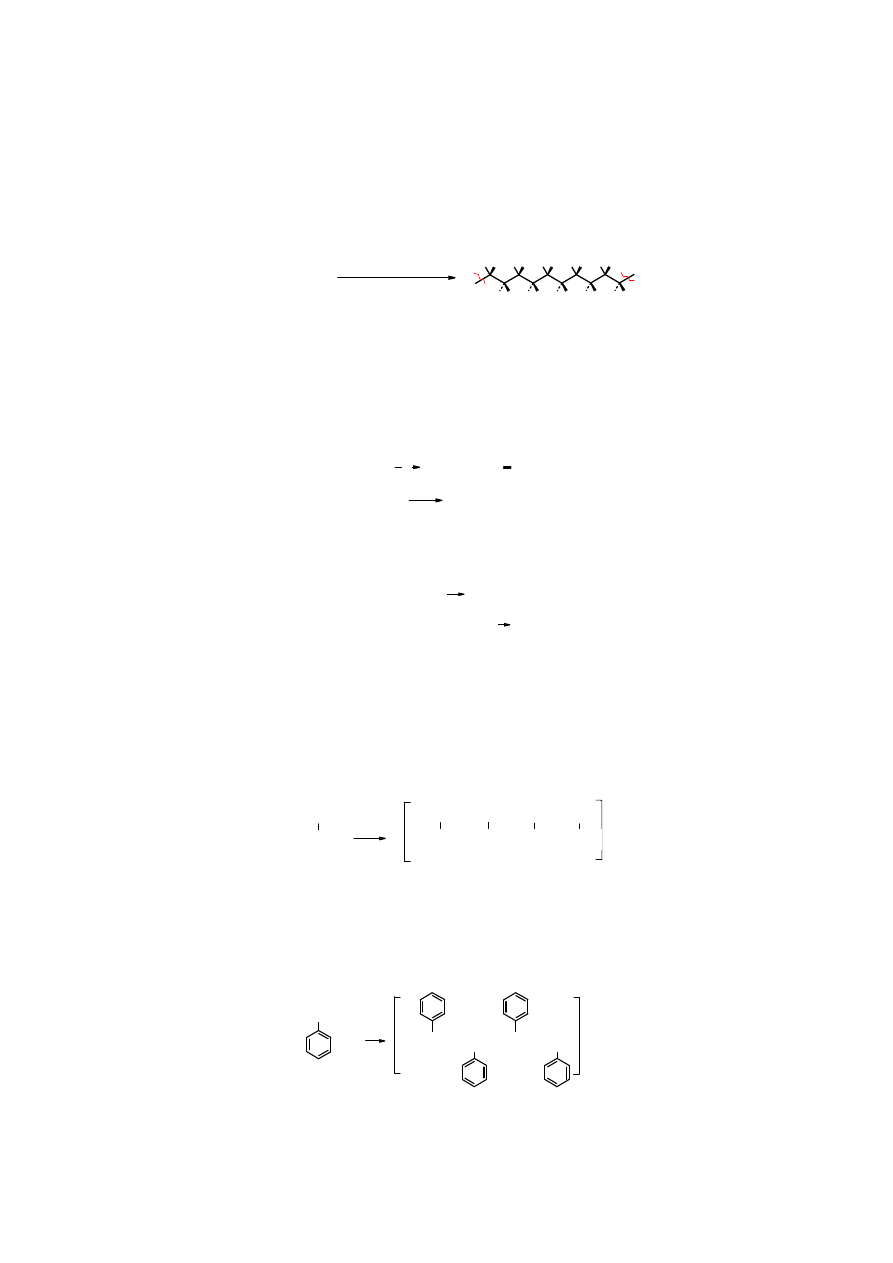
Eten
w obecności inicjatora rodnikowego (np.
nadtlenku benzoilu
), w podwyższonej
temperaturze i pod wysokim ciśnieniem ulega polimeryzacji do
polietylenu
– tworzywa
syntetycznego o dużym zastosowaniu praktycznym. Reakcja biegnie mechanizmem
łańcuchowym.
H H
H H
H H
H H
H H
H H
H H
H H
H H
H H
n H
2
C=CH
2
nadtlenek benzoilu
100-250
o
C, 10-30 Mpa
eten
fragment
polietylenu
W
zależności
od
warunków
polimeryzacji
otrzymuje
się
polietylen
twardy
(wysokospolimeryzowany) lub miękki.
Reakcja zaczyna się od rozpadu nadtlenku i wytworzenia rodnika –
PhCO
.
, który inicjuje
polimeryzację przekształcając cząsteczką
etenu
w rodnik –
In-CH
2
CH
2
.
:
PhCOOOCOPh
∆
2 PhCOO
.
In
.
In
.
+ H
2
C=CH
2
In-CH
2
-CH
2
.
inicjacja
Rodnik etylenowy reaguje z drugą cząsteczką
etenu
wytwarzając
rodnik tetrametylenowy, po
czym z kolei powstaje
rodnik heksametylenowy itd.:
In-CH
2
-CH
2
.
+ H
2
C=CH
2
In-CH
2
-CH
2
-CH
2
-CH
2
.
In-CH
2
-CH
2
-CH
2
-CH
2
.
+ H
2
C=CH
2
In-(CH
2
)
5
-CH
2
.
.
.
.
.
propagacja
Terminacja, czyli zakończenie wzrostu danego łańcucha (zatrzymanie polimeryzacji) następuje
poprzez kombinacje dwóch rodników lub utratę energii rodnika.
W reakcji polimeryzacji
propenu
otrzymuje się szeroko wykorzystywany
polipropylen
:
CH
3
CH
3
CH
3
CH
3
CH
3
CH
2
=CH
In
-CH
2
CHCH
2
CHCH
2
CHCH
2
CH-
n
propen
fragment
polipropylenu
Podobnej polimeryzacji poddaje się inne
alkeny lub ich pochodne, np.
styren
,
chlorek winylu
,
octan winylu
,
tetrafluoroeten
i inne otrzymując
polistyren
,
poli(chlorek winylu)
,
poli(octan
winylu)
,
teflon
i inne znane polimery.
CH=CH
2
In
-CH
2
CHCH
2
CHCH
2
CHCH
2
CH-
n

styren
fragment
polistyrenu
Znane są także tego typu polimery naturalne, chociażby kauczuk, który jest
poliizoprenem
.
CH
3
CH
2
=CH-CH=CH
2
n
izopren (2-metylobuta-1,3-dien)
fragment
kauczuku naturalnego
n
fragment
gutaperki
Kauczuk
jest izomerem cis-, znany jest również naturalny polimer
izoprenu
o geometrii trans-,
zwany
gutaperką
. Kauczuk naturalny i gutaperka różnią się właściwościami fizykochemicznymi
– kauczuk jest miękki i elastyczny, a gutaperka krucha i twarda. Właśnie układ cis- pozwala na
rozciąganie wiązań wzdłuż łańcucha. Stopień polimeryzacji naturalnego kauczuku waha się w
granicach 8 000 – 30 000, podczas gdy gutaperki około 1500.
Wyszukiwarka
Podobne podstrony:
00 02 00 beben zlozenie montazowy
P0 00 02 w
Proof 6000 PL 00 02 Selection
2015 08 20 08 00 02 01
00 02 01 beben
00 02 89
12 00 02 Gabaryty
00 02 02 wal
12 00 02 Frezowanie
12 00 02 02 xxx SeeSchStrO Sichtzeichen d Fz o L doc
12 00 02 05 xxx SeeSchStrO Ruh Verkehr m L doc
34 01 00 02 xxx Erste Hilfe doc
2015 08 20 08 00 02 01
więcej podobnych podstron