
Politechnika
Białostocka
Wydział:
Budownictwa i Inżynierii Środowiska
Instrukcja do zajęć laboratoryjnych
Temat ćwiczenia:
Wyznaczanie gęstości ciał stałych i cieczy
Wyznaczanie lepkości cieczy
Numer ćwiczenia:
9
Laboratorium z przedmiotu:
C H E M I A
Studia stacjonarne I stopnia
KOD: EKS1A100007
Opracowanie: dr Mariola Samsonowicz

1. Wprowadzenie
1. Gęstość
Gęstość jest wielkością, która używana jest do charakterystyki różnych substancji. Jest to
masa jednostkowej objętości danego ciała.
Gęstością bezwzględną (d) obiektu materialnego nazywamy stosunek jego masy (m) do
objętości (v):
𝑑 =
𝑚
𝑣
⌊
𝑘𝑔
𝑚
3
⌋
(1)
Jednostką gęstości w układzie SI jest kg/dm
3
. Często używaną jednostką jest również g/cm
3
.
Praktycznie każda substancja ma inną gęstość zależną od stanu skupienia, ciśnienia
zewnętrznego i temperatury. Z grubsza można stwierdzić, że najmniejszą gęstość mają
substancje w stanie gazowym, większą w stanie ciekłym, natomiast ciała stałe charakteryzują
się największą gęstością. Dla większości substancji objętość rośnie wraz ze wzrostem
temperatury, co oznacza zmniejszanie się gęstości. Wzrost ciśnienia powoduje zmniejszenie
objętości, a zatem wzrost gęstości substancji.
Gęstość podawana jest zazwyczaj w tablicach dla określonych wartości ciśnienia (1013 hPa) i
temperatury (np. 0
o
C, 18
o
C, 20
o
C, 25
o
C)
Gęstością względną (d
w
) nazywamy stosunek gęstości bezwzględnej danego ciała (d
1
) do
gęstości bezwzględnej innego ciała (d
2
) przyjętego za wzorcowe.
𝑑
𝑤
=
𝑑
1
𝑑
2
(2)
Jeśli oba ciała mają tę samą objętość wówczas:
𝑑
𝑤
=
𝑑
1
𝑑
2
=
𝑚
1
𝑣
∙
𝑣
𝑚
2
=
𝑚
1
𝑚
2
(3)
W praktyce gęstość względną danego ciała wyznacza się w odniesieniu do gęstości wody
destylowanej. Woda w temperaturze 4
o
C i pod ciśnieniem 1013 Pa ma gęstość równą 1000
kg/m
3
.
Gęstość nasypowa – określana jest jako stosunek masy luźno zasypanego suchego materiału
określonej frakcji (np. kruszywo, cement, proszek, biomasa) wypełniającego określony
pojemnik do objętości tego pojemnika. Jej wielkość zależy od materiału oraz od kształtu,
wielkości i rozkładu wielkości cząstek, a także od wszystkich parametrów decydujących o
warunkach tarcia między cząsteczkami materiału. Np. materiałem o niskiej gęstości
nasypowej (mały ciężar przy dużej objętości) jest słoma: 1 m
3
luźnej słomy waży zaledwie 40
– 60 kg, podczas gdy 1m
3
drewna waży 600 – 700 kg. W celu zagęszczenia słomy poddaje się
ją prasowaniu. Bele silnie sprasowanej słomy osiągają gęstość nasypową do 160 kg/m
3
.
Metody wyznaczania gęstości
1. Wyznaczenie masy ciała stałego i pomiar objętości ciała
Najprostszym sposobem wyznaczenia gęstości ciała stałego jest ustalenie jego wymiarów np.
przy pomocy suwmiarki oraz masy przez zważenie na wadze laboratoryjnej. Przy obliczaniu
stosuje się wzór na gęstość bezwzględną ciał. Metodę tą możemy zastosować w przypadku
brył foremnych (np. sześcianów, stożków czy kul),
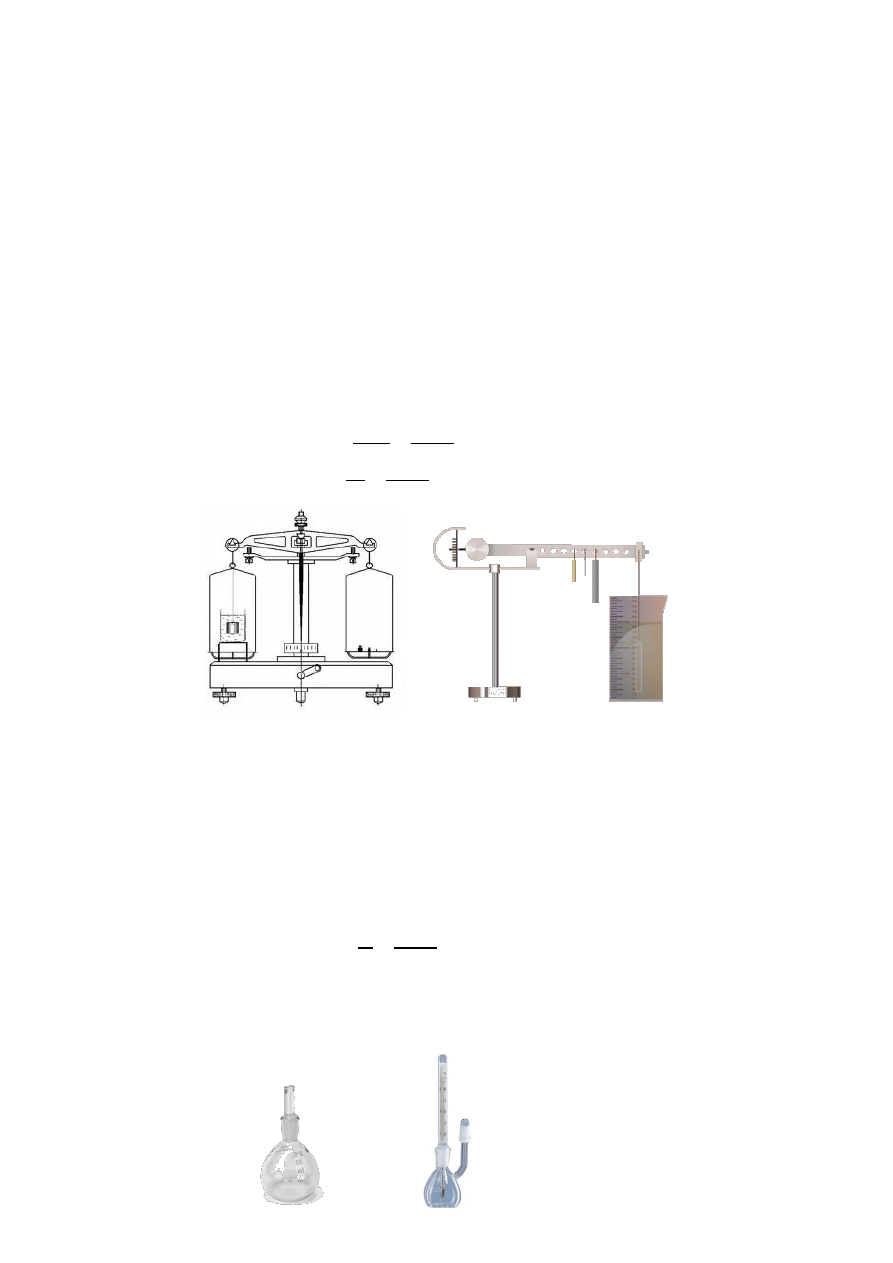
2. Waga hydrostatyczna
Gęstość ciał stałych o dowolnych kształtach można wyznaczyć korzystając z prawa
Archimedesa i wagi hydrostatycznej, którą może stanowić waga analityczna. Zasada pomiaru
w tej metodzie polega na dwukrotnym zważeniu badanego ciała, które jest zawieszone na
cienkim druciku (o masie zaniedbywalnie małej) na belce wagi: raz w powietrzu (m
p
), drugi
raz w cieczy wzorcowej (m
c
) (zwykle woda destylowana). Siła wyporu działająca na ciało
zanurzone w cieczy jest równa:
𝐹
𝑤
= 𝑣 ∙ 𝑑
𝑐
∙ 𝑔
(4)
Natomiast ciężar ciała w powietrzu jest równy:
𝑄
𝑝
= 𝑚
𝑝
∙ 𝑔 = 𝑣 ∙ 𝑑 ∙ 𝑔
(5)
gdzie:
v – objętość ciała zanurzonego;
d
c
– gęstość cieczy,
g – przyśpieszenie ziemskie,
d – gęstość ciała
Zgodnie z prawem Archimedesa ciężar ciała zanurzonego w cieczy (Q’) jest równy różnicy
ciężaru ciała w powietrzu i wiły wyporu działającej na to ciało.
𝑄′ = 𝑄
𝑝
− 𝐹
𝑤
(6)
𝑄
𝑝
− 𝑄
′
= 𝑣 ∙ 𝑑
𝑐
∙ 𝑔
(7)
Ze wzoru (7) przekształcając go otrzymuje się wyrażenie na objętość ciał (v):
𝑣 =
𝑄
𝑝
−𝑄′
𝑑
𝑐
∙𝑔
=
𝑚
𝑝
−𝑚′
𝑑
𝑐
(8)
Zatem:
𝑑 =
𝑚
𝑝
𝑣
=
𝑚
𝑝
𝑚
𝑝
−𝑚′
∙ 𝑑
𝑐
(9)
Rys.1. Wagi hydrostatyczne a) do pomiarów gęstości ciał stałych, b) waga Westphala-Mohra
umożliwiająca pomiar gęstości cieczy
Pomiar wagą hydrostatyczną zwaną również wagą Westphala-Mohra oparty jest także na
prawie Archimedesa z tym, że stała jest objętość pływaka, który jest całkowicie zanurzony w
badanej cieczy, a siła wyporu hydrostatycznego równoważona jest ciężarem odważników
wieszanych na ramieniu wagi.
Ze wzoru (9) wynika możliwość wyznaczenia gęstości badanej cieczy. Próbkę ciała stałego
należy zważyć w powietrzu, w cieczy wzorcowej o gęstości d
c
oraz w badanej cieczy o
gęstości d
x
. Wówczas:
𝑑
𝑥
𝑑
𝑐
=
𝑚
𝑝
𝑚
𝑝
−𝑚′
(10)
3. Pomiar gęstości za pomocą piknometru
Piknometr jest to niewielkie naczynie w kształcie kolby z dokładnie doszlifowanym korkiem.
W środku korka znajduje się kanalik, przez który może wypływać nadmiar cieczy z naczynia
(rys. 2).
a)
b)
b)
a)

Rys.2. Piknometr zwykły (a) i piknometr z termometrem
Ze względu na małe wymiary powierzchni przekroju kanalika zmniejsza się do minimum
parowanie cieczy. Przy badaniu cieczy o dużej lotności często na końcówkę korka nanosi się
kroplę oleju będącą dodatkową barierą zabezpieczającą przed stratami masy.
Zasada pomiaru przy użyciu piknometru polega na zważeniu piknometru suchego (m
1
),
następnie napełnionego wodą destylowaną (m
2
) oraz napełnionego badaną cieczą (m
3
).
Masa cieczy
𝑚 = 𝑚
3
− 𝑚
1
Masa wody destylowanej
𝑚
𝑤
= 𝑚
2
− 𝑚
1
= 𝑣 ∙ 𝑑
𝑡
gdzie:
d
T
– gęstość wody w temperaturze T
v – objętość wody destylowanej
Objętość cieczy jest równa objętości wody destylowanej, a zatem gęstość cieczy d
x
jest
równa:
𝑑
𝑥
=
𝑚
𝑣
=
𝑚
3
−𝑚
1
𝑚
2
−𝑚
1
∙ 𝑑
𝑇
(11)
Gęstość d
T
można odczytać z tablic dla temperatury wody używanej do pomiarów.
4. Metoda areometryczna
Metoda areometryczna wykorzystuje prawo Archimedesa. Areometr o stałym ciężarze
umieszczony w cieczy zanurza się na głębokość zależną od jej gęstości. Z podziałki, która jest
umieszczona na areometrze, nad powierzchnią cieczy odczytuje się gęstość badanej cieczy.
Areometr jest wąską szklaną rurką zakończoną kulistym zbiornikiem, który wypełniony jest
rtęcią lub śrutem, które równoważą siłę wyporu i utrzymują aerometr w pozycji pionowej
(częściowo zanurzony w badanej cieczy) podczas pomiaru. Dzieje się tak, ponieważ
spełniony jest warunek: siła ciężkości równoważy siłę wyporu. Równowaga ta wyrażona jest
wzorem:
𝑚 ∙ 𝑔
= 𝑣 ∙ 𝑑
𝑐
∙ 𝑔
(12)
gdzie: m – masa aerometru; g – przyśpieszenie ziemskie; v – objętość jego
zanurzonej części; d
c
– gęstość cieczy.
Wynika z niego, że głębokość zanurzenia aerometru (jej miarą jest v) jest
odwrotnie proporcjonalna do gęstości cieczy.
Rys.3. Areometry
Niektóre areometry wyposażone są dodatkowo w termometr umieszczony w dolnej części
areometru ułatwiający kontrolę temperatury podczas pomiaru. Areometry są z reguły
skalowane do pomiarów w temperaturze 20 ºC. Wykonując pomiary w innej temperaturze
trzeba skorzystać z poprawek bądź dokonać kalibracji.
2. Lepkość
Lepkość jest właściwością materii we wszystkich stanach skupienia, związaną z
oddziaływaniami międzycząsteczkowymi. Lepkością albo tarciem wewnętrznym nazywamy
siły oddziaływania powstające w cieczach podczas przesuwania się jednych warstw
względem drugich. Podczas laminarnego przepływu w rurce wszystkie warstwy cieczy
poruszają się w kierunkach równoległych, przy czym każda z inną prędkością. Warstwa
poruszająca się szybciej działa na warstwę poruszającą się wolniej siłą zgodnie ze zwrotem

ruchu, a zatem przyśpieszającą, natomiast warstwa poruszająca się wolniej hamuje ruch
warstwy poruszającej się szybciej. Jeżeli dwie warstwy cieczy oddalone od siebie o dx
wykazują stałą różnicę prędkości dv (dv≠0), to siłę styczną potrzebną do pokonania tarcia
wewnętrznego opisać można równaniem Newtona:
𝐹 = 𝜂𝑞
𝑑𝑣
𝑑𝑥
(13)
gdzie:
η- współczynnik proporcjonalności nazywany lepkością dynamiczną (bezwzględną),
q- pole powierzchni przesuwającychulegającej przesuwaniu,
dv/dx – gradient prędkości
Ciecze, w których lepkość w danej temperaturze jest stała, niezależna od gradientu prędkości
dv/dx noszą nazwę cieczy newtonowskich, a ciecze wykazujące odchylenia od tej reguły są
cieczami nienewtonowskimi.
Jednostką lepkości dynamicznej w układzie SI jest [N
.
s
.
m
-2
] (niutonosekunda na metr
kwadratowy) lub [Pa
.
s].
Pa ∙ s =
𝑘𝑔
𝑚∙𝑠
=
𝑁
𝑠∙𝑚
2
(14)
W technice bardzo często jest stosowane pojęcie lepkości kinematycznej, zwanej również
lepkością kinetyczną lub lepkością bezwzględną. Lepkość kinematyczną definiuje się jako
stosunek lepkości dynamicznej (η) cieczy do jej gęstości (d):
𝑣 =
𝜂
𝑑
(15)
Jednostką lepkości kinematycznej jest 1 stokes [cm
2
/s] (układ CGS). W układzie SI jednostką
lepkości kinematycznej jest [m
2
/s]. 1St = 10
-4
cm
2
/s. W praktyce używa się jednostki 10
6
razy
mniejszej [mm
2
/s]
Lepkość cieczy wynika z oddziaływań międzycząsteczkowych. Czynnikiem hamującym ruch
cieczy jest wzajemne przyciąganie cząstek. Inny jest mechanizm lepkości gazów. Pod niezbyt
wysokim ciśnieniem siły międzycząsteczkowe w gazach są małe. Tarcie wewnętrzne o środka
gazowego wynika ze zderzeń między cząsteczkami. Cząsteczki poruszające się w kierunku
przepływu gazu wykonują także ruchy chaotyczne we wszystkich innych kierunkach.
Wskutek tego następuje wzajemne przenikanie cząsteczek z jednej warstwy do drugiej.
Wymiana energii kinetycznej między nimi powoduje zmniejszenie ich składowej prędkości
w kierunku ruchu całego o środka. Lepkość gazów jest znacznie mniejsza od lepkości cieczy.
Lepkość cieczy na ogół zmienia się znacznie wraz z temperaturą. W miarę wzrostu
temperatury, w wyniku zwiększania się energii kinetycznej cząsteczek, zmniejszają się siły
przyciągania działające między cząsteczkami, efektem czego jest zmniejszenie się tarcia
wewnętrznego. Gazy zachowują się odwrotnie: wraz ze wzrostem temperatury ich lepkość
wzrasta, gdyż wzrasta liczba zderzeń między cząsteczkami.
Lepkość maleje wykładniczo wraz z temperaturą, co opisuje równanie Arrheniusa-Guzmana:
𝜂 = 𝐴𝑒
𝛥𝐸/𝑅𝑇
(16)
gdzie ΔE – energia aktywacji przepływu lepkiego (bariera energetyczna, którą musi pokonać
cząsteczka podczas ruchu pomiędzy cząsteczkami sąsiednimi), R - stała gazowa, T -
temperatura (wyrażana w °K); A - stała charakterystyczna dla danej cieczy (zależna od masy i
objętości molowej).
Inne czynniki mające wpływ na lepkość to: rodzaj materiału, czas, ciśnienie, pH, pole
elektryczne i magnetyczne
Metody wyznaczania lepkości
Pomiary lepkości kinematycznej cieczy są oparte o bezpośredni lub pośredni pomiar oporu,
jaki stawia ciecz przy względnym ruchu w stosunku do ciała stałego. Ruch cieczy powinien
być laminarny. Ruch taki ma miejsce przy małych prędkościach i w przewodach o małej
średnicy, zwanych kapilarami. Do pomiaru lepkości służą lepkościomierze – wiskozymetry.
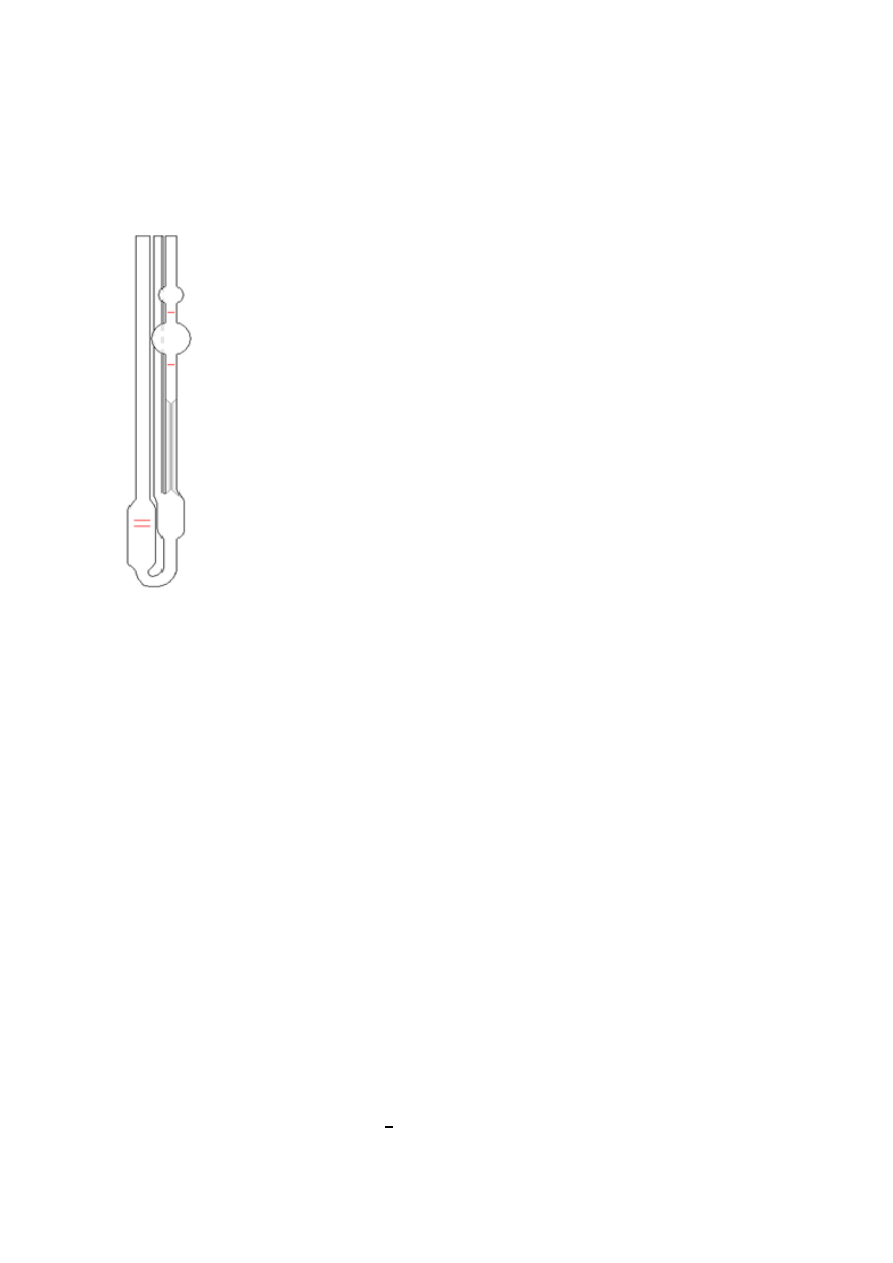
Wiskozymetry kapilarne – np. wiskozymetr Ubbelohde’a, gdzie oblicza się lepkość
kinematyczną przez pomiar czasu przepływu badanej cieczy przez rurkę kapilarną.
Wiskozymetr Ubbelohde’a zbudowany jest z trzech rurek połączonych ze
sobą. Szeroka rurka (1) posiada w dolnej części duży zbiorniczek (A), na
którym zaznaczono dwiema kreskami poziom, do jakiego należy wypełnić
lepkościomierz badaną cieczą. Rurka (3) składa się ze zbiorniczka (C)
kończącego się kapilarą z zaznaczonymi poziomami c
1
i c
2
. Trzecia rurka (2)
odchodzi od średniego zbiorniczka (B). Aby dokonać pomiaru należy przez
rurkę (1) napełnić zbiorniczek (A) tak, aby poziom badanej cieczy mieścił się
między kreskami. Następnie zatyka się palcem rurkę (2) i pompką podłączoną
do rurki (3) zasysa się ciecz powyżej poziomu c
1
po czym odłącza się pompkę
i zdejmuje się palec z rurki (2). u). Należy zmierzyć czas przesunięcia menisku
między poziomami c
1
i c
2
.
Wartość lepkości kinematycznej otrzymuje się z zależności:
𝑣 = 𝐶 ∙ 𝑡 (17)
gdzie: v – lepkość kinematyczna, [mm²/s]; C – stała kapilary, [mm²/s²],
t – średnia arytmetyczna czasów przepływu, [s].
Rys.4. Wiskozymetr Ubbelohde’a
Na podobnej zasadzie działają wiskozymetry Ostwalda i Englera.
Metoda Stokesa
Metoda pomiaru szybkości opadania kulki w cieczy została opracowana teoretycznie przez
Stokesa, który wyprowadził wzór na siłę, z jaką lepki ośrodek o gęstości d
c
przeciwdziała
ruchowi kulki o promieniu r, gęstości d
k
i prędkości v. Siła ta wynosi:
𝐹 = 6𝜋ɳ𝑟𝑣 (18)
gdzie:
F – siła oporu lepkiego; ɳ - współczynnik lepkości dynamicznej cieczy; r – promień kulki; v –
prędkość kulki.
Wzór ten jest słuszny wtedy, gdy opadająca kulka nie powoduje powstawania wirów (ruch
laminarny) a warstwy cieczy poruszają się równolegle względem siebie. Do pomiaru lepkości
tą metodą służy szklana rura, ustawiona pionowo, do której nalewa się badaną ciecz i
wpuszcza się kulkę o bardzo małym promieniu. W celu wyznaczenia współczynnika lepkości
należy zmierzyć czas (t) ruchu kulki na odpowiednio dobranym odcinku drogi (s).
Siła działająca na kulkę znajdującą się w cieczy jest równa według Prawa Archimedesa:
𝐹 = 𝑃 − 𝑄 (19)
gdzie:
P – siła wyporu;
Q – siła ciężkości
ciężar wypartej cieczy o objętości kuli:
𝑄 =
4
3
𝑟
3
𝜋𝑑
𝑘
𝑔 (20)
natomiast ciężar kuli:
B
A
C
c
1
c
2
1 2 3
𝑃 =
4
3
𝑟
3
𝜋𝑑
𝑐
𝑔 (21)
gdzie:
d
c
– gęstość cieczy,
d
k
– gęstość materiału z którego wykonano kulę,
g – przyśpieszenie ziemskie
Po podstawieniu wszystkich wartości uzyskujemy:
6𝜋ɳ𝑟𝑣 =
4
3
𝜋𝑟
3
(𝑑
𝑘
− 𝑑
𝑐
)𝑔 (22)
Współczynnik lepkości zatem wyznaczamy ze wzoru:
ɳ =
2𝑟
2
𝑔
9𝑠
(𝑑
𝑘
− 𝑑
𝑐
)𝑡 (23)
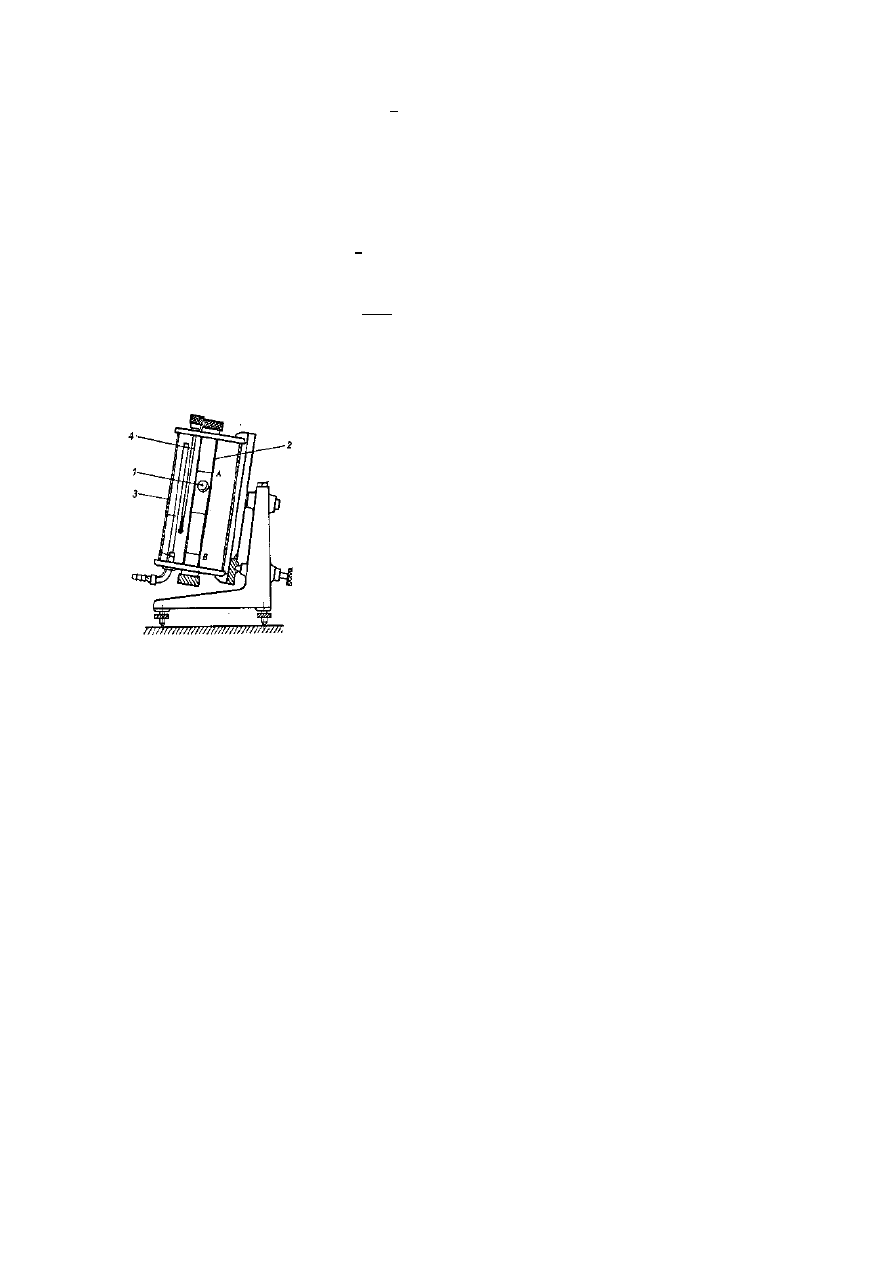
Pomiar lepkości tą metodą przeprowadza się w wiskozymetrze Höpplera.
Wiskozymetr Höpplera
1 – kulka
2 – rurka szklana
3 – płaszcz grzejny wodny
4 - termometr
Rys.5. Wiskozymetr Höpplera
W wiskozymetrze Höpplera kulka opada w rurce szklanej o dość małym promieniu
wewnętrznym r. Rurka ta posiada niewielkie odchylenie od pionu, skutkiem czego kulka
uzyskuje odpowiednie prowadzenie i nie odbija się od ścianek. Stąd w wyrażeniu
stosowanym praktycznie do obliczania lepkości:
ɳ = 𝐾𝑡(𝑑
𝑘
− 𝑑
𝑐
) (24)
gdzie:
K – stała kulki [m
2
/s
2
]
t – średni czas spadania kulki [s]
d
k
, d
c
– gęstość kulki i cieczy [kg/m
3
]
2. Cel i zakres ćwiczenia laboratoryjnego
Celem ćwiczenia jest zapoznanie z metodami badania gęstości ciał stałych (foremnych i
nieforemnych) oraz cieczy, doświadczalne wyznaczenie gęstości kilku ciał stałych i cieczy (o
różnym stężeniu procentowym) dostępnymi metodami. Celem ćwiczenia jest zapoznanie z
metodami określania lepkości cieczy oraz doświadczalne wyznaczenie lepkości cieczy (o
różnym stężeniu procentowym) dostępnymi metodami.
3. Metodyka badań
Przebieg realizacji eksperymentu
Doświadczenie 1. Wyznaczanie gęstości ciał stałych
Aparatura i szkło laboratoryjne: waga analityczna, suwmiarki, cienka nitka, zlewki,
cylindry miarowe, krystalizatory.
Odczynniki: woda destylowana, bryły: z aluminium, mosiądzu, stali, plexi itp.
Wykonanie doświadczenia
a) Wyznaczenie gęstości ciała stałego na podstawie pomiarów jego masy i objętości
1. Zmierzyć za pomocą suwmiarki wymiary otrzymanych brył foremnych (co
najmniej trzy razy) i na tej podstawie obliczyć jej objętość.
2. Zważyć na wadze analitycznej bryłę (co najmniej trzy razy)
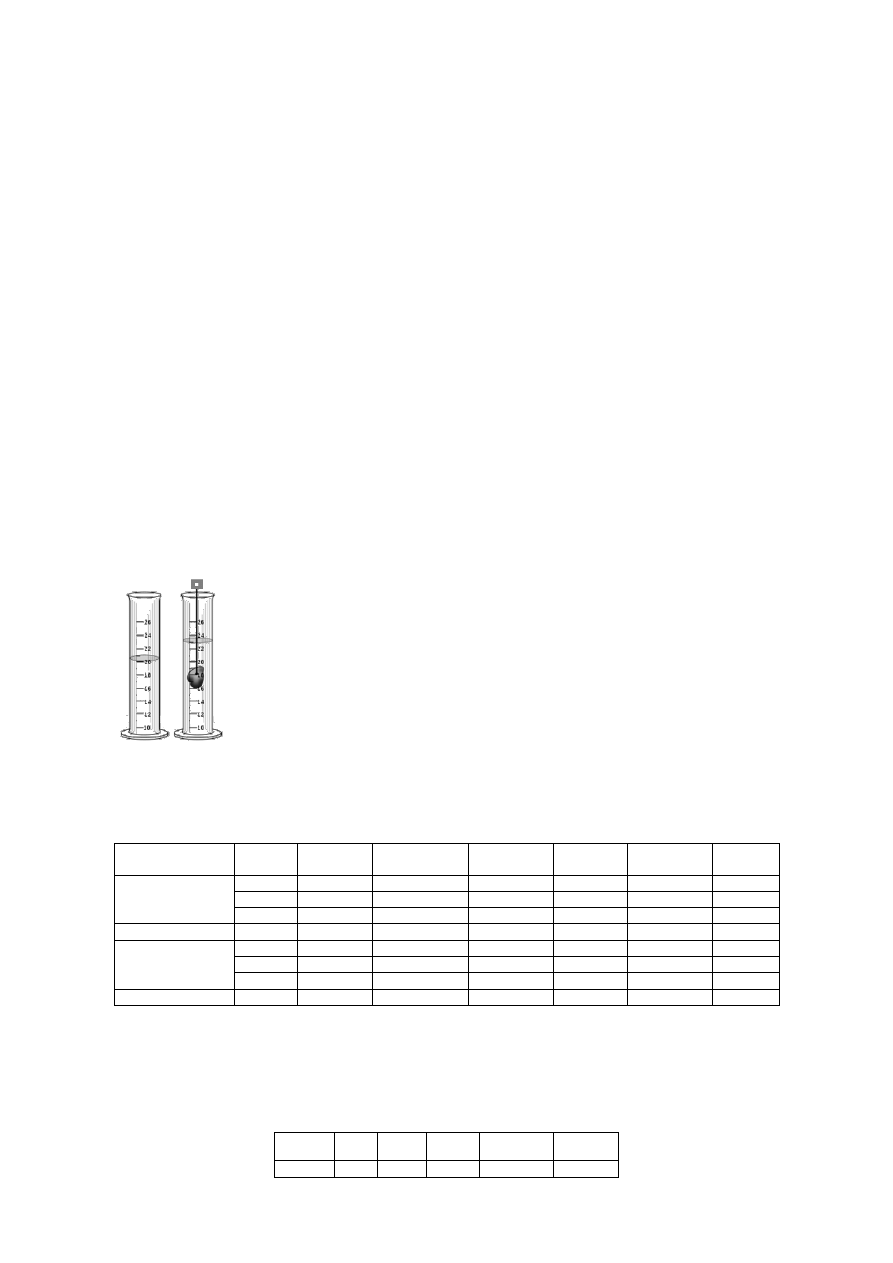
b) Wyznaczenie gęstości ciała stałego metoda hydrostatyczną
1. Zważyć na wadze analitycznej (m
p
) trzykrotnie badane ciała stałe.
2. Nalać wody destylowanej do cylindra do połowy jego objętości i odczytać
dokładną objętość(v
1
).
3. Zawiesić ciało na nitce i zanurzyć w cylindrze (rys.4) i ponownie ze skali odczytać
objętość wody destylowanej po zanurzeniu badanego ciała stałego (v
2
). Objętość
badanego ciała stałego (v) odczytać jako różnicę objętości po i przed
zanurzeniem ciała. Objętość odczytuje się zawsze względem menisku górnego
lub zawsze względem menisku dolnego, ustawiając oko na wysokości
poziomu cieczy w cylindrze, aby uniknąć błędu paralaksy.
4. Obliczyć gęstość badanych brył na podstawie prawa Archimedesa i wzorów
podanych w części wprowadzającej ćwiczenia.
Rys. 4. Schemat układu badawczego
Opracowanie wyników pomiarów
a)
1. Wyniki pomiarów zestawić w tabeli.
masa
[g]
wysokość
[cm]
długość
[cm]
szerokość
[cm]
średnica
[cm]
objętość
[cm
3
]
gęstość
[kg/m
3
]
Bryła 1
Wartości średnie
Bryła 2
Wartości średnie
2. Obliczyć gęstość otrzymanych brył oraz korzystając z tablic fizycznych określić z
jakiego materiału zostały wykonane.
b)
1. Wyniki pomiarów zestawić w tabeli:
m
p
[g]
v
1
[cm
3
]
v
2
[cm
3
]
v= v
2
− v
1
[cm
3
]
gęstość
[kg/m
3
]
Bryła 1
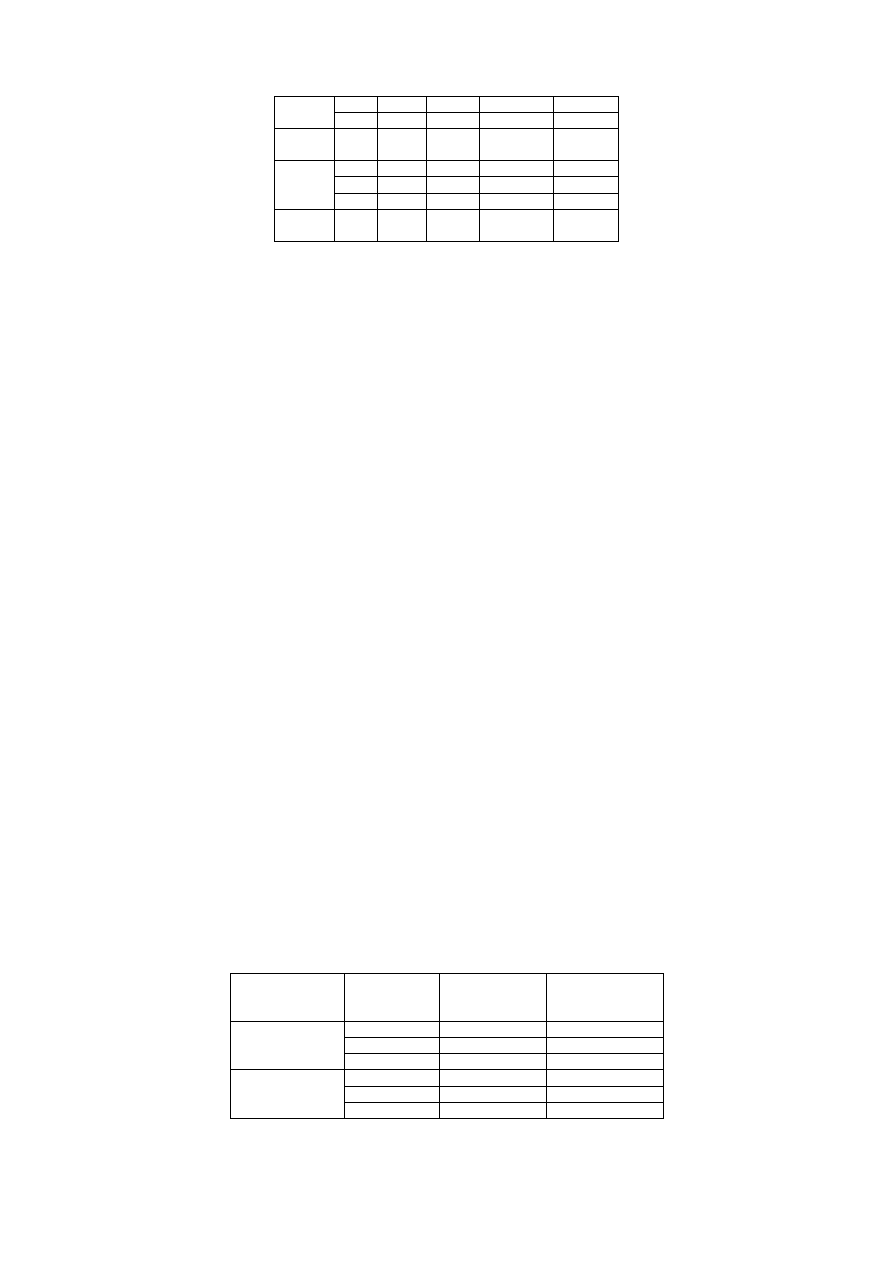
Wartości
średnie
Bryła 2
Wartości
średnie
2. Obliczyć gęstość otrzymanych brył oraz korzystając z tablic fizycznych określić z
jakiego materiału zostały wykonane.
3. Porównać wyniki z ćwiczenia a) i b); co jest przyczyną różnic w otrzymanych
wynikach gęstości.
Doświadczenie 2. Wyznaczanie gęstości cieczy
Aparatura i szkło laboratoryjne: areometr, piknometr, waga laboratoryjna, zlewki,
cylindry, kolby miarowe, naczynka wagowe, butelki szklane
Odczynniki: roztwory: sacharozy, soli nieorganicznych (st), gliceryny; woda destylowana
Wykonanie doświadczenia
1. Wykonać pomiary gęstości badanych roztworów o stężeniach wskazanych przez
prowadzącego, np.: 5%, 10% i 15% za pomocą aerometru.
a) Do wysokiego cylindrów miarowych wlać przygotowane roztwory.
b) Zanurzyć w nich areometr usuwając pęcherzyki powietrza. Areometr nie
powinien dotykać ścianek cylindra.
c) Odczytać gęstość cieczy na skali. Poziom powierzchni cieczy na skali aerometru
wyznacza jej gęstość. W używanych w ćwiczeniu areometrach skala podana jest w
g/cm
3
dla cieczy o temperaturze 20
o
C.
2. Wykonać pomiary gęstości za pomocą piknometru.
a) Piknometr należy oczyścić wodą destylowaną, a następnie osuszyć etanolem.
b) Wyznaczyć masę piknometru (dokładnie osuszonego) wraz z korkiem - m
1
.
c) Napełnić piknometr wodą destylowaną. Zamknąć korkiem, aby nadmiar
cieczy wypłynął przez kanalik w korku. Osuszyć piknometr bibułą i wyznaczyć
masę – m
2
.
d) Wyznaczyć temperaturę badanej wody. Wylać wodę i osuszyć piknometr.
e) Napełnić piknometr badaną cieczą, dokładnie osuszyć i wyznaczyć masę - m
3
.
Uwaga: Przy napełnianiu piknometru cieczą i jego ważeniu należy unikać ogrzewania
piknometru dłońmi. Pod wpływem ciepła ciecz zwiększa swoją objętość i wypływa na
zewnątrz
Opracowanie wyników pomiarów
1. Wyniki pomiarów zestawić w tabeli.
2. Porównać zastosowane metody.
3. W jaki sposób gęstość cieczy zależy od stężenia?
Rodzaj roztworu
Stężenie
[%]
Gęstość
(areometr)
[kg/m
3
]
Gęstość
(piknometr)
[kg/m
3
]
Roztwór I
Roztwór II
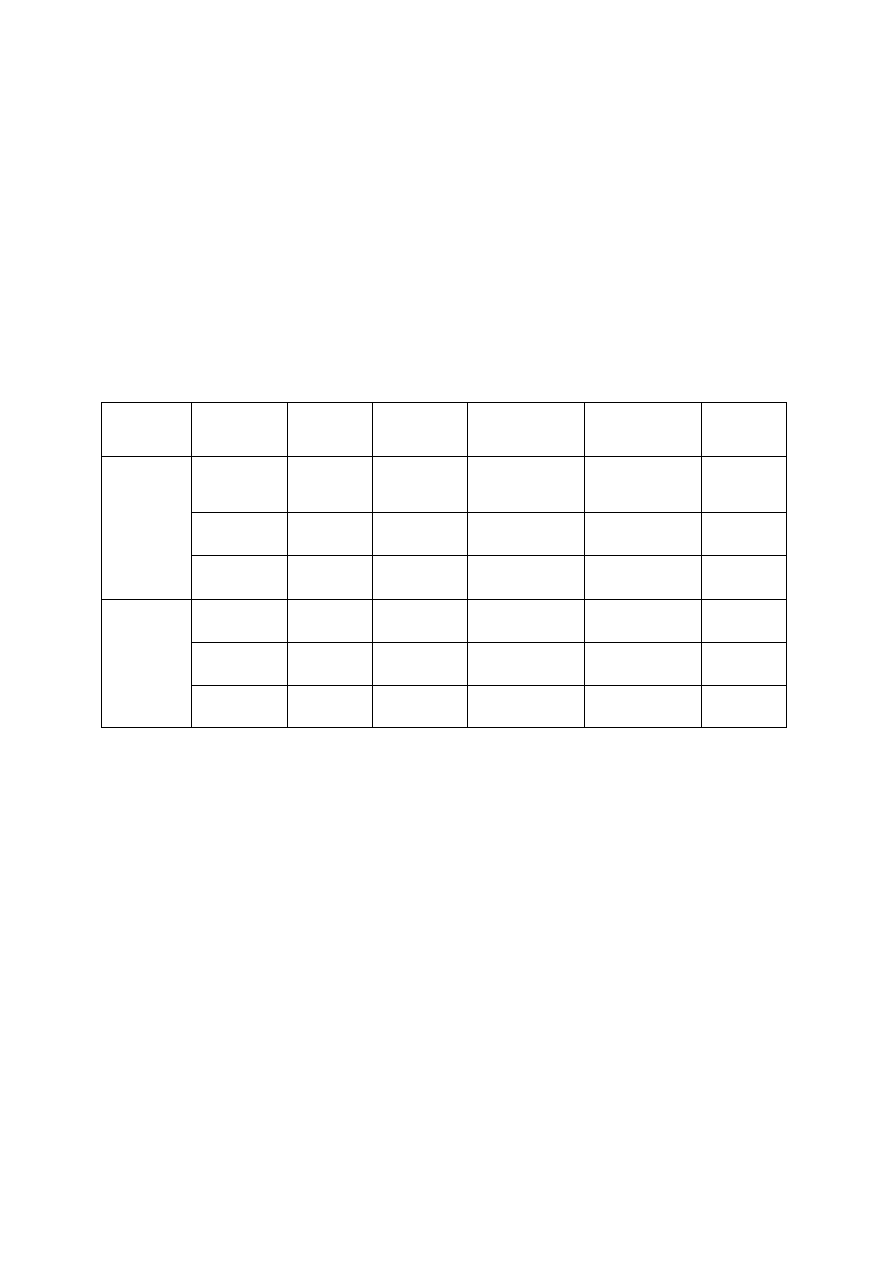
Doświadczenie 3. Wyznaczanie lepkości cieczy
Aparatura i szkło laboratoryjne: Lepkościomierz Ubbelohdego, stopery, zlewki, cylindry,
kolby miarowe, naczynka wagowe, butelki szklane
Odczynniki: roztwory: sacharozy, soli nieorganicznych (st), gliceryny; woda destylowana
Wykonanie doświadczenia
Przeprowadzić pomiar czasu przepływu badanych roztworów między poziomami c
1
i c
2
.
Pomiar czasu przepływu należy wykonać trzykrotnie dla każdego roztworu, a do obliczeń
stosować wartość średnią.
Opracowanie wyników
Wyniki pomiarów zestawić w tabeli i dokonać niezbędnych obliczeń:
Stężenie
procentowe
[%]
Czas
przepływu
t [s]
Średni czas
przepływu
t
śr
[s]
Lepkość
kinematyczna
v [m
2
/s]
Lepkość
dynamiczna
η [N
s
m
-2
]
Gęstość
roztworu
d [kg/m
3
]
Roztwór I
t
1
t
2
t
3
t
śr
Roztwór II
Lepkość cieczy kinematyczną i dynamiczną w danej temperaturze obliczyć ze wzorów (17) i (15).
Utylizacja odpadów:
Roztwory wylewamy do odpowiednich pojemników wskazanych przez prowadzącego
ćwiczenia.
Prezentacja i analiza wyników badań
Sprawozdanie studenckie powinno zawierać:
2.
Cel i zakres ćwiczenia laboratoryjnego,
3.
Krótki opis metodyki pomiaru,
4.
Schemat stanowiska pomiarowego,
5.
Tabele pomiarów i wyników,
6.
Obliczenia i przeliczanie jednostek,
7.
Wnioski.
Pytania kontrolne
1. Znajomość podstawowych pojęć: gęstość ciał, definicja, jednostki, gęstość względna i
bezwzględna, lepkość, lepkość dynamiczna, lepkość kinematyczna, ciecze newtonowskie
i nienewtonowskie,
2. Zależność gęstości i lepkości od temperatury,

3. Prawo Archimedesa,
4. Metody wyznaczania gęstości cieczy i ciał stałych,
5. Metody wyznaczania lepkości cieczy,
6. Budowa piknometru, zasada wyznaczania gęstości cieczy za pomocą piknometru,
7. Zasada działania wagi hydrostatycznej,
8. Budowa areometru, zasada pomiaru gęstości cieczy za pomocą areometru,
9. Budowa i zasada działania wiskozymetru Oswalda, Ubbelohde’a i Höpplera,
10. Równanie Arrheniusa-Guzmana, Stokesa, Newtona,
11. Omówić sposób realizacji ćwiczeń.
4. Wymagania BHP
Każdy z używanych odczynników wykonujący winien dozować za pomocą mikropipetki
samozasysającej (oddzielnej dla każdego odczynnika) co eliminuje możliwość używania
nadmiernych ilości odczynników, rozlań, poparzeń, napicia się.
Dozowanie odczynników pipetami szklanymi dokonuje się za pomocą nasadki
wciągającej.
Dozowanie związków trujących odbywa się z użyciem cylinderków.
W przypadku skaleczeń należy niezwłocznie obmyć ranę i przy współpracy
prowadzącego laboratorium opatrzyć jałowym środkiem opatrunkowym.
PRZEPISY BEZPIECZEŃSTWA
1. Każdy student jest zobowiązany mieć własny fartuch laboratoryjny.
2. Pracować należy ostrożnie i uważnie, nie prowadzić głośnych, rozpraszających uwagę
rozmów.
3. Należy ściśle stosować się do instrukcji i zarządzeń osoby prowadzącej ćwiczenia,
dotyczących sposobu wykonywania ćwiczeń. Nie wolno wykonywać eksperymentów i
prac nie wchodzących w zakres ćwiczeń, gdyż mogą one zagrażać bezpieczeństwu.
4. Starannie przestrzegać używania właściwych odczynników. Dokładne odczytanie
etykiety na słoiku lub butelce zmniejsza możliwość pomyłki.
5. Doświadczenia, w których wydzielają się żrące lub cuchnące gazy należy wykonywać
pod wyciągiem.
6. Wszystkie roztwory należy pipetować przy użyciu specjalnej nasadki (pompki do pipet).
7. Ogrzewając ciecze należy unikać ich miejscowego przegrzania. Nie wolno nachylać się
nad otwartym naczyniem z ogrzewaną cieczą. Ogrzewając roztwór w probówce, jej wylot
kierować zawsze należy w stronę, gdzie nikt się nie znajduje.
8. Stężone kwasy i zasady rozcieńczać ostrożnie, wlewając je małymi strumieniem do
wody. Należy uważać, aby ze względu na swe żrące działanie, kwas lub zasada nie
zetknęły się ze skórą. W przypadku zalania ubrania kwasem zmyć je rozcieńczonym
roztworem sody lub amoniaku. Po oblaniu ługiem - stosować należy rozcieńczony kwas
octowy.
9. O każdym wypadku, nawet pozornie błahym, jaki zaszedł w pracowni należy natychmiast
zawiadomić osobę prowadzącą ćwiczenia.
10. Poza teren laboratorium nie wolno wynosić żadnych chemikaliów, roztworów i substancji
11. Przed opuszczeniem pracowni należy umyć ręce.
PRZEPISY PORZĄDKOWE
Praca w laboratorium chemicznym wymaga dużej koncentracji uwagi oraz
skrupulatnego przestrzegania przepisów porządkowych i przepisów bezpieczeństwa. Każdy
pracujący w laboratorium chemicznym powinien pamiętać, że niewłaściwym zachowaniem i
lekceważącym stosunkiem do przepisów nie tylko utrudnia pracę sobie i innym, ale także
naraża inne osoby na niebezpieczeństwo.
1. W pracowni mogą przebywać tylko studenci należących do grupy wykonującej
ćwiczenia. Obecność obowiązuje przez cały czas trwania ćwiczeń.
2. W pomieszczeniach laboratoryjnych zabronione jest spożywanie posiłków oraz palenie
tytoniu.
3. Studenci odrabiający ćwiczenia obowiązani są do noszenia fartucha lub płaszcza
ochronnego.
4. Pracować należy tylko na wyznaczonym miejscu, posługując się chemikaliami i sprzętem
laboratoryjnym do niego przydzielonym. Wszystkie braki w odczynnikach i szkle należy
zgłaszać pracownikowi inżynieryjno-technicznemu, który natychmiast je uzupełni.
5. Stół laboratoryjny powinien być zawsze czysty i suchy. Rozlane przypadkowo
chemikalia należy starannie wytrzeć.
6. Butelek i słoików z odczynnikami nie wolno pozostawiać otwartych. Pobranych do
ćwiczeń odczynników nie należy wlewać lub wsypywać z powrotem do butelek czy
słoików, gdyż lepiej zniszczyć pewna niewielką ilość odczynnika niż zanieczyścić całość.
7. Pozostałości nie zużytych odczynników ciekłych należy wylewać do zlewu, spłukując go
obficie wodą. Roztwory zawierające drogie substancje należy zlewać do specjalnie do
tego celu przygotowanych naczyń. Podobnie postępować należy z resztkami substancji
stałych oraz ze stężonymi roztworami kwasów lub zasad.
8. Zabronione jest wrzucanie części stałych, np. stłuczonego szkła, papieru, zapałek,
korków itp. do zlewów i studzienek przy stołach laboratoryjnych. Wymienione materiały
należy wrzucać do kosza.
9. Zauważone uszkodzenie przyrządu lub zestawu aparaturowego należy zgłosić do
prowadzącego ćwiczenia.
10. Należy oszczędzać gaz, energię elektryczną i wodę. W szczególności odczynniki i wodę
destylowaną zużywać w ilościach jak najmniejszych, niezbędnych do wykonania
ćwiczenia. Do mycia naczyń należy używać wody wodociągowej, a do płukania już
czystych - małej objętości wody destylowanej. Po pobraniu wody destylowanej z butli
z tubusem konieczne jest sprawdzenie, czy ściskacz w gumowej rurce odpływowej
jest dobrze zaciśnięty.
Dodatkowe materiały:
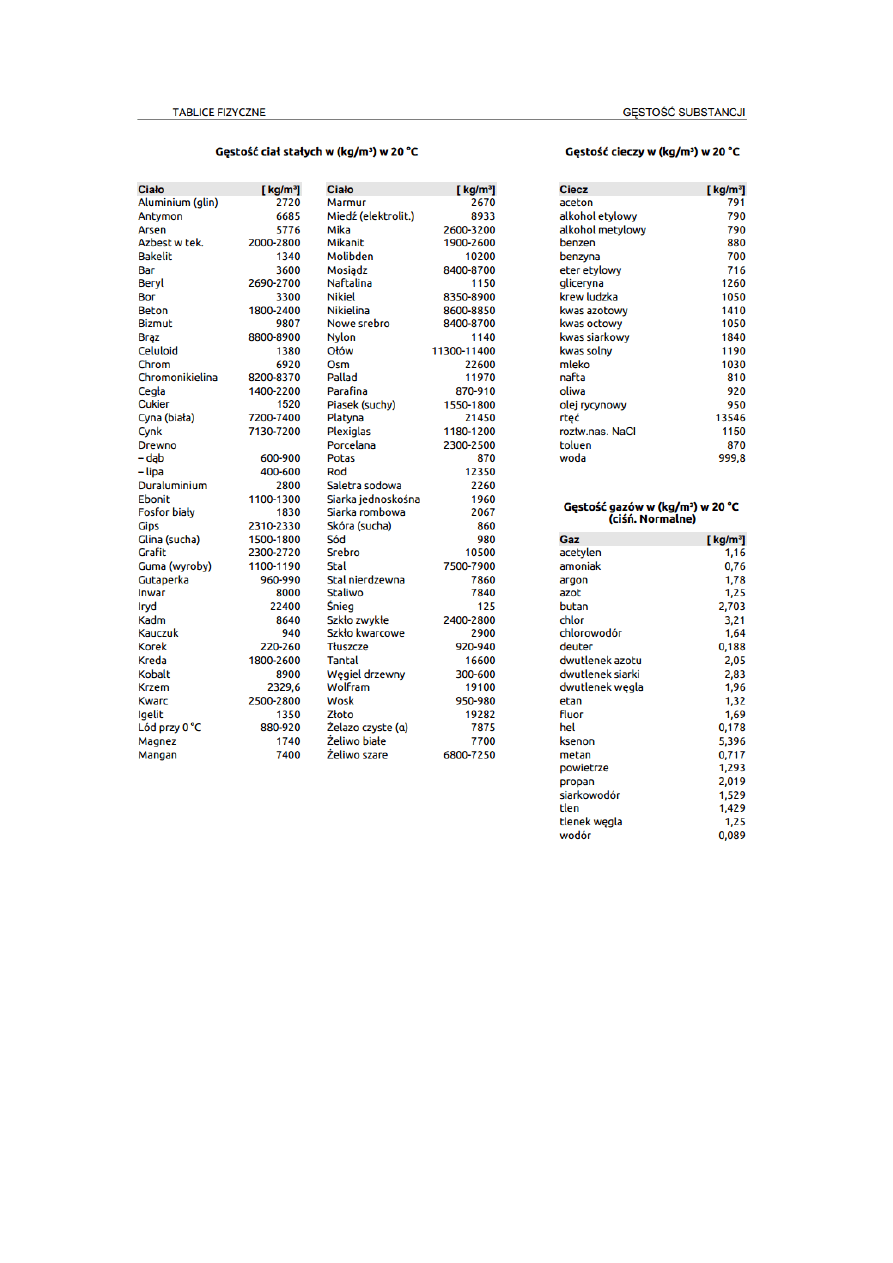
Tabela 1. Gęstość wody w zakresie temperatur 0
o
C – 30
o
C
Temperatura
[
o
C]
Gęstość
[kg/m
3
]
Temperatura
[
o
C]
Gęstość
[kg/m
3
]
Temperatura
[
o
C]
Gęstość
[kg/m
3
]
0
999,842
19
998,405
25
997,044
10
999,700
20
998,203
26
996,783
15
999,099
21
997,992
27
996,512
16
998,943
22
997,770
28
996,232
17
998,774
23
997,538
29
995,944
18
998,595
24
997,296
30
995,646
5. Literatura
1. Ćwiczenia rachunkowe z chemii fizycznej, A. Kisza, P. Freundlich, Wydawnictwo
Uniwerstytetu Wrocławskiego, Wrocław, 2004.
2. Ćwiczenia laboratoryjne z chemii fizycznej, T. Bieszczad, M. Moczar, D. Góralczyk, W.
Jarzęba, A.M. Turek, Wydawnictwo Uniwersytetu Jagiellońskiego, 2000, Kraków.
3. Eksperymentalna chemia fizyczna, E. Więckowska-Bryłka, Wyd. SGGW, Warszawa
2003.
4. Chemia fizyczna t. 1, t. 2, K. Pigoń, Z. Róziewicz, PWN, Warszawa, 2009.
Wyszukiwarka
Podobne podstrony:
więcej podobnych podstron