
Zagadnienie szczegółowe na egzamin z mikrobiologii:
PROCES PATOGENEZY
podpunkty: 172 – 188.
172. Mikrobiologiczne mechanizmy patogenezy.
173.Normalna flora bakteryjna człowieka: flora jamy ustnej, skóry, układu pokarmowego,
układu oddechowego i dróg moczowych.
Warto przeczytać to co było na ćwiczeniach, dokładnie ćw. 3 z mikro:)
1.Flora jamy ustnej:
-Sterptococcus
-Veillonella
-Klebsiella
-Neisseria
-Branhamella
-Bacetroides, zwłaszcza B. melaninogenes
-Rothia
-Capnocytophaga
-Candida
2 Flora skóry:
-Coryneobacterium
-Propionibacterium
-Staphylococcus epidermis
-S. aureus
-Peptococcus
-Enterobacteriace
-Acinteobacter
-Streptococcus viridans
3.Flora układu pokarmowego:
-Bifidobacterium
-Enterobacter
-Klebsiella
-Citrobacter (u noworodków )
-Bacteroides fragilis
-Clostridium
-Peptostreptococcus
-Proteus
-Pseudomonas
-Candiada (głównie w okrężnicy)
-E. coli
4.Flora układu oddechowego: (drogi dolne są fizjologicznie jałowe)
-Staphylococcus epidermis
-i 1/3 ludzi Staphylococcus aureus
-Neisseria
-Peptostreptococcus spp.
-Veillonella
5.Flora układu moczowego:
-Coryneobacterium

-gronkowce koagulazo-ujemne
-Lactobacillus
-drożdżaki
-Bacteroides
-Candida
-E. coli
174.Antagonizm bakteryjny.
175.Drobnoustroje chorobotwórcze, przykłady.
Vibrio cholerae ......................... cholera , zapalenie jelit, wodniste biegunki
Campylobacter jejuni .........................zapalenie jelit, wodniste biegunki
Haemophilus influenzae ......................... zapalenie opon mózgowych
Bordatella pertusis ......................... krztusiec
Brucella ......................... brucelloza (gorczka maltaska)
Neisseria gonorrhoeae ......................... rzeczka
Neisseria meningitidis ......................... zapalenie opon mózgowych
Branhamella catharralis ......................... zapalenie płuc
Legionella pneumophila .........................zapalenie płuc , gorczka Pontiac
Listeria monocytogenes .........................zapalenie opon mózgowych, listerioza
Bacteroides ......................... ropnie jamy brzusznej , płuc i mózgu
Streptobacillus moniliformis ......................... gorczka (po ugryzueniu szczura)
Mycoplasma pneumoniae ......................... zapalenie płuc
Mycobacterium tuberculosis ......................... gru
lica
Mycobacterium leprae ......................... trd
Treponema pallidum ......................... kiła
Spirillum minor ......................... gorczka
Borrelia ......................... dur powrotny , choroba Lyme
Leptospira ......................... zakaenie z gorczk
Bacillus anthracis ......................... wglik
Clostridium difficile .........................rzekome zapalenie jelita grubego
Clostridium perfringens ......................... zgorzel gazowa (gangrena)
103
Clostridium botulinum ......................... botulinoza , zatrucie jadem
kiełbasianym
Clostridium tetani ......................... tec
Corynebacterium diphttheriae .........................błonica
Staphylococcus aureus ......................... gronkowiec złocisty
Staphylococcus epidermidis ......................... moe wywoływa zakaenia protez
Streptococcus pneumoniae ......................... zapalenie płuc
Streptococcus mutans ......................... pruchnica zbów
Salmonella typhi ......................... dur brzuszny
Salmonella paratyphi ......................... dur rzekomy
Shigella dysenteriae ......................... czerwonka
Pseudomonas aeruginosa ......................... zakaenie ropne
Pseudomonas pseudomallei ......................... meliodoza: zapalenie płuc ,
posocznica
Yerisinia pestis ......................... duma

176.Postulaty Kocha.
Postulaty Kocha - to podstawowe reguły diagnostyczne przedstawione w 1892 roku przez Roberta
Kocha.. Spełnienie tych postulatów jest dowodem na to, że konkretny mikroorganizm może
powodować określoną chorobę
Treść postulatów:
•
Postulat 1 -Drobnoustrój musi być obecny u wszystkich osób mających daną chorobę i
powinien mieć związek ze zmianami chorobowymi.
•
Postulat 2 - Drobnoustrój musi być wyizolowany w czystej kulturze od osoby chorej.
•
Postulat 3 - Drobnoustrój, wyosobniony od chorej osoby, po wprowadzeniu do ludzi lub
zwierząt musi wywołać tą samą chorobę.
•
Postulat 4 - Drobnoustrój należy ponownie wyosobnić w czystej kulturze od
eksperymentalnie zakażonego człowieka lub zwierzęcia w celu spełnienia trzeciego
postulatu.
177.Bakterie oportunistyczne oraz (178.) Przykłady bakterii oportunistycznych.
Chorzy na choroby krwi mają niedobór odporności zarówno humoralnej, jak i komórkowej. Sprzyja
to wystąpieniu infekcji o ciężkim przebiegu, jak również pojawieniu się drobnoustrojów
oportunistycznych i opornych na powszechnie stosowane antybiotyki szczepami szpitalnymi.
Zakażenia przebiegają skąpoobjawowo, a jedynym sygnałem choroby może być gorączka lub
wstrząs. W takich przypadkach konieczne jest przeprowadzenie możliwie szybko diagnostyki i
natychmiastowe leczenie empiryczne antybiotykami o szerokim spektrum działania, a następnie
jego ewentualna zmiana zgodnie z antybiogramem.
Oprócz zakażeń wewnątrz i zewnątrzpochodnych dla chorych z zaburzeniami odporności
szczególnie charakterystyczna jest dodatkowo podatność na zakażenia drobnoustrojami
oportunistycznymi (tj. niepatogennymi dla osób zdrowych) oraz zakażenia drobnoustrojami
szpitalnymi, wyselekcjowanymi pod względem oporności na stosowane chemioterapeutyki.
Spośród bakterii oportunistycznych najbardziej charakterystyczne są zakażenia saprofitem skóry
Staphylococcus epidermidis. Zakażenia szpitalne najczęściej są wywoływane przez bakterie
Pseudomonas, Klebsiella, Clostridium difficile oraz grzyby pleśniowe.
Zakażenia grzybicze są zazwyczaj reprezentowane przez: Candida spp. i Aspergillus spp., przy
czym wśród gatunków z rodzaju Candida najczęściej występuje Candida albicans, ale zwiększa się
też liczba zakażeń Candida glabrata, Candida krusei i Candida tropicalis. Zakażenie drożdżakami
objawia się zmianami na śluzówkach jamy ustnej oraz dróg rodnych u kobiet, a spośród narządów
wewnętrznych stosunkowo często zajmuje śledzionę i wątrobę. Zdarza się posocznica Candida spp.,
czego dowodzą dodatnie wyniki posiewów z krwi. Aspergillus spp. najczęściej powoduje zapalenie
płuc, prowadzące do powstawania jam, zapalenie zatok, a także zajęcie CUN o szczególnie złym
rokowaniu.
Pneumocystis carinii jest patogenem stwierdzanym niemal wyłącznie u chorych z zaburzoną
odpornością, u których może spowodować śródmiąższowe zapalenie płuc o bardzo ciężkim
przebiegu.
Spośród zakażeń pierwotniakowych największe znaczenie ma zakażenie Toxoplasma gondii, przy
czym najczęściej jest to reaktywacja wcześniej przebytego zakażenia. Zakażenie zarówno
pierwotne, jak i wtórne może się objawiać w wielu narządach, ale najbardziej charakterystyczne jest
zajęcie ośrodkowego układu nerwowego.
Spośród zakażeń wirusowych największą rolę odgrywa uaktywnienie wirusów zdolnych do
przetrwania po pierwotnej infekcji w komórkach chorego w stanie latencji. Dotyczy to zwłaszcza

herpes-wirusów oraz wirusa cytomegalii.
179.Endotoksyny i egzotoksyny, przykłady+ mechanizm działania ze szczególnym
uwzględnieniem egzotoksyn wytwarzanych przez bakterie z rodzajów Clostridium i Bacillus.
180.Reakcja organizmu człowieka na egzotoksyny i endotoksyny.
a) endotoksyna – LPS obecny w ścianie komórkowej wszystkich bakterii Gram – ujemnych.
Działanie LPS na ustrój człowieka obejmuje m.in. gorączkę, leukopenię, hipoglikemię, hipotensję i
wstrząs, zaburzenie perfuzji narządów wewnętrznych i kwasicę metaboliczną, unieczynnianie
składowej C3 kasady dopełniacza, zespół DIC i zgon.
b) egzotoksyny, które dzielą się na:
- neurotoksyny (np.: neurotoksyna syntetyzowana przez Clostridium botulinum, wchłaniana z jelita
do krwiobiegu) hamujące przekaźnictwo synaptyczne
- cytotoksyny – letalne dla komórek eukariotycznych. Przykłady: toksyna shiga ShT, shiga – like
toksyny SLT1 i SLT2 E. coli (nazywane również verotoksynami VT), czynnik nekrotyzujący CNF
E. coli, cytotoksyna rozciągająca komórki CDT wytwarzana przez niektóre szczepy Campylobacter
jejuni, E. coli, Shigella spp., hemolizyny syntetyzowane przez różne szczepy wielu gatunków
patogenów jelitowych
- enterotoksyny – zaburzają działanie pompy jonowej enterocytów i wchłanianie wody w jelicie,
co jest przyczyną rozwoju biegunki. Enterotoksyny zaburzają jedynie funkcje komórek nie
uszkadzając ich. Przykładami enterotoksyn syntetyzowanych przez patogeny jelitowe są:
enterotoksyna ciepłochwiejna - LT, enterotoksyna ciepłostała - ST, enterotoksyna ciepłostała
EAST1, enterotoksyna ciepłostała Yersinia enterocolitica - Yst, enterotoksyna ciepłochwiejna
choleryczna CT, enterotoksyny Shigella flexneri - ShET1 i ShET2.
Egzotoksyny Clostridium i Bacillus są ładnie opisane w skrypcie od str. 5. Nie kopiowałąm bo tego
jest za dużoooo i brzydko się kopiowało;)
PORÓWNANIE TOKSYN
EGZOTOKSYNY
ENDOTOKSYNY
-Wydzielane przez żywe komórki, znajdują się
w dużym stężeniu w podłożu płynnym
-polipeptydy o m.cz. 10 000- 900 000
-dość nietrwałe, temp. powyżej 60°C często
niszczy toksyczność w krótkim czasie
-wysoko antygenne, pobudzają wytwarzanie
antytoksyny o wysokim mianie, antytoksyna
neutralizuje toksynę
-formaldehyd, kwasy, ogrzewanie itp. zmieniają
je w antygenne, nietoksyczne toksoidy
bardzo toksyczne, w dawkach mikrogramowych
śmiertelne dla zwierząt laboratoryjnych
-u gospodarza nie wywołują gorączki
-integralna część ścian komórkowych bakterii
G-, uwalniana po ich rozpadzie
-kompleksy lipopolisacharydowe, za
toksyczność odpowiedzialny jest
prawdopodobnie lipid A
-dość trwałe, wytrzymują ogrzewanie w temp.
powyżej 60°C kilka godzin bez utraty
toksyczności
-nie pobudzają działania antytoksyny, pobudzają
wytwarzanie przeciwciał przeciwko części
polisacharydowej
-nie przechodzą w toksoidy
-mało toksyczne, dawki rzędu setek
mikrogramów śmiertelne dla zwierząt
laboratoryjnych
181.Udział Sterptosoccus mutans i innych bakterii w próchnicy zębów.
ZE SKRYPTU:
Otoczki bakteryjne a próchnica zbów

Większość otoczek bakteryjnych zbudowana jest z polimerów cukrów (heksozy często, pentozy –
rzadziej) lub aminokwasów. Podstawowym składnikiem homopolimerycznych otoczek
Streptococcus mutans, G (+), (główny sprawca próchnicy zbów) i Leuconostoc mesenteroides, G
(+), jest
glukoza.
U bakterii G (+) otoczki s zazwyczaj tworzone przez dwa lub więcej rodzaje
cukrów, np. u Streptococcus pneumoniae. W jamie ustnej człowieka wystpuje około 500 gatunków
bakterii, które zasiedlają wszystkie powierzchnie. Powodem próchnicy jest wysokowglowodanowa
dieta prowadząca do przesunięcia równowagi flory bakteryjnej w kierunku namnażania się
szczepów potencjalnie (w obecności cukrów) szkodliwych; dzieje si tak ponieważ mikroorganizmy,
które maj korzystne warunki do rozwoju produkuj substancje (opsoniny) działającej na
zahamowanie wzrostu gatunków pokrewnych. Czynnikiem powodującym zachwianie równowagi w
florze bakteryjnej jest równie alkohol. Do XVIII wieku napoje były słodzone miodem który nie
przyczyniał si do próchnicy w takim stopniu jak obecnie czyni to sacharoza. Streptococcus mutans
wytwarza w obecności dużych ilości sacharozy otoczki; sacharoza jest rozkładana do glukozy i
fruktozy. Glukoza wykorzystywana jest do tworzenia polimeru z którego zbudowana jest otoczka.
Enzymem w tej reakcji jest transferaza glukozydowa. Otoczka jest rodzajem depozytu materiałów
odżywczych. Poza tym ma właściwości silnej adhezyny; wiąże się ona z cienką błonką powstającą
na powierzchni zębów powstającą na skutek wiązania się glikoprotein stale zwilżającej zęby śliny
przez jony wapnia szkliwa zbudowanego z fosforanu wapnia. Dieta bogata w węglowodany
prowadzi do wytwarzania otoczek przez S. mutans, adhezję do powierzchni szkliwa i uszkodzenia
zębów przez produkty metabolizmu. W przypadku rozpatrywania próchnicy posiadanie uzębienia
heterodontycznego jest wadą. Wąże się to z występowaniem zagłbień na powierzchni
przedtrzonowców i trzonowców, w których pozostają resztki pokarmu będące pożywką dla bakterii.
Siekaczeci kły maj gładkie powierzchnie i na nich bakterie nie maj ju żtak dobrych warunków do
rozwoju. Uszkodzenie emalii (szkliwa) jest pierwszym krokiem do powstania próchnicy i
jej posętpu. S. mutans nie jest jedynym gatunkiem uczestniczącym w genezie psucia się zębów, ale
ze względu na niewątpliwie ogromny udział w omawianym procesie można go traktowa niejako
reprezentanta. Oprócz glukozy w wyniku rozkładu sacharozy powstaje fruktoza. Otoczka
bakterii zawiera obfitość glukanów, lecz składa się z niewielkich ilości fruktanów. (Interesującym
jest fakt, że w obecności samej glukozy synteza otoczki nie zachodzi; dzieje si tak dopiero w
obecności sacharozy poddawanej rozkładowi.) Fruktoza wykorzystywana jest przez
mikroorganizmy przede wszystkim jako substrat oddechowy i ulega utlenianiu do pirogronianu w
szlaku glikolitycznym; po tych przemianach redukowana jest do kwasu mlekowego –głównej
substancji odpowiedzialnej za niszczenie szkliwa. S. mutans jest niewrażliwy na wysokie stężenie
kwasu mlekowego. Potrzeba mniej więcej dwóch godzin, aby zby po umyciu zostały kolonizowane
przez bakterie. Nie jest problemem mycie zębów, ale języka – to on stanowi rezerwuar
mikroorganizmów. Pierwsze bakterie to tzw. bakterie wczesnej kolonizacji. Należą one do G (+) i
osadzaj się na warstewce tworzącej się poprzez zwilżanie zębów lin. Do tych bakterii przylegaj
kolejne. Wcześni kolonizatorzy prowadzą do uszkodzenia szkliwa i daj dostęp późnym
kolonizatorom do głębszych warstw zęba. Po pewnym czasie wkraczaj późni kolonizatorzy; ci są w
większości beztlenowcami i wewnątrz, pod szkliwem prowadzą do rozkładu tkanki i jej gnicia.
S. mutans ,a zdolność do zdominowania bakterii kolonizujących zby przez fakt
wytwarzania otoczki oraz bakteriocyny działajcej na bakterie G (+): Bakteriocyna ma podobne
właściwości do antybiotyku, a jej wytwarzane jest najprawdopodobniej z mechanizmem
przypominającym ten u bakterii świecących; sprowadza się to do reakcji na odpowiednią
liczebność, a dokładniej na zagęszczenie populacji i regulowane jest przez „zmysł tłoku”.
Streptococcus mutans nie jest stałym elementem flory bakteryjnej. Nie występuje
u bardzo małych dzieci a take u ludzi, którzy stracili wszystkie zby. Okno infekcyjne dla
S. mutans w życiu człowieka przypada na 19-31 miesiące życia. Bakterie mogą
się przedostać na dziecko z rodzica na drodze pocałunku. Często dochodzi do infekcji S. mutans w
okresie pojawiania się pierwszych zębów, gdy dziecko gryzie wszystko i wszystkich.

182.Adhezyny, przykłądy, funkcja.
Adhezyny warunkujące kolonizację, która stanowi pierwszy krok w rozwoju zakażenia.
Proces przylegania (adhezji) związany jest ze strukturami powierzchniowymi drobnoustrojów
chorobotwórczych: fimbriami, białkami, wielocukrowymi otoczkami, łańcuchami
polisachrydowymi LPS .
Wśród patogenów jelitowych opisano szereg fimbrii adhezyjnych zbudowanych z podjednostek
białka strukturalnego piliny:
a) fimbrie tzw. powszechne występujące u wielu pałeczek jelitowych rodziny Enterobacteriaceae
(także u gatunków komensalnych) oznaczane akronimem MS (mannose – sensitive) z uwagi na
hamujące działanie mannozy na proces hemaglutynacji (zlepiania krwinek czerwonych pod
wpływem fimbrii). Hemaglutynacja jest jednym z testów pozwalających na wykrywanie u bakterii
obecności fimbrii.
b) fimbrie CFA/I i CFA/II nazywane czynnikiem kolonizacji (colonization factor antigen)
c) fimbrie agregacyjne AAF-I i AAF-II (aggregative adherence fimbria)
d) fimbrie BFP (bundle forming pilus) – tworzące na powierzchni bakterii skupiska (wiązki).
Poza fimbriami (jedna komórka bakteryjna może posiadać kilka rodzajów fimbrii) w procesie
adhezji ważną rolę spełniają białka błony zewnętrznej np.: - białko intimina enteropatogennych
szczepów E. coli odpowiedzialne za ścisły kontakt E. coli z enterocytem; - białka adhezyjne
Yersinia enterocolitica – YadA, PsaA;
183.Mechanizmy kolonizacji organizmów wyższych przez bakterie.
184.Charakterystyka bakterii z rodzaju Mycobacterium.
-bakterie o pałeczkowate, nie zarodnikujące, tlenowe, trudno się barwią, lecz po zabarwieniu są
odporne na odbarwieniem kwasem lub alkoholem (są kwasoodporne)
-poza licznymi formami saprofitycznymi do grupy tej należą bakterie chorobotwórcze (np.
Mycobacterium tuberculosis i Mycobacterium leprae), które wywołują przewlekłe choroby ze
zmianami typu ziarniaków zakaźnych.
Mycobaterium tuberculosis
Morfologia i identyfikacja
A. Organizmy typowe. W tkankach zwierzęcych są to proste pałeczki, cienkie. Na podłożach
sztucznych występują formy ziarenkowate lub nitkowate. Nie można ich zaklasyfikować ani do
bakterii Gram-dodatnich ani Gram-ujemnych. Zabarwione barwnikami zasadowymi nie odbarwiają
się alkoholem, mimo działania na nie jodem. Prawdziwe prątki gruźlicy charakteryzują się
"kwasoodpornością", np. 95% alkohol etylowy z dodatkiem 3% HCl (kwaśny alkohol) szybko
odbarwia wszystkie bakterie z wyjątkiem prątków gruźlicy. Kwasoodporność zależy od zachowania
całości otoczki woskowej. Barwienie metodą Ziehla-Neelsena służy do identyfikacji
mykobakterii. W plwocinie lub skrawkach tkanek obecność mykobakterii można wykazać za
pomocą żółtopomarańczowej fluorescencji po zabarwieniu barwnikami fluorochromowymi (np.
auraminą lub rodaminą).
B. Posiewy. Stosuje się 3 rodzaje podłoży:
1. Proste podłoża syntetyczne. Duże inokulum rośnie przez kilka tyg na prostych podłożach
syntetycznych. Nie udaje się otrzymać wzrostu z małych ilości materiału ze względu na obecność
małych ilości toksycznych kwasów tłuszczowych. Toksyczne działanie kwasów tłuszczowych znosi
dodanie do podłoża surowicy zwierzęcej lub albuminy, a kwasy tłuszczowe mogą w takich
przypadkach przyspieszać wzrost. Wzrost bakterii ułatwia dodatek do podłoża węgla

aktywowanego.
2. Podłoża z albuminą i kwasem oleinowym. Na podłożach tych uzyskuje się wzrost niezależnie
od wielkości inokulum, zwłaszcza w obecności preparatów Tween (rozpuszczalnych w wodzie
estrów kwasów tłuszczowych, jak podłoże Dubosa). Zwykle mykobakterie rosną w postaci grudek
lub zbitej masy ze względu na hydrofobowy charakter powierzchni
komórek
. Tween zwilża
powierzchnię i w ten sposób umożliwia wzrost rozproszony w podłożach płynnych. Na podłożach
złożonych wzrost jest zwykle szybszy.
3. Złożone podłoża organiczne. Małe inokulum, np. próbki pobrane od chorych, posiewa się na
podłoża zawierające złożone substancje organiczne, np. żółtko jaja, surowicę zwierzęcą, wyciągi
tkankowe. Podłoża te często zawierają penicylinę lub zieleń malachitową (np. podłoże
Lowensteina-Jensena) w celu zahamowania wzrostu innych bakterii.
C. Charakterystyka wzrostu. Prątki gruźlicy są bezwzględnymi tlenowcami, które czerpią energię
z utleniania licznych prostych związków węgla. Zwiększenie ciśnienia CO2 wzmaga ich wzrost.
Aktywność biochemiczna nie jest charakterystyczna, a szybkość wzrostu jest znacznie mniejsza niż
u większości bakterii. Czas podwojenia liczby komórek wynosi ok. 18 h. Formy saprofityczne
rosną szybciej, namnażają się dobrze w temp 22 C, wytwarzają więcej barwnika i są w mniejszym
stopniu kwasoodporne niż formy chorobotwórcze.
D. Reakcje na czynniki fizyczne i chemiczne. Mykobakterie są bardziej odporne na działanie
czynników chemicznych od innych bakterii ze względu na hydrofobowy charakter ich powierzchni
i grudkowy wzrost. Barwniki (np. zieleń malachitowa) lub leki przeciwbakteryjne (np. penicylina),
które są bakteriostatyczne dla innych bakterii, można dodawać do podłoży bez obawy zahamowania
wzrostu mykobakterii. Zasady i kwasy umożliwiają przeżycie niektórych prątków i są używane do
"stężenia" próbek klinicznych i częściowego usunięcia towarzyszących bakterii. Prątki gruźlicy są
niewrażliwe na wysychanie i mogą długo przebywać w suchej plwocinie.
Patogeneza
Mykobakterie nie wytwarzają znanych toksyn. Zawarte w kropelkach o wymiarach 1-5 nm są
wdychane i przedostają się do pęcherzyków płucnych. Wywoływanie zmian i ich cofanie się lub
rozwój głównie określa 1) liczba mykobakterii w inokulum i ich namnażanie się; 2) odporność lub
wrażliwość gospodarza.
A. Dwa podstawowe rodzaje zmian:
1. Wysiękowy. Obejmuje ostrą reakcję zapalną z pojawieniem się płynu obrzękowego,
wielojądrowych krwinek białych, a później monocytów dookoła prątków gruźlicy. Ten rodzaj zmian
obserwuje się głównie w tkance płucnej, w której przypomina zapalenie płuc. Może cofnąć się
samoistnie z całkowitym wchłonięciem wysięku; może prowadzić do martwicy tkanki lub przejść w
drugi rodzaj zmian (wytwórczy). W czasie fazy wysiękowej test tuberkulinowy staje się dodatni.
2. Wytwórczy. W pełni rozwinięty (ziarniak przewlekły) składa się z 3 stref: 1) centralnej części
wypełnionej wielojądrowymi komórkami olbrzymimi, wewnątrz których znajdują się prątki
gruźlicy; 2) strefy środkowej zawierającej jasne komórki nabłonkowe, często ułożone promieniście;
3) strefy obwodowej zawierającej fibroblasty, limfocyty i monocyty. W późniejszym okresie
rozwija się tkanka włóknista, a strefa centralna ulega serowaciejącej martwicy. Taką zmianę nazywa
się gruzełkiem. Serowaty gruzełek może się przebić do oskrzela, opróżnić się w nim i utworzyć
jamę. Może następnie się zagoić przez zwłóknienie lub zwapnienie.
B. Rozprzestrzenienie bakterii w organizmie gospodarza. Prątki gruźlicy mogą się
rozprzestrzeniać w organizmie gospodarza bezpośrednio przez naczynia chłonne i układ
krwionośny, a także przez oskrzela lub przewód pokarmowy. W czasie pierwszego zakażenia prątki
gruźlicy zawsze rozprzestrzeniają się z miejsca wniknięcia przez naczynia chłonne do regionalnych
węzłów chłonnych. Mogą się rozprzestrzeniać dalej i dostawać się do krwi, która roznosi je do
wszystkich narządów (rozsiew prosówkowy). Prątki mogą przenikać do krwi po uszkodzeniu żył

przez serowaciejący gruzełek i drogę węzłów chłonnych. W zmianach serowaciejących
uwalnianych do oskrzeli są aspirowane do dalszych części płuc lub połykane i przekazywane do
żołądka i jelit.
C. Umiejscowienie wewnątrzkomórkowe. Prątki gruźlicy po umiejscowieniu w tkance znajdują
się głównie wewnątrz monocytów,
komórek
układu siateczkowo-śródbłonkowego i komórek
olbrzymich. Jest to jedna z przyczyn małej skuteczności chemioterapii.
Zakażenie pierwotne i typy powtórnego zakażenia.
Po pierwszym kontakcie gospodarza z prątkami gruźlicy obserwuje się zazwyczaj objawy: 1)
rozwój ostrej wysiękowej zmiany z szybkim zajęciem naczyń chłonnych i regionalnych węzłów
chłonnych; "zespół Ghona" jest pierwotną zmianą tkankową (zwykle w płucach) wraz ze zmianami
w węzłach chłonnych; zmiany wysiękowe często goją się w krótkim czasie; 2) węzły chłonne
ulegają masowemu serowaceniu, które zwykle wapnieje; 3) test tuberkulinowy staje się dodatni.
Takie zakażenie pierwotne występowało w przeszłości, zwykle u dzieci, obecnie jest jednak
częstsze u dorosłych, którzy nie przebyli zakażenia i dlatego wynik testu tuberkulinowego we
wczesnym okresie życia był u nich ujemny. W zakażeniu pierwotnym zajęta może być każda część
płuc, lecz najczęściej jest to ich podstawa.
Zakażenie typu reaktywacji wywołują zwykle prątki gruźlicy, które przetrwały zakażenie
pierwotne. Gruźlica tego typu charakteryzuje się przewlekłymi zmianami tkankowymi, tworzeniem
gruzełków, serowaceniem i włóknieniem. Zmiany w regionalnych węzłach chłonnych są
nieznaczne. Węzły te nie serowacieją. Zakażenie tego typu zwykle zaczyna się u szczytu płuc, gdyż
ciśnienie cząstkowe tlenu jest tam największe.
Różnicę między zakażeniem pierotnym a wtórnym wykazano doświadczalnie w postaci zjawiska
Kocha. Po wstrzyknięciu śwince morskiej zjadliwych prątków gruźlicy podskórnie powstała ranka
szybko się goi, ale w miejscu wstrzyknięcia w ciągu 2 tyg powstaje guzek. Guzek ten ropieje, a
ropień się nie goi. W sąsiednich węzłach chłonnych rozwijają się gruzełki i masywne serowacenie.
Jeśli temu samemu zwierzęciu wstrzyknie się później prątki gruźlicy w inne miejsce ciała, to
kolejność objawów jest całkowicie odmienna; w miejscu wstrzyknięcia szybko powstaje martwica
skóry, ale owrzodzenie szybko się goi. Regionalne węzły chłonne albo nie zostają zakażone, albo
zakażenie występuje z opóźnieniem.
Różnice między zakażeniem pierwotnym a wtórnym lub reaktywacją przypisuje się 1) odporności i
2) nadwrażliwości zapoczątkowanej pierwszym zakażeniem prątkami gruźlicy u gospodarza.
Odporność i nadwrażliwość.
Jeśli gospodarz przeżyje pierwsze zakażenie prątkami gruźlicy, to nabywa pewną odporność (p.
zjawisko Kocha) i zwiększa się u niego zdolność do umiejscawiania prątków gruźlicy. Opóźnia się
ich namnażanie, ogranicza rozprzestrzenianie i zmniejsza rozsiewanie przez naczynia włosowate.
Można to w znacznym stopniu przypisać zdolności komórek jednojądrowych do ograniczania
namnażania wchłoniętych bakterii i prawdopodobnie do niszczenia ich. Komórki jednojądrowe
nabywają "odporność komórkową" podczas pierwszego zakażenia organizmu gospodarza.
Tworzą się przeciwciała przeciwko licznym składnikom komórkowym prątków gruźlicy. Obecność
przeciwciał można wykazać za pomocą precypitacji, hemaglutynacji biernej i testu ELISA
(immunoabsorbcja z udziałem enzymów). Żadna z tych reakcji serologicznych nie ma
jednoznacznego związku ze stanem immunologicznym gospodarza, ale wysokie miano przeciwciał
IgG przeciwko PPD wykrywane testem ELISA, występuje u chorych z czynną gruźlicą płuc.
Podczas pierwotnego zakażenia organizm gospodarza nabywa także nadwrażliwość na prątki
gruźlicy. Dowodem tego jest powstanie dodatniej reakcji na tuberkulinę. Wrażliwość na tuberkulinę
mogą także wywołać całe prątki gruźlicy lub białko bakterii w połączeniu z rozpuszczalnym w
chloroformie woskiem prątków, lecz nie sama tuberkulina. Nadwrażliwość i oporność wydają się
wyraźnymi, odrębnymi aspektami tej samej reakcji z udziałem komórek.
Próba tuberkulinowa

A. Materiał. Stara tuberkulina (OT) jest stężonym przesączem bulionu, w którym przez 6 tyg
hodowano prątki gruźlicy. Poza czynną tuberkuliną materiał ten zawiera różne inne składniki
komórek prątków gruźlicy i podłoża. Oczyszczona pochodna (PPD) jest otrzymywana przez
chemiczne frakcjonowanie starej tuberkuliny i stanowi najlepszy materiał do wykonywania testów
skórnych. PPD jest standaryzowana w "jednostkach tuberkuliny" pod względem aktywności
biologicznej. Jednostka tuberkuliny (TU) jest to aktywność PPD Seiberta serii 49608 w określonym
buforze zawarta w określonej masie. Jest to tzw. PPD-S, stanowiąca standard tuberkuliny, wg
którego określa się moc wszystkich produktów za pomocą próby biologicznej, tj. wielkości reakcji
u człowieka. Tuberkulina pierwszej mocy ma 1 TU, pośredniej mocy- 5 TU, drugiej mocy- 250 TU.
Biorównowartość PPD nie jest oparta na masie materiału, lecz na porównywalnej aktywności.
B. Dawka tuberkuliny. Duża ilość tuberkuliny wstrzyknięta nadwrażliwemu gospodarzowi może
wywołać miejscową reakcję oraz zaczerwienienie, stan zapalny i martwicę w głównych miejscach
zakażenia (reakcje ogniskowe). Zwykle tuberkulinę podaje się w objętości 0, 1 ml podskórnie.
C. Reakcja na tuberkulinę. U osoby, która nie miała kontaktu z mykobakteriami, reakcja na PPD-
S jest ujemna. U osób, które przebyły zakażenie pierwotne prątkami gruźlicy, w ciągu 24-48 h
powstaje stwardnienie, obrzęk, zaczerwienienie, a w przypadku bardzo silnej reakcji nawet
martwica centralna. Wynik odczytuje się po 48 lub 72 h. Wynik testu skórnego uważa się za
dodatni, jeśli po wstrzyknięciu 5 TU powstaje stwardnienie o średnicy 10 mm lub większej.
Dodatnie reakcje utrzymują się przez kilkanaście dni. Słabe reakcje zanikają szybciej.
Próba tuberkulinowa staje się dodatnia w ciągu 4-6 tyg po zakażeniu (lub wstrzyknięciu
niezjadliwych bakterii). Wynik może być ujemny w obecności zakażenia przy "anergii"
spowodowanej jednoczesnym zakażeniem gruźlicą i innymi chorobami, jak Odrą, choroba
Hodgkina, sarkoidoza lub w przypadku immunosupresji. Dodatni wynik próby tuberkulinowej
może się czasami zmienić w ujemny po leczeniu izoniazydem. Po szczepieniu BCG reakcja
dodatnia utrzymuje się czasami tylko przez 3-7 lat. Tylko usunięcie żywych prątków gruźlicy z
organizmu powoduje zmianę próby tuberkulinowej na ujemną. Jednak osoby, które przed laty
wykazywały dodatnią reakcję na PPD i są zdrowe, mogą nie reagować dodatnio na tuberkulinę.
Kiedy takie osoby zbada się ponownie 2 tyg później, wtedy wynik reakcji na PPD-
"przypomnianej" przez niedawne wstrzyknięcie antygenu- będzie dodatni ze stwardnieniem o
odpowiedniej średnicy. Zdolność reagowania na tuberkulinę osoby o wyniku dodatnim mogą
przekazać osobom o wyniku ujemnym wyłącznie przez komórki- nigdy przez surowicę.
D. Interpretacja próby tuberkulinowej. Dodatni wynik próby wykazuje na przebyte zakażenie i
utrzymywanie się żywych mykobakterii w niektórych tkankach. Nie oznacza czynnej choroby lub
istniejącej odporności. Osoby z dodatnim wynikiem próby tuberkulinowej są zagrożone chorobą
wskutek reaktywacji zakażenia pierwotnego, podczas gdy osoby z ujemnym wynikiem próby
tuberkulinowej nie są zagrożone niebezpieczeństwem choroby, choć mogą zostać zakażone ze
źródeł zewnętrznych.
Objawy kliniczne
Ponieważ prątki gruźlicy atakują wszystkie narządy, objawy kliniczne zakażenia są zmienne.
Zmęczenie, osłabienie, utrata masy ciała i gorączka mogą być objawami zakażenia gruźliczego.
Zaatakowanie płuc prowadzi do przewlekłego kaszlu i krwioplucia, co zwykle wiąże się z
zaawansowanym procesem gruźliczym. Zaatakowanie opon mózgowych i układu moczowego może
przebiegać bez innych objawów gruźlicy. Rozsianie przez krew prowadzi do gruźlicy prosówkowej
ze zmianami w wielu narządach i dużą śmiertelnością.
Diagnostyczne testy laboratoryjne
Żaden z dostępnych obecnie testów tuberkulinowych lub serologicznych nie jest w stanie
udowodnić istnienia czynnej choroby wywołanej przez prątki gruźlicy. Tylko wyizolowanie
prątków stanowi taki dowód.
Leczenie

Odpoczynek fizyczny i psychiczny, dobre odżywianie, które stosowano w przeszłości, zostały
wyparte przez swoistą chemioterapię. Obecnie najczęściej używanym lekiem przeciwgruźliczym
jest izoniazyd, a także: etambutol, ryfampicyna i streptomycyna. Niestety prątki gruźlicy szybko
nabywają oporność na każdy z tych leków. Leczenie jest najskuteczniejsze wtedy, gdy leki podaje
się w skojarzeniach (np. izoniazyd+ryfampicyna, izoniazyd+etambutol), co opóźnia powstawanie
form opornych. Czasami występują zakażenia pierwotne prątkami gruźlicy opornymi na jeden lub
więcej leków. Dostępne chemioterapeutyki powodują supresję prątków i usunięcie większości
mykobakterii. Wyleczenie kliniczne uzyskuje się zwykle po 6-12 miesiącach. Ważną rolę w
leczeniu odgrywa sam organizm gospodarza. Chory mający prąki w plwocinie staje się niezakaźny
w ciągu 2-3 tyg po rozpoczęciu skutecznego leczenia.
Szczególna oporność przewlekłej gruźlicy na leki wynika z wielu przyczyn: 1) większość prątków
umiejscawia się wewnątrz komórek; 20 serowaty charakter zmian, choć sam nie przyja namnażaniu
się mykobakterii, utrudnia działanie leków; 3) w przewlekłej chorobie prątki gruźlicy są
metabolicznie nieczynne i dlatego niewrażliwe na działanie leków.
Epidemiologia
Najczęstszym żródłem zakażenia jest człowiek, który wydala duże liczby prątków, zwłaszcza z
układu oddechowego. Bliski kontakt (np. w rodzinie) i masowe narażenie (np. personel medyczny)
umożliwiają zakażenie kropelkowe. Mleko krów chorych na gruźlicę jest żródłem zakażenia
gruźlicą budlęcą, jeśli nie zostały podjęte odpowiednie środki zapobiegawcze, a mleko nie jest
pasteryzowane.
Zapobieganie i zwalczanie
1. Najważniejsze jest wczesne wykrywanie zachorowań i źródeł zakażenia (próby tuberkulinowe,
zdjęcia klatki piersiowej) i szybkie leczenie, aż chory stanie się niezakaźny.
2. Eliminowanie przypadków gruźlicy u bydła oraz pasteryzacja mleka.
3. Chemioterapia osób, u których wynik próby tuberkulinowej zmienił się z ujemnego na dodatni.
4. Szczepienia różnymi żywymi i niezjadliwymi prątkami gruźlicy, zwłaszcza BCG (prątki
Caimette'a-Guerina- atenuowane mykobakterie bydlęce) powodują powstanie pewnej odporności na
zakażenia. Szczepienie BCG powoduje wzrost odporności przez ograniczony okres.
Indywidualna odporność gospodarza. Nieswoiste czynniki mogą zmniejszać odporność
organizmu gospodarza i w ten sposób sprzyjać przejściu zakażenia bezobjawowego w postać
czynną choroby. Do takich "aktywatorów" gruźlicy należą: niedożywienie, wycięcie żołądka,
podawanie dużych dawek kortykosteroidów lub leków immunosupresyjnych. Chorym takim można
"zapobiegawczo" podawać izoniazyd w każdym wieku.
Inne mykobakterie:
-M. kansasii: wymaga do wzrostu podłoży złożonych, rośnie w T=37ºC, wywołuje chorobę płuc i
zakażenia układowe, których nie można odróżnić od gruźlicy zwłaszcza u osób o upośledzonej
odporności: wrażliwy na ryfampicynę
-M. avium- intracellurale: rośnie w T=43ºC, bakterie te tworzą gładkie i miękkie kolonie o
słabym zabarwieniu, mogą zakażać ptaki i rzadko powodują zakażenia u człowieka, w USA są
jednak zakażenia bo bakterie te występują w wodzie i glebie i powodują reakcje skórne na PPD
-M. scrofulaceum: jest przyczyną przewlekłej limfadenopatii u małych dzieci, wycięcie węzłów
chłonnych jest metodą leczniczą,
-M. matinum i ulceranas: występują w wodzie i mogą zakażać ryby, powodują powierzchniowe
zmiany skórne;
-M. chelonei: zakaża świńskie zastawki serca
-M. lepre: wywołuje trąd, typowe laseczki kwasoodporne,
185.Charakterystyka bakterii z rodzajów Staphylococcus i Streptococus.
Staphylococcus
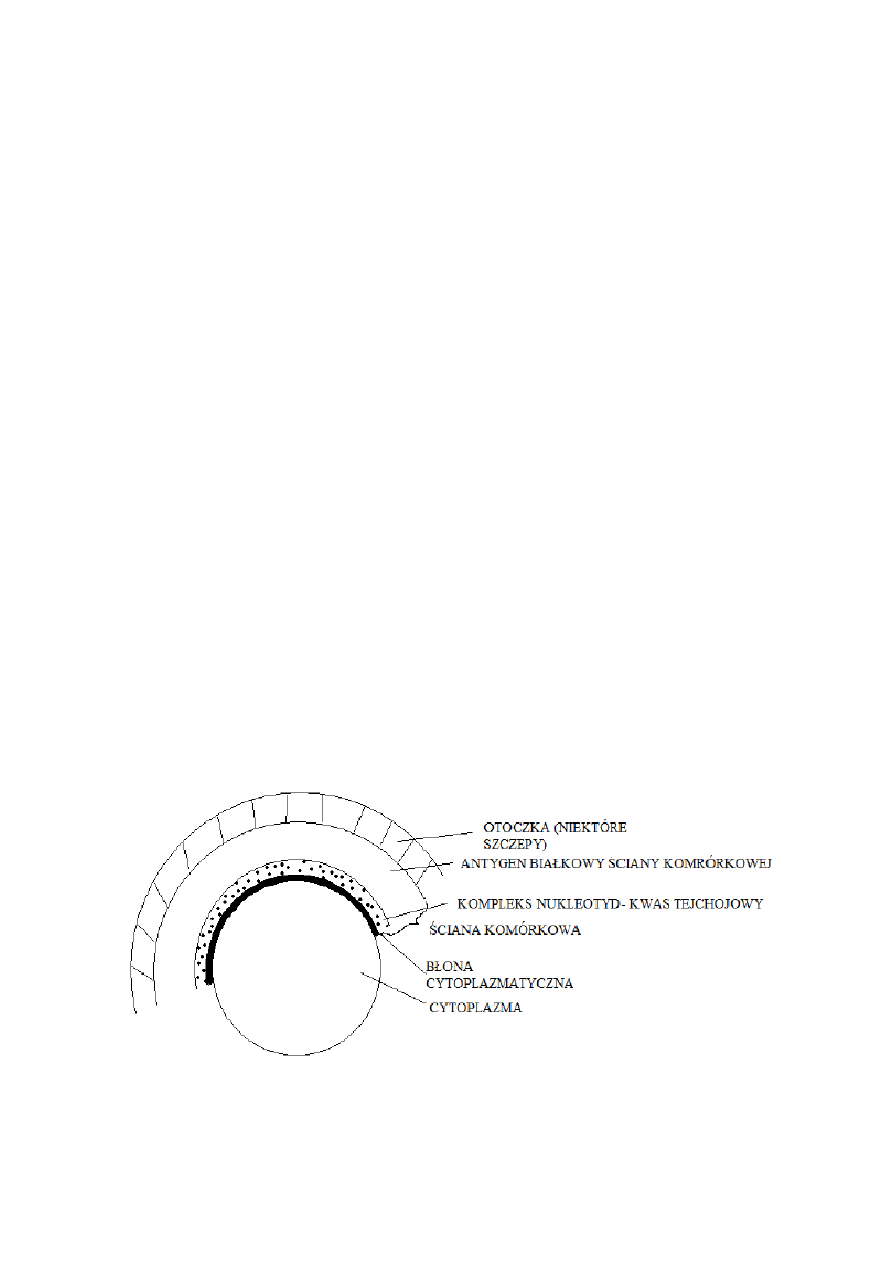
Są to bakterie G(+), ułożone zwykle w nieregularne skupiska przypominające grona. Rosną łatwo
na na zwykłych podłożach i są czynne metabolicznie, fermentując węglowodany i i wytwarzając
pigmenty, których barwa waha się od białej do ciemnożółtej. Niektóre szczepy wchodzą w skład
prawidłowej flory bakteryjnej skóry i błon śluzowych człowieka; inne wywołują ropnie i wrzody.
Gronkowce chorobotwórcze często hemolizują krew, koagulują osocze i wytwarzają różne enzymy
i toksyny. Szybko nabywają odporność na leki. Do tego rodzaju należy ok. 20 gatunków. S.aureus
jest koagulazododatni. Koagulazoujemne stanowią prawidłowa florę czlowieka: S. epidermis
(czasami może wywołuwać zakazenia protez), S. saprophyticus (zakażenia dróg moczowych u
młodych kobiet).
Morfologia i identyfikacja
A. Organizmy typowe.
Kuliste komórki o średnicy ok. 1μm ułożne w nieregularne skupiska. Są nieruchliwe i nie tworzą
zarodników
B. Posiewy.
Gronkowce rosną łatwo na większości zwykłych podłoży laboratoryjnych w warunkach tlenowych
lub mikroaerofilnych. Najszybciej rosną w T= 37ºC, ale barwnik najlepiej wytwarzają w temp T=
20-25ºC; S. aureus- kolonie szare- złociste, S. epifermis- szare kolonie.
C. Charakterystyka wzrostu.
Gronkowce wytwarzają katalazę, która różnicuje je od paciorkowców. Wolno fermentują
wytwarzając kwas mlekowy. Dość odporne na wysoką temperaturę (wytrzymują 50 ºC przez 30
minut). Gronkowce są wrażliwe na wankomycynę.
Struktura natygenowa
Gronkowce zawieają antygen białkowy i polisacharydowy. Peptydoglikan, polimer
polisacharydowy zbudowany z połączonych podjednostek, stanowi sztywny szkielet ściany
komórkowej. Mocne kwasy czy lizozym niszczą peptydoglikan.
Antygenami mogą być kwasy tejchojowe. Białko A jest składnikiem ściany komórkowej licznych
szczepów S. aureus, które wiąże się z częścia Fc cząsteczki IgG. Niektóre szczepy S. aureus mają
otoczki, które hamują fagocytozę przez wielojądrowe krwinki białe w nieobecności swoistych
przecwiciał. Wiele posiada koagulazę lub czynnik zlepiający na powierzchni ściany komórkowej.
Koagulaza nieenzymatycznie wiąże fibrynogen powodując agregację bakterii.
Antygenowa budowa gronkowców. Poniżej schemat.
Toksyny i enzymy
A. Katalaza. Gronkowce wytwarzają katalazą, która rozkłada nadtlenek wodoru do wody i tlenu.
B. Koagulaza- S. aureus wytwarza- białko podobne do enzymu, powoduje krzepnięcie krwi w
obecności czynnika występującego w surowicach.

C. Inne enzymy. Hialuronidaza, czynnika rozprzestrzeniania, stafilokinaza, proteinazy, lipazy i i β-
laktamazy.
D.Egzotoksyny. Należą tu liczne toksyny, które po wstrzyknięciu zwierzętom są śmiertelne,
wywołują martwicę skóry. Toksyna α silnie działa na mięśnie gładkie naczyń. Toksyna β rozkłada
sfingomielinę i jest toksyczna dla ludzkich krwinek. Egzotoksyna pod wpływem formaliny staje się
nietoksyczna.
E. Leukocydyna. Toksyna ta może zabijać krwinki białe wielu zwierząt.
F. Toksyna złuszczająca. Uogólnione złuszczanie skóry.
G. Toksyna zespołu wstrząsu toksycznego (TSST). U człowieka wywołuje gorączkę, wstrząs i
zaburzenia wielu układów.
H. Enterotoksyny. Istnieje 6 rozpuszczalnych toksyn (A-F) wytwarzanych przez 50% szczepów S.
aureus. Enterotoksyny są ciepłostałe (wytrzymują gotowanie przez 30 minut) i odporne na enzymy
przewodu pokarmowego.
Patogeneza.
S. epidermis stanowi składnik skóry ludzkiej, układu oddechowego i pokarmowego. S. aureus
znajduje się u 40-50% ludzi w wydzielinie z nosa. Mogą one powodować wrzody czy zakażenia
układu moczowego.
Patologia
Prototypem zmiany wywołanej przez gronkowce jest czyrak lub inny ropień ograniczony. Grupy
S.aureus które osiedlają się w torebce włosowej, powodują martwicę tkanki (czynnik nekrotyzujący
skrę). Wytwarzana koagulaza koaguluje fibrynę wokół zmiany i w naczyniach chłonnych
prowadząc do powstania ściany, która ogranicza proces. Ścianę tę wzmacnia gromadzące się
komórki zapalne, a potem- tkanka włóknista. W centralnej części tkanka ulega rozpuszczeniu.
Bakterie z jednego ogniska mogą rozprzestrzeniać się przez układ chłonny lub krwionośny do
innych okolic ciała. Staphylococcus auresu może wywoływać zapalenie opon mózgowych , ropień
opłucnej, zapalenie wsierdzia i posocznicę z ropieniem każdego narządu.
Leczenie
Do długotrwałego leczenia stosuje się tetracykliny i wankomycynę. Ciężko jest wyleczyć osoby
zakażone tą bakterią, bo uzyskują one szybko odporność na podawane antybiotyki i bardzo szybko
się przenoszą. W leczeniu stosuje się jeszcze drenaż.
Streptococcus
Paciorkowce należą do G(+), charakterystycznie ułożone w łańcuszki lub pary. Poszczególne
ziarniaki są kuliste lub owalne. Długość łańcuszka zmienia się w zależności od warunków
środowiska. Niektóre paciorkowce wytwarzają polisacharydy otoczkowe. Większość szczepów z
grup A, B, C wytwarza otoczki, składające się z kwasu hialuronidowego. Ściana komórkowa
paciorkowców zawiera białka (antygeny M, T, R), węglowodany i peptydoglikany. Włosopodobne
rzęski wystają ponad otoczkę paciorkowców grupy A. Składają się one częściowo z białka M i są
pokryte kwasem lipotejchojowym. Na podłożu stałym dają dyskowate kolonie, z grupy A
śluzowate. Podstawowym źródłem energii jest rozkład cukrów. Najbardziej wymagające są
paciorkowce chorobotwórcze dla człowieka. Większość należy do względnych beztlenowców.
Struktura antygenowa
Znane są liczne substancje antygenowe:
1.Swoisty grupowo antygen ściany komórkowej. Węglowodan ten stanowi podstawę podziału na
grupy serologiczne.Swoistośćserologiczną swoistego grupowo węglowodanu określa aminocukier.
2.Białko M: jest ściśle związnae ze zjadliwością grupy A paciorkowców i występuje głównie u
organizmów dających kolonie matowe lub śluzowe. Białko M zapobiega fagocytozie zjadliwych
paciorkowców.

3.Substancja T: ten antygen nie ma związku ze zjadliwością, substancja T jest ciepłochwiejna i
wrażliwa na działanie kwasów.
4.Nukleoproteiny:wyciągi paciorkowców sporządzone za pomocą słabych zasad zawierają
mieszaninę białek i innych substancji o małej swoistości serologicznej, zwane substancjami P, które
stanowią prawadopodobnie większość zawartości komórek paciorkowców.
Paciorkowce grupy A wytwarzają ponad 20 produktów o właściwościach antygenowych. Należą do
nich m. inn.: streptokinaza (wytwarzana przez beta-hemolizujące paciorkowce, przekształaca
plazminogen osocza ludzkiego w plazminę- czynny enzym proteolityczny, który trawi fibrynę i inne
białka), streptodornaza (deoksyrybonukleaza paciorkowcowa), hialuronidaza, toksyna erytrogenna,
hemolizyny, streptolizyna S, streptolizyna O.
Praktyczny podział opiera się między innymi na morfologii kolonii i rodzaju hemolizy na agarze z
krwią. Paciorkowce wywołują takie choroby jak:
róża, zakażenie poporodowe, posocznica, paciorkowcowe zapalenie gardła, paciorkowceowe
zapalenie ropne skóry, zapalenie wsierdzia, gorączka reumatyczna, kłębkowe zapalenie nerek,
Wszystkie paciorkowece beta-hemolizujące grupy A są wrażliwe na penicylinę G, a większość też
na erytromycynę.
186.Mechanizmy obronne gospodarza przed inwazją drobnoustrojów.
Tylko niektóre drobnoustroje są zdolne do przenikania przez nieuszkodzoną skórę. Pot i wydzielina
gruczołów łojowych wskutek kwaśnego pH i prawdopodobnie obecności związków chemicznych
(szczególnie kwasy tłuszczowe) mają właściwości przeciwbakteryjne. W skórze obecny jest
lizozym- enzym rozpuszczający ściany komórkowe niektórych bakterii. Występuje też we łzach,
wydzielinach układu oddechowego i szyjki macicy. Odporność zmienia się z wiekiem. Błony
śluzowe dróg oddechowych są pokryte warstewką śluzu, który stale jest poruszany w kierunku
naturalnych otworów przez nabłonek rzęskowy. Bakterie mają tendencję o przyklejania się do
śluzu. Śluz też posiada lizozym i inne enzymy przeciwbakteryjne. Niektóre drobnoustroje łączą się
z powierzchniowymi komórkami nabłonkowymi za pomocą adhezyn i receptorów komórkowych.
Jeśli takie komórki mają na swojej powierzchni przeciwciała IgA, to do połączenia się
drobnoustrojów nie dochodzi. Jest to mechanizm odporności gospodarza. Jeśli drobnoustrój
zniszczy przeciwciało za pomocą proteazy, stanowi to „czynnik wirulencji”. Kiedy mikroorganizm
wniknie do błony śluzowej, wtedy bywa pobrany przez fagocyty i przeniesiony do naczynia
chłonnego. Węzły chłonne działają jak bariery zapobiegające dalszemu rozprzestrzenianiu się
drobnoustrojów i mogą niszczyć bakterie. Aparat śluzowo-rzeskowy ukł. oddechowego
wspomagany przez magrofagi płuc usuwa bakterie z dróg oddechowych. Cały układ obronny może
zostać zablokowany przez alkohol, papierosy, narkotyki, niedotlenienie, kwasicę. Specyficzną
obroną są włosy w otworach nosowych oraz odruch kaszlowy. Ślina zawiera liczne nezymy
hydrolityczne, kwaśny odczyn żołądka unieczynnia bakterie, , w jelicie cienkim jest wiele
enzymów proteolitycznych i czynne makrofagi.
187.Nieswoiste mechanizmy obronne gospodarza: reakcja zapalna i jej objawy, fagocytoza.
Każde uszkodzenie tkanki np. takie, które w wyniku daje usadowienie i namnażanie się
drobnoustrojów, prowadzi do powstania procesu zapalnego. Rozpoczyna się od rozszerzenia
miejscowych tętniczek i naczyń włosowatych, z których wycieka osocze. W miejscu urazu
gromadzi się płyn obrzękowy i powstaje siateczka fibrynowa, która zamyka naczynia limfatyczne,
co ma na celu ograniczenie rozprzestrzeniania się drobnoustrojów. Wielojądrowe krwinki białe
przyklejają się do ścian naczyń włosowatych, a następnie migrują na zewnątrz w kierunku czynnika

drażniącego. Migrację tę pobudzają składniki płynu wysiękowego (chemotaksja). Fagocyty
pochłaniają drobnoustroje i zaczynają je trawić. Wkrótce odczyn w miejscu zapalenia staje się
bardziej kwaśny, a proteazy komórkowe zapoczątkowują lizę krwinek białych. Duże makrofagi
jednojądrowe przedostają się do miejsca zapalenia i zaczynają pochłaniać resztki krwinek białych
oraz drobnoustrojów, torując drogę do likwidacji procesu zapalnego. Spośród prawdopodobych
przekaźników reakcji zapalnych można wymienić: limfokiny i pochodne kwasu arachidonowego,
jak prostaglandyny, leukotrieny i tromboksany. Leki hamujące syntezę prostaglandyn (przez
hamowanie cyklooksygeznaz) działają jako lepi przeciwzapalne. Różne etapy takiego procesu
zapalnego mogą dominować w zależności drobnoustroju, który spowodował zapalenie. Powstający
we wczesnym okresie płyn obrzękowy może nawet pobudzać rozwój bakterii. Fagocytoza i
obecność fagocytów zabija tylko niektóre bakterie, podczas gdy dla innych służy jako środek
transportu i ochrony a nawet namnażania.
Gorączka należy do objawów reakcji zapalnej. Ostatecznymi regulatorami temperatury ciała są
ośrodki w podwzgórzu. Są one pobudzą przez czynniki chemiczne i fizyczne. Gorączka jest
wynikiem bezpośredniego uszkodzenia mechanicznego lub wprowadzenia związków chemicznych
do ośrodków termoregulacji. Do substancji wywołujących gorączkę należą endotoksyny bakterii G-
i wyciągi z komórek- monocyty i makgofagi- zwane interleukiną-1.
1.Endotoksyny. Są to ciepłostałe polisacharydy. Po wstrzyknięciu dożylnym wywołują gorączkę
po 60-90 min okresie utajenia. Powtarzane wstrzyknięcia endotoksyn powodują tolerancję biorcy,
po dlaszych wstrzyknięciach brak reakcji.
2.Interleukina-1. Jest ciepłochwiejna- niszczy ja 30 min. w temp. 90°C. PO wstrzyknięciu
dożylnym gorączka pojawia się po kilku minutach. Powtarzalne wstrzyknięcia nie powodują braku
reakcji. Interleukina jest przenoszona przez krew do ośrodka termoregulacji i tam zapoczątkowuje
procesy których efektem jest gorączka.
3.Limfokiny. Są to przekaźniki regulacyjne, wytwarzane w pewnych komórkach limfoidalnych.
188.Szczepionki.
Szczepionka – preparat pochodzenia biologicznego, zawierający żywe, o osłabionej zjadliwości
(atenuowane) lub zabite drobnoustroje chorobotwórcze lub fragmenty ich struktury, czy metabolity;
stosowany w celu wywołania odpowiedzi immunologicznej(odporności poszczepiennej – sztucznej
czynnej).
Szczepionki dzielimy na:
•
szczepionki swoiste – zapobiegające konkretnym jednostkom chorobowym (bruceloza,
wścieklizna, ospa)
•
szczepionki nieswoiste – zwiększające poziom ogólnej odporności (np. preparat Panodina
lub Westastymina)
Drobnoustroje używane do produkcji szczepionki pochodzą z izolowanych szczepów o ustalonych
właściwościach – o zmniejszonej zjadliwości – atenuowane (np. na drodze wielokrotnych pasaży),
zabite lub niechorobotwórcze dla gatunku biorcy, np. człowieka (szczepionka BCG przeciw
gruźlicy, wytworzona ze szczepu prątków atakujących bydło. W celu uśmiercania zarazków
wykorzystywanych w szczepionkach używa się zazwyczaj wysokiej temperatury, środków
chemicznych ( fenol, alkohol ) lub promieniowania jonizującego. Szczepienia wykonuje
jednorazowo lub z powtórzeniem w celu uzyskania większego miana przeciwciał w surowicy (tzw.
booster effect – dosł. efekt wzmacniacza).
Typy szczepionek
•
klasyczne:
•
żywe o pełnej wirujencji. Jedyna do dziś stosowana (pierwsza w historii) to
szczepionka Edwarda Jennera przeciw ospie prawdziwej. Zawiera on wirusa

krowianki.
•
żywe atenuowane – w 1881 wprowadzone przez Ludwika Pasteura, obecnie
przykładem są: BCG, szczepionka Sabina MMR. Ryzyko stanowi możliwość
przejścia atenuowanych szczepów w formę w pełni wirulentną.
•
zabite – wywołują odporność krótkotrwałą, zwykle poprzez odpowiedź humoralna.
Przykłady: Szczepionka na krztusiec
•
anatoksyny – toksyny pozbawione zjadliwości, lecz o zachowanych właściwościach
antygenowych. Przykład: szczepionka przeciw błonicy i tężcowi.
•
Szczepionki nowej generacji:
•
żywe atenuowane patogeny zmodyfikowane genetycznie (najczęściej delecja)
•
podjednostkowe – antygen danego patogenu na większym nośniku. Przykład:
antygen Haemophilus influenzae na cząsteczce difosforybozylofosforanu (PRPP)
•
z czystego DNA "wbijana" w komórki szczepionego – słaba odpowiedź limfocytów
T
C
•
w roślinach zakażonych genetycznie modyfikowanymi bakteriami produkującymi
antygen patogenu – brak kontroli dawki antygenu, niestabilność bakterii (możliwe
mutacje).
Szczepionki poliwalentne
Aktualnie coraz częściej stosuje się szczepionki, które uodparniają przed kilkoma chorobami – są to
tzw. szczepionki skojarzone (poliwalentne). Przykładem takiej szczepionki jest Di-Per-Te przeciw
błonicy, tężca i krztuśca. Ponadto takie szczepionki dają wyższą odporność niż antygeny podane
osobno.
Odporność poszczepienna jest odpornością czynną, tzn. po immunizacji antygenem w organizmie
biorcy powstają przeciwciała; inaczej, niż w przypadku podania gotowych przeciwciał w postaci
surowicy (odporność bierna).
Odporność poszczepienna utrzymuje się od kilku tygodni do kilku lat, w zależności od:
•
rodzaju szczepionki (atenuowana, żywa, zabita),
•
ilości przebytych szczepień (rewakcynacja),
•
stanu ogólnego biorcy w chwili szczepienia (zarobaczenie, infekcje, kondycja), itp.
Drogi podania szczepionek
Większość szczepionek podawana jest w postaci zastrzyku, lecz są także takie, które aplikuje się
doustnie (przeciw poliomyelitis). Można szczepić drogą wziewną – rozpylając szczepionkę do nosa
(przeciw grypie). Przeciwko ospie prawdziwej szczepiono (do 1980 roku, aktualnie nie są
prowadzone powszechne szczepienia) przy pomocy skaryfikatora, czyli przyrządu do zadraśnięcia
naskórka (skaryfikacji) lub cienkiej igły, którą uciskano wielokrotnie powierzchnię skóry.
Przeciwwskazania do szczepień
•
zaburzenia odporności przy szczepionkach atenuowanych – ale nie zakażenie HIV
•
ostre choroby zakaźne
•
ostre choroby z temp. > 38-38,5°C
•
okres zaostrzenia choroby przewlekłej
•
alergie na składniki szczepionki
•
ciąża (dotyczy głównie pierwszego trymestru, przede wszystkim szczepionki atenuowane,
głównie przeciw różyczce)
Zdarza się, że po zaszczepieniu pojawiają się niepożądana odczyny poszczepienne.

W Polsce szczepień obowiązkowych dokonuje się do 18. roku życia i u osób szczególnie
narażonych (studentów nauk medycznych, pracowników służby zdrowia i weterynaryjnej, przed
niektórymi zabiegami medycznymi, przed wyjazdem do niektórych krajów tropikalnych, etc.).
Osoba poddawana szczepieniu powinna być zdrowa.
Document Outline
Wyszukiwarka
Podobne podstrony:
więcej podobnych podstron