Alkacymetria
ANALIZA OBJĘTOŚCIOWA
H
2
C
2
O
4
Substancje podstawowe wykorzystywane w alkacymetrii
:
1. H
2
C
2
O
4
+ 2 NaOH
= Na
2
C
2
O
4
+ 2 H
2
O
2.
C
6
H
5
COOH + NaOH =
C
6
H
5
COONa + H
2
O
3.
Na
2
B
4
O
7
+ 2 HCl + 5 H
2
O
4 H
3
BO
3
+ 2 NaCl
1.
Ściśle określony skład chemiczny
2. Stabilne chemicznie
3. Duża masa molowa
4. Rozpuszczalne w wodzie lub rozpuszczają się w wyniku reakcji w czasie miareczkowania
1
10
37
,
381
2
7
4
2
mol
g
M
O
H
O
B
Na
1
2
06
,
126
2
4
2
2
mol
g
M
O
H
O
C
H
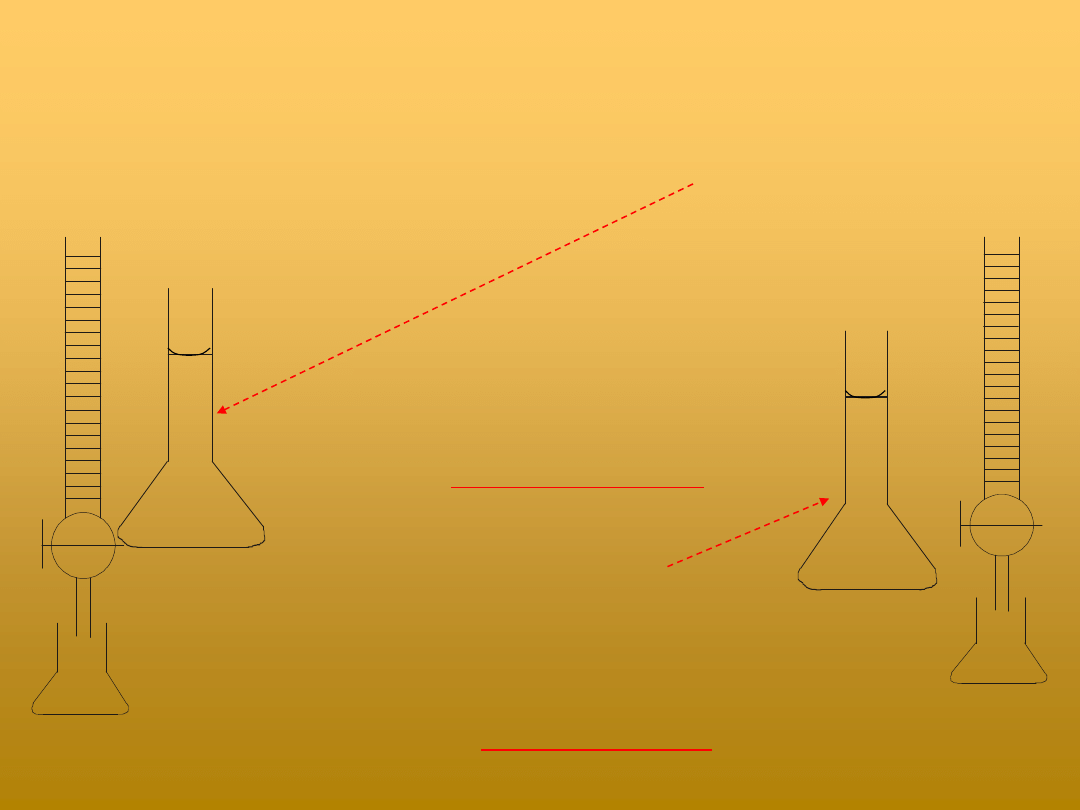
Alkacymetryczne oznaczanie HCl
metodą miareczkowania mianowanego roztworu NaOH
1. Przygotowanie mianowanego roztworu H
2
C
2
O
4
o stężeniu około 0,05 mol·dm
–3
w kolbie miarowej (V
k,1
)
2. Przygotowanie roztworu NaOH o stężeniu około 0,1 mol·dm
–3
(w butelce z korkiem gumowym) z nasyconego roztworu NaOH,
o c
p
=40% i d = 1,4g/cm
3
3. Oznaczenie stężenia NaOH
4. Oznaczenie stężenia HCl w badanym roztworze (V
k,2
)
z wykorzystaniem mianowanego roztworu NaOH
Biureta
(roztwór
NaOH
)
Kolba stożkowa
(roztwór H
2
C
2
O
4
,
fenoloftaleina)
Biureta
(roztwór
NaOH
)
Kolba stożkowa
(roztwór HCl,
fenoloftaleina)
H
2
C
2
O
4
HCl
H
2
C
2
O
4
+ 2 NaOH = Na
2
C
2
O
4
+ 2 H
2
O
HCl + NaOH = NaCl + H
2
O
śr
NaOH
O
C
H
O
C
H
NaOH
V
c
V
c
,
4
2
2
4
2
2
2
HCl
NaOH
śr
NaOH
HCl
V
c
V
c
,

Przykład 1.
Do miareczkowania mieszaniny CaCO
3
i MgCO
3
o masie 0,7214g zużyto 30 cm
3
roztworu
HCl o stężeniu 0,5505 mol/dm
3
. Obliczyć % skład tej mieszaniny.
Dane:
V(HCl) = 30 cm
3
c(HCl) = 0,5505mol/dm
3
m(CaCO
3
) + m(MgCO
3
) = 0,7214 g
M(CaCO
3
) = 100 g/mol
M(MgCO
3
) = 84 g/mol
Należy obliczyć:
%(CaCO
3
) = ?
Rozwiązanie:
CO
3
2-
+ 2 H
+
= CO
2
+ H
2
O
2
1
3
3
CaCO
HCl
CaCO
n
n
3
3
MgCO
HCl
CaCO
HCl
HCl
n
n
n
2
1
3
3
MgCO
HCl
MgCO
n
n
3
3
2
2
MgCO
CaCO
HCl
n
n
n
84
7214
,
0
2
100
2
x
x
c
V
HCl
HCl
g
m
CaCO
1736
,
0
3
06
,
24
100
7214
,
0
1736
,
0
100
7214
,
0
%
3
3
CaCO
CaCO
m

Alkacymetryczne oznaczanie stężenia HCl
metodą miareczkowania odważki boraksu (tetraboranu sodu)
Na
2
B
4
O
7
+ 2 HCl + 5 H
2
O
4 H
3
BO
3
+ 2 NaCl
HCl
Biureta
(roztwór
HCl
)
Kolba stożkowa
Odważka Na
2
B
4
O
7
10H
2
O ,
wskaźnik)
i
HCl
O
H
O
B
Na
i
O
H
O
B
Na
i
HCl
V
M
m
c
,
10
,
10
,
2
7
4
2
2
7
4
2
2
śr
HCl
HCl
k
HCl
HCl
c
V
M
m
,
,

Przykład 2.
Obliczyć % zawartość Na
2
CO
3
w sodzie technicznej, jeżeli do miareczkowania odważki tej
sody o masie 1,1045 g zużywa się 35 cm
3
roztworu HCl o stężeniu 0,4955 mol/dm
3
.
Dane:
V(HCl) = 35 cm
3
c(HCl) = 0,4955 mol/dm
3
M
sody technicznej
= 1,1045 g
M(Na
2
CO
3
) = 106 g/mol
Należy obliczyć:
%(Na
2
CO
3
) = ?
Rozwiązanie:
CO
3
2-
+ 2 H
+
= CO
2
+ H
2
O
3
2
2
CO
Na
HCl
n
n
2
1
3
2
HCl
CO
Na
n
n
3
2
3
2
2
CO
Na
CO
Na
HCl
HCl
M
m
c
V
HCl
HCl
CO
Na
CO
Na
c
V
M
m
3
2
3
2
2
1
g
m
CO
Na
9192
,
0
4955
,
0
035
,
0
106
2
1
3
2
22
,
83
100
1045
,
1
9192
,
0
100
%
3
2
3
2
sody
CO
Na
m
m
CO
Na

Kolorymetryczne wskaźniki pH
HW = H
+
+ W
–
b
1
b
2
]
[
]
[
]
[
HW
W
H
K
HW
b
W
K
H
HW
HW
1
10
]
[
]
[
]
[
Wskaźnik
pH
Barwa
Błękit tymolowy
1,2 - 2,8
Z
czerwonej
w
fioletową
Oranż metylowy
3,1 - 4,4
Z
czerwonej
w
żółtą
Czerwień metylowa
4,2 - 6,0
Z
czerwonej
w
żółtą
Błękit
bromotymolowy
6,0 - 7,6
Z
żółtej
w
niebieską
Lakmus
5,0 - 8,0
Z
czerwonej
w
niebieską
Fenoloftaleina
8,3 - 10,0
Z bezbarwnej
w
czerwoną
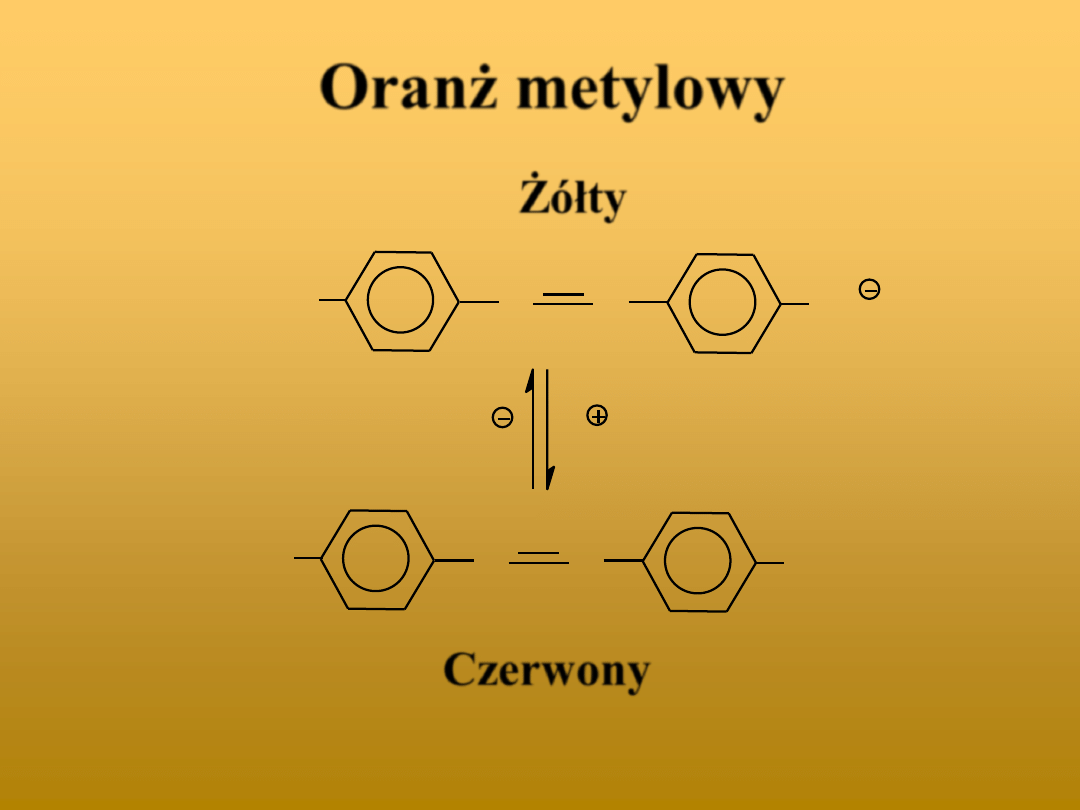
Oranż metylowy
Żółty
H
OH
N
N
SO
3
N
(CH
3
)
2
N
N
N
(CH
3
)
2
SO
3
H
Czerwony
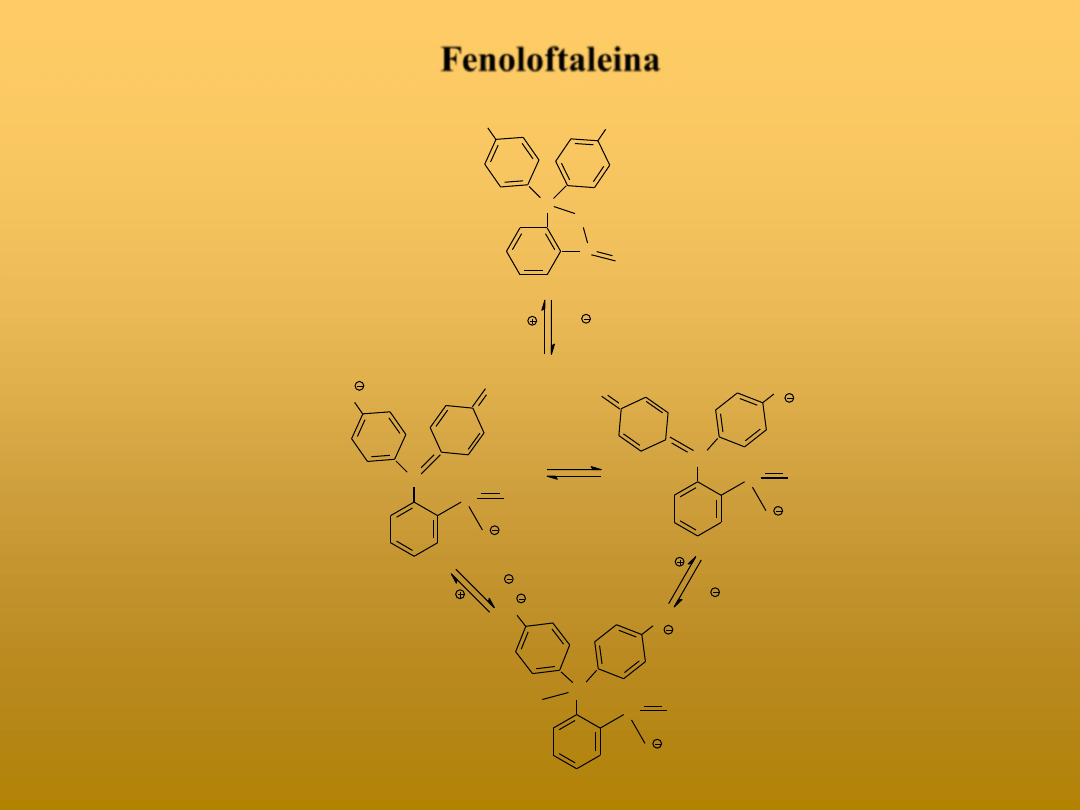
Fenoloftaleina
IV
C
O
O
C
O
O
O
O
C
O
C
O
O
C
O
C
O
O
HO
I
II
III
OH
C
OH
C
O
O
OH
H
OH
OH
H
H
Struktura bezbarwna
pH<8,3
Struktura barwna
Struktura barwna
pH: 8,3 - 10,0
pH: 8,3 - 10,0
Struktura bezbarwna
pH>10,0
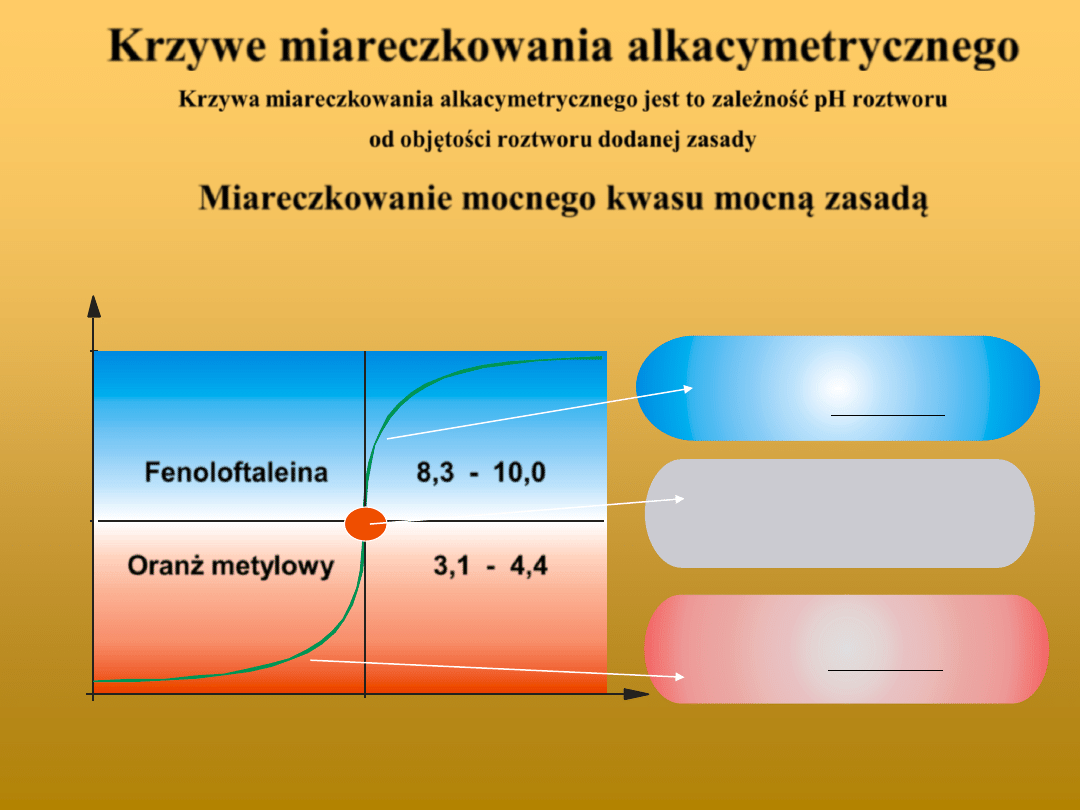
Krzywe miareczkowania alkacymetrycznego
Krzywa miareczkowania alkacymetrycznego jest to zależność pH roztworu
od objętości roztworu dodanej zasady
Miareczkowanie mocnego kwasu mocną zasadą
Gdy V
z
= PRM
[H
+
] = [OH
–
] = 1·10
–7
mol/dm
3
PRM
pH
14
7
0
0
V
z
Gdy V
z
)
,
(
PRM
k
z
k
k
z
z
V
V
c
V
c
V
OH
]
[
Gdy V
z
)
,
0
[ PRM
k
z
z
z
k
k
V
V
c
V
c
V
H
]
[
Oranż metylowy
Fenoloftaleina
3,1 - 4,4
8,3 - 10,0
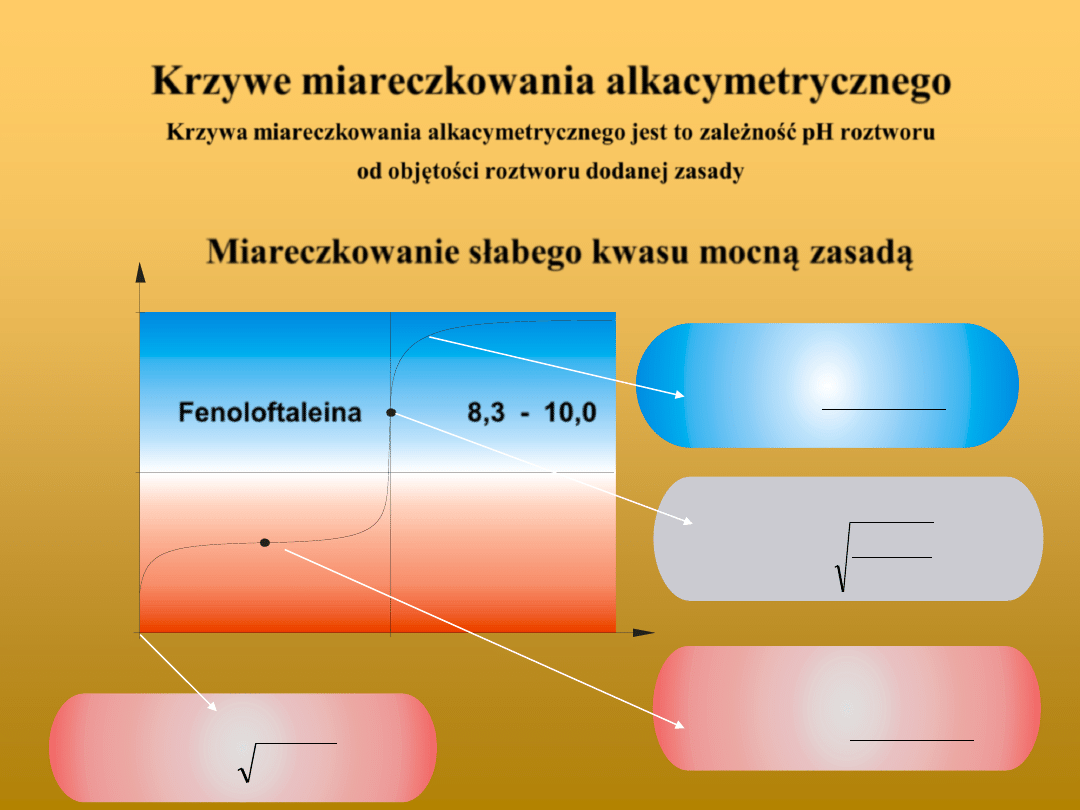
Krzywe miareczkowania alkacymetrycznego
Krzywa miareczkowania alkacymetrycznego jest to zależność pH roztworu
od objętości roztworu dodanej zasady
Miareczkowanie słabego kwasu mocną zasadą
pH
V
z
PRM
0
0
7
Gdy V
z
= PRM
Gdy V
z
)
,
0
( PRM
)
,
(
PRM
Gdy V
z
Gdy V
z
= 0
k
z
k
k
z
z
V
V
c
V
c
V
OH
]
[
s
w
a
c
K
K
H
]
[
z
z
z
z
k
k
a
c
V
c
V
c
V
K
H
]
[
k
a
c
K
H
]
[
Fenoloftaleina
8,3 - 10,0
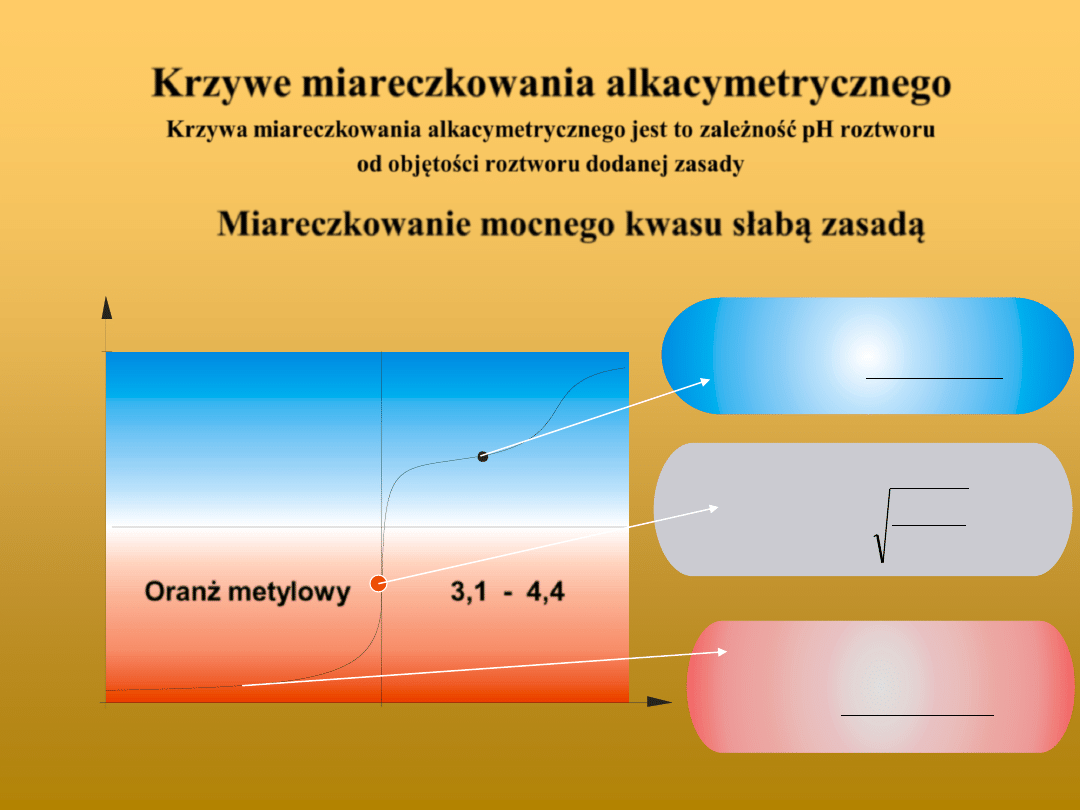
Krzywe miareczkowania alkacymetrycznego
Krzywa miareczkowania alkacymetrycznego jest to zależność pH roztworu
od objętości roztworu dodanej zasady
Miareczkowanie mocnego kwasu słabą zasadą
pH
7
0
0
PRM
V
z
)
,
(
PRM
Gdy V
z
Gdy V
z
= PRM
Gdy V
z
)
,
0
[ PRM
b
w
s
K
K
c
H
]
[
k
k
k
k
z
z
b
c
V
c
V
c
V
K
OH
]
[
z
k
z
z
k
k
V
V
c
V
c
V
H
]
[
Oranż metylowy
3,1 - 4,4
k
a
c
K
H
]
[
pH
14
7
0
0
PRM
V
z
z
z
z
z
k
k
a
c
V
c
V
c
V
K
H
]
[
k
k
k
k
z
z
b
c
V
c
V
c
V
K
OH
]
[
b
a
w
K
K
K
H
]
[
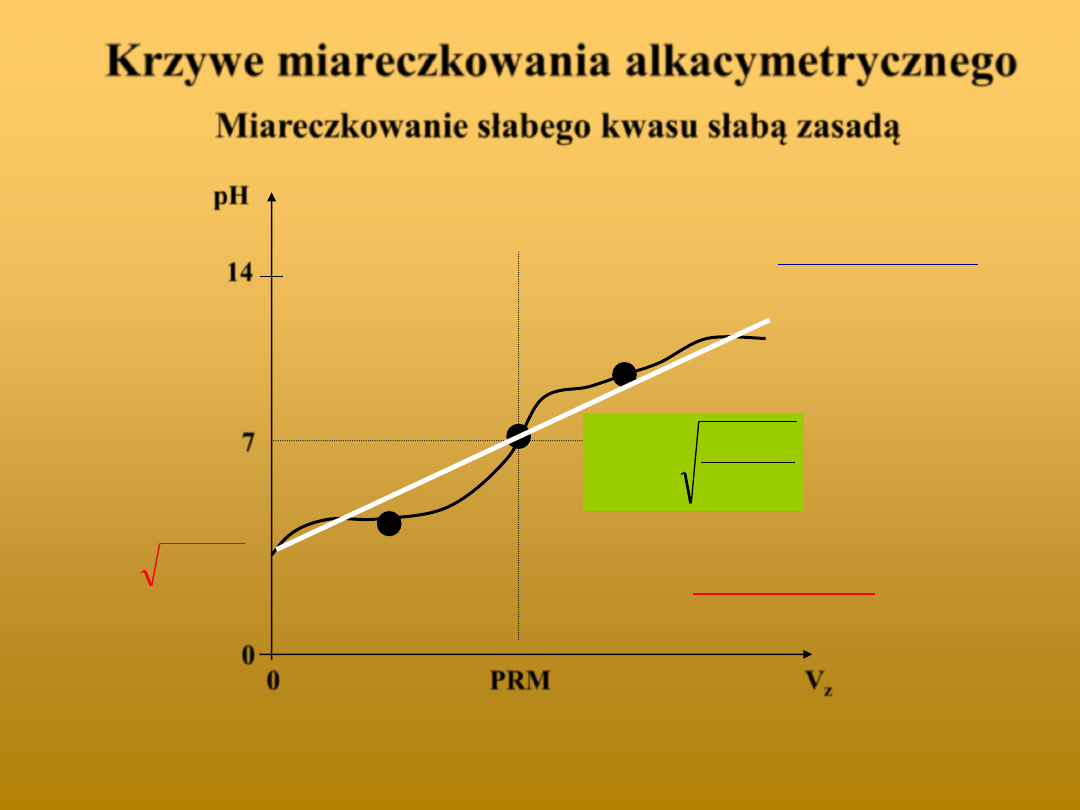
Krzywe miareczkowania alkacymetrycznego
Miareczkowanie słabego kwasu słabą zasadą

Przykład 2.
Oblicz pH roztworu otrzymanego w wyniku dodania do 50 cm
3
roztworu kwasu octowego
(K
a
= 1,76·10
-5
), o stężeniu 0,5 mol/dm
3
roztworu zasady sodowej o stężeniu 0,3 mol/dm
3
w ilości:
a) 90 % potrzebnej do zobojętnienia tego kwasu
b) 105 % potrzebnej do zobojętnienia tego kwasu.
Dane:
V(CH
3
COOH) = 50 cm
3
c(CH
3
COOH) = 0,5 mol/dm
3
c(NaOH) = 0,3 mol/dm
3
K
a
= 1,76·10
-5
Należy obliczyć:
a) pH(90% zob.) = ?
b) pH(105% zob.) = ?
Rozwiązanie:
CH
3
COOH + OH
-
= CH
3
COO
-
+ H
2
O
a) pH(90% zob.)
b) pH(105% zob.)
05
,
1
.
%
105
k
z
n
n
zob
9
,
0
.
%
90
k
z
n
n
zob
3
75
3
,
0
5
,
0
50
9
,
0
9
,
0
cm
c
c
V
V
z
k
k
z
3
5
,
87
3
,
0
5
,
0
50
05
,
1
05
,
1
cm
c
c
V
V
z
k
k
z
6
5
10
96
,
1
3
,
0
75
3
,
0
75
5
,
0
50
10
76
,
1
]
[
z
z
z
z
k
k
a
c
V
c
V
c
V
K
H
71
,
5
pH
0476
,
0
3
,
0
5
,
87
5
,
0
50
3
,
0
5
,
87
]
[
k
z
k
k
z
z
V
V
c
V
c
V
OH
32
,
1
pOH
68
,
12
pH
pH
PRM
V
z
pH
V
z
PRM
0
7
14
0
ΔV
z
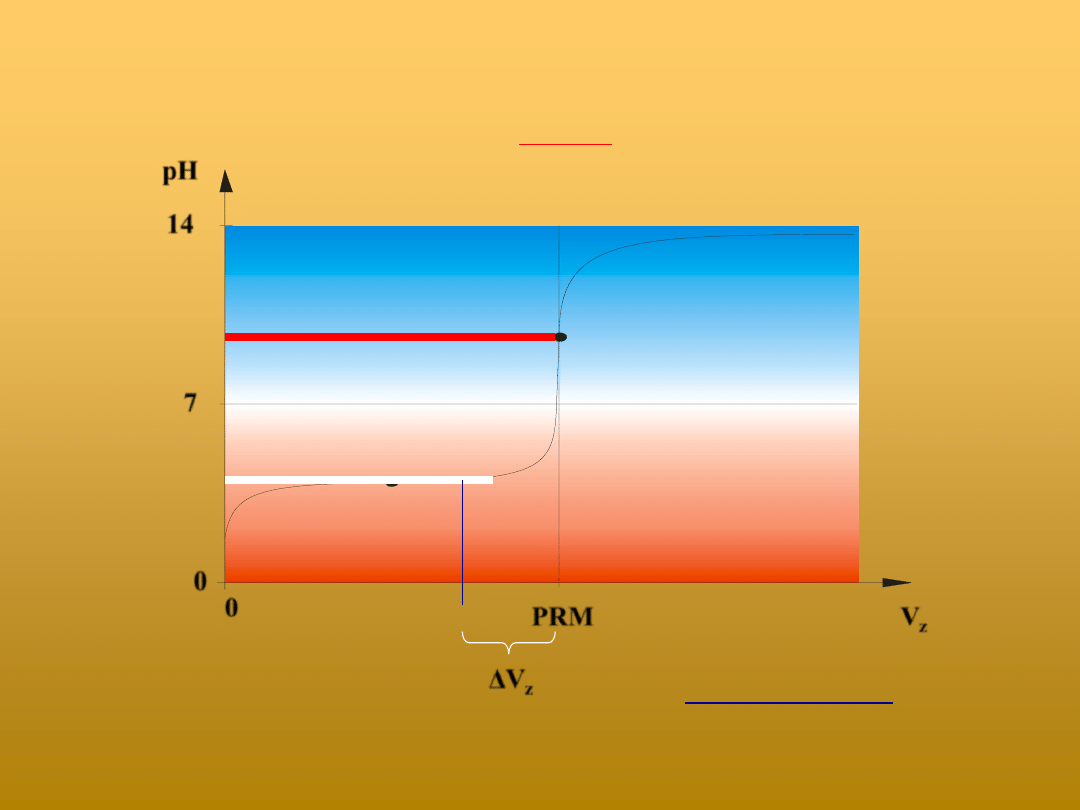
Jaki błąd oznaczenia stężenia kwasu (dodatni, czy ujemny) popełni się stosując
niewłaściwy wskaźnik w czasie miareczkowania słabego kwasu mocną zasadą?
k
z
z
k
V
c
V
c
k
z
z
z
k
V
c
V
V
c
)
(
k
z
z
k
V
c
V
c
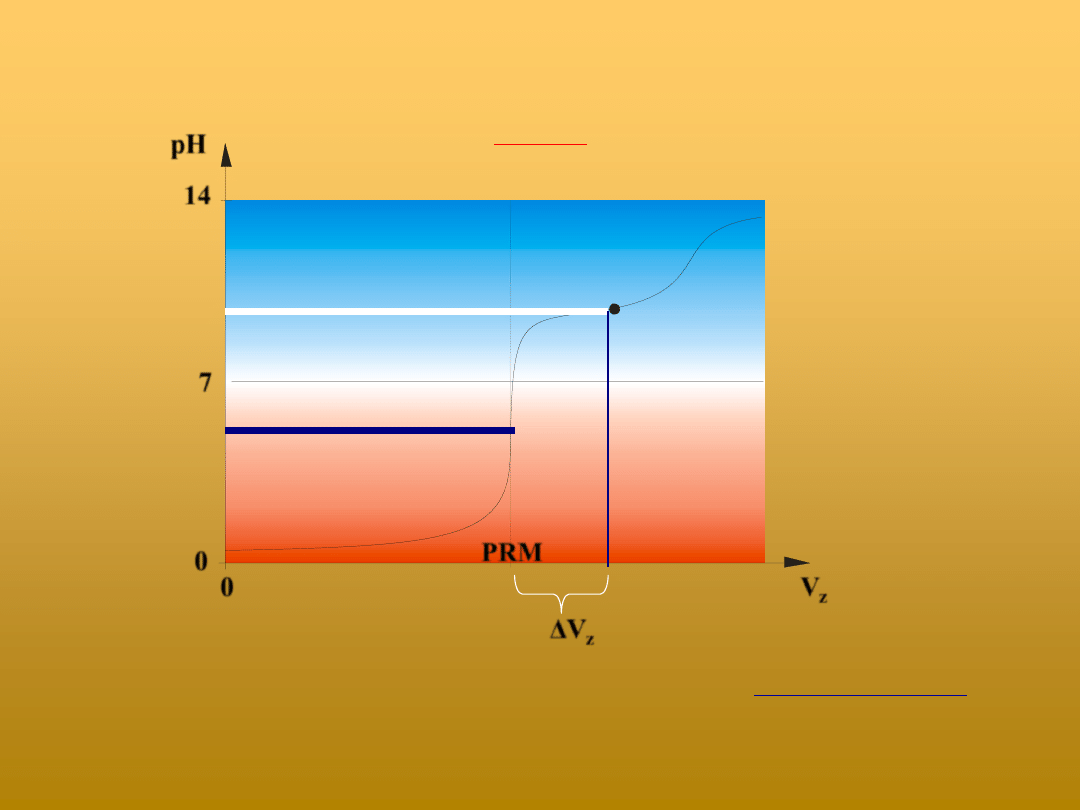
Jaki błąd oznaczenia stężenia kwasu (dodatni, czy ujemny) popełni się stosując
niewłaściwy wskaźnik w czasie miareczkowania mocnego kwasu słabą zasadą?
k
z
z
z
k
V
c
V
V
c
)
(
pH
14
7
0
0
PRM
V
z
ΔV
z
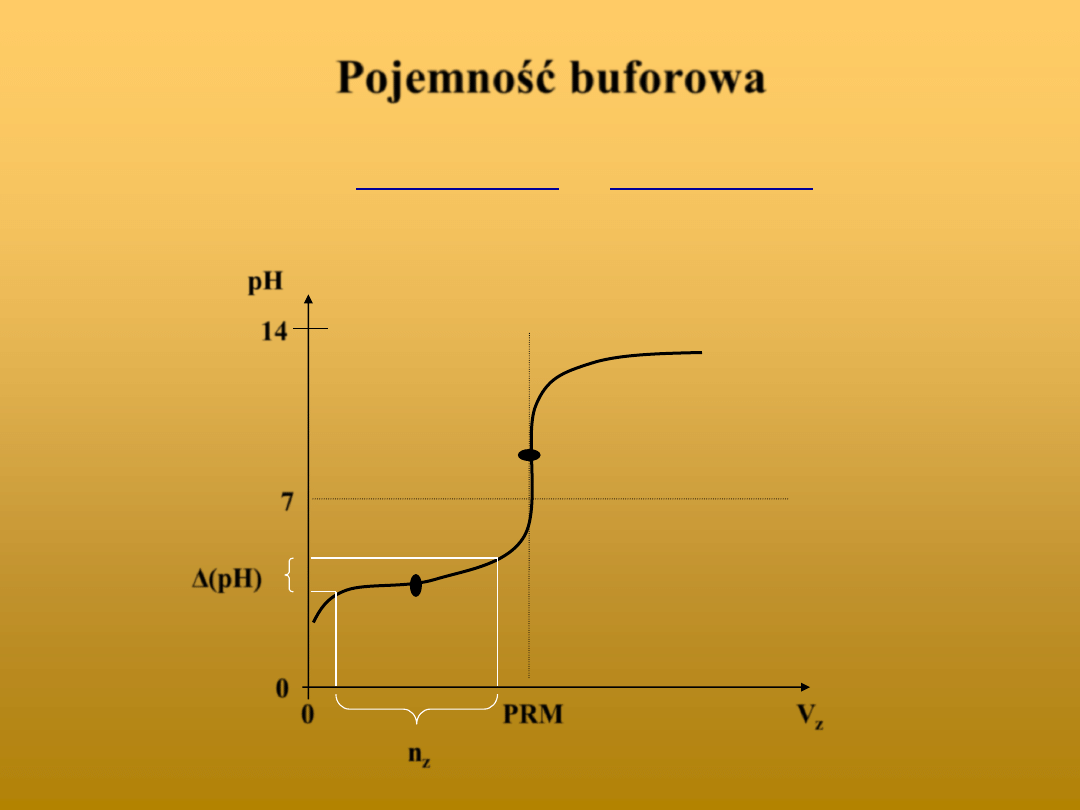
Pojemność buforowa
b
OH
b
H
V
pH
V
pH
n
n
)
(
)
(
pH
14
7
0
PRM
V
z
n
z
Δ(pH)
0
b
OH
b
H
V
pH
V
pH
n
n
)
(
)
(
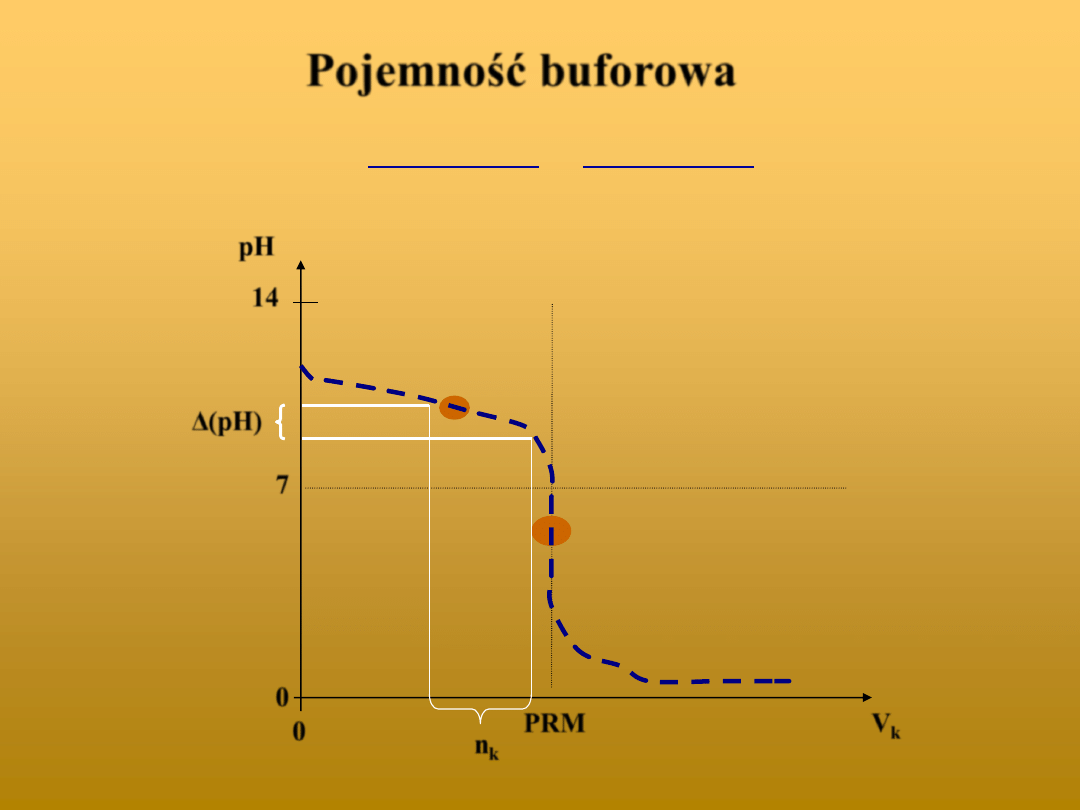
Pojemność buforowa
pH
14
7
0
0
PRM
V
k
n
k
Δ(pH)

Dane:
V(Buforu) = 50 cm
3
c
k
b
= 0,5 mol/dm
3
c
s
b
= 0,75 mol/dm
3
V(HCl) = 10 cm
3
c(HCl) = 0,1 mol/dm
3
K
a
= 1,76·10
-5
Należy obliczyć:
= ?
Przykład 3.
10 cm
3
roztworu HCl o stężeniu 0,1 mol/dm
3
dodano do 50 cm
3
roztworu buforu
octanowego, w którym: c
k
b
= 0,5 mol/dm
3
i c
s
b
= 0,75 mol/dm
3
.
Oblicz pojemność buforową tego buforu. K
a
= 1,76·10
-5
.
Rozwiązanie:
CH
3
COO
-
+ H
+
= CH
3
COOH
b
H
V
pH
n
)
(
b
s
b
k
a
c
c
K
H
]
[
5
5
10
17
,
1
75
,
0
5
,
0
10
76
,
1
]
[
H
I. Początkowe pH roztworu buforowego:
II. pH roztworu buforowego po dodaniu HCl:
93
,
4
pH
HCl
HCl
b
s
b
HCl
HCl
b
k
b
a
c
V
c
V
c
V
c
V
K
H
]
[
5
5
10
25
,
1
1
,
0
10
75
,
0
50
1
,
0
10
5
,
0
50
10
76
,
1
]
[
H
90
,
4
pH
3
33
,
3
50
03
,
0
1
,
0
50
)
(
dm
mol
V
pH
b
H
n
Stopień hydrolizy ( )
AB -> A
+
+ B
-
A
+
+ H
2
O = AOH + H
+
s
c
H ]
[
b
s
w
K
c
K
H
]
[
Hydroliza jest zjawiskiem odwrotnym do dysocjacji elektrolitycznej
s
b
w
c
K
K
Stopień hydrolizy ( )
B
–
+ H
2
O = HB + OH
–
s
c
OH ]
[
s
a
w
c
K
K
H
]
[
a
s
w
s
a
w
w
K
c
K
c
K
K
K
OH
]
[
s
a
w
c
K
K
Hydroliza jest zjawiskiem odwrotnym do dysocjacji elektrolitycznej

Przykład 3.
W którym roztworze sól w większym stopniu uległa hydrolizie?
a) Roztwór NH
4
Cl o c = 0,03 mol/dm
3
. K
b
= 1, 8·10
-5
b) Roztwór NaNO
2
o c = 0,05 mol/dm
3
. K
a
= 2·10
-4
.
Dane:
c
1
(NH
4
Cl) = 0,03 mol/dm
3
c
2
(NaNO
2
) = 0,05 mol/dm
3
K
a
= 2·10
-4
K
b
= 1, 8·10
-5
Należy obliczyć:
φ
1
= ?
φ
2
= ?
s
b
w
c
K
K
s
a
w
c
K
K
4
5
14
1
10
36
,
1
03
,
0
10
8
,
1
10
1
5
4
14
2
10
16
,
3
05
,
0
10
2
10
1
b
s
w
K
c
K
H
1
]
[
s
a
w
c
K
K
H
2
]
[
6
5
14
1
10
08
,
2
10
8
,
1
03
,
0
10
1
]
[
H
9
5
14
2
10
2
05
,
0
10
2
10
1
]
[
H
39
,
5
1
pH
70
,
8
2
pH
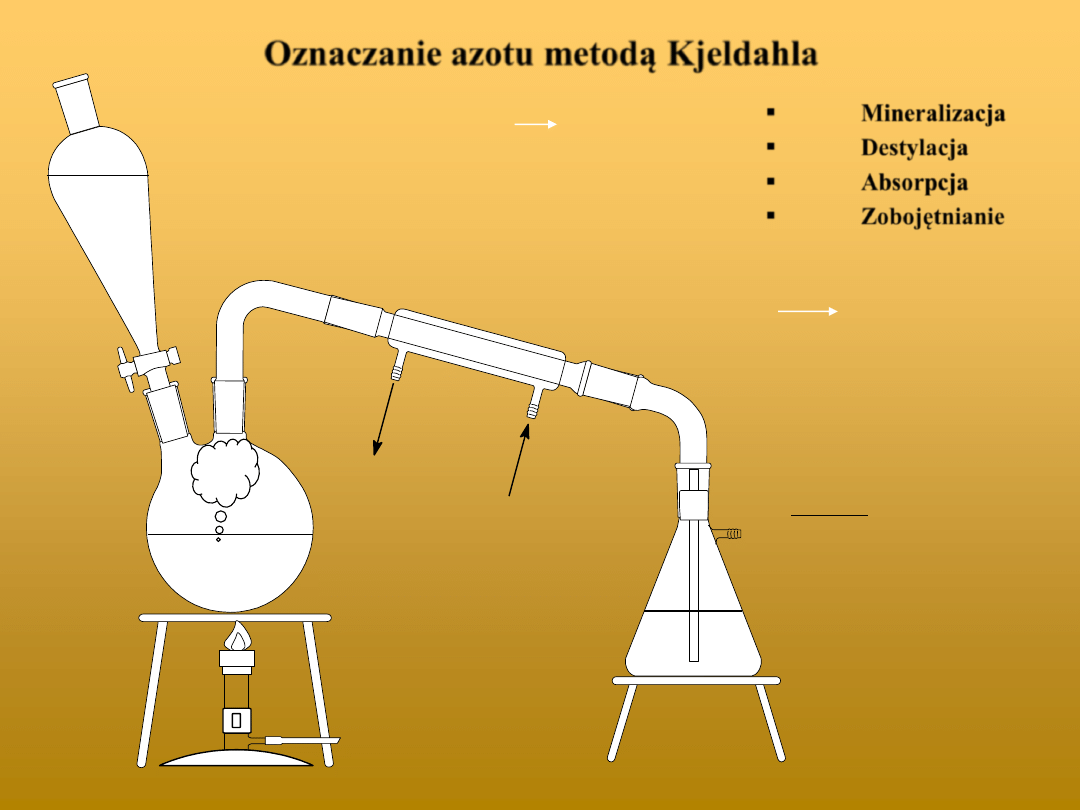
Oznaczanie azotu metodą Kjeldahla
Mineralizacja
Destylacja
Absorpcja
Zobojętnianie
H C CH NH + 6 H SO 2 CO + 2 NH + SO + 5 SO + 6 H O
2
2
2
2
2
2
4
4
4
2-
+
NH
4
+
+ OH
–
H
2
O + NH
3
3 NH
3
+ H
3
BO
3
3 NH
4
+
+ BO
3
3–
BO
3
3–
+ 3 H
+
H
3
BO
3
H
2
SO
4
2 H
+
+ SO
4
2–
3
3
3
4
n
n
BO
NH
3
1
3
3
n
n
H
BO
c
V
M
m
n
n
n
n
H
H
H
NH
H
NH
N
N
4
4
1
c
c
n
n
n
n
k
k
k
H
H
H
2
2
2
1
m
N
= 2 · 14·(V
k
- V
śl
) ·c
k
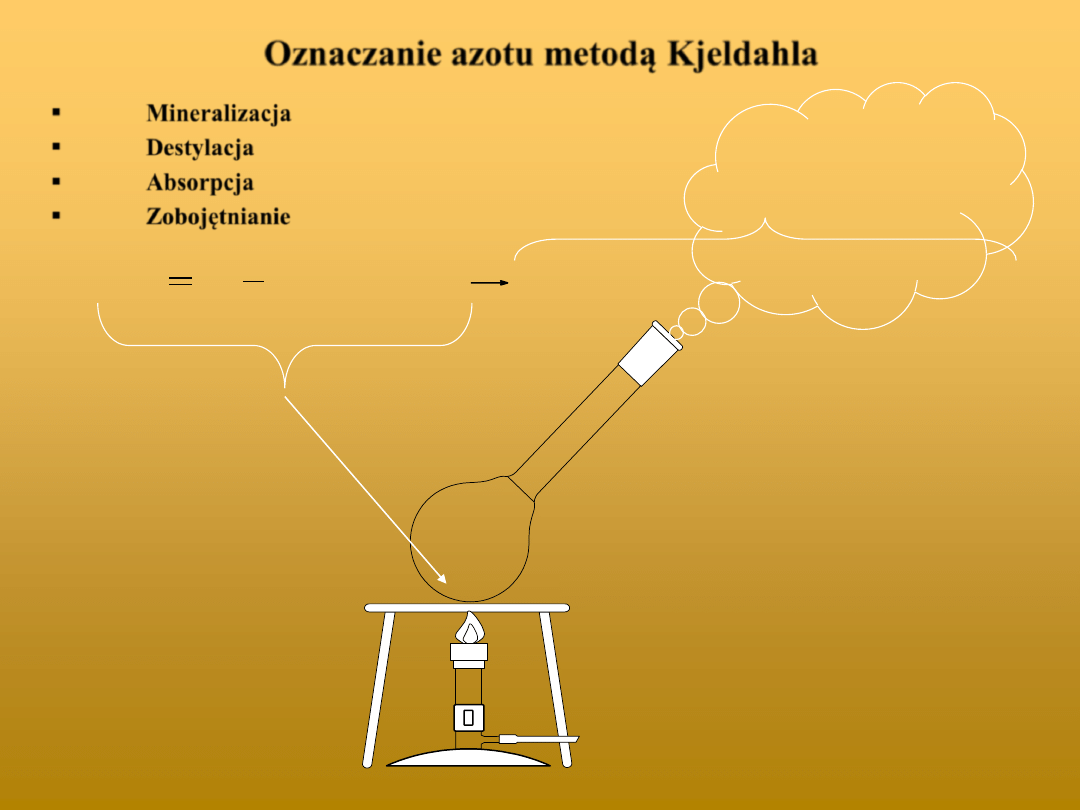
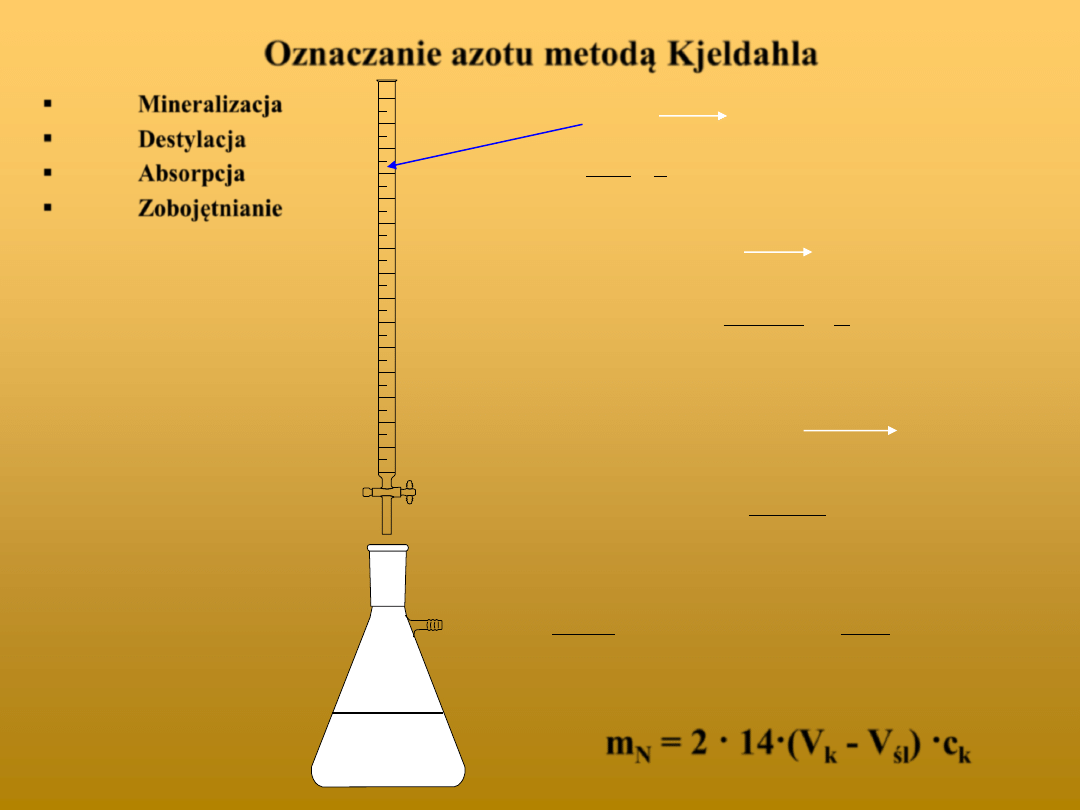
Oznaczanie azotu metodą Kjeldahla
Mineralizacja
Destylacja
Absorpcja
Zobojętnianie
H C CH NH + 6 H SO 2 CO + 2 NH + SO + 5 SO + 6 H O
2
2
2
2
2
2
4
4
4
2-
+
CO
2
, SO
2
NH
4
+
Oznaczanie azotu metodą Kjeldahla
NH
4
+
+ OH
–
H
2
O + NH
3
Mineralizacja
Destylacja
Absorpcja
Zobojętnianie
NaOH
NH
4
+
NH
3
3 NH
3
+ H
3
BO
3
3 NH
4
+
+ BO
3
3–
H
3
BO
3
3
3
3
4
n
n
BO
NH
Oznaczanie azotu metodą Kjeldahla
Mineralizacja
Destylacja
Absorpcja
Zobojętnianie
3
1
3
3
n
n
H
BO
c
V
M
m
n
n
n
n
H
H
H
NH
H
NH
N
N
4
4
1
BO
3
3–
+ 3 H
+
H
3
BO
3
H
2
SO
4
2 H
+
+ SO
4
2–
3 NH
3
+ H
3
BO
3
3 NH
4
+
+ BO
3
3–
3
3
3
4
n
n
BO
NH
c
c
n
n
n
n
k
k
k
H
H
H
2
2
2
1
NH
4
+
, BO
3
3-
m
N
= 2 · 14·(V
k
- V
śl
) ·c
k

1. Do 200 cm
3
roztworu kwasu octowego o pH = 4,88 dodano 100 cm
3
H
2
O.
Oblicz pH otrzymanego roztworu. K
a
= 1,76·10
-5
.
2. Oblicz pH roztworu otrzymanego przez zmieszanie 250 cm
3
roztworu mocnego kwasu
o pH
1
= 1,55 z 440 cm
3
roztworu mocnej zasady o pH
2
= 12,45.
3. Oblicz pH roztworu otrzymanego w wyniku dodania do 25 cm
3
roztworu kwasu octowego
o c
k
= 0,15 mol/dm
3
20 cm
3
roztworu NaOH o stężeniu c
z
= 0,15 mol/dm
3
. K
a
= 1,76·10
-5
.
4. Oblicz pH roztworu otrzymanego w wyniku dodania do 20 cm
3
roztworu kwasu solnego
o c
k
= 0,15 mol/dm
3
25 cm
3
roztworu NH
4
OH o stężeniu c
z
= 0,15 mol/dm
3
. K
b
=1,8·10
-5
.
5. Oblicz pH roztworu otrzymanego w wyniku dodania do 20 cm
3
roztworu kwasu solnego
o c
k
= 0,15 mol/dm
3
30 cm
3
roztworu NH
4
OH o stężeniu c
z
= 0,10 mol/dm
3
. K
b
=1,8·10
-5
.
6. Oblicz pH roztworu otrzymanego w wyniku dodania do 20 cm
3
roztworu kwasu octowego
o c
k
= 0,15 mol/dm
3
30 cm
3
roztworu NaOH o stężeniu c
z
= 0,10 mol/dm
3
. K
a
= 1,76·10
-5
.
7. Oblicz pH roztworu otrzymanego w wyniku dodania do 20 cm
3
roztworu kwasu octowego
o c
k
= 0,15 mol/dm
3
30 cm
3
roztworu NaOH o stężeniu c
z
= 0,15 mol/dm
3
. K
a
= 1,76·10
-5
.
8. Oblicz pH roztworu otrzymanego w wyniku dodania do 30 cm3 roztworu kwasu solnego
o c
k
= 0,15 mol/dm
3
25 cm
3
roztworu NH
4
OH o stężeniu c
z
= 0,15 mol/dm
3
. K
b
=1,8
·
10
-5
.
9. Oblicz pojemność buforową 500 cm
3
roztworu, w którym stężenie kwasu octowego
c
k
= 0,55 mol/dm
3
, a stężenie octanu sodu c
s
= 0,45 mol/dm
3
. K
a
= 1,76
·
10
-5
.
Zadania z alkacymetrii

10. 20 cm
3
roztworu NH
3
o stężeniu 0,10 mol/dm
3
miareczkowano roztworem HCl o c = 0,20 mol/dm
3
.
Oblicz pH roztworów wyjściowych i roztworu otrzymanego po dodaniu: 8,0; 10,0; 12,0 cm
3
roztworu HCl. K
b
=1,8·10
-5
.
11. 25,0 cm
3
roztworu NH
3
o stężeniu 0,12 mol/dm
3
miareczkowano roztworem HCl o stężeniu
0,15 mol/dm
3
. Oblicz wartości pH: a) roztworów wyjściowych, b) po dodaniu 10,0 cm
3
kwasu,
c) w PRM, d) po dodaniu 25,0 cm
3
roztworu HCl. Dobierz wskaźnik PRM. K
b
=1,8·10
-5
.
12. Oblicz zmianę pH w zakresie 99-101% zobojętnienia 20,0 cm
3
roztworu NaOH o c = 0,1025
mol/dm
3
roztworem kwasu octowego o stężeniu 0,2750 mol/dm
3
. K
a
= 1,75·10
-5
.
13. Oblicz zmianę pH w zakresie 99-101% zobojętnienia 20 cm
3
roztworu kwasu solnego
o stężeniu 0,225 mol/dm
3
roztworem amoniaku o stężeniu 0,345 mol/dm
3
. K
b
=1,8·10
-5
.
14. 20,0 cm
3
roztworu NaOH o c = 0,10 mol/dm
3
miareczkowano roztworem HNO
2
(K
a
= 5,0·10
-4
)
o stężeniu 0,20 mol/dm
3
. Oblicz pH roztworu: a) przed dodaniem kwasu, b) po dodaniu 5,0 cm
3
kwasu, c) w PRM, d) po dodaniu 20,0 cm
3
kwasu. Naszkicuj krzywą miareczkowania.
15. 20 cm
3
roztworu NH
3
o c = 0,12 mol/dm
3
(K
b
=1,8·10
-5
) miareczkowano roztworem HCl
o c = 0,15 mol/dm
3
. Oblicz pH roztworu: a) przed dodaniem kwasu, b) po dodaniu 8,0 cm
3
roztworu HCl, c) w PRM, d) po dodaniu 50,0 cm
3
roztworu HCl. Naszkicuj krzywą
miareczkowania.
Zadania z alkacymetrii (c.d.)

16. Oblicz pH roztworu octanu sodu o stężeniu c
s
= 0,5 mol/dm
3
. Jaka będzie wartość pH, jeżeli
do 50 cm
3
tego roztworu dodać:
a) 1 cm
3
roztworu HCl o c
HCl
= 0,1 mol/dm
3
,
b) 1 cm
3
roztworu NaOH o c
NaOH
= 0,1 mol/dm
3
? K
a
= 1,76·10
-5
.
17. Oblicz pH roztworu chlorku amonu o stężeniu c
s
= 0,5 mol/dm
3
. Jaka będzie wartość pH, jeżeli
do 50 cm
3
tego roztworu dodać:
a) 1 cm
3
roztworu HCl o c
HCl
= 0,1 mol/dm
3
,
b) 1 cm
3
roztworu NaOH o c
NaOH
= 0,1 mol/dm
3
? K
b
=1,8·10
-5
.
18. 1 cm
3
roztworu HCl o stężeniu 0,01 mol/dm
3
dodano do:
a) 50 cm
3
roztworu buforu octanowego, w którym: c
k
b
= 0,5 mol/dm
3
i c
s
b
= 0,75 mol/dm
3
b) 50 cm
3
roztworu buforu amonowego, w którym: c
z
b
= 0,75 mol/dm
3
i c
s
b
= 0,5 mol/dm
3
.
Oblicz pojemność buforową tych buforów. K
a
= 1,76·10
-5
, K
b
=1,8·10
-5
.
19. Oblicz pH roztworu otrzymanego w wyniku dodania do 50 cm
3
roztworu kwasu octowego
(K
a
= 1,76·10
-5
), o stężeniu 0,5 mol/dm
3
roztworu zasady sodowej o stężeniu 0,3 mol/dm
3
w
ilości:
a) 90 % potrzebnej do zobojętnienia tego kwasu
b) 105 % potrzebnej do zobojętnienia tego kwasu.
Zadania z alkacymetrii (c.d.)
Wyszukiwarka
Podobne podstrony:
więcej podobnych podstron