2010-03-19
1
ROZTWORY BUFOROWE
wpływ kwasów i zasad na pH i pojemność buforową
ustroju człowieka
Ćwiczenie 1
P. Niemiec 2010
Wszystkie reakcje biochemiczne zachodz
ące w organizmach żywych
wymaga
ją do swojego przebiegu odpowiedniej wartości pH.
Nawet niewielkie wahania pH mo
gą prowadzić do zaburzeń procesów
biochemicznych
Zachod
zące w komórkach procesy kataboliczne prowadzą do
zakwaszenia
komórek i płynu pozakomórkowego.
Zakwaszenie polega na gromadzeniu s
ię nadmiaru jonów H
+
,
których
głównym źródłem jest CO
2
,
CO
2
powstaje w licznych reakcjach katabolicznych, generowanych
przez
dekarboksylazy
(katalizuja
reakcję odłączania CO
2
)
ROZTWORY BUFOROWE
CO
2
+ H
2
O
H
2
CO
3
H
+
+ HCO
3
-
P. Niemiec 2010
ROZTWORY BUFOROWE
W regulacji gospodarki kwa-
sowo-zasadowej
uczestniczą:
- bufory
-
płuca
- nerki
-
wątroba
Układy buforowe
są głównym
mechanizmem zabezpiecza -
jącym przed zakwaszeniem
organizmu
P. Niemiec 2010
ROZTWORY BUFOROWE
Bufory posiada
ją
zdoln
ość buforowania
, czyli przeciwstawiania si
ę
zmianom pH po dodaniu do nich niewielkich il
ości kwasów lub zasad
Są to mieszaniny słabego kwasu i jego soli z mocną zasadą lub
mieszaniny
słabej zasady i jej soli z mocnym kwasem np.;
CH
3
COOH i CH
3
COONa
Wielk
ością charakteryzującą zdolność buforowania danego roztworu
jest
pojemn
ość buforowa
(im
większa tym większe zdolności buforowe)
pH
roztworów buforowych oblicza się wg. następującego wzoru
(równanie Hendersona - Hasselbalcha)
:
pK
k
= - log K
k
,
K
k
– stała dysocjacji kwasu
C
s
– stężenie soli,
C
k
– stężenie kwasu
k
s
k
s
k
k
C
C
lg
pK
C
C
lg
pK
pH
P. Niemiec 2010
ROZTWORY BUFOROWE
P. Niemiec 2010
ROZTWORY BUFOROWE

2010-03-19
2
36
.
7
)
CO
(mmol/L
1.2
)
HCO
(mmol/L
2
24
lg
1
.
6
pH
2
3
94
.
6
)
CO
(mmol/L
2
1.2
)
HCO
(mmol/L
2
24
lg
1
.
6
pH
2
3
P. Niemiec 2010
ROZTWORY BUFOROWE
pH roztworów buforowych zależy od pK kwasu i stosunku stężeń soli
do kwasu
najważniejszym buforem organizmu jest
bufor
wodorowęglanowy
(HCO
3
-
/CO
2
), dlatego pH osocza w warunkach fizjologicznych wynosi:
4
.
7
)
L
/
mmol
2
.
1
(
CO
)
L
/
mmol
24
(
HCO
lg
)
1
.
6
(
pK
pH
2
3
k
P. Niemiec 2010
ROZTWORY BUFOROWE
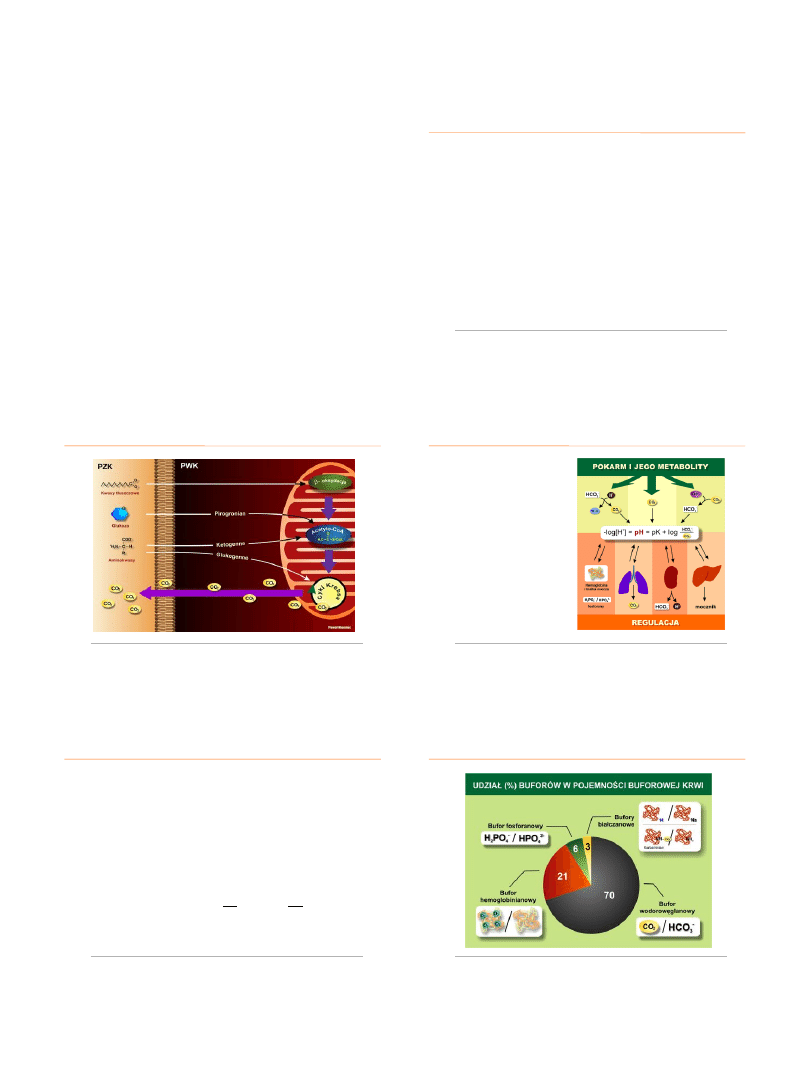
BUFOR WODORO
WĘGLANOWY
najw
ażniejszy bufor organizmu
jego metabolizm opisuje równanie
losy CO
2
- 75-80 % reaguje z H
2
O (reakcja katalizowana przez
anhydra
zę
węglanową
)
- 15 % tworzy p
ołączenia
karbaminianowe
z resztami aminokwasu
waliny bi
ałek (głównie hemoglobiny)
- 5-10% jest transportowane w postaci gazu rozpuszczonego w wodzie
przestrzeni wew
nątrzkomórkowej
Karbaminian
CO
2
+ H
2
O
H
2
CO
3
H
+
+ HCO
3
-
P. Niemiec 2010
ROZTWORY BUFOROWE
P. Niemiec 2010
BUFOR HEMOGLOBINIANOWY
– wymiana gazowa
CO
2
+ H
2
O
H
2
CO
3
H
+
+ HCO
3
-
P. Niemiec 2010
BUFOR HEMOGLOBINIANOWY
– wymiana gazowa
CO
2
+ H
2
O
H
2
CO
3
H
+
+ HCO
3
-
BUFOR FOSFORANOWY
najważniejszy pod względem ilościowym bufor moczu
stosunek H
2
PO
4
-
do HPO
4
2-
we krwi wynosi 1:4, w moczu wynosi 4:1
H
2
PO
4
-
HPO
4
2-
+ H
+
fosforany obecne w moczu pierwotnym warunkują:
- wydalanie H
+
-
powstawanie wodorowęglanów w nerkach
zmiana
stosunku
fosforanów w moczu w porównaniu z ich
stosunkiem we krwi wynika ze zmiany fosforanu II-
rzędowego (HPO
4
2-
)
w I-
rzędowy (H
2
PO
4
-
) przez
wiązanie H
+
podczas regeneracji
jonów
HCO
3
-
.
P. Niemiec 2010
ROZTWORY BUFOROWE
2010-03-19
3
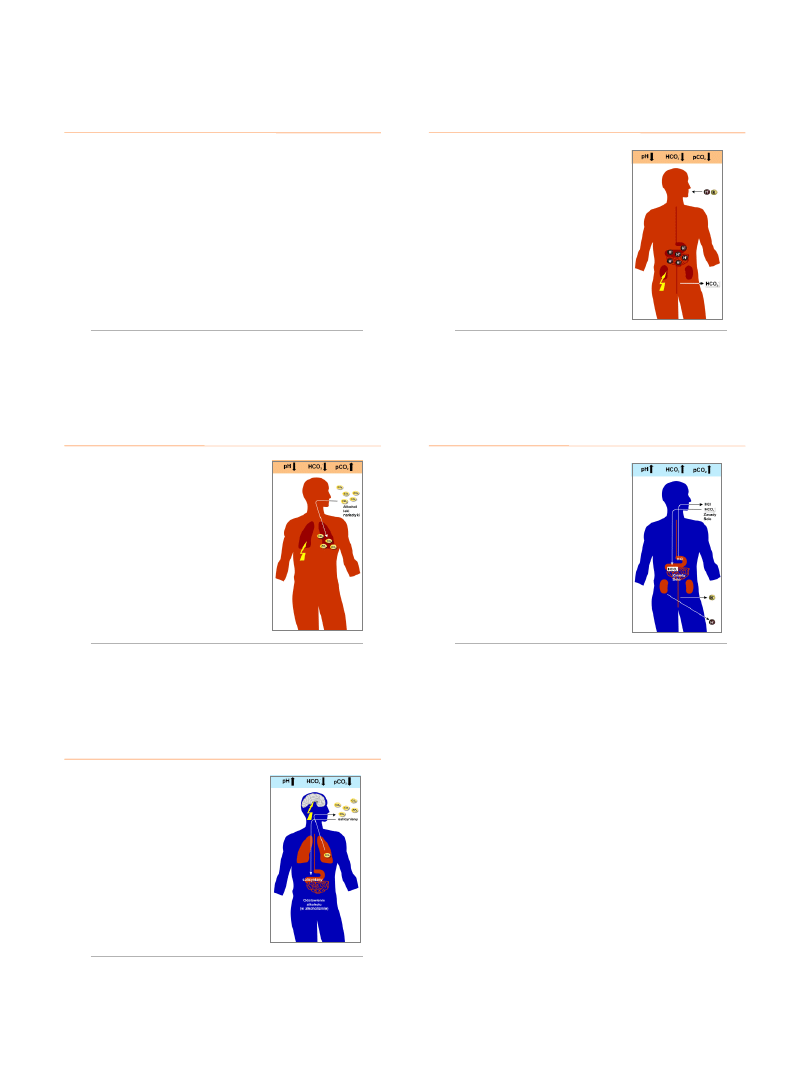
ROLA NEREK
w regulacji gospodarki kwasowo-zasadowej
-
eliminacja jonów H
+
z ustroju
-
resorpcja zwrotna HCO
3
-
w kanalikach nerkowych
-
wydalanie nadmiaru jonów HCO
3
-
przy wzroście ich stężenia
..
w płynie pozakomórkowym
-
regeneracja
jonów HCO
3
-
P. Niemiec 2010
ROZTWORY BUFOROWE
NAGROMADZENIE
SIĘ KWASÓW
- endogennych (np.
ketokwasów w cukrzycy)
- L-mlekowego (podczas hipoksji lub anoksji)
- D-mlekowego (fermentacja flory bakteryjnej)
UTRATAZASAD
-
niewydolność nerek (brak wytwarzania HCO
3
-
.....
i
niemożność jego regeneracji)
- utrata HCO
3
-
z przewodem pokarmowym
....
.
(biegunki)
NADMIERNA
PODAŻ K
+
KWASICA METABOLICZNA
ZABURZENIA GOSPODARKI KWASOWO-ZASADOWEJ
P. Niemiec 2010
ROZTWORY BUFOROWE
ZMNIEJSZONA WENTYLACJA PĘCHERZYKOWA
-
oddychanie powietrzem o dużym stężeniu CO
2
-
zniszczenie miąższu płuc
-
unieruchomienie mięśni oddechowych
-
przedawkowanie leków przeciwbólowych
-
zatrucie alkoholem, morfiną, barbituranami
KWASICA ODDECHOWA
ZABURZENIA GOSPODARKI KWASOWO-ZASADOWEJ
P. Niemiec 2010
ROZTWORY BUFOROWE
ZASADOWICA METABOLICZNA
NIEDOBÓR NaCl, KCl, H
+
-
utrata kwaśnej treści żołądka (np. wymioty)
-
nadmierna utrata kwasów z moczem
-
utrata potasu z kałem
-
nadmierna podaż zasad doustnie lub
.....
pozajelitowo
-
nadmierna podaż soli organicznych
ZABURZENIA GOSPODARKI KWASOWO-ZASADOWEJ
P. Niemiec 2010
ROZTWORY BUFOROWE
ZASADOWICA ODDECHOWA
ZWIĘKSZONA WENTYLACJA PĘCHERZYKOWA
-
zapalenie mózgu i opon mózgowych
-
nowotwory mózgu
-
nagłe odstawienie alkoholu w przewlekłym
.....
alkoholizmie
- zatrucie salicynianami
- stany nerwicowe
ZABURZENIA GOSPODARKI KWASOWO-ZASADOWEJ
P. Niemiec 2010
ROZTWORY BUFOROWE
Wyszukiwarka
Podobne podstrony:
01 roztwory buforoweid 2924 Nieznany
01 roztwory buforoweid 2924 Nieznany
22 01 2011 TEST A 2id 29465 Nieznany
01 roztwory buforowe
01 2id 2523 Nieznany (2)
01 Wprowadzenie 2id 2982 Nieznany (2)
2013 01 15 ustawa o srodkach pr Nieznany
102 106 SUPLEMENT 53 2id 11668 Nieznany
2 PE 2012 2id 21154 Nieznany (2)
1 Wprowadzenie 2id 8727 Nieznany (2)
01 badanie sieci 3fid 3055 Nieznany (2)
IS wyklad 14 15 01 09 MDW id 22 Nieznany
014 2id 3218 Nieznany (2)
1informatyka 2id 19002 Nieznany (2)
28 01 2014 Lechowski id 31904 Nieznany (2)
więcej podobnych podstron