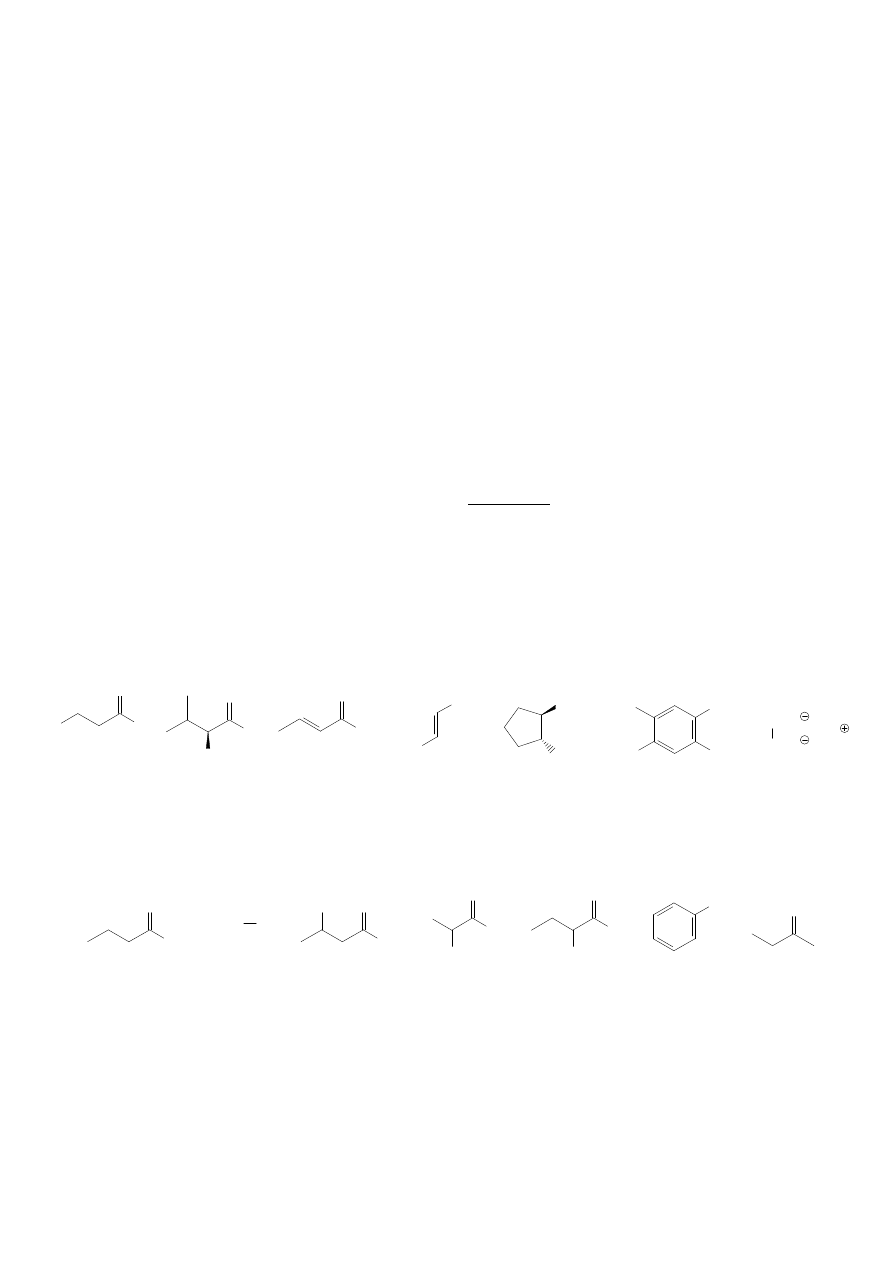
13. Kwasy karboksylowe.
(konwersatorium, gr. D1 – Chemia, II rok, 2011/2012Z)
Zagadnienia
a) Nazewnictwo systematyczne i zwyczajowe kwasów karboksylowych i ich soli.
b) Struktura grupy karboksylowej. Wiązania wodorowe w cząsteczkach kwasów karboksylowych. Wpływ
podstawienia kwasów alifatycznych oraz aromatycznych (w szczególności pochodnych kwasu
benzoesowego) na stopień ich kwasowości.
c) Otrzymywanie kwasów karboksylowych: a) utlenianie alkoholi I-rz. lub aldehydów (→kwasy alifatyczne;
/np. Na
2
Cr
2
O
7
/H
2
SO
4
lub KMnO
4
/); b) utlenianie łańcuchów bocznych alkilobenzenów zawierających I lub
II-rz. grupy alkilowe (→pochodne kwasu benzoesowego /Na
2
Cr
2
O
7
, H
2
SO
4
, ogrzew. lub KMnO
4
, H
2
O,
ogrzew.); c) utleniające rozszczepienie wiązania C=C w alkenach posiadających przynajmniej jeden
winylowy atom wodoru (→kwasy karboksylowe lub mieszanina kw. karboksylowego i ketonu /stęż.
KMnO
4
, ogrzew./); d) ozonoliza lub utlenianie alkinów (1. O
3
, 2. H
2
O lub stęż. KMnO
4
); e) kwasowa lub
zasadowa hydroliza nitryli (H
+
/H
2
O, lub
-
OH/H
2
O); f) karboksylowanie związków Grignarda (CO
2
).
d) Reakcje kwasów karboksylowych: a) deprotonowanie (→sole kwasów karboksylowych); b) redukcja do
alkoholi I-rz. (1. LiAlH
4
, 2.H
3
O
+
lub BH
3
·THF); c) redukcja do aldehydów (1. SOCl
2
,
2. LiAl[OC(CH
3
)
3
]
3
H); d) alkilowanie kwasów z utworzeniem ketonów (1. R−Li (2 mole), 2. H
3
O
+
);
e) substytucja nukleofilowa w grupie acylowej [→chlorki kwasowe /SOCl
2
lub (COCl)
2
/; →bezwodniki
kwasowe /chlorek kwasowy+kwas karboksylowy lub anion karboksylanowy/; →estry /kwas
karboksylowy+alkohol, kat. H
+
(estryfikacja Fischera, mechanizm!) lub anion karboksylanowy+alifatyczny
halogenek I-rz. (S
N
2)/; →amidy /kwas karboksylowy+amoniak lub amina, wysoka temperatura – metoda
małoefektywna i rzadko stosowana/]; f) substytucja elektrofilowa w kwasach aromatycznych;
g) α-bromowanie – reakcja Hella-Volharda-Zielinskiego (reakcja HVZ; przykład substytucji w pozycji α
/Br
2
, PBr
3
/).
Zadania
1. Nazwij poniższe związki.
a)
b)
c)
d)
f)
g)
e)
Br
O
OH
O
OH
COOH
COOH
COOH
NO
2
H
3
C
Br
COOH
HOOC
Mg
2
COO
COO
O
OH
Ph
2. Narysuj wzory strukturalne następujących związków.
a) kwas chlorooctowy
b) kwas ftalowy
c) kwas bursztynowy
d) mrówczan magnezu
e) benzoesan sodu
f) kwas acetylooctowy
3. Uszereguj poniższe związki w kolejności rosnącej kwasowości.
a)
b)
c)
d)
e)
g)
f)
O
OH
CH
3
OH
O
OH
Cl
OH
O
OH
Cl
Cl
O
OH
Cl
O
4. W każdej z podanych grup ułóż związki w szeregu malejącej kwasowości.
I. a) kw. p-toluenosulfonowy b) kw. octowy c) kw. bromooctowy;
II. a) kw. benzoesowy b) kw. o-nitrobenzoesowy c) kw. m-nitrobenzoesowy
III. a) kw. p-metylobenzoesowy b) kw. p-chlorobenzoesowy c) kw. p-aminobenzoesowy
5. W każdej z podanych par związków wskaż silniejszą zasadę.
a) CH
3
COO
-
, ClCH
2
COO
-
;
b) acetylenek (etynid) sodu, octan sodu;
c) octan sodu, etanolan sodu.

6. Przedstaw produkty poniższych reakcji.
a)
b)
c)
d)
e)
Na
2
Cr
2
O
7
, H
2
SO
4
f)
g)
h)
i)
k)
l)
j)
COOH
1. LiAlH
4
2. H
3
O
CH
2
Br
2. H
3
O
1. NaCN
COOH
1. SOCl
2
2. AlCl
3
okt-4-yn
CH
2
OH
CH
2
OH
KMnO
4
, H
2
O
(stęż., gorący)
(stęż., ciepły)
KMnO
4
, H
2
O
KMnO
4
, H
2
O
(stęż., ciepły)
Br
O
O
2. CO
2
1. Mg, eter
3. H
3
O
COOH
CH
3
COOH
NH
3
t. pok.
O
OH
OH
H
1. O
3
2. H
2
O
O Na
O
m)
CH
3
Br
butan-2-ol, H
7. Zaproponuj możliwe drogi realizacji poniższych, kilkuetapowych syntez.
a)
OH
Ph
O
OH
Ph
b)
COOH c)
COOH
d)
O
Br
O
COOH
e)
O
OH
O
H
Br
Wyszukiwarka
Podobne podstrony:
Theory and practise of teaching history 18.10.2011, PWSZ, Theory and practise of teaching history
przez 13 KWASY KARBOKSYLOWE2
INFRASTRUKTURA MIEJSKA 18 10 2011
Kultura - wykład - 18.10.2011 W, Notatki filologia angielska
Podstawy pedagogiki - 18.10.2011, APS pedagogika specjalna
13 Kwasy karboksylowe
Pedagogika Specjalna - 18.10.2011, APS pedagogika specjalna
Wykład 1 renaturyzacja z 18.10.2011, Ochrona Środowiska pliki uczelniane, Renaturyzacja wód
13 Kwasy karboksylowe materiały dodatkowe
INFRASTRUKTURA MIEJSKA 18.10.2011, Ochrona Środowiska, semestr VII, INFRASTRUKTURA MIEJSKA, infrastr
przez 13 KWASY KARBOKSYLOWE2
Dyskusja - 13.10.2011 W, Notatki filologia angielska
Materiały do wykładu 2 (13 10 2011)
18 xii 2011 godz 13 probka 1
18 xii 2011 godz 13 probka 2
C5 (X7) C4CG011GP0 2 13 10 2011 Demontaż Montaż Uszczelki Na tylnych drzwiach
Historia wykład 13 10 2011 W
PRK 23 10 2011 org
więcej podobnych podstron