
1
Wydział Inżynierii Procesowej i Ochrony Środowiska
Katedra Systemów Inżynierii Środowiska
L
ABORATORIUM Z
C
HEMII
D
LA STUDENTÓW
K
IERUNKU
BHP

2
HARMONOGRAM
ZAJĘĆ
PRACOWNI
Z
CHEMII
Kierunek: BHP. II semestr; Wymiar: 30godz; 7 pracowni po 4godz.+ 2godz.
1. Przepisy BHP. Odebranie szafek laboratoryjnych .Wstęp do laboratorium.
Przygotowanie roztworu: kwasu solnego
2. Kolokwium 1 – Identyfikacja kationów grupy I -III
3. Kolokwium 2 – Identyfikacja kationów grup IV-V i anionów
4. Kolokwium 3- Alkacymetria. Oznaczanie wodorotlenku sodu.
5. Kolokwium 4- Kompleksometria. Oznaczanie cynku.
6. Kolokwium 5- Spektrofotometria. Spektrofotometryczne oznaczanie żelaza(III)
metodą tiocyjanianową.
7. Termin rezerwowy - 1.
8. Termin rezerwowy - 2. Zdanie sprzętu.
Zaliczenie ćwiczeń.
OBOWIĄZUJĄCY ZAKRES MATERIAŁU
I. Podstawowe wiadomości z chemii wymagane od studentów niezbędne do rozpoczęcia
laboratorium.
1. Układ okresowy: pojęcie pierwiastka, liczba atomowa i masowa, podział pierwiastków na
bloki pierwiastków, grupy i szeregi. Znajomość nazw, symboli i stopnia utlenienia
pierwiastków grup głównych układu okresowego oraz wybranych pierwiastków bloku-d
(chrom, mangan, żelazo, kobalt, nikiel, miedź, cynk, srebro, kadm, złoto, rtęć). Metale,
niemetale i semimetale. Tlenki kwasowe, zasadowe i amfoteryczne. Własności kwasowe i
zasadowe pierwiastków.
2. Znajomość nazw i wzorów podstawowych kwasów, zasad i soli. Umiejętność pisania
reakcji powstawania soli, kwasów i zasad. Dysocjacja elektrolityczna kwasów, zasad i soli.
Stopień dysocjacji elektrolitów. Podział na mocne i słabe elektrolity. Hydroliza soli.
3. Jednostka atomowa masy. Definicja mola i masy molowej.
4. Stężenie roztworów: procentowe i molowe. Przygotowywanie roztworów o określonym
stężeniu molowym i procentowym. Mieszanie, rozcieńczanie i zatężanie roztworów.

3
II. Kolokwium 1 - Identyfikacja kationów grup I-III
1. Rodzaje odczynników stosowanych w analizie jakościowej
2. Cele i zadania analizy jakościowej.
3. Podział kationów na grupy analityczne-odczynniki grupowe. Dokładne warunki
wytrącania kationów grup I-III. Tioacetamid, jako odczynnik grupowy.
4. Reakcje charakterystyczne wykrywanych kationów Ag
+
, Pb
2+
, Cu
2+
, Hg
2+
, Mn
2+
, Fe
3+
,
(odczynnik grupowy danego kationu i jego działanie, reakcje charakterystyczne danego
kationu, równania reakcji, kolory osadów, rozpuszczalność osadów).
III. Kolokwium 2 – Identyfikacja kationów grup IV-V i anionów
1. Odczynniki grupowe i reakcje charakterystyczne wykrywanych kationów grup IV-V: Ca
2+
,
NH
4
+
, K
+
.(odczynnik grupowy danego kationu i jego działanie, reakcje charakterystyczne
danego kationu, równania reakcji, kolory osadów, rozpuszczalność osadów)
2. Podział anionów na grupy analityczne.
3. Reakcje charakterystyczne chlorków, siarczanów(VI), azotanów(V) i fosforanów(V).
(odczynnik grupowy danego anionu i jego działanie, reakcje charakterystyczne danego
kationu, równania reakcji, kolory osadów, rozpuszczalność osadów)
IV. Kolokwium 3 - Alkacymetria
1. Analiza miareczkowa.
Podział metod miareczkowych według rodzaju titrantu oraz
sposobu prowadzenia miareczkowania. Błędy w analizie miareczkowej.
2. Obliczenia w analizie miareczkowej - obliczenia na podstawie stechiometrii reakcji
i stężenia molowego. Umiejętność rozwiązywanie zadań z zakresu alkacymetrii.
3. Alkacymetria. Reakcje kwas-zasada, reakcje zobojętniania i hydrolizy. Teoria Arrheniusa,
stała dysocjacji, stopień dysocjacji, stała i stopień hydrolizy, prawo rozcieńczeń Ostwalda.
Teoria kwasów i zasad wg Brönsteda. Iloczyn jonowy wody, definicja i obliczanie pH.
Wskaźniki kwasowo-zasadowe według teorii Ostwalda. Krzywe miareczkowania:
mocnego kwasu mocną zasadą, mocnej zasady mocnym kwasem, słabego kwasu
mocną zasadą, słabej zasady mocnym kwasem, słabego kwasu słabą zasadą,
wieloprotonowych kwasów i zasad. Punkt równoważnikowy i punkt końcowy.
Roztwory buforowe, pojemność buforowa, obliczanie pH roztworów buforowych.
Roztwory mianowane, substancje wzorcowe do mianowania kwasów i zasad.
4. Oznaczanie wodorotlenku sodowego. Wyprowadzenie wzorów na: miano kwasu solnego
ustawiane na węglan sodowy oraz na masę NaOH w próbie.

4
V. Kolokwium 4 - Kompleksometria
1. Charakterystyka metody: ogólny schemat reakcji, metale oznaczane tą metodą.
Kompleksometria, chelatometria, kompleksonometria.
2. Pojęcia podstawowe w kompleksometrii: atom centralny, liczba koordynacyjna. Ligandy
jedno i wielofunkcyjne, sól
kompleksowa, sfera
koordynacji, kompleksy
homoligandowe i chelatowe.
3. Trwałość kompleksów. Stała trwałości. Kompleksy bierne i labilne. Czynniki
wpływające na trwałość kompleksów.
4. Kompleksy chelatowe. Kompleksony. Kwas etylenodiaminotetraoctowy i jego sól
disodowa. Czynniki wpływające na trwałość kompleksu z EDTA (pH, stopień
utlenienia, rodzaj atomów donorowych, konfiguracja elektronowa).
5. Wskaźniki kompleksometryczne i ich podział (czerń eriochromowa T, mureksyd)
6. Metody miareczkowania roztworem EDTA (bezpośrednie, odwrotne, podstawieniowe).
Przykłady oznaczeń.
7. Kompleksometryczne oznaczanie cynku. Wyprowadzenie wzoru na masę cynku w badanej
próbie.
8. Umiejętność rozwiązywania zadań z zakresu kompleksometrii.
VI. Kolokwium 5 - Spektrofotometria
1. Co to jest światło białe i monochromatyczne?
2. Jaka jest zależność między absorpcją promieniowania a barwą substancji?
3. Długość fali promieniowania. Zakres ultrafioletowy i widzialny widma
4. Na czym polega zjawisko absorpcji światła w roztworach związków chemicznych?
5. Co się dzieje w cząsteczkach związku chemicznego, gdy absorbują światło z zakresu
widzialnego i ultrafioletu?
6. Widmo elektronowe związku (zależność absorbancji od długości fali).
7. Co to są chromofory i auksochromy?
8. Absorbancja i transmitancja.
9. Prawo Lamberta-Beera: warunki stosowalności i odchylenia.
10. Metoda krzywej wzorcowej.
11. Budowa i działanie spektrofotometru.
12. Kolorymetryczne oznaczanie żelaza
13. Umiejętność rozwiązywania zadań z zakresu spektrofotometrii.

5
Literatura do kolokwium:
1. Instrukcja: „Laboratorium z chemii”
2. B. Jankiewicz, I. Ludomirska, A. Korczyński - Analiza jakościowa. Skrypt Politechniki
Łódzkiej, Łódź 1994.
3. K. Badowska-Olenderek, J. Czyżewski, J. Naumczyk - Laboratorium podstaw chemii
analitycznej. Oficyna Wydawnicza Politechniki Warszawskiej, Warszawa 1997.
4. T. Lipiec, Z. S. Szmal - Chemia analityczna z elementami analizy instrumentalnej. PZWL,
Warszawa 1972.
5. F. Domka, J. Jasiczak – Chemia ogólna: analiza jakościowa, (II wydanie), Wydawnictwo
Akademii Ekonomicznej w Poznaniu, Poznań 2004.
6. W. N. Aleksiejew - Analiza jakościowa. /IV wydanie/, PWN, Warszawa 1968.
7. J. Masłowska, R. Sołoniewicz – Schematy analizy jakościowej kationów /III wydanie/,.
Skrypt Politechniki Łódzkiej, Łódź 1994.
8. A. Cygański „Metody spektroskopowe w chemii analitycznej" WNT(1993)
9. A. Cygański „Chemiczne metody analizy ilościowej” WNT(1987), (1992),(1994)
10. A. Cygański, R. Sołoniewicz, „Laboratorium analizy ilościowej" tom 1, 2 i 3
Skrypt Politechniki Łódzkiej.
11. J. Minczewski, Z. Marczenko „Chemia analityczna” tom 1-3, PWN
12. D. A. Skoog, D. M. West, F. James Holler, S. R. Grouch, “Podstawy chemii analitycznej” , t.1, 2
PWN 2006.
13. A. Persona, „Chemia analityczna. „Podstawy klasycznej analizy ilościowej” Medyk 2007.

6
Wiadomości wstępne:
JAKOŚCIOWA I ILOŚCIOWA ANALIZA NIEORGANICZNA
Przedmiot chemii analitycznej. Cel i metody analizy chemicznej.
Definicja chemii analitycznej:
Jest to nauka stosowana, zajmująca się odkrywaniem i formułowaniem zasad, kryteriów
i metod umożliwiających ustalenie z określoną czułością, precyzją i dokładnością
jakościowego i ilościowego składu obiektów materialnych.
Chemia analityczna ma dwa cele:
Cel praktyczny: ustalenie składu obiektów materialnych
Cel podstawowy: badania nad opracowaniem nowych metod analitycznych
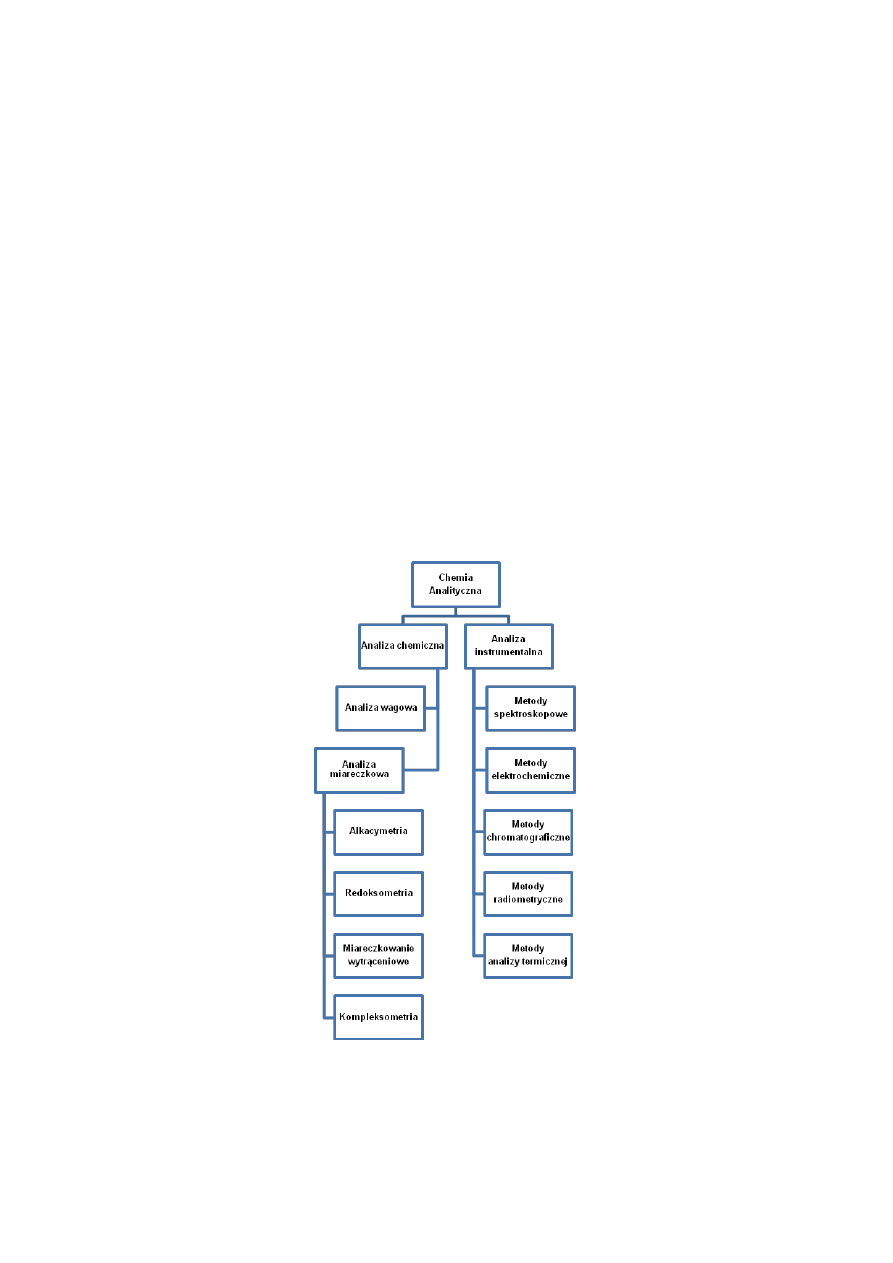
Cel praktyczny chemii analitycznej dokonuje się poprzez:
Analizę chemiczną
Analizę instrumentalną.
Metody analizy chemicznej i instrumentalnej stosuje się do:
Identyfikacji składników badanej substancji (analiza jakościowa)
Określenie składu ilościowego badanej substancji (analiza ilościowa).
Metody analizy chemicznej zwane także klasycznymi wykorzystują odpowiednie reakcje
chemiczne, które pozwalają wykryć i oznaczyć ilościowo badany składnik (analit).
Metody analizy instrumentalnej wykorzystują charakterystyczne właściwości fizyczne
lub fizykochemiczne substancji do jej identyfikacji i ilościowego oznaczenia. Do metod
instrumentalnych
analizy
należą
metody
spektroskopowe,
elektrochemiczne,
chromatograficzne, radiometryczne i analizy termicznej.
Metody chemiczne są często pomocne w analizie instrumentalnej i tylko umiejętne
posługiwanie się metodami klasycznymi, jak i instrumentalnymi zapewnia prawidłowe
wykonanie zadań analitycznych.
Wśród chemicznych metod analizy jakościowej istnieje podział na:
Analizę przeprowadzaną "na sucho", polegającą na badaniu substancji bez
przeprowadzania jej do roztworu (np. charakterystyczne barwienie płomienia, stapianie
z sodą, zachowanie podczas prażenia),
Analizę przeprowadzaną "na mokro", w której badane składniki (jony) znajdują się
w toku analizy w roztworze.
W analizie "na mokro" wykorzystuje się reakcje chemiczne o czułości od 50 do
0.001
g/cm
3
. Przebiegają one między składnikami badanymi (jonami) a stosowanymi
odczynnikami.
Odczynniki można podzielić na:
Specyficzne, dające w określonych warunkach reakcję tylko z danym jonem
(tzn. umożliwiające wykrycie go w obecności innych); jest ich bardzo niewiele,

7
Selektywne, reagujące podobnie z pewną grupą jonów,
Maskujące, wiążące w trwały związek jon uboczny (przeszkadzający) i wyłączające go
z udziału w roztworze,
Grupowe, wykazujące zdolność wytrącania określonej kategorii jonów z roztworu w
pewnych warunkach i umożliwiające podział ich na tzw. grupy analityczne,
Charakterystyczne, za pomocą, których dokonuje się identyfikacji jonów wewnątrz
grupy analitycznej.
Podział analizy jakościowej na analizę kationów i anionów, a tych na grupy analityczne,
stanowi duże ułatwienie w przebiegu analizy.
W analizie chemicznej wykorzystywane są odpowiednie reakcje chemiczne, które pozwalają
oznaczyć daną substancje w postaci osadu (metody wagowe) lub ustalić koniec przebiegu
reakcji, a następnie wyciągnąć wnioski o ilości oznaczanej substancji
Metody analizy chemicznej można podzielić w zależności od typu reakcji na metody:
Analizy wagowej (grawimetrycznej), w której wykorzystuje się reakcje wytrącania
trudno rozpuszczalnych osadów. Osad zawierający oznaczany analit wydziela się
z roztworu, suszy się lub praży, a następnie waży się na wadze analitycznej.
Na podstawie zachodzącej reakcji wytrącania i masy osadu można określić ilość
oznaczanego osadu.
Analizy miareczkowej (metody analizy objętościowej). Metody polegają na
pomiarze objętości roztworu standardowego (titrant) dodawanego powoli z biurety
w procesie miareczkowania. Roztwór standardowy reaguje z oznaczanym analitem,
a koniec reakcji ustala się przy pomocy odpowiedniego wskaźnika. W oparciu
o objętość zużytego roztworu titranta i jego stężenie wylicza się ilość analitu.
W zależności od typu reakcji analizę miareczkową dzielimy na cztery podstawowe działy:
Alkacymetrię
Redoksometrię
Miareczkowanie wytrąceniowe
Kompleksometrię
Alkacymetria wykorzystuje reakcje zobojętniania kwas-zasada i dzieli się na:
Alkalimetrię – oznaczanie substancji przez miareczkowanie mianowanym roztworem
zasady
Acydymetrię – oznaczanie substancji przez miareczkowanie mianowanym roztworem
kwasu
Redoksometria wykorzystuje rekcje utlenienia-redukcji i ogólnie stosuje się do oznaczania
reduktorów lub utleniaczy. Miareczkowanie redoksometryczne dzieli się na:
Oksydymetrię – oznaczanie substancji przez miareczkowanie roztworami utleniaczy
• Manganometria (titrant KMnO
4
)
• Jodometria (I
2
, Na
2
S
2
O
3
)
• Bromianometria (KBrO
3
)
• Jodanometria (KIO
3
)
• Chromianometria (K
2
Cr
2
O
7
)
• Cerometria (Ce(SO
4
)
2
)
Reduktometrię – oznaczanie substancji przez miareczkowanie reduktorami
8
• Ferometria (FeSO
4
)
• Tytanometria (TiCl
3
)
• Askorbinometria (witamina C (kwas askorbinowy))
Miareczkowanie wytrąceniowe wykorzystuje reakcje wytrącania trudno rozpuszczalnych
osadów w wyniku łączenia jonów titrantu i substancji oznaczanej. Najbardziej znane
miareczkowania wytrąceniowe to:
• argentometria AgNO
3
, NH
4
SCN
• merkurometria Hg
2
(NO
3
)
2
Miareczkowanie kompleksometryczne polega na reakcji tworzenia, rozpuszczalnych, słabo
zdysocjowanych (trwałych) związków kompleksowych. Dzieli się na:
•
Miareczkowania chelatometryczne – miareczkowanie kompleksonometryczne, w
którym stosuje się do miareczkowania związki organiczne zwane kompleksonami
(pochodne kwasów aminopolikarboksylowych jak EDTA (sól disodowa kwasu
etylenodiaminotetraoctowego))
•
Miareczkowania niechelatometryczne np. merkurometryczne Hg(NO
3
)
2
P
ODZIAŁ METOD CHEMII ANALITYCZNEJ

9
Ć
WICZENIE NR
1:
Identyfikacja kationów grup I-III: Ag
+
, Pb
2+
, Cu
2+
, Hg
2+
,Mn
2+
i Fe
3+
1.
P
ODZIAŁ KATIONÓW NA GRUPY ANALITYCZNE
Podstawą klasyfikacji analitycznej kationów jest podział kationów na odpowiednie
grupy analityczne, który umożliwia systematyczny tok analizy kationów. Podstawą podziału
są reakcje tworzenia trudno rozpuszczalnych osadów oznaczanych kationów z
odczynnikami grupowymi takimi jak kwas solny, siarkowodór, siarczek amonu, węglan
amonu. Głównym celem stosowania tych odczynników jest dokładne oddzielenie
analitycznych grup kationów z mieszaniny kationów. Zastosowanie właściwego odczynnika
grupowego pozwala szybko wykazać obecność lub brak jonów danej grupy w badanej próbce
roztworu.
Klasyczny podział 28 najczęściej występujących kationów, dokonany przez
C. R. Freseniusa, obejmuje pięć następujących grup analitycznych:
I grupa analityczna (grupa kwasu solnego).
Do tej grupy zaliczamy jony
Ag
+
, Pb
2+
, Hg
2
2+
, które w reakcji z 2 mol/dm
3
(2 M)
1
kwasem chlorowodorowym HCl,
tworzą w roztworze trudno rozpuszczalne chlorki. Chlorki są nierozpuszczalne w
rozcieńczonych kwasach mineralnych z wyjątkiem chlorku ołowiu(II) PbCl
2
, który
rozpuszcza się w gorącej wodzie. Siarczki tych kationów nie rozpuszczają się w
rozcieńczonych kwasach.
II grupa analityczna (grupa siarkowodoru).
Do tej grupy należą kationy:
Hg
2+
, Pb
2+
, Cu
2+
, Bi
3+
, Cd
2+
, As(III)
2
, As(V), Sb(III), Sb(V), Sn(II) i Sn(IV) wytrącane w
roztworze przez siarkowodór H
2
S z kwaśnego roztworu (0.2-0.3 M HCl pH~0.5
3
).
III grupa analityczna (grupa siarczku amonu).
Obejmuje kationy Al
3+
,
Cr
3+
, Fe
3+
, Co
2+
, Ni
2+
, Mn
2+
, Zn
2+
, których siarczki są trudno rozpuszczalne w wodzie, ale
łatwo rozpuszczalne w rozcieńczonych kwasach, dlatego siarczki tej grupy nie mogą być
wytrącone razem z katonami I i II grupy. Jony Al
3+
i Cr
3+
pod wpływem odczynnika
grupowego tworzą, zamiast siarczków , trudno rozpuszczalne wodorotlenki. Odczynnikiem
grupowym III grupy jest siarczek amonowy (NH
4
)
2
S, w środowisku alkalicznym,
obecność buforu amonowego (NH
3
·H
2
O + NH
4
Cl), który wytrąca odpowiednie siarczki lub
wodorotlenki Al(OH)
3
i Cr(OH)
3
.
IV grupa analityczna (grupa węglanu amonowego).
Występujące w tej
grupie jony: Ca
2+
, Sr
2+
, Ba
2+
są wytrącane przez (NH
4
)
2
CO
3
w obecności buforu
amonowego (NH
3
·H
2
O + NH
4
Cl) w postaci trudno rozpuszczalnych węglanów.
1
2 M oznacza stężenie molowe 2 mol/dm
3
2
Oznaczenie liczbą rzymską wskazuje ze pierwiastek może być obecny w roztworze w postaci anionu
3
pH= -log[H
+
]: ujemny logarytm stężenia jonów wodorowych w roztworze
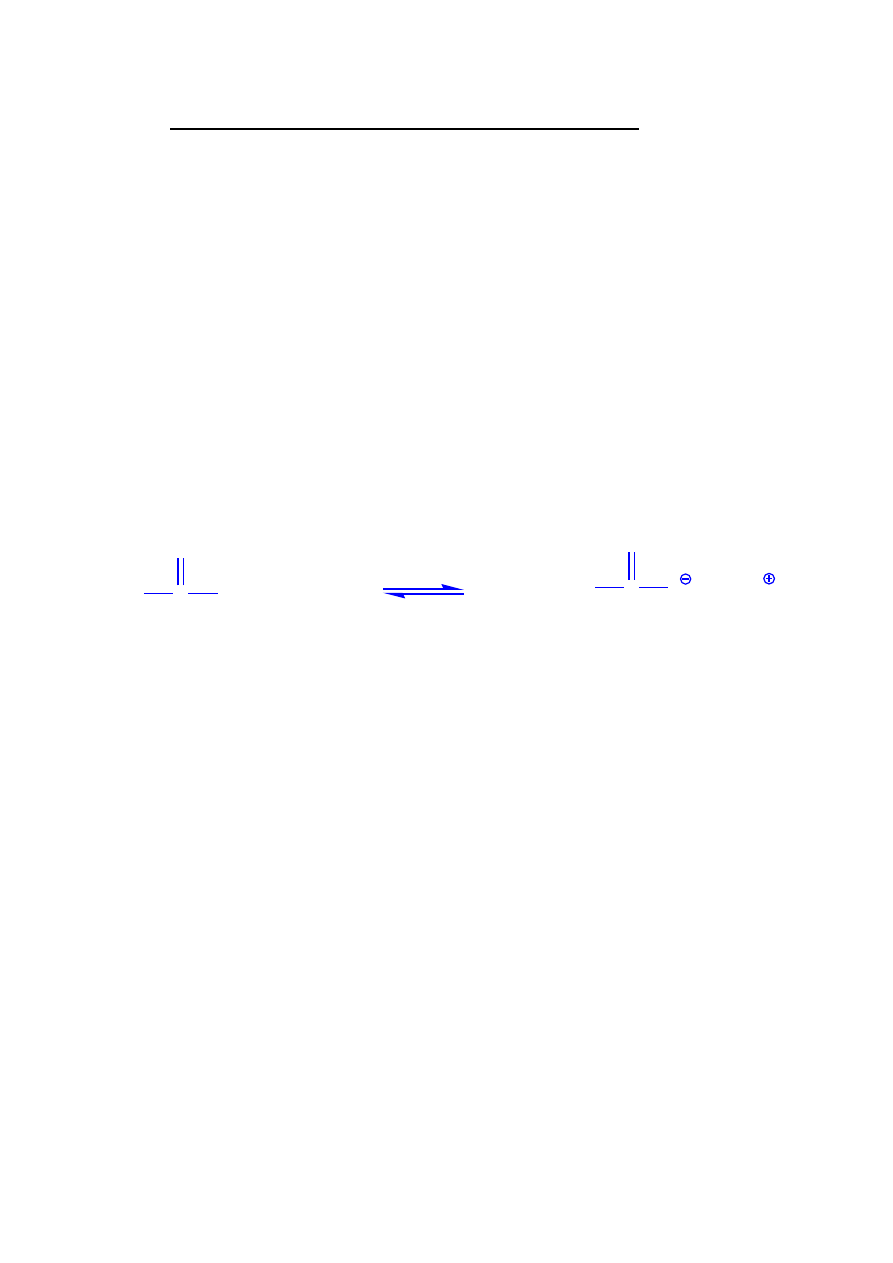
10
V grupa analityczna (brak odczynnika grupowego).
Do grupy zaliczane
są kationy: Na
+
, K
+
, NH
4
+
, Mg
2+
, które pozostają w roztworze po kolejnym oddzieleniu
kationów grup I-IV. Jony tej grupy nie mają odczynnika grupowego. Chlorki, siarczki
i węglany kationów tej grupy są rozpuszczalne w wodzie. Wyjątek stanowi zasadowy
węglan dihydroksymagnezu Mg
2
(OH)
2
CO
3
, który jest trudno rozpuszczalny w wodzie, ale
łatwo jest rozpuszczalny w roztworach soli amonowych i nie ulega wytrąceniu, jeżeli do
roztworu doda się NH
4
Cl.
Współcześnie tok analizy kationów oparty jest na stosowaniu 0.5 M wodnego roztworu
tioacetamidu zamiast siarkowodoru i siarczku amonu. Związki siarkowodoru są bardziej
szkodliwe dla zdrowia, charakteryzują się wyjątkowo przykrym zapachem.
Tioacetamid hydrolizuje w środowisku kwaśnym lub alkalicznym, podczas ogrzewania, z
utworzeniem siarkowodoru, który w chwili powstania wytrąca osady odpowiednich
siarczków. Ten sposób wytrącania siarczków z roztworów homogenicznych daje siarczki o
zwartej,
grubokrystalicznej
strukturze,
łatwe
do
sączenia
i
przemywania,
co ułatwia analizę. Poza tym tioacetamid jest mniej toksyczny od siarkowodoru.
H
3
C
C
S
NH
2
+
2 H
2
O
H
2
S
+ H
3
C
C
O
O
+
NH
4
tioacetamid
H
+
lub OH
-
Przy omawianiu reakcji charakterystycznych w poszczególnych grupach
analitycznych uwzględniono tylko niektóre kationy: Ag
+
, Pb
2+
, Cu
2+
, Hg
2+
, Mn
2+
,
Fe
3+
, Ca
2+
,
NH
4
+
i K
+
.
Szczegółowy podział kationów na grupy analityczne przedstawiono jest na
poniższym schemacie.
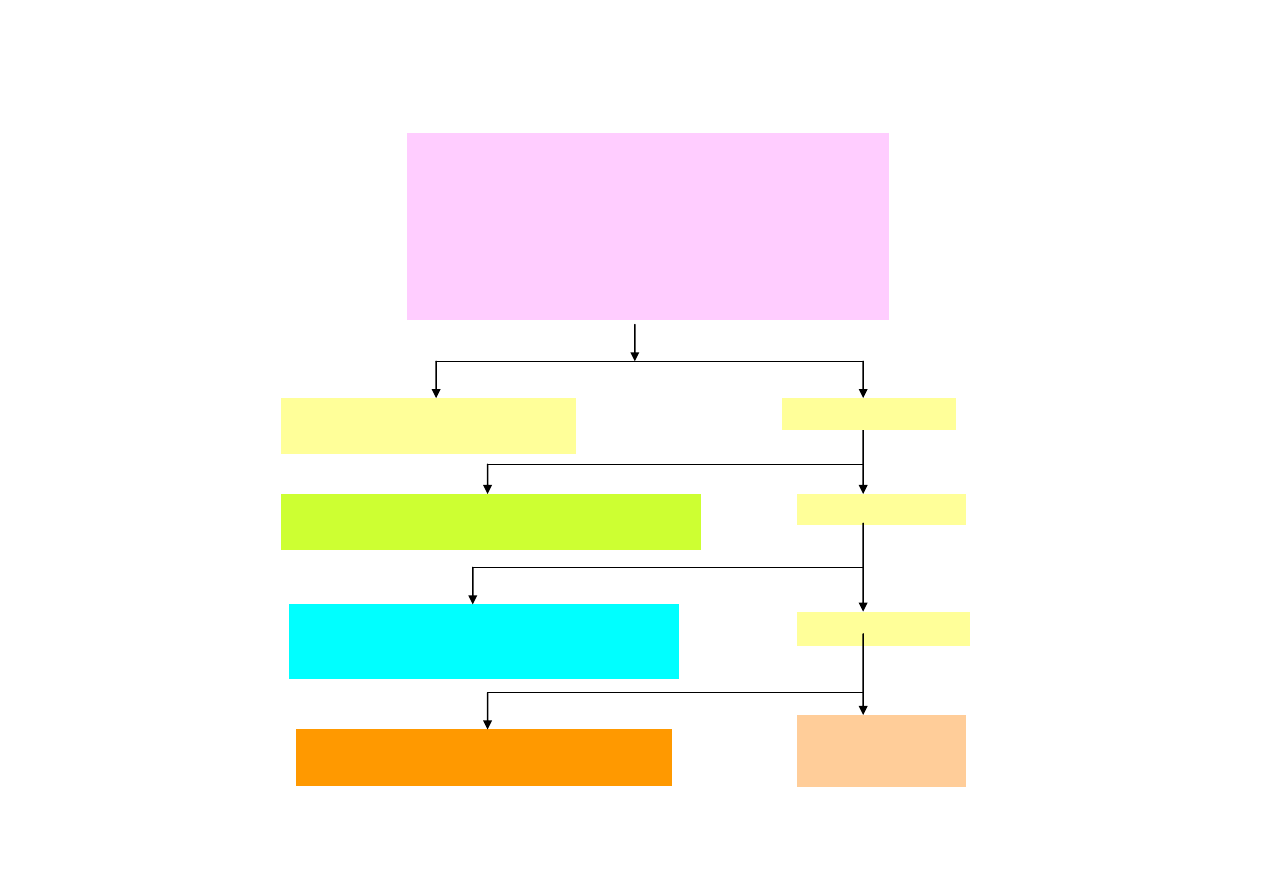
11
Kationy wszystkich grup:
Ag
+
, Pb
2+
, Hg
2
2+
- I grupa
Cu
2+
, Bi
3+
, Cd
2+
, Pb
2+
, Hg
2+
, As(III,V), Sb(III,V), Sn(II,IV)
–II grupa
Al
3+
, Cr
3+
, Fe
2+
, Fe
3+
, Co
2+
, Ni
2+
, Zn
2+
, Mn
2+
-III grupa
Ca
2+
, Sr
2+
, Ba
2+
- IV grupa
NH
4
+
, Na
+
, K
+
, Mg
2+
- V grupa
Rozdział kationów na grupy analityczne wg Freseniusa
Grupa I
– chlorki trudno rozp. w H
2
O
AgCl, PbCl
2
, Hg
2
Cl
2
Pozostałe kationy
(NH
4
)
2
S lub AKT + bufor amonowy
amon amonowy
Pozostałe kationy
Grupa II
– nierozpuszczalne w rozc. kwasach siarczki
CuS, Bi
2
S
3
, CdS, PbS, HgS, As
2
S
3
, As
2
S
5
, Sb
2
S
3
, SnS
2
H
2
S lub AKT + 0.2 M HCl
wytrącanie
Grupa III
– rozpuszczalne w kwasach siarczki,
nierozpuszczalne w zasadach siarczki i wodorotlenki
Al(OH)
3
, Cr(OH)
3
, Fe(OH)
3
, ZnS, NiS, CoS, MnS
Grupa IV
– nierozpuszczalne w H
2
O węglany
CaCO
3
, SrCO
3
, BaCO
3
Pozostałe kationy
Pozostałe kationy:
Grupa V:
NH
4
+
, Na
+
, K
+
, Mg
2+
(NH
4
)
2
CO
3
+ bufor amonowy
2 M HCl
wytrącanie
wytrącanie
wytrącanie

12
2.
R
EAKCJE CHARAKTERYSTYCZNE WYBRANYCH KATIONÓW
I
GRUPY
Odczynnikiem grupowym I grupy analitycznej jest ok. 2M roztwór kwasu
chlorowodorowego HCl.
Do tej grupy należą katony srebra Ag
+
, rtęci Hg
2
2+
i ołowiu Pb
2+
.
Reakcje jonu srebra Ag
+
1. Roztwór 2 M kwasu chlorowodorowego HCl (odczynnik grupowy) wytrąca biały
serowaty osad chlorku srebra AgCl
Ag
+
+ Cl
-
→ AgCl↓
biały
Wykonanie: Do 2-3 kropli badanego roztworu dodaj 2-3 krople 2M HCl do wytrącenia osadu.
Jest to osad ciemniejący na świetle (fotochemiczny rozkład na srebro i chlor),
nierozpuszczalny w 2M roztworze HNO
3
, rozpuszczalny w amoniaku z utworzeniem
kompleksowego związku - chlorku diaminasrebra
AgCl + 2NH
3
·H
2
O → [Ag(NH
3
)
2
]Cl + H
2
O
2. Roztwór wodorotlenku NaOH lub KOH wytrąca nietrwały wodorotlenek srebra
rozkładający się na tlenek srebra i wodę
2Ag
+
+ 2NaOH → Ag
2
O↓ + H
2
O+ 2 Na
+
ciemnobrunatny
Wykonanie: Do 2-3 kropli badanego roztworu dodaj 2-3 krople 3 M. NaOH do wytrącenia osadu.
3. Roztwór wodny amoniaku wytrąca biały, brunatniejący osad rozpuszczalny w
nadmiarze odczynnika z utworzeniem wodorotlenku diaminasrebra
2Ag
+
+ 2NH
3
·H
2
O → Ag
2
O↓ + H
2
O+ 2 NH
4
+
Ag
2
O + 4NH
3
·H
2
O → 2[Ag(NH
3
)
2
]OH + 3 H
2
O
Wykonanie: Próbę należy wykonać w suchej probówce. Do 3 kropli badanego roztworu dodaj 1-2 krople
NH
3
·H
2
O (do oznaczania Ag
+
) - widać zmętnienie (powstał osad AgCl). Dodanie dalszych 2-3 kropli roztworu
NH
3
·H
2
O powoduje rozpuszczenie osadu.
4. Roztwór jodku potasu KI wytrąca osad jodku srebra
Ag
+
+I
-
→ AgI↓
żółtozielonkawy
Wykonanie: Do 2-3 kropli badanego roztworu dodaj kroplami KI do wytrącenia osadu.
5. Roztwór chromianu(VI) potasu K
2
CrO
4
wytrąca osad chromianu(VI) srebra
2 Ag
+
+ CrO
4
2-
→ Ag
2
CrO
4
↓
czerwonobrunatny
Osad ten rozpuszcza się w rozcieńczonym HNO
3
i w NH
3
·H
2
O.
Wykonanie: Do 2-3 kropli badanego roztworu dodaj 1-2 krople K
2
CrO
4
do wytrącenia osadu.

13
Reakcje jonu ołowiu (II) Pb
2+
1. Roztwór 2 M HCl (odczynnik grupy I) wytrąca osad chlorku ołowiu(II)
Pb
2+
+ 2Cl
-
→ PbCl
2
↓
biały
Osad chlorku ołowiu (II) rozpuszcza się w gorącej wodzie, a po oziębieniu krystalizuje w
postaci drobnych blaszek.
Wykonanie: Do 2-3 kropli badanego roztworu dodaje się 1-2 krople 2 M roztworu HCl do wytrącenia osadu.
W celu rozpuszczenia osadu należy wstawić probówkę zawierająca roztwór z osadem do łaźni wodnej.
Następnie ochłodzić roztwór w zlewce z zimną wodą (wytrąci się osad).
2. Roztwór wodorotlenku NaOH lub KOH wytrąca osad wodorotlenku ołowiu(II)
o właściwościach amfoterycznych, który jest rozpuszczalny w nadmiarze odczynnika i w
mocnych kwasach.
Pb
2+
+ 2 OH
-
→ Pb(OH)
2
↓
biały
Pb(OH)
2
+ 2NaOH → Na
2
PbO
2
+ 2H
2
O
ołowin sodowy
Pb(OH)
2
+ 2NaOH → Na
2
[Pb(OH)
4
]
tetrahydroksyołowian(II) sodowy
Pb(OH)
2
+ 2HNO
3
→ Pb(NO
3
)
2
+ 2H
2
O
Wykonanie: Do 2-3 kropli badanego roztworu dodaje się 1-2 krople 3 M NaOH do wytrącenia osadu.
3. Roztwór amoniaku NH
3
∙OH wytrąca osad wodorotlenku ołowiu(II) nierozpuszczalny
w nadmiarze odczynnika
Pb
2+
+ 2NH
3
∙H
2
O → Pb(OH)
2
↓ + 2NH
4
+
biały
Wykonanie: Do 2 - 3 kropli badanego roztworu dodaje się 5-6 kropli 2 M 2NH
3
∙H
2
O do wytrącenia osadu.
4. Roztwór jodku potasu KI wytrąca osad jodku ołowiu (II).
Pb
2+
+ 2I
-
→ PbI
2
↓
żółty
Osad jodku ołowiu(II) rozpuszcza się w gorącej wodzie, a po oziębieniu krystalizuje
Wykonanie: Do 1 kropli badanego roztworu dodaje się 1 kroplę roztworu KI i 2 krople 2 M. roztworu kwasu
octowego CH
3
COOH (wytrąci się żółty osad). Dodaj ok. 2 ml wody i ogrzewaj probówkę do rozpuszczenia
osadu na wrzącej łaźni wodnej. Po oziębieniu w zlewce z zimną wodą krystalizuje piękny, błyszczący, żółty
osad. Jest to jedna z najpiękniejszych reakcji analitycznych.
5. Roztwór chromianu(VI) potasowego K
2
CrO
4
wytrąca osad chromianu(VI) ołowiu(II)
Pb
2+
+ CrO
4
2-
→ PbCrO
4
żółty
Wykonanie: Do 2-3 kropli badanego roztworu dodaje się 1-2 krople 2 M roztworu kwasu octowego CH
3
COOH
i 1-2 krople roztworu K
2
CrO
4
.
14
3. R
EAKCJE CHARAKTERYSTYCZNE WYBRANYCH KATIONÓW
II
GRUPY
Odczynnikiem grupowym II grupy jest siarkowodór H
2
S (lub AKT) w obecności
2M roztworu kwasu chlorowodorowego HCl). Do tej grupy zalicza się następujące jony:
ołowiu Pb
2+
, rtęci Hg
2+
, bizmutu Bi
3+
, miedzi Cu
2+
, arsenu As(III), As(V), antymonu
Sb(III), Sb(V), cyny Sn(II) i Sn(IV).
Reakcje jonu rtęci (II) Hg
2+
1. Siarkowodór H
2
S (AKT w obecności 2M roztworu HCl – odczynnik grupowy II
grupy), wytrąca barwne osady soli podwójnych (np.HgCl
2
·2HgS), w których sole rtęci (II)
połączone są w różnych stosunkach. Barwa osadu zmienia się w miarę dodawania
odczynnika, od białej poprzez żółtobrunatną i brunatną do czarnej
Hg
2+
+ S
2-
→ HgS↓
czarny
Osad rozpuszcza się w wodzie królewskiej (1 obj. HNO
3
stęż. + 3 obj. HCl stęż.).
Wykonanie: Do 2-3 kropli badanego roztworu dodaj 1-2 krople 2 M roztworu HCl i 2-3 krople roztworu AKT.
Mieszaninę ogrzać na łaźni wodnej 8-10 min.
2. Roztwór wodorotlenku NaOH lub KOH wytrąca osad tlenku rtęci(II)
Hg
2+
+ 2OH
-
HgO↓ + H
2
O
żółty
Wykonanie: Do 2-3 kropli badanego roztworu dodaje się 1-2 krople 3 M roztworu NaOH. Wytrąca się
czerwonobrązowy osad przechodzący w nadmiarze odczynnika strącającego w żółty.
3. Roztwór amoniaku NH
3
·H
2
O wytrąca osady soli amino- lub tlenoaminortęci(II)
HgCl
2
+ 2NH
3
H
2
O
HgNH
2
Cl↓ + NH
4
Cl + 2H
2
O
biały
2 Hg(NO
3
)
2
+ 4 NH
3
H
2
O
O
Hg
NH
2
NO
3
+ NH
4
NO
3
+ 3 H
2
O
Hg
biały
Wykonanie: Do 2-3 kropli badanego roztworu dodaje się 1-2 krople 3 M roztworu NH
3
·H
2
O aż do uzyskania
odczynu zasadowego i wytrącenia osadu.
4. Roztwór jodku potasu KI wytrąca osad jodku rtęci(II), rozpuszczalny w nadmiarze
odczynnika z utworzeniem związku kompleksowego jodortęcianu(II) potasu
Hg
2+
+ 2I
-
HgI
2
↓
czerwony
HgI
2
+ 2KI
K
2
[HgI
4
]
bezbarwny
Wykonanie: Do 2 kropli badanego roztworu dodaje się 1 kroplę 0.1 M roztworu KI (wytrąci się osad).
Następnie dodaj dalsze 1-2 krople roztworu KI do rozpuszczenia osadu.

15
Reakcje jonu miedzi(II) Cu
2+
1. Siarkowodór H
2
S (AKT) –odczynnik grupowy wytrąca osad siarczku miedzi(II)
Cu
2+
+ S
2-
→ CuS↓
czarny
Siarczek miedzi(II) rozpuszcza się w gorącym 2 M roztworze kwasu azotowego(V) HNO
3
.
Wykonanie: Do 2-3 kropli badanego roztworu dodaje się 1-2 krople 2 M roztworu HCl i 2-3 krople roztworu
AKT. Mieszaninę ogrzewać na łaźni wodnej 8-10 min.
2. Roztwór wodorotlenku NaOH lub KOH wytrąca osad wodorotlenku miedzi(II), który po
podgrzaniu przechodzi w tlenek
Cu
2+
+ 2OH
-
→ Cu(OH)
2
↓
niebieskozielony
Cu(OH)
2
→ CuO↓ + H
2
O
brunatnoczerwone
Wykonanie: Do 2-3 kropli badanego roztworu dodaje się 1 kroplę 3 M roztworu NaOH.
3. Roztwór amoniaku NH
3
·H
2
O wytrąca osad wodorotlenku miedzi (II), rozpuszczalny w
nadmiarze
amoniaku
z
utworzeniem
związku kompleksowego wodorotlenku
tetraaminomiedzi(II). Jest to jedna z najbardziej charakterystycznych reakcji Cu
2+
.
Cu
2+
+ 2NH
3
·H
2
O → Cu (OH)
2
↓ + 2NH
4
+
niebieskozielony
Cu(OH)
2
+ 4NH
3
·H
2
O → [Cu(NH
3
)
4
](OH)
2
+ 4H
2
O
szafirowy
Wykonanie: Do 2-3 kropli badanego roztworu powoli dodaje się kroplami 0.5 M roztwór NH
3
·H
2
O aż do
wytrącenia osadu, i dalej aż do jego rozpuszczenia.
4. Roztwór jodku potasu KI wytrąca osad jodku miedzi(II), który rozkłada się na jodek
miedzi(I) z równoczesnym wydzieleniem jodu
2Cu
2+
+ 4I
-
2CuI
2
↓
Cu
2
I
2
↓ + I
2
↑
czarny
biały czerwonobrunatny
Wykonanie: Do 1 kropli badanego roztworu dodaje się 1 kroplę roztworu KI.
5. Roztwór
heksacyjanożelazianu(II) potasowego K
4
[Fe(CN)
6
]
wytrąca osad
heksacyjanożelazianu(II) miedzi(II)
2Cu
2+
+ [Fe(CN)
6
]
4-
→
Cu
2
II
[Fe
II
(CN)
6
]↓
czerwonobrunatny
Jest to reakcja bardzo czuła. W roztworach rozcieńczonych powstaje tylko czerwonawe
zabarwienie.
Wykonanie: Do 1 kropli badanego roztworu dodaje się 1-2 krople roztworu K
4
[Fe(CN)
6
]
.

16
4
.
R
EAKCJE CHARAKTERYSTYCZNE WYBRANYCH KATIONÓW
III
GRUPY
Odczynnikiem grupowym III grupy jest siarczek amonu (NH
4
)
2
S lub AKT w
obecności buforu amonowego (NH
3
∙H
2
O + NH
4
Cl).
Do tej grupy należą kationy niklu Ni
2+
, kobaltu Co
2+
, żelaza Fe
3+
i Fe
2+
, manganu
Mn
2+
, chromu Cr
3+
, glinu Al
3+
i cynku Zn
2+
.
Siarczek amonu (NH
4
)
2
S to sól w dość znacznym stopniu zdysocjowana, dlatego
stężenie jonów siarczkowych S
2-
jest wystarczające do przekroczenia iloczynów
rozpuszczalności siarczków kationów III grupy i wytrącenia osadów. Iloczyny
rozpuszczalności
4
tych siarczków są znacznie większe od iloczynów rozpuszczalności
siarczków II grupy (np. I
rCuS
=8.0·10
-36
; I
rMnS
=1.0·10
-11
). Aby zapobiec hydrolizie siarczku
amonowego, stosuje się dodatek roztworu amoniaku NH
3
·H
2
O (przesunięcie równowagi
reakcji hydrolizy w lewo).
(NH
4
)
2
S + H
2
O ↔ + NH
4
HS
NH
4
HS + H
2
O ↔ NH
3
·H
2
O + H
2
S
Oprócz roztworu amoniaku należy dodać do roztworu kationów III grupy chlorku amonu,
NH
4
Cl. Z jednej strony zapobiega to strącaniu się wodorotlenku magnezu, Mg(OH)
2
pod
wpływem amoniaku, a z drugiej przeszkadza w powstawaniu koloidalnych roztworów
siarczków i wodorotlenków III grupy, pod warunkiem, że proces strącania prowadzony jest
z roztworu ogrzanego uprzednio do wrzenia.
Reakcje jonu żelaza(III) Fe
3+
1. Roztwór (NH
4
)
2
S wytrąca osad siarczku żelaza(III)
2Fe
3+
+ 3S
2-
→ Fe
2
S
3
↓
czarny
Osad łatwo rozpuszcza się w kwasach, np. w 2M HCl
Fe
2
S
3
+ 4HCl → 2FeCl
2
+ S↓ + 2H
2
S
biały koloidalny osad siarki
Wykonanie: Do 2 kropli badanego roztworu dodać 1 kroplę 2 M roztworu NH
3
ˑH
2
O (do odczynu słabo
zasadowego) + NH
4
Cl i 2-3 krople AKT. Mieszaninę ogrzewać na łaźni z wrzącą wodą 5-10 min.
2. Roztwór wodorotlenku NaOH lub KOH wytrąca osad wodorotlenku żelaza(III)
Fe
3+
+ 3OH
-
→ Fe(OH)
3
↓
brunatny
Osad ten rozpuszcza się w kwasach, np.
Fe(OH)
3
+ 3HCl
FeCl
3
+ 3H
2
O
4
Iloczyn rozpuszczalności jest to iloczyn stężeń jonów trudnorozpuszczalnego osadu w roztworze nad osadem.
Dla reakcji równowagi trudnorozpuszczalnego osad A
a
B
b
↔ aA
aq
b+
+ bB
aq
a-
iloczyn rozpuszczalności można
wyrazić wzorem
b
-
a
a
b
B
A
r
]
B
[
]
A
[
I
b
a
. Osad soli lub wodorotlenku wytrąca się w roztworze, gdy iloczyn
stężeń jonów w roztworze jest większy niż iloczyn rozpuszczalności dla danego osadu.

17
Wykonanie: Do 1-2 kropli badanego roztworu dodać 1-2 krople 3 M roztworu NaOH aż do wytrącenia się
czerwonobrunatnego osadu.
3. Roztwór amoniaku NH
3
·H
2
O wytrąca osad brunatny wodorotlenku żelaza(III) jak w
reakcji z NaOH.
4. Roztwór heksacyjanożelazianu(III) potasu K
3
[Fe(CN)
6
] tworzy rozpuszczalną sól -
heksacyjanożelazian(III) żelaza(III)
Fe
III
[Fe
III
(CN)
6
] o zabarwieniu brunatnym
Wykonanie: Do 1-2 kropli badanego roztworu dodać 1-2 krople K
3
[Fe(CN)
6
]
aż do wytrącenia się
czerwonobrunatnego osadu.
5. Roztwór heksacyjanożelazianu(II) potasu K
4
[Fe(CN)
6
] wytrąca osad
heksacyjanożelazianu(II) żelaza(III), tzw. błękit pruski
4 Fe
3+
+ 3[Fe(CN)
6
]
4-
→ Fe
4
III
[Fe
II
(CN)
6
]
3
↓
ciemnoniebieski
Wykonanie: Do 1-2 kropli badanego roztworu dodać 1 kroplę roztworu
K
4
[Fe(CN)
6
].
6. Roztwór KSCN tiocyjanianu (rodanek) potasu, tworzy rozpuszczalne związki
kompleksowe o zabarwieniu krwistoczerwonym
Fe
3+
+ SCN
-
→ [Fe(SCN)]
2+
Fe
3+
+ 2SCN
-
→ [Fe(SCN)
2
]
+
Fe
3+
+ 3SCN
-
→ Fe(SCN)
3
Dalszy nadmiar jonów tiocyjanianowych powoduje powstawanie kolejnych jonów
kompleksowych [Fe(SCN)
4
]
-
, [Fe(SCN)
5
]
2-
, [Fe(SCN)
6
]
3-
; zabarwienie roztworu staje się
bardziej intensywne. Reakcja ta jest bardzo czuła, stosowana w analizie wody. Pozwala
wykryć Fe
3+
. Jest to specyficzna reakcja dla Fe
3+
, pozwala wykryć bezpośrednio kationy Fe
3+
w obecności wielu innych kationów.
Wykonanie: Do 1-2 kropli badanego roztworu dodać 1 kroplę roztworu
KSCN lub NH
4
SCN.
Reakcje jonu manganu(II) Mn
2+
1. Roztwory siarczku amonowego (NH
4
)
2
S wytrąca osad siarczku manganu(II)
Mn
2+
+ S
2-
MnS
cielisty
Osad ten łatwo rozpuszcza się w kwasach.
Wykonanie: Do 2 kropli badanego roztworu dodać 2 krople 2 M NH
3
∙H
2
O, 4 krople 0.5 M NH
4
Cl i 3 krople
AKT. Mieszaninę ogrzewać na łaźni wodnej 5-10 min, aż do wytrącenia na dnie probówki jasnoróżowo -
cielistego osadu.
2. Roztwór NaOH lub KOH wytrąca osad wodorotlenku manganu(II)
Mn
2+
+ 2OH
-
Mn(OH)
2
biały
Mn(OH)
2
rozpuszcza się w rozcieńczonych kwasach oraz solach amonowych

18
Wodorotlenek manganu(II) utlenia się tlenem z powietrza do kwasu manganowego(IV), a
następnie manganianu(IV) manganu(II)
2Mn(OH)
2
+ O
2
2H
2
MnO
3
H
2
MnO
3
+ Mn(OH)
2
MnMnO
3
+ 2H
2
O
brunatny
Wykonanie: Do 2-3 kropli badanego roztworu dodać 1 (!) kroplę 3 M NaOH. Probówkę z osadem energicznie
wstrząsnąć. Wytrącony osad przez moment jest biały i natychmiast ciemnieje na powietrzu.
Jeżeli wraz z zasadą wprowadzimy do roztworu Mn
2+
utleniacz np. nadtlenek wodoru H
2
O
2
to
H
2
MnO
3
powstaje od razu i wytrąca się w postaci ciemnobrunatnego osadu:
Mn
2+
+ H
2
O
2
+ 2OH
-
→ H
2
MnO
3
↓ + H
2
O
3. Roztwór amoniaku NH
3
∙H
2
O wytrąca osad wodorotlenku manganu(II) jak w reakcji z
NaOH rozpuszczalny w nadmiarze amoniaku
Wykonanie: Do 2-3 kropli badanego roztworu dodać 1 (!) kroplę 2 M NH
3
∙H
2
O. Probówkę z osadem
energicznie wstrząsnąć. Wytrącony osad przez moment jest biały i natychmiast ciemnieje na powietrzu.
4. Roztwór K
3
[Fe(CN)
6
] wytrąca osad heksacyjanożelazianu(III) manganu(II)
3Mn
2+
+ [Fe(CN)
6
]
3-
Mn
3
[Fe(CN)
6
]
2
brunatny
Wykonanie: Do 1 kropli badanego roztworu dodać 1 kroplę K
3
[Fe(CN)
6
].
5. Roztwór K
4
[Fe(CN)
6
] wytrąca osad heksacyjanożelazianu(II) manganu(II)
2Mn
2+
+ [Fe(CN)
6
]
4-
Mn
2
[Fe(CN)
6
]
biały
Wykonanie: Do 1 kropli badanego roztworu dodać 1 kroplę K
4
[Fe(CN)
6
].
6. Roztwór nadsiarczanu amonu (NH
4
)
2
S
2
O
8
wobec katalizatora AgNO
3
, w środowisku
kwaśnym, utlenia jony Mn
2+
do jonów manganianowych(VII) MnO
4
-
. Reakcja jest bardzo
czuła, stosowana do oznaczania śladowych ilości manganu w wodzie
katalizator Ag
2Mn
2+
+ 5S
2
O
8
2-
+ 8H
2
O →2HMnO
4
+ 10SO
4
2-
+ 14H
+
jasnoróżowy
ciemnofioletowy
Wykonanie: Do 1 kropli (nie więcej!) badanego roztworu dodać 50 kropli wody i wymieszać. Z tego roztworu
pobrać 1 ml i dodać do niego 2 krople stężonego HNO
3
i 10 kropli 1% roztworu AgNO
3
(pojawia się
zmętnienie) oraz szczyptę (NH
4
)
2
S
2
O
8
i wymieszać. Mieszaninę ogrzewać na wrzącej łaźni wodnej ok. 3-5 min.
Probówkę z wytrąconym brązowo-brunatnym osadem wyjąć z łaźni i energicznie wstrząsnąć - osad opada na
dno probówki, a roztwór ma fioletowo-różowe zabarwienie. Probówkę odstawić na chwilę - osad opadnie, a
kolor będzie wyraźniejszy.

19
C
ZĘŚĆ PRAKTYCZNA ANALIZY KATIONÓW
.
Identyfikacja pojedynczych kationów w roztworze polega na dodawaniu odczynników
charakterystycznych do małych porcji badanego roztworu. Na ogół zaczyna się od
stwierdzenia, do której grupy analitycznej należy zawarty w roztworze kation. W tym celu do
kolejnych porcji roztworu dodaje się odczynniki grupowe kolejnych grup analitycznych.
W przypadku powstania osadu i stwierdzenia, że badany kation należy do I grupy, do
kilku nowych porcji badanego roztworu dodaje się inne odczynniki charakterystyczne. Na
podstawie wyników tych reakcji (powstanie charakterystycznej barwy lub zapachu,
wytrącenie się osadu, jego barwa, rozpuszczalność) i dalszych reakcji z innymi odczynnikami
identyfikuje się badany kation.
Jeżeli po dodaniu odczynnika grupowego I grupy kationów osad nie wytrąca się, do tej
samej porcji roztworu dodaje się odczynnik grupowy II grupy. Brak reakcji wytrącania
oznacza brak kationu II grupy w badanym roztworze. Następnie dodaje się odczynnik
grupowy III grupy. Jeżeli i w tym przypadku nie powstanie osad, dodaje się odczynnik
grupowy IV grupy. Jeżeli osad nie powstanie, oznacza to, że badany kation należy do V grupy
lub w roztworze brak jest w ogóle kationów. Po stwierdzeniu, do której grupy analitycznej
należy kation, przeprowadza się opisane uprzednio reakcje charakterystyczne.
Ć
WICZENIE
1 polega na identyfikacji wybranych kationów grup I-III.
Część I: Należy zapoznać się ze wszystkimi reakcjami kationów I-III grup wykonując
samodzielnie reakcje grupowe (dla zidentyfikowania grupy) i charakterystyczne tych
kationów. Potrzebne roztwory znajdują się na sali na półkach nad stołami laboratoryjnymi, w
koszyczkach na stołach oraz pod wyciągiem. Przebieg reakcji musi być zapisany w dzienniku
laboratoryjnym w postaci tabelki. Po zapoznaniu się z reakcjami należy zgłosić się do
asystenta po zadanie.
Część II: W 3 probówkach otrzymanych od asystenta (każda zawiera roztwór jednej soli)
należy zidentyfikować znajdujące się w nich kationy. Identyfikację należy przeprowadzić wg
opisanych reguł. Do probówek wlewać po kilka kropli badanego roztworu i kroplami
dodawać roztwory poszczególnych odczynników. Wyniki analizy przedstawić wg podanego
schematu:
Nr
probówki
Przebieg analizy
Obserwacje
Wnioski
Wynik
1
Próbka + HCl
Brak osadu
Kation nie należy do I
grupy
Próbka + AKT
Czarny osad
Kation II grupy
Próbka + NaOH
Niebieskozielony osad
Cu
2+
osad + NH
3
∙H
2
O
Osad rozpuszcza się
Próbka + NH
3
∙H
2
O
Szafirowy zabarwienie
roztworu
Cu
2+
Próbka + K
4
[Fe(CN)
6
]
Czerwonobrunatny osad
Cu
2+
Rekcje w toku analizy
Cu
2+
+ 2 S
-2
→ CuS↓
Cu
2+
+ 2 OH
-
→Cu(OH)
2
↓
Cu(OH)
2
+ 4 NH
3
∙H
2
O → [Cu(NH
3
)
4
](OH)
2
+ H
2
O
2 Cu
2+
+ [Fe(CN)
6
]
4-
→Cu
2
[Fe(CN)
6
]↓
Cu
2+
2
itd
itd
itd

20
Ć
WICZENIE
NR
2
IDENTYFIKACJA KATIONÓW GRUP
(IV-V)
ORAZ WYBRANYCH ANIONÓW
CHLORKÓW
,
AZOTANÓW
(V),
SIARCZANÓW
(VI)
I FOSFORANÓW
(V)
1.
R
EAKCJE CHARAKTERYSTYCZNE WYBRANEGO KATIONU
IV
GRUPY
Odczynnikiem grupowym IV grupy analitycznej kationów jest węglan amonu
(NH
4
)
2
CO
3
w obecności buforu amonowego (NH
3
∙H
2
O + NH
4
Cl).
Do tej grupy zaliczmy jony wapnia Ca
2+
, strontu Sr
2+
i baru Ba
2+
.
Węglan amonu, jako sól w roztworach wodnych jest całkowicie zdysocjowana:
(NH
4
)
2
CO
3
→ 2NH
4
+
+ CO
3
2-
Jako sól słabej zasady i słabego kwasu ulega on także w roztworach wodnych hydrolizie:
(NH
4
)
2
CO
3
+ H
2
O
↔ NH
4
HCO
3
+ NH
3
·H
2
O
Powstający w tej reakcji kwaśny węglan amonu dysocjuje dalej:
NH
4
HCO
3
↔ NH
4
+
+ HCO
3
-
W roztworze wodnym węglanu amonu obok jonów CO
3
2-
są więc jony HCO
3
-
, które z
kationami IV grupy dają łatwo rozpuszczalne kwaśne węglany. Utrudnia to całkowite
wytrącenie i oddzielenie kationów IV grupy. W celu przeciwdziałania powstawaniu kwaśnych
węglanów dodaje się do roztworu węglanu amonu roztwór amoniaku. Cofa on reakcję
hydrolizy węglanu amonu zgodnie z reakcją
NH
4
HCO
3
+ NH
4
OH
(NH
4
)
2
CO
3
+ H
2
O
Roztwór amoniaku, w obecności węglanu amonu może powodować wytrącanie jonu magnezu
z grupy V w postaci Mg
2
(OH)
2
CO
3
. Z tego względu konieczny jest dodatek NH
4
Cl. Osad
Mg
2
(OH)
2
CO
3
jest rozpuszczalny w roztworze soli amonowych.
Reakcje jonu wapnia Ca
2+
1. Roztwór węglanu amonu (NH
4
)
2
CO
3
wytrąca osad węglanu wapnia
Ca
2+
+ CO
3
2-
CaCO
3
biały
Węglan wapnia rozpuszcza się w rozcieńczonych kwasach z wydzieleniem dwutlenku węgla
CaCO
3
+ 2H
+
Ca
2+
+ H
2
O + CO
2
Wykonanie: Do 2 kropli badanego roztworu dodaj 1-2 krople 2M. roztworu (NH
4
)
2
CO
3
. Osad rozpuszcza się w
4-5 kroplach 2 M. HCl.
2. Roztwór NaOH lub KOH wytrąca osad wodorotlenku ze stężonych roztworów soli
wapnia
Ca
2+
+ 2 OH
-
Ca(OH)
2
biały
Osad ten jest dość dobrze rozpuszczalny w wodzie ok. 1.2 g/dm
3
w temperaturze pokojowej.
Wykonanie: Do 1 kropli badanego roztworu dodaj 1-2 krople 3M. roztworu NaOH.

21
3. Roztwór szczawianu amonowego (NH
4
)
2
C
2
O
4
wytrąca osad szczawianu wapnia
Ca
2+
+ C
2
O
4
2-
Ca C
2
O
4
biały
Szczawian wapnia rozpuszcza się w mocnych kwasach mineralnych, nie rozpuszcza się w
kwasie octowym CH
3
COOH.
Wykonanie: Do 1 kropli badanego roztworu dodać 1 kroplę roztworu (NH
4
)
2
C
2
O
4
. Wytrąca się osad, który
rozpuszcza się w 5-6 kroplach 6 M HNO
3
.
4. Roztwór wodorofosforanu(V) sodu Na
2
HPO
4
w obecności NH
4
OH wytrąca biały osad
fosforanu(V) wapnia
3 Ca
2+
+ HPO
4
2-
+ 2 NH
4
OH
Ca
3
(PO
4
)
2
+ 2 H
2
O + 2 NH
4
+
Wykonanie: Do 2 kropli badanego roztworu dodać 3-4 krople roztworu NH
4
Cl i 4 krople roztworu
Na
2
HPO
4
.
5. Roztwór chromianu(VI) potasu K
2
CrO
4
nie wytrąca osadu.
6. Roztwór dichromianu(VI) potasu K
2
Cr
2
O
7
nie wytrąca osadu.
7. Zabarwienie płomienia - sole wapnia zabarwiają płomień palnika gazowego na kolor
ceglasto-czerwony.
Wykonanie: Wprowadź badany roztwór na druciku platynowym do płomienia palnika gazowego. Pojawiające
się ceglastoczerwone zabarwienie świadczy o obecności jonów wapnia.
2.
R
EAKCJE CHARAKTERYSTYCZNE WYBRANYCH KATIONÓW
V
GRUPY
Kationy V grupy analitycznej nie posiadają odczynnika grupowego.
Do tej grupy należą jony: sodu Na
+
, potasu K
+
, amonu NH
4
+
i magnezu Mg
2+
Reakcje jonu amonowego NH
4
+
1. NaOH, KOH wypierają z soli amonowych przy podgrzaniu lotny NH
3
.
NH
4
Cl + NaOH → NH
3
↑ + NaCl + H
2
O
Wydzielający się amoniak można poznać po zapachu lub zmianie zabarwienia wilgotnego,
różowego papierka lakmusowego, umieszczonego u wylotu probówki z mieszaniną reagującą,
na kolor niebieski.
Wykonanie: Do 4-6 kropli badanego roztworu dodaj 4-6 kropli 6 M KOH i umieść w probówce uniwersalny
papierek wskaźnikowy zawieszony na jej krawędzi. Podczas ogrzewania probówki w łaźni wodnej papierek
zmienia zabarwienie na zielone tzn. wskazuje na środowisko alkaliczne.
2.
Roztwór heksaazotynokobaltanu(III) sodowego Na
3
[Co(NO
2
)
6
] wytrąca osad heksa-
azotynokobaltanu(III) sodowo-amonowego
2NH
4
+
+ Na
+
+ [Co(NO
2
)
6
]
3-
(NH
4
)
2
Na[Co(NO
2
)
6
]↓
żółty
Wykonanie: Do 1 - 2 kropli badanego roztworu dodaj 1 kroplę roztworu Na
3
[Co(NO
2
)
6
].

22
3. Odczynnik Nesslera - alkaliczny roztwór jodortęcianu(II) potasu K
2
[HgJ
4
] wytrąca osad
jodku tlenoaminortęci(II)
W przypadku bardzo małej liczby jonów NH
4
+
osad nie wydziela się, a jedynie występuje
żółte, pomarańczowe lub brązowe zabarwienie roztworu w zależności od ich stężenia.
NH
4
Cl + 2 K
2
[HgI
4
] + 4 KOH
O
Hg
NH
2
I
Hg
żółtobrunatny
+ 7 KI + KCl + 3 H
2
O
Wykonanie: 1-2 krople badanego roztworu wkroplić do probówki i rozcieńczyć 8-10 kroplami wody
destylowanej. Dodać 1-2 krople odczynnika Nesslera.
Reakcje jonu potasu K
+
`
1. Roztwory NaOH, KOH nie wytrącają osadu.
2. Roztwór heksaazotynokobaltanu(III) sodu Na
3
[Co(NO
2
)
6
] wytrąca z roztworów
zakwaszonych kwasem octowym osad heksaazotynokobaltanu(III) sodowo-potasowego
2 K
+
+ Na
+
+ [Co(NO
2
)
6
]
3-
K
2
Na[Co(NO
2
)
6
]
żółty
Jest to najbardziej czuła reakcja na jon K
+
, prowadzona na „mokro”. Stosuje się ją do
oznaczania potasu w wodzie.
Wykonanie: Do 1-2 kropli badanego roztworu dodaj 1 kroplę roztworu Na
3
[Co(NO
2
)
6
]. Wstrząśnij i odstaw
probówkę.
3. Zabarwienie płomienia - sole potasu zabarwiają płomień palnika gazowego na kolor
jasno fioletowy. Ta barwa może być tłumiona żółtą barwą jonów sodowych, które dają żółtą
barwę płomienia nawet w śladowych ilościach
Wykonanie: Wprowadź badany roztwór na druciku platynowym do płomienia palnika gazowego. Pojawi się
jasno fioletowe zabarwienie.
23
ANALIZA ANIONÓW
Na podstawie systematyki Bunsena najczęściej występujące aniony podzielono na 7 grup
analitycznych. Podział ten uwarunkowany jest różnicami w zachowaniu się poszczególnych
anionów względem azotanu(V) srebra i chlorku baru oraz różną rozpuszczalnością
powstających w tych reakcjach osadów w rozcieńczonym kwasie azotowym(V) (tabela).
Program przewiduje opanowanie umiejętności identyfikowania anionów: Cl
-
, NO
3
-
i
SO
4
2-
, PO
4
3-
.
Podział anionów na grupy analityczne wg Bunsena
Grupa
analityczna
Aniony
0.1M AgNO
3
0.25M BaCl
2
I
Chlorkowy Cl
-
Bromkowy Br
-
Jodkowy I
-
Cyjankowy CN
-
Tiocyjanianowy SCN
-
Chlorowy(I) ClO
-
Heksacyjanożelazianowy(III) [Fe(CN)
6
]
3-
Heksacyjanożelazianowy(II) [Fe(CN)
6
]
4-
Biały lub żółty osad
nierozpuszczalny
w 2M HNO
3
Brak osadu
II
Siarczkowy S
2-
Azotanowy (IV)NO
2
-
Octanowy CH
3
COO
-
Czarny l
ub biały osad
rozpuszczalny w 2M
HNO
3
(Ag
2
S na
gorąco)
Brak osadu
III
Siarczanowy(IV) SO
3
2-
Węglanowy CO
3
2-
Szczawianowy C
2
O
4
2-
Boranowy BO
2
-
Winianowy C
4
H
4
O
6
2-
Wodorofosforanowy(III) HPO
3
2-
Manganowy(VI) MnO
4
2-
Biały osad
rozpuszczalny w
2M HNO
3
Bia
ły osad
rozpuszczalny
w 2M HNO
3
IV
Ditionianowy (tiosiarczanowy) S
2
O
3
2-
Chromianowy(VI) CrO
4
2-
Fosforanowy(V) PO
4
3-
Arsenianowy(V) AsO
4
3-
Arsenianowy(III) AsO
3
3-
Wanadynowy(V) V
2
O
7
4-
Barwny osad
rozpuszczalny w
2M HNO
3
Biały osad
rozpuszczalny
w 2M HNO
3
V
Azotanowy(V) NO
3
-
Chlorowy(V) ClO
3
-
Chlorowy(VII) ClO
4
-
Manganowy(VII) MnO
4
-
Manganowy(VI) MnO
4
2-
Brak osadu
Brak osadu
VI
Fluorkowy F
-
Siarczanowy(VI) SO
4
2-
Heksafluorokrzemianowy SiF
6
2-
Brak osadu
Biały osad
nierozpuszczalny
w 2 M HNO
3
VII
Krzemianowy SiO
3
2-
,
Wolframianowi WO
4
2-
Żółty osad
rozpuszczalny
w 2M HNO
3
Biały osad
rozpuszczalny
w 2M HNO
3

24
Reakcje jonu chlorkowego Cl
-
1. Roztwór azotanu(V) srebra AgNO
3
wytrąca serowaty osad chlorku srebra
Ag
+
+ CI
-
AgCl
biały
Osad ten ciemnieje na świetle dziennym (rozkład na srebro i chlor). Chlorek srebra jest
nierozpuszczalny w rozcieńczonych kwasach mineralnych, rozpuszczalny w NH
3
∙H
2
O.
AgCl + 2 NH
3
∙H
2
O
[Ag(NH
3
)
2
]Cl + 2 H
2
O
chlorek diaminosrebra
Po zakwaszeniu otrzymanego roztworu wytrąca się ponownie osad AgCl
[Ag(NH
3
)
2
]Cl+ 2HNO
3
AgCl
+ 2NH
4
NO
3
Wykonanie: Do 2-3 kropli badanego roztworu dodaj 2-3 krople 0.1 M. roztworu AgNO
3
.
2. Roztwór chlorku baru BaCl
2
nie wytrąca osadu.
3. Roztwór azotanu ołowiu(II) Pb(NO
3
)
2
wytrąca z niezbyt rozcieńczonych roztworów
chlorków krystaliczny osad chlorku ołowiu(II)
Pb
2+
+ 2Cl
-
PbCl
2
biały
Chlorek ołowiu(II) jest rozpuszczalny w gorącej wodzie.
Wykonanie: Próbę należy wykonać w suchej probówce. Do 2 kropli badanego roztworu dodaj 2 krople
roztworu
Pb(NO
3
)
2
.
4. Roztwór manganianu(VII) (nadmanganianu) potasu KMnO
4
zostaje w środowisku
kwaśnym na gorąco odbarwiony przez jony chlorku (słaby reduktor)
2MnO
4
-
+ 10Cl
-
+16H
+
5Cl
2
+ 2 Mn
2+
+ 8H
2
O
Wykonanie: Do 4 kropli badanego roztworu dodaj kroplę stężonego KMnO
4
i 1kroplę stęż. H
2
SO
4
. Mieszaninę
należy ogrzać ok. 10-15 min. (pod wyciągiem!).
Reakcja jonu azotanowego(V) NO
3
-
1. Roztwór azotanu(V) srebra AgNO
3
nie wytrąca osadu.
2. Roztwór chlorku baru BaCl
2
nie wytrąca osadu.
3. Roztwór siarczanu(VI) żelaza(II) FeSO
4
z azotanami(V) tworzy , tzw. „reakcję
obrączkową”.
Polega ona na utlenieniu FeSO
4
do Fe
2
(SO
4
)
3
i na redukcji azotanów (V) do tlenku azotu NO.
Powstający tlenek tworzy z nadmiarem FeSO
4
siarczan nitrozowy żelaza(II) o brunatnym
zabarwieniu:
2NaNO
3
+ 8FeSO
4
+ 4H
2
SO
4
→ 2Fe(NO)SO
4
+ Na
2
SO
4
+ 3Fe
2
(SO
4
)
3
+ 4H
2
O
Wykonanie: Do probówki wprowadzić 2 krople roztworu zawierającego jony azotanowe i 4 krople stęż. H
2
SO
4
.
Następnie probówkę oziębić zimną wodą i ostrożnie dodać po ściance 4 krople nasyconego roztworu FeSO
4
. Na
granice zetknięcia obu roztworów powstaje brązowa obrączka. Stosowane roztwory muszą być zimne, gdyż
siarczan nitrozowy żelaza (II) w wyższej temperaturze ulega rozkładowi wg reakcji:
Fe(NO)SO
4
→ FeSO
4
+ NO

25
4. Reakcja z Cu i kwasem siarkowym
Miedź redukuje rozcieńczony kwas azotowy do tlenku azotu NO
3Cu + 8H
+
+ 2NO
3
-
3Cu
2+
+ 2NO
+ 4H
2
O
2NO + O
2
2NO
2
(tlen z powietrza)
Do roztworu azotanu dodajemy trochę stężonego kwasu H
2
SO
4
i metaliczną miedź.
Zawartość probówki ogrzewamy (pod wyciągiem). Wydziela się brunatny gaz, najlepiej
widoczny na tle białej kartki.
Wykonanie: Do 3 kropli badanego roztworu dodaj 3-4 wiórki Cu i 5 kropli stężonego H
2
SO
4
. Wstrząsaj lekko
probówką.
5. Difenyloamina (C
6
H
5
)
2
NH tworzy z jonami NO
3
-
w stężonym H
2
SO
4
niebieskie
zabarwienie, które powstaje na skutek utlenienia odczynnika przez powstający kwas azotowy.
Wykonanie: Do probówki wkroplić 2-3 krople roztworu difenyloaminy i 1 kroplę badanego roztworu. W
obecności jonów NO
3
-
pojawi się ciemnoniebieskie zabarwienie.
Uwaga: Reakcja jest bardzo czuła, ale niespecyficzna. Taki sam efekt daje użycie innych utleniaczy np.: ClO
3
-
,
AsO
4
-
, NO
2
-
.
Reakcja jonu siarczanowego (VI) SO
4
2-
1. Roztwór azotanu(V) srebra AgNO
3
wytrąca osad tylko ze stężonych roztworów
siarczanów(VI)
2Ag
+
+ SO
4
2-
Ag
2
SO
4
biały
2. Roztwór chlorku baru BaCl
2
wytrąca krystaliczny osad siarczanu(VI) baru,
nierozpuszczalny w rozcieńczonych kwasach mineralnych, rozpuszczalny w stężonym kwasie
siarkowym(VI) na gorąco
Ba
2+
+ SO
4
2-
BaSO
4
biały
BaSO
4
+ H
2
SO
4
Ba(HSO
4
)
2
Wykonanie: Do 2 kropli badanego roztworu dodaj 2 krople roztworu BaCl
2
.
3. Roztwór azotanu(V) ołowiu(II) Pb(NO
3
)
2
wytrąca osad siarczanu(VI) ołowiu(II),
rozpuszczalny w stężonych ługach i w stężonym kwasie siarkowym(VI)
Pb
2+
+ SO
4
2-
PbSO
4
biały
PbSO
4
+ 4OH
-
PbO
2
2-
+ SO
4
2-
+ 2H
2
O
PbSO
4
+ H
2
SO
4
Pb
2+
+ 2HSO
4
-
Wykonanie: Do 2 kropli badanego roztworu dodaj 2 krople roztworu PbCl
2
.
Reakcje jonu fosforanowego (V) PO
4
3-
Jon fosforanowy PO
4
3-
jest anionem kwasu ortofosforowego H
3
PO
4
. Jest to kwas średniej
mocy i jako kwas trójzasadowy jest zobojętniany trójstopniowo tworząc trzy rodzaje soli:
fosforany trójmetaliczne (obojętne): np. Na
3
PO
4
, Ca
3
(PO
4
)
2
fosforany dwumetaliczne (kwaśne, wodorofosforan): np. Na
2
HPO
4
, CaHPO
4
Fosforany jednometaliczne (kwaśne, diwodorofosforan): np. NaH
2
PO
4
, Ca(H
2
PO
4
)
2

26
1. Roztwór chlorku baru BaCl
2
wytrąca z roztworu Na
2
HPO
4
biały osad BaHPO
4
,
rozpuszczalny w kwasach (z wyjątkiem H
2
SO
4
):
Ba
2+
+ HPO
4
2-
BaHPO
4
Jeśli te reakcję wykonujemy w obecności mocnych zasad lub NH
4
OH, jon HPO
4
2-
przechodzi
w jon PO
4
3-
:
HPO
4
2-
+ OH
-
PO
4
3-
+ H
2
O
W tym przypadku strąca się osad Ba
3
(PO
4
)
2
:
3Ba
2+
+ 2PO
4
3-
Ba
3
(PO
4
)
2
Osad ten rozpuszcza się w kwasach tak samo jak BaHPO
4
.
Wykonanie: Do 2 kropli badanego roztworu dodaj 1 kroplę 2 M NH
4
OH i 2 krople roztworu BaCl
2
i wstrząśnij
probówką. Wytrąca się biały osad rozpuszczalny w 6 M HNO
3
.
2. Mieszanina magnezowa (MgCl
2
+NH
4
Cl + NH
3
∙H
2
O) wytrąca biały, krystaliczny osad
MgNH
4
PO
4
:
HPO
4
2-
+ NH
3
∙H
2
O + Mg
2+
MgNH
4
PO
4
+ H
2
O
Wykonanie: Do 2 kropli badanego roztworu dodaj 10 kropli mieszaniny magnezowej. Wytrąca się biały osad.
3. Roztwór molibdenianu amonowy (NH
4
)
2
MoO
4
w HNO
3
(1:1) wytrąca z roztworów
fosforanów charakterystyczny, żółty krystaliczny osad fosforomolibdenianu amonowego o
wzorze (NH
4
)
3
H
4
[P(Mo
2
O
7
)
6
].
Osad ten rozpuszcza się w nadmiarze fosforanów tworząc aniony zespolone i dlatego
odczynnik musi być użyty w dużym nadmiarze.
PO
4
3-
+ 3NH
4
+
+ 12MoO
4
2-
+ 24H
+
→ (NH
4
)
3
H
4
[P(Mo
2
O
7
)
6
]↓ + 10H
2
O
Wykonanie: Do 2 kropli badanego roztworu dodaj 10-15 kropli (!) roztworu molibdenianu amonu. Powstaje
żółte zabarwienie roztworu. Probówkę wstrząśnij energicznie i odstaw na chwilę. Wytrąca się żółty krystaliczny
osad.

27
C
ZĘŚĆ PRAKTYCZNA
Ćwiczenie 2 polega na identyfikacji wybranych trzech kationów i czterech anionów.
Część I: Należy zapoznać się ze wszystkimi reakcjami oznaczanych kationów i anionów
wykonując samodzielnie reakcje charakterystyczne. Potrzebne roztwory znajdują się na sali
na półkach nad stołami laboratoryjnymi, w koszyczkach na stołach oraz pod wyciągiem. Po
zapoznaniu się z reakcjami należy zgłosić się do asystenta po zadanie.
Część II: W 3 probówkach otrzymanych od asystenta (każda zawiera roztwór jednej soli)
należy zidentyfikować znajdujące się w nich kation i anion. Identyfikację anionu należy
przeprowadzić wg opisanych zasad. Do probówek wlewać po kilka kropli badanego roztworu
i kroplami dodawać roztwory poszczególnych odczynników. Wyniki analizy przedstawić wg
podanego schematu
Nr
probówki
Przebieg analizy
Obserwacje
Wnioski
Wynik
1
Próbka + AgNO
3
Osad + HNO
3
Osad + NH
3
∙H
2
O
Próbka + BaCl
2
Próbka + Pb(NO
3
)
2
Osad + gorąca H
2
O
Próbka + KMnO
4
, kwaśne
środowisko
Biały osad
Nie rozpuszcza się
Rozpuszcza się
Brak osadu
Biały osad
Rozpuszcza się
Odbarwienie roztworu
I grupa
Cl
-
Cl
-
Reakcje w toku
Ag
+
+ Cl
-
→ AgCl↓
AgCl + 2NH
3
∙H
2
O → [Ag(NH
3
)
2
]Cl + 2H
2
O
Pb
2+
+ 2Cl
-
→ PbCl
2
↓
2MnO
4
-
+ 10Cl
-
+ 16H
+
→ 5Cl
2
+ 2Mn
2+
+ 8H
2
O
Cl
-
2
itd
Według podobnego schematu wykonać analizę kationów obecnych w probówce wykrywając
Ca
2+
, NH
4
+
lub K
+
. W przypadku kationu Ca
2+
należy wykryć jego obecność w probówce w
reakcji z odczynnikiem grupowym IV grupy.

28
Ć
WICZENIE NR
3
Oznaczanie wodorotlenku sodowego NaOH
1. Przygotowanie mianowanego roztworu kwasu solnego
Kwas solny o stężeniu 0.1 mol/dm
3
sporządza się przez rozcieńczenie stężonego roztworu
HCl ok. 35% masowych o gęstości 1.18 g/cm
3
. Sposób obliczenia objętości stężonego kwasu
solnego, którą należy wziąć do przygotowania 1l roztworu o stężeniu 0,1 mol/dm
3
HCl jest
następujący: Z definicji stężenia wyrażonego w procentach masowych wynika, że 35 g HCl
znajduje się w 100 g roztworu stężonego, tj. w
3
84,7cm
1,18
100
.
Masa 0.1 mol roztworu HCl wynosi 0.1 M
HCl
= 0.1*36,5 = 3.65 g HCl. Ta masa znajduje się
w następującej objętości stężonego kwasu solnego:
35 g HCl - 84,7 cm
3
3,65 g HCl - V
x
V
x
=
l
8,83cm
35
84,7
3,65
3
Należy, więc cylinderkiem odmierzyć 9 cm
3
stężonego roztworu HCl i rozcieńczyć do
objętości 1 dm
3
lub odpowiednio mniejszą objętość stężonego kwasu, jeśli przygotowujemy
0.5 lub 0.3 dm
3
rozcieńczonego kwasu. Otrzymuje się w ten sposób roztwór o stężeniu
przybliżonym, którego dokładne miano ustala się przez miareczkowanie odważek sody
otrzymanej z NaHCO
3
. Podczas takiego miareczkowania wobec oranżu metylowego
przebiega reakcja:
Na
2
CO
3
+ 2HCl → 2NaCl + H
2
O + CO
2
UWAGA! Przygotować 0.5 dm
3
0.1 mol/dm
3
kwasu solnego w butelce ze szlifowanym
korkiem.

29
2. Nastawianie miana 0.1 mol/dm
3
HCl na węglan sodowy.
Bezwodny węglan sodowy zawiera zwykle nieco wilgoci oraz kwaśnego węglanu sodowego.
Ogrzewanie w ciągu ok. godziny w temp. 270-300
o
C pozbawia sodę wilgoci oraz domieszek
NaHCO
3
w wyniku termicznego rozkładu:
2 NaHCO
3
→ Na
2
CO
3
+ CO
2
+ H
2
O
Ogrzewanie sody przeprowadza się w tyglu porcelanowym w piecu elektrycznym
z regulowana temperaturą lub w łaźni piaskowej ogrzewanej palnikiem gazowym.
Temperaturę sody w tyglu sprawdza się termometrem, który jednocześnie służy do mieszania,
co pewien czas zawartości tygla. Tygiel z wysuszoną sodą umieszcza się w eksykatorze, a po
ostudzeniu przesypuje się sodę do szczelnego naczynka wagowego, które także przechowuje
się w eksykatorze.
Odważki sody powinny być takiej wielkości, aby podczas miareczkowania zużywano
z biurety 30-40 ml 0.1 mol/dm
3
HCl. Miareczkowanie prowadzi się wobec oranżu
metylowego w sposób podany poniżej.
W naczynku wagowym odważa się dokładnie (przez odsypywanie) naważkę 0.15-0.20 g
Na
2
CO
3
i przenosi ilościowo do kolbki stożkowej o pojemności 250 cm
3
. Odważony węglan
rozpuszcza się w ok. 60 cm
3
wody destylowanej, dodaje 4 krople oranżu metylowego
i roztwór miareczkuje z biurety roztworem przygotowanego kwasu solnego. Miareczkowanie
prowadzi się aż do pojawienia się barwy cebulkowej, przejściowej miedzy żółtą i czerwoną.
Wykonuje się, co najmniej 3 oznaczenia.
Pod koniec miareczkowania roztwór jest nasycony CO
2
, który obniża nieco pH roztworu
NaCl. W przypadku trudności w ustaleniu końca miareczkowania należy przygotować
roztwór porównawczy, tzw. wzorzec (świadek) miareczkowania, którym jest roztwór
o objętości i stężeniu równych objętości i stężeniu roztworu miareczkowanego w końcu
miareczkowania.
30
Stężenie kwasu oblicza się wg wzoru:
106
V
m
1000
1
2
c
3
2
CO
Na
HCl
gdzie: c
HCl
- stężenie molowe roztworu HCl;
3
2
CO
Na
m
-
odważka Na
2
CO
3
,
V - objętość roztworu HCl zużyta na miareczkowanie odważki sody o masie
3
2
CO
Na
m
.
3. Oznaczenie NaOH
Otrzymane zadanie (próbkę) rozcieńcza się wodą destylowaną do kreski w kolbie miarowej
o objętości 250 cm
3
i dokładnie miesza. Następnie odmierza się pipetą 25 cm
3
tego roztworu
do kolbki stożkowej, dodaje 2-3 krople oranżu metylowego i miareczkuje przygotowanym
roztworem kwasu solnego (ok. 0.1 mol/dm
3
) do zmiany barwy z żółtej na cebulkową.
Wynik oblicza się z wzoru:
40
1000
V
c
M
1000
V
c
m
HCl
HCl
NaOH
HCl
HCl
NaOH
gdzie: c
HCl
- stężenie molowe HCl;
V
HCl
- objętość roztworu HCl zużyta podczas miareczkowania.

31
CWICZENIE NR 4
Kompleksometryczne oznaczanie cynku.
/. Mianowany roztwór EDTA
Jeżeli dysponuje się odpowiednio czystym wersenianem disodowym to można roztwór EDTA
przygotować przez rozpuszczenie w wodzie odpowiedniej odważki dwuwodnej soli. Nie
należy jednak wersenianu suszyć, ponieważ bezwodna sól jest higroskopijna i musi być
przechowywana w eksykatorze nad P
2
O
5
, ale sól uwodniona jest trwała w dużym zakresie
wilgotności powietrza.
Masa
molowa
wersenianu
disodowego
Na
2
H
2
Y
2
·H
2
O
wynosi
372.10 g/mol.
Do przygotowania roztworu o stężeniu 0.05 mol/dm
3
należy rozpuścić 18.6050 g
Na
2
H
2
Y
2
·H
2
O w wodzie i rozcieńczyć wodą do objętości 1 dm
3
.
W przypadku związku o mniejszej lub niepewnej czystości należy nastawić jego miano
stosując odpowiednie substancje wzorcowe. Substancje wzorcowe, które zostały
z pozytywnymi wynikami zastosowane do nastawiania miana roztworów EDTA, można
podzielić na dwie grupy:
1/ metale i tlenki organiczne (Mg, Cu, Ni, Zn, Cd, MgO, PbO, ZnO);
2/ nieorganiczne sole bezwodne (MgSO
4
, CaCO
3
, PbCl
2
, Pb(NO
3
)
2
).
Najlepiej ustalać miano roztworu EDTA na roztwór wzorcowy oznaczanego metalu
w warunkach określonej metody. Nie jest to jednak regułą w kompleksometrii. Z substancji
wzorcowych często stosowany jest węglan wapnia.
W miareczkowaniach kompleksometrycznych stosuje się najczęściej roztwory o stężeniach
0.1-0.01 mol/dm
3
. Duża czułość wskaźników kompleksometrycznych umożliwia stosowanie
roztworów nawet o stężeniu 0.001 mol/dm
3
.
2. Oznaczanie cynku
Jony cynkowe miareczkuje się roztworem EDTA w środowisku buforu (NH
4
Cl-NH
3
)
wobec czerni eriochromowej jako wskaźnika.
Oznaczaniu cynku przeszkadzają przede wszystkim jony miedzi, niklu i kobaltu. Metale te
oraz żelazo (po zredukowaniu do Fe(II) kwasem askorbinowym) maskuje się
przeprowadzając je w trwałe kompleksy cyjankowe. Dodany cyjanek potasowy przeprowadza
także cynk w kompleks cyjankowy. Cynk demaskuje się, (czyli uwalnia z kompleksu
cyjankowego) za pomocą aldehydu mrówkowego. Aldehyd wiąże cyjanki w trwałą

32
cyjanohydrynę uwalniając jony cynkowe, które można teraz odmiareczkować roztworem
EDTA. Podobnie jak cynk zachowuje się kadm.
Glin oraz żelazo(III) można maskować
fluorkami. Fluorki wiążą jony wapnia i magnezu w trudno rozpuszczalne związki.
Odczynniki:
1. EDTA, 0,05 mol/dm
3
2. Roztwór buforowy o pH ok. 10.
Rozpuścić 70 g chlorku amonowego cz.d.a. w wodzie, dodać 570 dm
3
stężonego
amoniaku i rozcieńczyć roztwór wodą do 1 dm
3
.
3.
Czerń eriochromowa T
Zmieszać dokładnie przez roztarcie w moździerzu porcelanowym 0.10 g czerni
eriochromowej T z 20 g chlorku sodowego czda. Przechowywać mieszaninę
w szklanym naczyniu z doszlifowanym korkiem.
Wykonanie oznaczenia
Otrzymane zadanie (badany roztwór) rozcieńczyć wodą w kolbie miarowej do objętości
250 cm
3
. Pobrać 25 cm
3
do kolby stożkowej o poj. 250 cm
3
i rozcieńczyć wodą destylowaną
do ok. 60 cm
3
. Do prawie
o
bojętnego roztworu dodać 5 cm
3
roztworu buforowego, szczyptę
mieszaniny czerni eriochromowej T z NaCl i miareczkować roztworem EDTA do zmiany
zabarwienia
roztworu
miareczkowanego
z
różowofiołkowego na niebieskie.
Miareczkować w obecności świadka (niebieskiego roztworu przemiareczkowanego).
Obliczenia
Zawartość cynku w g obliczyć ze wzoru:
m
Zn
=
c
EDTA
V
EDTA
1000
65.37
Reakcje zachodzące w roztworze podczas oznaczania cynku
W roztworach wodnych metale znajdują się nie w postaci wodnych jonów, lecz w postaci
akwakompleksów, tj. kompleksów, w których ligandami są cząsteczki wody Reakcje
tworzenia się kompleksu można przedstawić równaniem ogólnym
[M(H
2
O)
x
]
n+
+ L
p-
→ ML
n-p
+ xH
2
O
Reakcja tworzenia kompleksów z EDTA jest zgodna z tym równaniem. Sól sodowa kwasu
etylenodiaminotetraoctowego w roztworze wodnym dysocjuje na jony
Na
2
H
2
Y → H
2
Y
2-
+ 2Na
+
33
Jon H
2
Y
2-
ma silne właściwości kompleksotwórcze i reaguje z kationami M
n+
zgodnie
z następującym równaniem:
[M(H
2
O)
x
]
n+
+ H
2
Y
2-
↔ MY
n -4
+ 2H
3
O
+
+ (x-2)H
2
O
Trwałość kompleksów EDTA zależy od czynników wewnętrznych tj. właściwości danego
kationu, ale również od czynników zewnętrznych jak pH roztworu. Wzrost stężenia jonów H
+
powoduje przesuwa równowagę reakcji w kierunku substratów, co powoduje zmniejszenie
trwałości kompleksu:
M
n +
+ H
2
Y
2-
↔ MY
n -4
+ 2 H
+
Oznaczanie metali (Ca, Mg, Zn) odbywa się w obecności czerni eriochromowej T,
zachowującej się jak wskaźnik alkacymetryczny mający dwa przejścia barwne
odpowiadające dwustopniowej dysocjacji protonów:
Oznaczenie wykonuje się najczęściej w roztworach o pH 10, przy którym następuje
wyraźna zmiana barwy.
Reakcje zachodzące w roztworze podczas oznaczania cynku:
a) reakcja ze wskaźnikiem
b) reakcja podczas miareczkowania EDTA
W czasie miareczkowania następuje zmiana barwy z czerwonej (barwa kompleksu cynku ze
wskaźnikiem) na niebieską, charakterystyczną dla jonów czerni eriochromowej.
Wydzielające się w tej reakcji jony H
+
zostają związane przez bufor.
niebieski
Zn
2+
+ HF
2-
ZnF
-
+ H
+
winnoczerwony
ZnF
-
+ H
2
Y
2-
ZnY
2-
+ HF
2-
+ H
+
winnoczerwony
bezbarwny
niebieski
H
2
F
-
HF
2-
F
3-
pH 6.3
pH 11.5
różowy
niebieski
pomarańczowy

34
Ć
WICZENIE NR
5.
Spektrofotometryczne oznaczanie żelaza(III) metodą tiocyjanianową
1. Zasada oznaczenia żelaza metodą tiocyjanianową (rodankową)
Jon żelazowy tworzy z jonami tiocyjanianowymi (rodankowymi) zabarwienie
krwistoczerwone. Przy małej ilości jonów tiocyjanianowych powstaje początkowo FeSCN
2-
, a
zwiększenie ich stężenia prowadzi do powstania jonu [Fe(SCN)
6
]
3-
. Intensywność barwy
roztworu zależy od stężenia jonów SCN
-
i od innych czynników. W obecności dużego
nadmiaru jonów tiocyjanianowych roztwór podlega prawu Beera w szerokim zakresie stężeń.
Reakcję należy wykonywać w środowisku kwaśnym, najlepiej od kwasu azotowego, w celu
cofnięcia hydrolizy jonu żelazowego
Fe
3 +
+ 3H
2
O → Fe(OH)
3
↓ + 3H
+
W wykonaniu oznaczenia przeszkadza obecność wielu anionów i kationów. Szereg
anionów tworzy z jonami żelazowymi jony zespolone, jak np. fluorki, fosforany, chlorki,
winiany, arseniany, octany. Z tego względu w razie nieobecności dużego nadmiaru t ych
anionów najlepiej jest strącić najpierw żelazo amoniakiem w postaci Fe(OH)
3
, następnie osad
rozpuścić w kwasie azotowym i w otrzymanym roztworze kolorymetrycznie oznaczyć
żelazo.
W wykonaniu oznaczenia przeszkadza obecność kationów tworzących osady i kompleksy z
jonami tiocyjanianowymi. Należą tu: Hg
2+
(tworzą Hg(SCN)
2
i [Hg(SCN)
4
]
2-
, dopuszczalna
zawartość 1 mg/ml), Cd
2+
, Zn
2+
, Mn
2+
, Ag
+
,Cu
2+
', Bi
3+
, Co
2+
, Ni
2+
,Cr
3+
i inne.
Pod nieobecność podanych wyżej jonów można oznaczyć metodą tiocyjanianową nawet
2.5 µg Fe w 50 cm
3
roztworu. Do oznaczenia najodpowiedniejsze są stężenia żelaza od
0.04 do 0.1 mg w 50 cm
3
.
Barwa roztworu po pewnym czasie słabnie wskutek redukcji jonów Fe
3+
przez jony SCN
-
.
W eterze, acetonie i innych rozpuszczalnikach organicznych kompleks tiocyjaniano-żelazowy
jest znacznie trwalszy. Z tego względu podczas oznaczania bardzo małych ilości żelaza,
prowadzi się oznaczania w roztworze zawierającym 50% acetonu. Kompleks tiocyjaniano-
żelazowy można również ekstrahować eterem (lub alkoholem izoamylowym)
i prowadzić oznaczenie w tym rozpuszczalniku. Czułość metody tiocyjanianowej (rodankowej)
wzrasta 2-3 krotnie przez zastosowanie rozpuszczalnika organicznego zamiast wody.
35
Natężenie barwy porównuje się z roztworem wzorcowym, zawierającym znaną ilość żelaza
Roztwór wzorcowy sporządza się zwykle z naważki Fe
2
(SO
4
)
3
·(NH
4
)
2
SO
4
·24H
2
O lub
FeNH
4
(SO
4
)
2
·12H
2
O.
Wykonanie oznaczenia.
1. Sporządzenie roztworu wzorcowego żelaza..
Jede n mo l, t j. 481 . 98 g FeNH
4
(SO
4
)
2
·12 H
2
O uwo dnio nego s iarcza nu żelazowo-
amonowego zawiera 55.85 g Fe. Zwykle sporządza się roztwór podstawowy zawierający
0.1 mg Fe w 1 cm
3
. W tym celu rozpuszcza się w wodzie destylowanej zakwaszonej 10 cm
3
stężonego HNO
3
odważkę 0.4317 g soli FeN H
4
(SO
4
)
2
·12 H
2
O i rozcieńcza wodą do
objętości 1 dm
3
.
Jeżeli potrzebny jest roztwór wzorcowy o stężeniu 0.01 mg Fe/cm
3
to wówczas 25 cm
3
roztworu podstawowego przenosi się do kolby miarowej o pojemności 250 cm
3
, dodaje 5
cm
3
stężonego HNO
3
i rozcieńcza wodą destylowaną do kreski.
2. Przygotowanie krzywej wzorcowej
Do pięciu kolb miarowych o pojemności 50 cm
3
zawierających 25 cm
3
acetonu dodać kolejno
0.125-1.5 cm
3
roztworów żelaza o stężeniu 0.1 mg Fe/ cm
3
, następnie dodać po 10 ml 10%
NH
4
SCN (do każdej kolby), uzupełnić wodą destylowaną do kreski i dokładnie wymieszać
Zmierzyć absorbancję otrzymanych roztworów wzorcowych na kolorymetrze wobec wody,
jako odnośnika przy długości fali λ.= 495 nm (Rys. 1). Należy uważać, aby roztwory nie były
poddawane bezpośredniemu działaniu promieni słonecznych.
Rys. 1. Widmo spektralne kompleksu tiocyjanianożelazowego(III).

36
Na podstawie otrzymanych wyników wykreśla się krzywą wzorcową (kalibracji) w jednym z
układów:
absorbancja vs. stężenie Fe w roztworze lub absorbancja vs masa Fe w
roztworze (przy stałej objętości roztworu V=50 cm
3
).
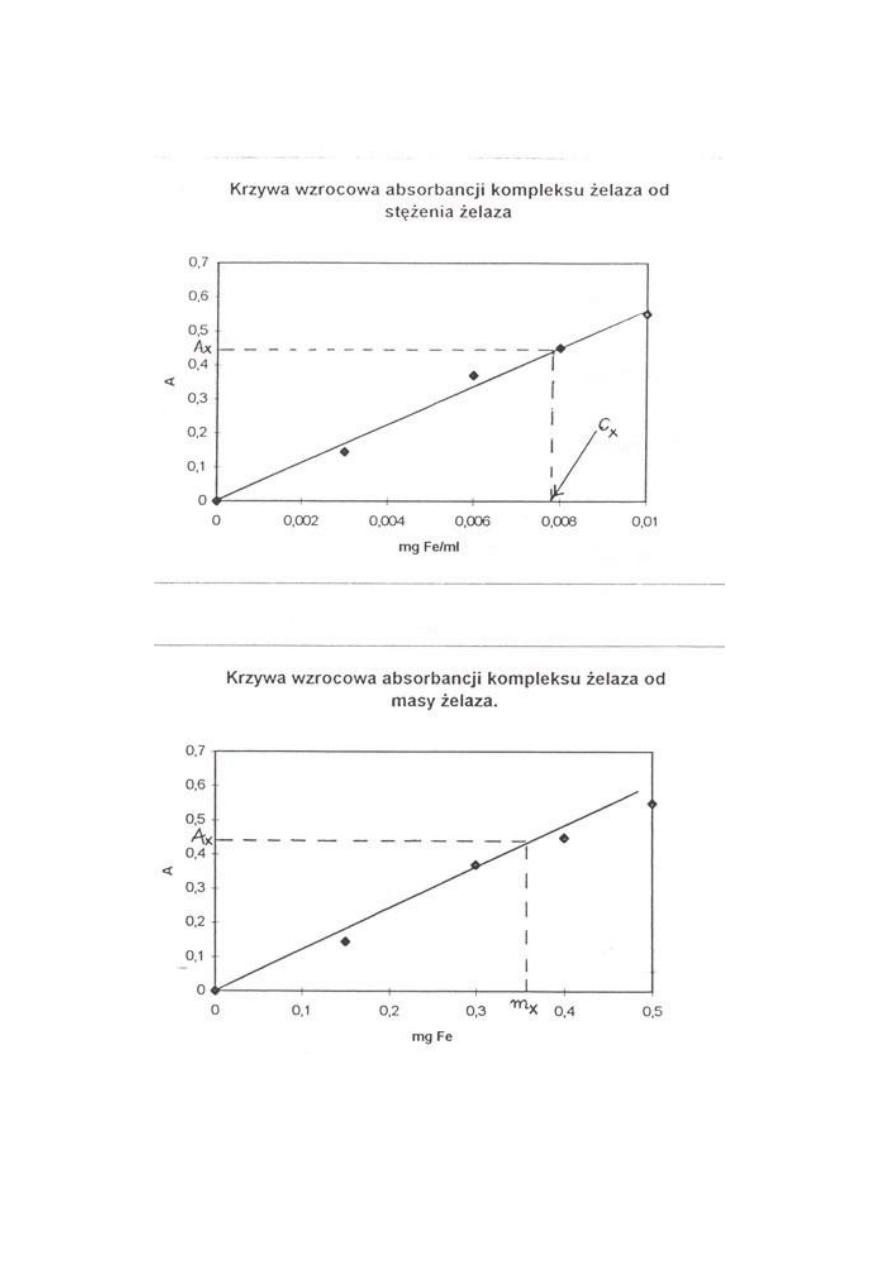
37

38
3 Oznaczanie żelaza w badanej próbie
Do otrzymanego w kolbie miarowej na 50 cm
3
zadania zawierającego nieznaną ilość żelaza
dodać: 25 cm
3
acetonu, 10 cm
3
roztworu 10%-owego roztworu NH
4
SCN, uzupełnić roztwór
wodą destylowaną do kreski i dokładnie wymieszać.
Zmierzyć absorpcję otrzymanego roztworu na spektrofotometrze wobec wody, jako odnośnika
Należy uważać, aby roztwory nie były poddawane bezpośredniemu działaniu promieni
słonecznych.
Na podstawie przygotowanej krzywej wzorcowej (kalibracji) obliczyć masę żelaza w
otrzymanym od asystenta roztworze do analizy ( w badanej próbie).
m
Fe
[mg] = ( c
x
)·50
gdzie
c
x
- stężenie Fe odczytane z wykresu A = f(c
Fe
)
lub odczytanej z wykresu A = f(m
Fe
)
39
40
41
Wyszukiwarka
Podobne podstrony:
istan Laboratorium chemiczne, BHP, Instrukcje-Stanowiskowe
5 2 3a CCNA1 Laboratorium pl id Nieznany (2)
BHP Modul 4 tresc id 84462 Nieznany (2)
BHP Modul 2 tresc id 84460 Nieznany (2)
Instrukcja BHP formatyzerko c 150250 id 215772
Laboratorium wiczenie6 id 26186 Nieznany
Automatyka Laboratorium Nr 1 id 73181 (2)
Instrukcja bhp w laboratorium, Bhp Nieposegregowane
BBP0392 SLUZBA BHP ORGANIZACJA I DZIALANIE id 8191 (2)
BHP Modul 1 tresc id 84459 Nieznany (2)
Podstawy Automatyki Laborator Opracowanie id 72970
Laboratoria 3 (wypelniona) id 2 Nieznany
BHP Wyklad 10 id 84576 Nieznany (2)
więcej podobnych podstron