Mechanizmy reakcji
Seminarium 1
podstawy, ładunek formalny, hybrydyzacja
ILOŚĆ WIĄZAŃ
(wymagana ilość elektronów- ilość obecnych elektronów)/2= ilość
wiązań.
(wymagana liczba to 2 dla każdego atomu wodoru i 8 dla pozostałych, za wyjątkiem tych z
grupy IIIA dla których jest to liczba 6, ilość obecnych to ta wynikająca z położenia w układzie
okresowym))
ILOŚC PIERŚCIENI I/LUB WIĄZAŃ NIENASYCONYCH. Na podstawie ilości
atomów węgla oblicz ilość atomów wodoru dla nasyconego węglowodoru (2n+1).
Oblicz - od ilości atomów wodoru odejmij 1 na każdy atom azotu lub fosforu i dodaj 1
na każdy atom halogenu. Otrzymana sumę odejmij od obliczonej wcześniej liczby
atomów wodoru dla węglowodoru nasyconego. Obliczona liczbę podziel przez dwa.
Otrzymana w ten sposób wielkość stanowi o ilości wiązań podwójnych i/lub
pierścieni. Takie obliczenia nie sprawdzają się jeżeli struktura zawiera atomy o
większej niż 8 elektronowej powłoce walencyjnej.
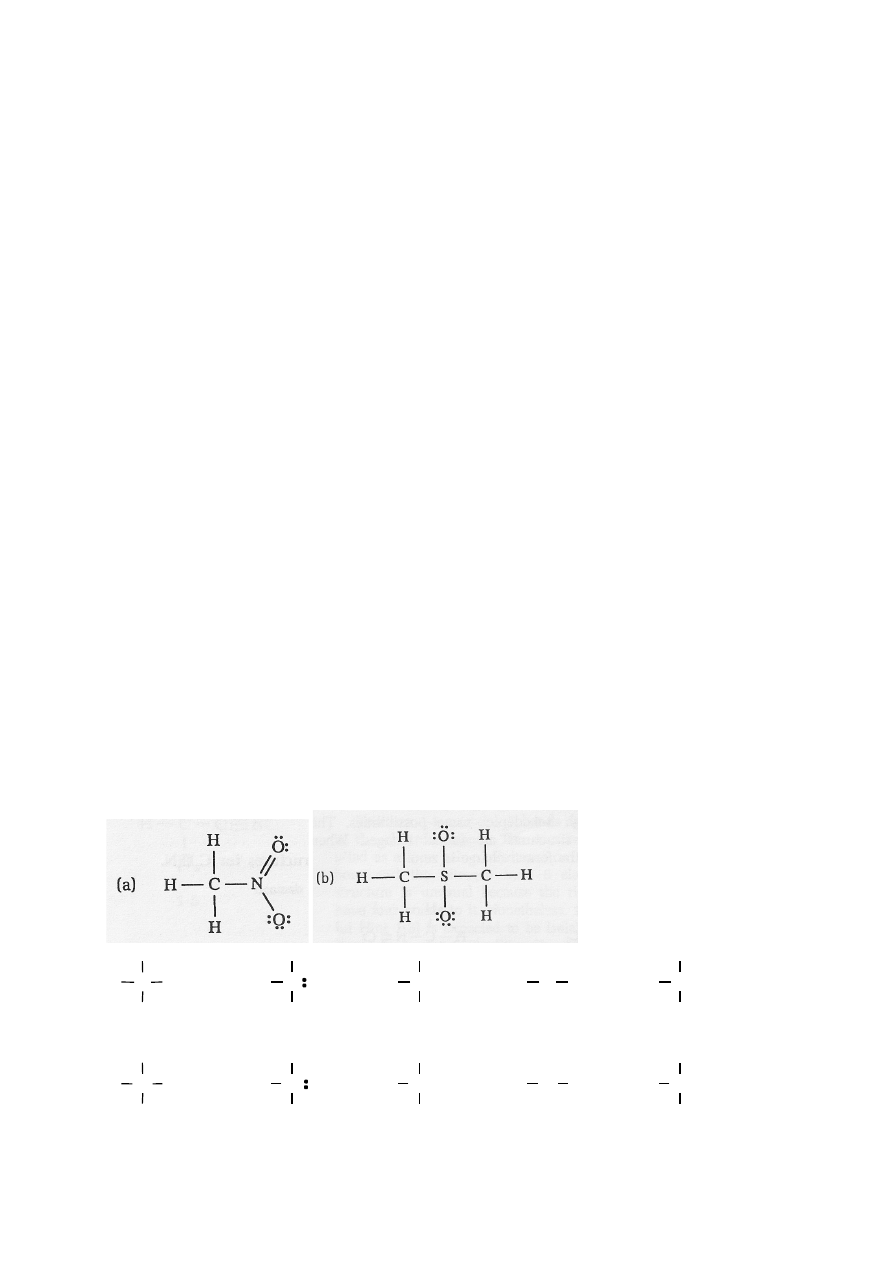
ŁADUNEK FORMALNY NA ATOMIE. (Ilość nieuwspólnionych elektronów +
(ilość uwspólnionych elektronów/2) = A Jeżeli A odpowiada ilości elektronów
walencyjnych atomu wynikającej z położenia danego atomu w układzie okresowym to
ładunek formalny na atomie wynosi 0. Ładunek jest ujemny (-1 na każdy nadmiarowy
elektron) lub dodatni (+1 na każdy brakujący elektron)
!!! Przy obliczeniach uwzględnij
Przykładowe zadania
1. Oblicz ilość wiązań i pierścieni dla
C
2
H
2
Cl
2
Br
2
, C
2
H
3
N, ……………….przygotuj swoje przykłady
2. Oblicz ładunki formalne na poszczególnych atomach
C
H
H
H
H
C
H
H
H
C
H
H
H
C
H
H
C
H
H
H
..
.
N
H
H
H
H
N
H
H
H
N
H
H
H
N
H
H
N
H
H
H
..
.

O
H
H
H
O
H
H
H
H
O
H
H
O
H
H
H
..
.
O
H
H
..
..
H C C N
H
H
H C C N
H
H
C
H
H
H
C N
C
H
H
C N
H
C
H
H
N C
H
3. Określ hybrydyzację poszczególnych atomów oraz geometrię poszczególnych fragmentow
……………….przygotuj swoje przykłady
Document Outline
Wyszukiwarka
Podobne podstrony:
dyd tech405a, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
dyd tech412, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna
dyd tech409 12a, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organi
dyd tech407a, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
dyd tech407b, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
dyd tech404b, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
dyd tech406b, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
dyd tech413, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna
dyd tech404a, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
dyd tech403a, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
dyd tech409, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna
dyd tech402, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna
dyd tech406, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna
dyd tech410, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna
dyd tech411, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna
dyd tech401a, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
dyd tech406a, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
dyd tech414, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna
więcej podobnych podstron