
ANALIZA ZWIĄZKÓW ORGNICZNYCH
OGÓLNE PRÓBY WYKRYWANIA PSZCZEGÓLNYCH GRUB ZWIĄZÓW
WĘGLOWODORY
Rodzaj
węglowodor
u
Reakcje charakterystyczne
Wynik próby
nasycony
Rozpuszczalność w stęż.
H
2
SO
4
negatywny
nienasycony
Rozpuszczalność w stęż.
H
2
SO
4
rozpuszczenie się próbki lub zmiana
zabarwienia lub ogrzanie się próbki lub
wydzielenie się pęcherzyków gazu
Reakcja z wodą bromową
(Br
2aq.
)
zanik żółtej barwy wody bromowej
Reakcja z KMnO
4
zanik fioletowej barwy KMnO
4
i powstanie
brunatnego osadu MnO
2
aromatyczny
Rozpuszczalność w stęż.
H
2
SO
4
negatywny
Reakcja Le Rosena
powstanie czerwonobrunatnego lub
brunatnego związku policyklicznego
Reakcja z chloroformem i
AlCl
3
powstanie barwnych kompleksów
FLUORWCOPOCHODNE I ZWIĄZKI NITROWE
Wykrywanie azotu i fluorowców – stapianie z sodem, próba Lassaigne'a ( wykrywanie azotu), reakcja z AgNO
3
( wykrywanie fluorowca)
ZWIĄZKI NITROWE
Potwierdzenie obecności grupy nitrowej - reakcja z difenyloaminą
W probówce umieszcza się kroplę benzenowego roztworu badanego związku i kroplę 5 % benzenowego
roztworu difenyloaminy i ogrzewa się we wrzącej łaźni wodnej. Po odparowaniu rozpuszczalnika na dnie
probówki powstaje w razie obecności nitrozwiązku stop barwy żółtopomarańczowej.
ALKOHOLE I FENOLE
Próba na obecność alkoholu
Do probówki odmierza się około 1 ml badanej substancji i dodaje 0,2 ml 0,03% wodnego roztworu NH
4
V0
3
, a
następnie 1-2 krople 2,5% roztworu 8-hydroksychinoliny. Zawartość probówki należy pozostawić w statywie na
kilka minut. Pojawienie się czerwonego lub czerwono-brązowego zabarwienia roztworu potwierdza obecność
alkoholu. Do związków, które dają próbę negatywną należą: alkohol allilowy, benzylowy, gliceryna jak również
aminoalkohole i hydroksykwasy.
Wykrywanie fenoli
Badanie rozpuszczalności w 5% NaOH
Do probówki zawierającej około 0.lg substancji stałej lub 0.2ml substancji ciekłej dodaje się 4ml 5% roztworu
NaOH. Następnie należy delikatnie wytrząsać zawartość i sprawdzić efekt oddziaływania NaOH na analizowaną
substancję. W tych warunkach w przypadku o- i p- wielowodorotlenowych fenoli następuje reakcja utlenienia
tlenem atmosferycznym. Skutkiem tego jest powstanie brązowego zabarwienia roztworu.
Badanie rozpuszczalności w 5% NaHCO
2
Do probówki dodjae się okolo 0,05g badanej substancji stalej lub 0,2 mloraz 2ml 5% roztworu NaHCO
3
i
delikatnie wytrząsa. Należy uważnie obserwować, czy podczas rozpuszczania substancji nie wydzielają się
pęcherzyki gazu.
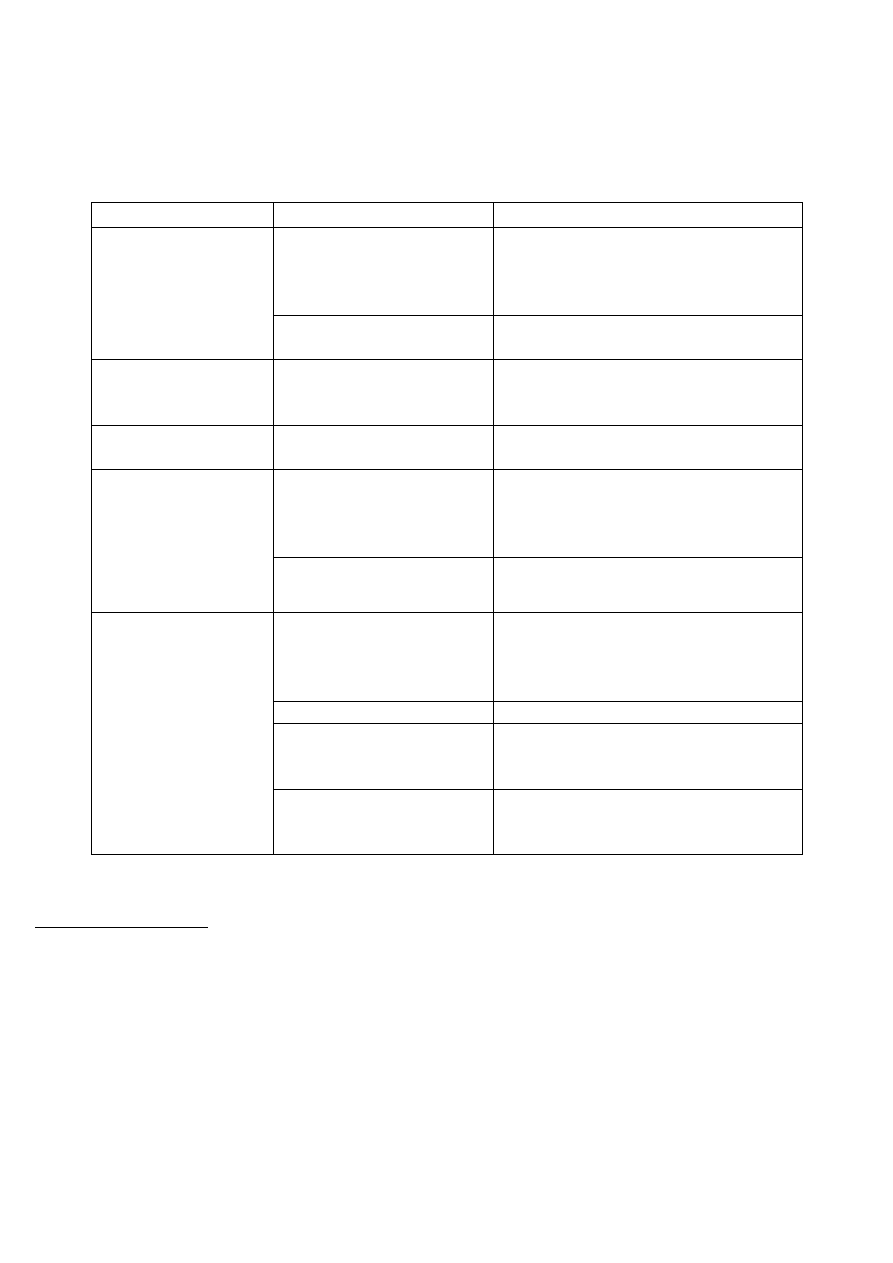
Próba wykrywania fenoli z chlorkiem żelaza (III)
Do probówki dodaje się kilka kropel przygotowanego roztworu fenolu (około 0,1 g rozpuszcza się w wodzie lub
40% etanolu), a następnie dodaje się po jednej kropli 1% roztwór FeCl
3
aż do pojawienia się zabarwienia
(czasem tylko przejściowego). Do drugiej probówki należy dodać sam rozpuszczalnik (woda lub 40% etanol)
oraz taką samą objętość 1% roztworu FeCl
3
- próba ślepa. Zmianę zabarwienia porównuje się wobec próby
ślepej.
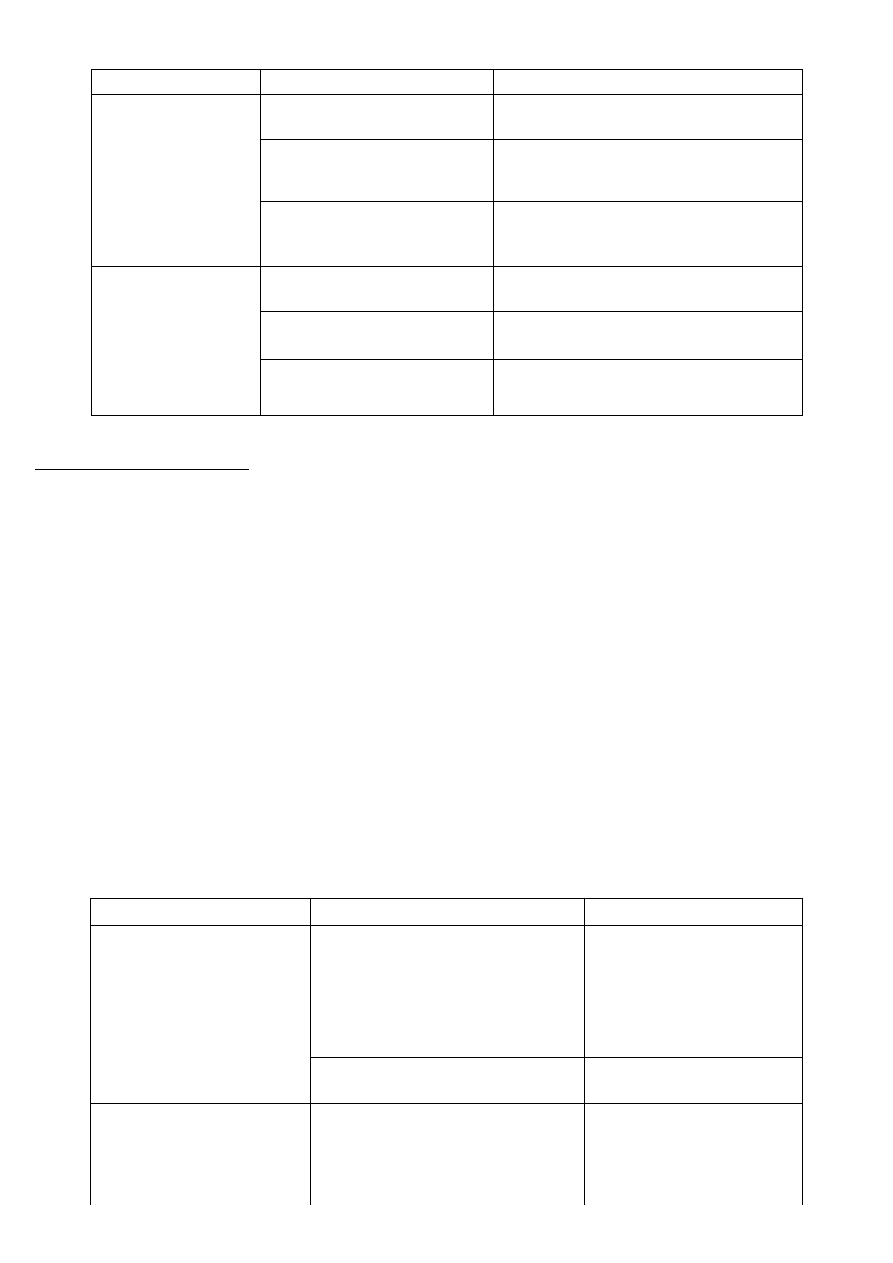
Rodzaj alkoholu
Reakcje charakterystyczne
Wynik próby
Alkohol
próba wykrywająca obecność
alkoholu: reakcja z
metawanadanem amonu i 8-
hydroksychinoliną
Powstawanie czerwono-brązowego
zabarwienia
reakcja z sodem
Gwałtowne wydzielenie się pęcherzyków
wodoru
Alkohol nienasycony
Reakcja z wodą bromową
(Br
2aq
.)
odbarwianie wody bromowej
Alkohole
wielowodorotlenowe
Reakcja z galaretowatym
osadem Cu(OH)
2
Powstaje szafirowy roztwór
Rzędowość alkoholu
próba Lucasa
Zmętnienie natychmiastowe - Alkohol III
rz.
Po 5-10 min, zmętnienie - alkohol II rz.
Brak zmian - alkohol I rz.
Reakcja ze stężonym HC1
Tylko alkohole III rz. dają zmętnienie po
kilku minutach
Fenol
Rozpuszczalność w
5%NaOH i 5%NaHC0
3
Przy użyciu 5%NaOH może wydzielać
się osad, zmieniać barwa roztworu, przy
użyciu 5%NaHC0
3
brak objawów reakcji
Próba z FeCl
3
Powstają barwne kompleksy
Utlenianie fenoli np. próba
Tollensa
Powstaje metaliczne srebro w postaci
„lustra" na ściankach probówki, lub
szary osad
Reakcje pierścienia
aromatycznego fenoli np. Br
2
aq
Odbarwienie wody bromowej z
możliwością powstawania osadu
ALDEHYDY I KETONY
OGÓLNE PRÓBY WYKRYWANIA GRUPY KARBONYLOWEJ
Reakcja z 2,4 dinitrofenylohydrazyną
Do probówki odmierza się 2-3 krople lub 0,1 g badanej substancji rozpuszczonej w jak najmniejszej ilości wody
lub etanolu a następnie 3ml 2,4-dinitrofenylofydrazyny. Probówkę koniecznie należy ogrzać do wrzenia i
schłodzić. Powstający po ochłodzeniu osad żółty, pomarańczowy lub ceglastoczerwony potwierdza obecność
grupy karbonylowej. Jeżeli osad nie powstaje zaraz po schłodzeniu to próbę należy odstawić na 10 min. w
temperaturze pokojowej.
Reakcja z hydroksylaminą
0,4g chlorowodorku hydroksyloaminy rozpuszcza się w 2ml wody i dodaje się 2ml IM NaOH i 0,2g badanego
związku. Dla substancji nierozpuszczalnych w wodzie dodaje się etanolu aż do uzyskania klarownego roztworu.
Całość ogrzewa się 15 min w łaźni wodnej, a następnie chłodzi w wodzie z lodem. Jeżeli z zimnego roztworu
osad nie wypada dodaje się wody.
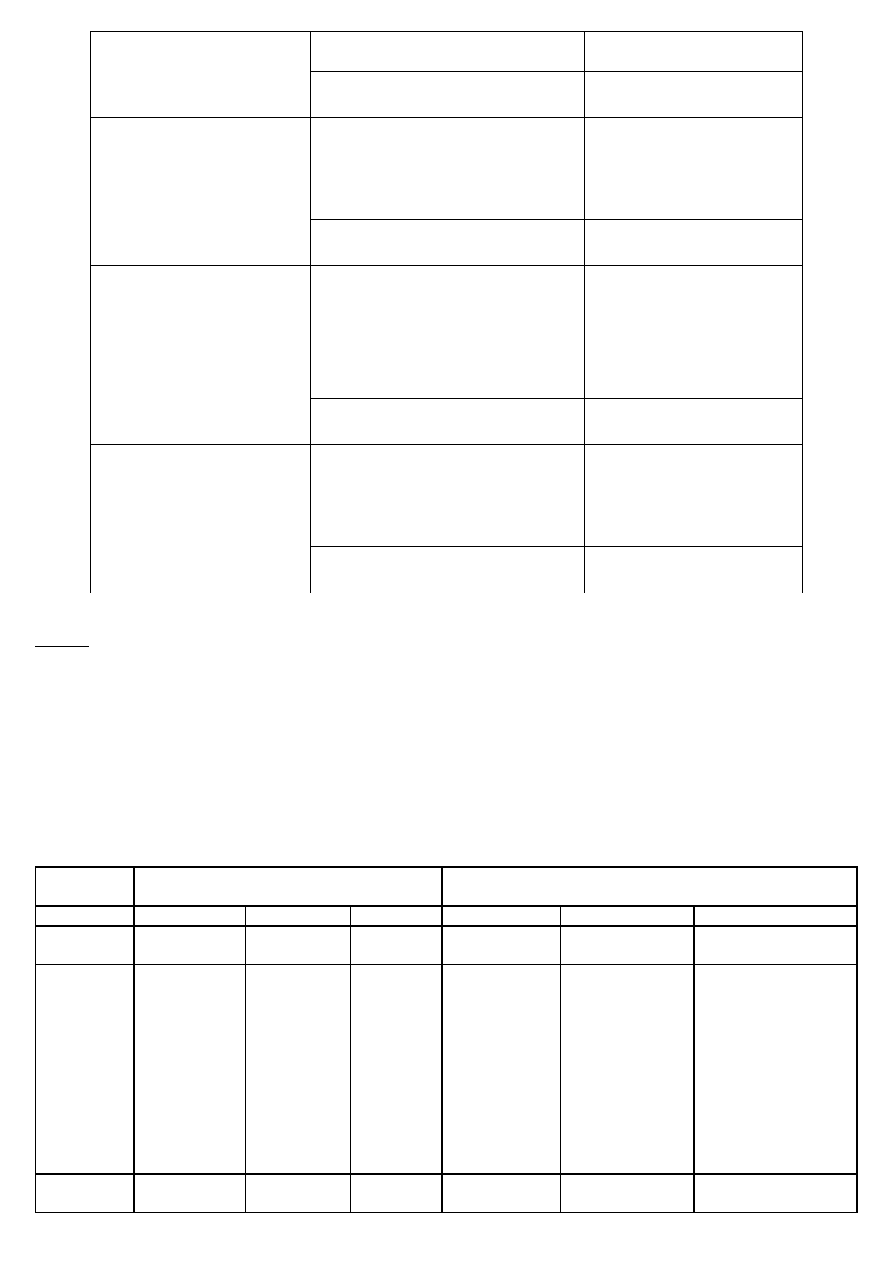
Rodzaj związku
Reakcje charakterystyczne
Wynik próby
Aldehyd
2,4 dinitrofenylohydrazyną
Powstanie barwnego osadu
Próba Tollensa
Powstanie metalicznego srebra w postaci
„lustra" na ściankach probówki, lub
szarego osadu
Próba Fehlinga
Powstawanie ceglastoczerwonego osadu
keton
2,4 dinitrofenylohydrazyną
Powstanie osadu
Reakcja Legała
Powstanie brunatnoczerwonego
zabarwienia
Reakcja Zimmermanna
Powstanie brunatnoczerwonego
zabarwienia
KWASY KARBOKSYLOWE
Próba z wodorowęglanem sodu - NaHCO
3
Próba z wodorowęglanem sodu pozwala odróżnić kwasy karboksylowe od fenoli.
Do probówki dodaje się około 1 ml 5% roztworu NaHCC>3 i kroplę lub 0.0lg substancji badanej. Wydzielanie się
pęcherzyków CO2 wskazuje na obecność kwasu.
Próba ze wskaźnikiem uniwersalnym
0, 1 ml lub 0,05 g badanej substancji rozpuszcza się na szkiełku zegarkowym w około 1 ml
wody destylowanej.
Do przygotowanego roztworu zanurza się papierek wskaźnikowy i odczekuje minutę. Porównanie zabarwienie
papierka ze wzorcową skalą barw odpowiadających określonemu zakresowi pH dostarcza informacji o
charakterze badanej substancji.
Próba z fenoloftaleiną
Związki o charakterze kwasowym odbarwiają zasadowy roztwór fenoloftaleiny.
Próba jodan - jodek
Do probówki zawierającej około 5mg badanej substancji lub dodaje się (nasycony roztwór w 2 kroplach etanolu)
zadaje się w probówce 2 kroplami 2% roztworu KI i 2 kroplami 4% roztworu KIO3. Probówkę zamyka się
zwitkiem waty i ogrzewa przez minutę we wrzącej łaźni wodnej. Po oziębieniu dodaje się 4 krople 0.1% roztworu
skrobi. W obecności kwasów powstaje wolny jod, który zabarwia skrobię na kolor fioletowy lub
fioletowoniebieski.
Rodzaj substancji
Reakcje charakterystyczne
Wynik próby
Kwas alifatyczny
Reakcja z fenoloftaleiną, Reakcja z
NaHCO 3
Odbarwianie roztworu
fenoloftaleiny
Wydzielanie
pęcherzyków gazu
Reakcja z FeCl
3
Powstawanie czerwone
zabarwienia
Kwas aromatyczny
Reakcja z fenoloftaleiną, Reakcja z
NaHCO 3
Odbarwianie roztworu
fenoloftaleiny
Wydzielanie
pęcherzyków gazu
Reakcja nitrowania
Powstaje żółte
zabarwienie
Kwas aromatyczny z grupą
hydroksylową
Reakcje z fenoloftaleiną, NaHC0
3
Odbarwianie roztworu
fenoloftaleiny Wydzielanie
pęcherzyków gazu
Reakcja z FeCl
3
Powstaje fioletowe
zabarwienie
Kwas alifatyczny z grupą
hydroksylową
Reakcje z fenoloftaleiną, NaHC0
3
Odbarwianie roztworu
fenoloftaleiny
Wydzielanie
pęcherzyków gazu
Reakcja z KMn0
4
Odbarwianie roztworu
KMn0
4
Kwas
dikarboksylowy
Reakcje z fenoloftaleiną, NaHC0
3
Odbarwianie roztworu
fenoloftaleiny Wydzielanie
pęcherzyków gazu
Reakcja z rezorcyną
Powstawanie barwy
niebieskiej
AMINY
POTWIERDZENIE OBECNOŚCI AZOTU
Próba Lassaigne'a
Metoda Willa i Varrentrappa.
Metodą tą można wykrywać azot związany w grupie aminowej pierwszorzędowej -C-NH
2
, amidowej –CONH
2
oraz -C=NH w grupie iminowej lub –(CO)
2
NH w grupie imidowej.
W suchej probówce ogrzewamy płomieniem palnika gazowego taką samą ilość badanej próbki (np. 0,1 lub 0,2 g)
i wapna sodowanego (równocząsteczkowa mieszanina NaOH i Ca(OH)
2
). W trakcie ogrzewania dochodzi do
powstania m.in. amoniaku, który pod wpływem temp. ulatnia się zabarwiając zwilżony wodą papierek
uniwersalny.
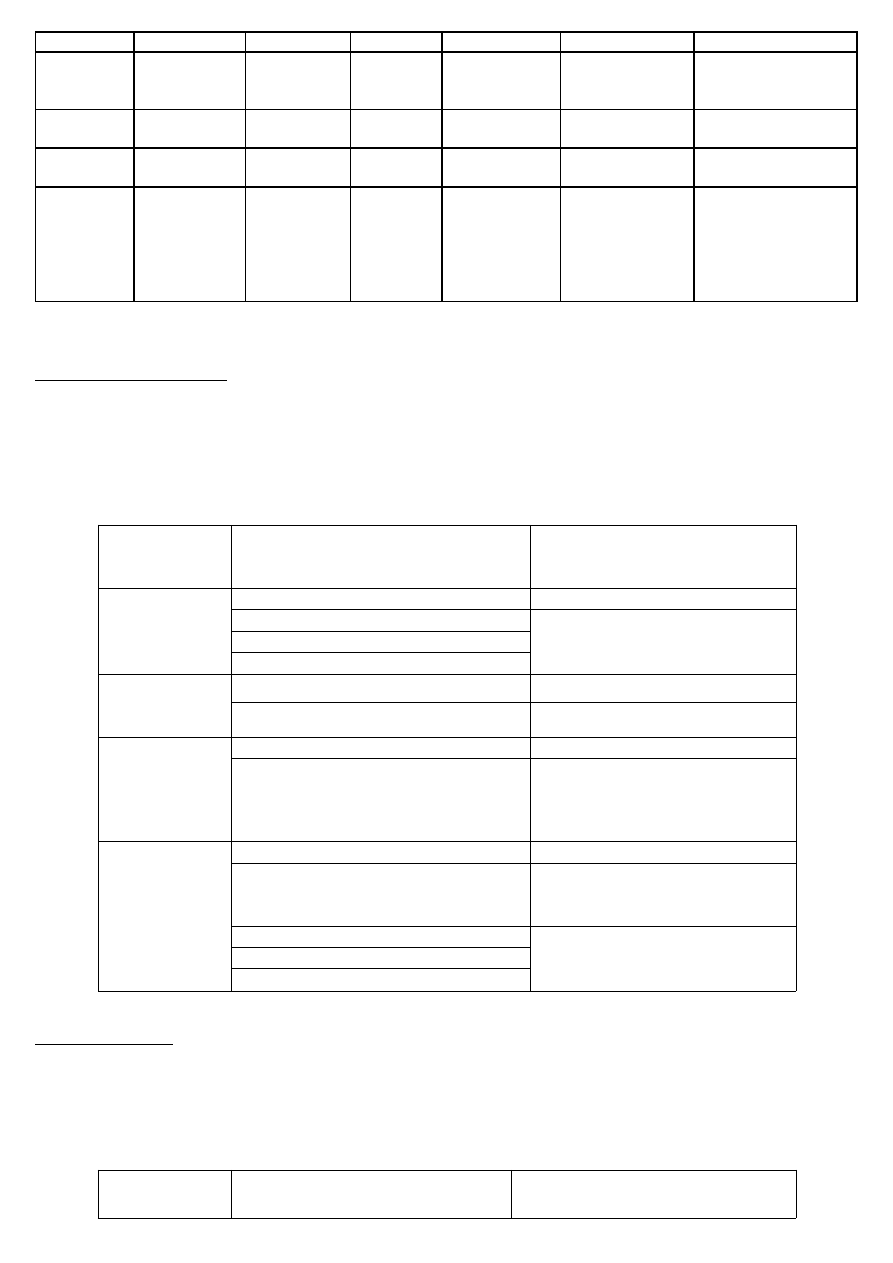
Rodzaj
reakcji
Aminy alifatyczne
Aminy aromatyczne
1
o
2
o
3
o
1
o
2
o
3
o
Metoda
Hinsberga
+
+
-
+
+
-
Reakcja z
HNO
2
+
pęcherzyki
azotu
+
żółty lub
pomarańcz
owo-
żółty olej
-
+
Bezbarwne
sole
diazoniowe,
Sprzęganie z
2-naftolem
dają
czerwone
zabarwienie
+
żółty osad
+
(reagują
tylko
aminy
nie
podstawione
w
pozycji para- )
p-nitrozopochodne
o barwie żółto-
pomarańczowej, po
zalkalizowaniu
zasada o barwie
zielonej
Reakcja
ninhydryno
+
-
-
+
-
-
wa
Reakcja
izonitrylow
a
+
-
-
+
-
-
Próba
Riminiego
+
-
-
-
-
-
Próba
Simona
-
+
-
-
-
-
Reakcja z
kwasem
cytrynowy
m
w
bezwodnik
u octowym
-
-
+
-
-
+
AMINOKWASY I BIAŁKA
REAKCJA NINHYDRYNOWA
Reakcja ta nie jest specyficzna wyłącznie dla aminokwasów. Amoniak oraz część związków zawierających I-
rzędową grupę aminową dają z ninhydryną charakterystyczne zabarwienie. Aminokwasy, peptydy i białka
powodują iż powstaje zabarwienie niebieskie, fioletowe, czerwono-fioletowe lub czerwone.
Ok. 50 mg aminokwasu należy rozpuścić w ok. 0,5 ml 0,2% etanolowego roztworu
ninhydryny. Zabarwieniepowstaje natychmiast lub dopiero w następstwie ogrzania mieszaniny do wrzenia.
Rodzaj
substancji
Reakcje charakterystyczne
Wynik próby
a-Aminokwas
Stapianie z sodem i próba Lassaigne'a Potwierdzenie obecności azotu
Reakcja ninhydrynowa
Reakcja z solami miedzi
Reakcja deaminacji i dekarboksylacji
Reakcja pozytywna
Aminokwas z
ugrupowaniem
aromatycznym
Stapianie z sodem i próba Lassaigne'a Potwierdzenie obecności azotu
Reakcja ksantoproteinowa
Reakcja pozytywna
Aminokwas
zawierający
siarkę(grupa -SH
lub -CH
2
-S-CH
3
)
Stapianie z sodem i wykrywanie siarki
Potwierdzenie obecności siarki
Wykrywanie grup tiolowych
Reakcja pozytywna, jeśli
występuje grupa -SH, negatywna,
gdy siarka występuje w postaci
-CH
2
-S-CH
3
Białko
Reakcja ninhydrynowa
Reakcja pozytywna
Reakcja ksantoproteinowa
Reakcja pozytywna jeśli w skład
białka wchodzą aminokwasy
aromatyczne
Reakcja biuretowa
Reakcje strąceniowe
Denaturacja
Reakcja pozytywna
WĘGLOWODANY
Reakcja Molischa
Dodatni wynik reakcji dają sacharydy, aldehydy, kwasy organiczne oraz aceton.
Do probówki zawierającej ok. 1 ml wodnego roztworu próbki dodać 2 krople 10% rozt. P-naftolu (odczynnik
Molischa). Następnie dodać 1 ml stęż. H
2
SO
4
, wlewając po ściankach probówki tak, aby ciecze się nie
zmieszały. Na granicy faz pojawiają się charakterystyczne pierścienie o barwie niebieskiej lub fioletowej.
Rodzaj
substancji
Reakcje charakterystyczne
Wynik próby

Sacharydy
Reakcja Molischa
potwierdzenie obecności sacharydu
Mono- i
disacharydy
Redukcja odczynnika Barfoeda
monosacharydy natychmiast
redukują Cu
2+
, a disacharydy po
hydrolizie
Tworzenie osazonów
wytrącony osad po
przekrystalizowaniu wykazuje
temperaturę topnienia
charakterystyczną dla danego cukru
Aldozy/ ketozy Reakcja barwna z roztworem
mocznika i chlorku cynawego
ketozy dają zabarwienie niebieskie, a
aldozy (po podgrzaniu) czerwone
Pentozy/
heksozy
Reakcja barwna z kwaśnym
roztworem aniliny i kwasu octowego
pentozy dają zabarwienie czerwone,
metylopentozy - żółtoczerwone, a
heksozy nie dają zabarwienia
Metody wykrywania związków organicznych.
WĘGLOWODORY
Rozpuszczalność w stęż. H
2
SO
4
Rozpuszczanie się substancji w stężonym kwasie siarkowym wiąże się często z jakąś reakcją. Zewnętrznym
przejawem takiej reakcji może być rozgrzewanie się roztworu, wydzielanie się gazów itp. Węglowodory
nasycone oraz aromatyczne w temperaturze pokojowej nie rozpuszczają się w stężonym kwasie siarkowym -
dają negatywny wynik próby. Węglowodory nienasycone przechodzą w postać rozpuszczalnych w wodzie estrów
kwasu siarkowego:
Wykonanie:
W probówce należy umieścić 0,1 g lub 0,2 ml badanej substancji, a następnie ostrożnie dodać 3 ml stęż. H
2
S0
4
.
Przez 1-2 min należy obserwować zachowanie się próbki, ewentualnie delikatnie ją wstrząsając. Pozytywnym
wynikiem próby jest nie tylko fizyczne rozpuszczenie się próbki, ale również zmiana zabarwienia, ogrzanie się
próbki, wydzielenie się pęcherzyków gazu.
Reakcja z wodą bromową (Br
2aq.
)
Związki zawierające wiązanie nienasycone (alkenowe lub alkinowe) ulegają reakcjom typu addycji, czyli
przyłączania. Przykładem takiej reakcji jest przebiegająca z różna szybkością reakcja addycji bromu:
Wykonanie:
W probówce należy umieścić 2 ml badanej substancji lub 0,1 g badanej substancji rozpuszczonej w 2 ml
chloroformu. Następnie wkraplać wodę bromową obserwując jej ewentualne odbarwienie się.
Reakcja z manganianem (VII) potasu (KMnO
4
)
Związki zawierające wiązanie nienasycone ulegają reakcji utleniania powodując odbarwienie wodnego roztworu
KMnO
4
oraz wydzielenie brunatnego osadu MnO
2
.
Wykonanie:
Do 0,5 ml badanej substancji lub roztworu ok. 0,1 g badanej substancji w wodzie lub acetonie dodawać kroplami
1-2 % roztworu wodnego KMnO
4
. Odbarwienie się roztworu w czasie 1-5 min i wydzielenie brunatnego osadu
MnO
2
jest pozytywnym wynikiem próby.
Reakcja Le Rosena
Węglowodory aromatyczne mono- i policykliczne, cykloalkeny (np. cykloheksen) oraz ich pochodne dają barwna
reakcję z roztworem formaldehydu w stęż. H
2
SO
4
(odczynnik Marquisa). Reakcji tej nie dają ani alkany i
cykloalkany, ani alkeny.
Wykonanie:
Do 0,1 g lub 1 ml badanej substancji dodać 2-3 ml odczynnika. Obserwować tworzenie się czerwonobrunatnego
lub brunatnego związku policyklicznego.
Reakcja z chloroformem i AlCl
3
Węglowodory aromatyczne i policykliczne dają z bezwodnym AlCl
3
w roztworze CHCl
3
barwną reakcję w wyniku
tworzenia barwnych pochodnych trifenylometanu.
Wykonanie:
W probówce umieścić 0,5 ml lub 0,1 g badanej substancji, a następnie dodać 1-2 ml CHCl
3
(suchego). Probówkę

wstrząsnąć w celu zwilżenia jej ścianek. Następnie do ukośnie ułożonej probówki dodać niewielką ilość
bezwodnego AlCl
3
, tak aby zatrzymał się na zwilżonych ściankach probówki. W przypadku obecności
węglowodorów aromatycznych na ściankach tworzy się punktowe zabarwienie (różne w zależności od rodzaju
węglowodoru np. naftalen daje zabarwienie niebieskie, fenantren – czerwono purpurowe).
Wykrywanie azotu i fluorowców.
Stapianie z sodem.
Wykrywanie tych pierwiastków w związkach organicznych polega najczęściej na przeprowadzeniu ich w stan
jonowy, co następuje w wyniku stapiania związków organicznych lub organiczno-nieorganicznych z metalicznym
sodem. Produktami zachodzących reakcji są proste związki nieorganiczne (cyjanki i/lub halogenki sodu), w
których anion wykrywa się klasycznymi metodami jakościowej analizy nieorganicznej.
N(azot w badanym związku) + C + Na → NaCN
X (chlor, brom, fluor, jod w badanym związku) + Na → NaX
Wykonanie:
W małej probówce (wysokość 2-4 ml i średnica 0,5 ml) umieszcza się niewielką ilość badanej substancji ok. 0,02
g oraz ok. 0,1 g osuszonego na bibule metalicznego sodu (kawałek wielkości ziarenka pieprzu). Probówkę
ogrzewa się najpierw delikatnie w płomieniu palnika (do momentu wypalenia się oparów związku), a następnie
intensywnie wypraża do czerwoności. Rozżarzoną probówkę rozbija się o dno parowniczki zawierającej ok. 10-
15 ml wody destylowanej. Roztwór wodny zawierający rozpuszczone sole przesącza się, a przesącz analizuje
się pod kątem występowania jonów CN
-
bądź fluorowca. Jeśli otrzymany przesącz nie jest bezbarwny próbę
należy powtórzyć.
Wykrywanie azotu - próba Lassaigne'a
Jest to najbardziej ogólna metoda pozwalająca na wykrycie azotu bez względu na sposób jego związania w
związkach organicznych. Obecność jonów CN
-
powstałych w próbie Lassaigne'a można wykryć przez
wytworzenie błękitu pruskiego, tzw. heksacyjanożelazianu (II) żelaza (III) o wzorze Fe4[Fe(CN)6]3.
Wykonanie:
Do ok. 1-2 ml przesączu powstałego po stapianiu z sodem dodaje się kilka kryształków FeS0
4
*7H
2
0, gotuje
przez kilka minut i zakwasza 10% HCl, by rozpuścić tworzący się w środowisku zasadowym osad wodorotlenku
żelaza (II). Następnie roztwór zadaje się 1-2 kroplami 10% FeCl
3
. Obecność jonów azotu stwierdza się
obserwując zielononiebieskie zabarwienie roztworu, a po chwili wypadnięcie osadu błękitu pruskiego wg reakcji:
FeS0
4
+ 2 NaCN → Fe(CN)
2
+ Na
2
SO
2
Fe(CN)
2
+ 4 NaCN → Na
4
[Fe(CN)
6
]
3 Na
4
[Fe(CN)
6
] + 4 FeCI
3
→ Fe
4
[Fe(CN
6
]
3
+ 12 NaCI
Wykrywanie fluorowca - reakcja z AgNO
3
Anion fluorowca wykrywa się zazwyczaj dodając azotan srebra (I) do zakwaszonego kwasem azotowym
roztworu przesączu.
Wykonanie:
Do ok. 1 ml przesączu po stapianiu z sodem dodać 1 ml 10 % HNO3, a następnie 1 ml 0,1 M roztworu AgNO3.
W razie powstania osadu sprawdzić, czy rozpuszcza się w 10 % NH3 (aq.) i 10 % HNO3.
Chlorki dają biały osad AgCl, przechodzący w świetle dziennym w fiołkowy, rozpuszczalny w 10 % NH3 (aq.) i
nierozpuszczalny w 10 % HNO3.
Bromki dają jasnożółty osad AgBr, zieleniejący na świetle, trudno rozpuszczalny w 10 % NH3 (aq.) i
nierozpuszczalny w 10 % HNO3.
Jodki tworzą żółty osad Agi, nierozpuszczalny w 10 % NH3 (aq.) i 10 % HNO
3
.
Fluorki nie dają osadu z AgNO
3
ponieważ powstający AgF jest rozpuszczalny w wodzie.
Próba Beilsteina
Wykonanie:
Ok. 0,1 g substancji umieszcza się na oczyszczonej i wyprażonej szpatelce miedzianej i wprowadza do nie
świecącej części płomienia palnika gazowego. W tych warunkach związki organiczne zawierające fluorowce
tworzą przy ogrzewaniu lotne połączenia miedzi barwiące płomień palnika gazowego na kolor zielony (jod),
intensywnie niebieskozielony (chlor), zielony z niebieskim serduszkiem (brom).
ZWIĄZKI NITROWE
Związki nitrowe są połączeniami organicznymi o budowie R-NO
2
, gdzie R oznacza alkil lub aryl. W zależności
od rzędowości atomu węgla, z którym związana jest grupa nitrowa rozróżnia się nitrozwiązki 1-, II-, III-rzędowe.
Potwierdzenie obecności grupy nitrowej - reakcja z difenyloaminą
Większość związków nitrowych daje ze stopioną difenyloaminą barwne kompleksy (przeważnie

pomarańczowoczerwone) o strukturze: RN
+
(O
-
)=O → C
6
H
5
– NH - C
6
H
5
Wykonanie:
W probówce umieszcza się kroplę benzenowego roztworu badanego związku i kroplę 5 % benzenowego
roztworu difenyloaminy i ogrzewa się we wrzącej łaźni wodnej. Po odparowaniu rozpuszczalnika na dnie
probówki powstaje w razie obecności nitrozwiązku stop barwy żółtopomarańczowej.
Rozróżnienie nitroalkanów I- i II-rzędowych od III-rzędowych i aromatycznych - rozpuszczalność w NaOH
I-rzędowe i II-rzędowe nitroalkany rozpuszczają się w roztworach stężonych zasad dając żółte zabarwienie,
natomiast III-rzędowe i aromatyczne są nierozpuszczalne.
Wykonanie:
Do ok. 1 ml 20 % roztworu NaOH dodaje się 1-3 krople badanej próbki i wytrząsa obserwując ewentualne
rozpuszczenie próbki.
Rozróżnienie I- i II-rzędowych nitroalkanów - reakcja z kwasem azotowym (III)
Nitroalkany I-rzędowe reaguj a z kwasem azotowym (III), tworząc związki o charakterze nitro oksymów, zwane
kwasami nitrolowymi, których sole są barwy czerwonej:
R–CH
2
–NO
2
+ HONO → R-CH(-NO)-NO
2
↔ R-C(=N-OH)-NO
2
II-rzędowe nitroalkany w analogicznych warunkach tworzą tzw. pseudonitrole o zabarwieniu niebieskim lub
niebieskozielonym: R
2
-CH-NO
2
+ HONO → R
2
-C(-ON)-NO
2
Wykonanie:
Do ok. 0,5 ml 40 % roztworu NaOH dodaje się 2-3 krople nitroalkanu, wstrząsa, a po rozpuszczeniu dodaje się
ok. 1 ml 10 % roztworu NaN0
2
. Następnie ostrożnie wkrapla się 10% roztwór H
2
SO
4.
Rozróżnienie III-rzędowych nitroalkanów i nitrozwiązków aromatycznych - redukcja grupy nitrowej do
hydroksylaminowej
Ar-NO
2
+ 2H
2
→ Ar-NHOH + H
2
O
Ar-NHOH + Ag
2
O → Ar-NO + H
2
O + 2Ag
Wykrycie grupy -NO2 w nitrozwiązkach aromatycznych polega na jej redukcji np. do pochodnych N-
arylohydroksylaminy, które wykazując właściwości redukujące dają charakterystyczne reakcje np. lustra
srebrowego.
Wykonanie:
0,5 ml lub 0,2 g badanej substancji rozpuszcza się w ok. 10 ml 50 % etanolu, dodaje się 0,5 g NH4CI i ok. 0,5 g
pyłu cynkowego. Całość ogrzewa się kilka minut, a następnie pozostawia na 5-10 min. Po odsączeniu od
nieprzereagowanego cynku do przesączu dodaje się amoniakalnego roztworu AgN03. Pojawienie się czarnego,
szarego lub srebrzanego osadu wskazuje na obecność pochodnej hydroksylaminy, a więc grupy
Ar-N02.
ALKOHOLE
Wykrywanie grupy hydroksylowej:
-
reakcja z wanadanem(V) amonu (metawanadanem amonu) i 8-hydroksychinoliną,
-
reakcja z metalicznym sodem.
Próba na obecność alkoholu
W reakcji z metawanadanem amonu (NH
4
V0
3
) i 8-hydroksychinoliną można wykryć obecność grupy
hydroksylowej w alkoholach. Związki zawierające grupę OH tworzą barwne (czerwone lub czerwonobrązowe
zabarwienie) połączenia kompleksowe.
Wykonanie:
Do probówki odmierza się około 1 ml badanej substancji i dodaje 0,2 ml 0,03% wodnego roztworu NH
4
V0
3
, a
następnie 1-2 krople 2,5% roztworu 8-hydroksychinoliny. Zawartość probówki należy pozostawić w statywie na
kilka minut. Pojawienie się czerwonego lub czerwono-brązowego zabarwienia roztworu potwierdza obecność
alkoholu. Do związków, które dają próbę negatywną należą: alkohol allilowy, benzylowy, gliceryna jak również
aminoalkohole i hydroksykwasy.
Reakcja z sodem
Reakcja z metalicznym sodem służy do wykrywania substancji zawierających kwasowy (aktywny) wodór. Są to
alkohole i tioalkohole, fenole, kwasy, acetylen i jego pochodne, związki o czynnej grupie metylenowej, estry
(powstają acyloiny) i metyloketony. Alkohole I- rzędowe reagują z metalicznym sodem bardzo gwałtownie z
wydzieleniem gazowego wodoru, II-rzędowe wolniej, III-rzędowe bardzo słabo. Wykonanie tej próby daje
orientacyjny wynik.
2 ROH + 2 Na → 2 R-ONa + H
2
Wykonanie:
Do probówki odmierza się około lml badanej substancji, a następnie osuszony skrawek metalicznego sodu.
Wydzielanie gazowego produktu (wodoru) potwierdza obecność kwasowego wodoru w badanej próbce.

Wykrywanie alkoholi polihydroksylowych
Reakcją charakterystyczną pozwalającą odróżnić alkohole polihydroksylowe od monohydroksylowych jest
reakcja ze świeżo strąconym wodorotlenkiem miedzi (II). Alkohole polihydroksylowe tworzą z jonami miedzi
(Cu
2+
) kompleksy chelatowe o barwie szafirowej.
2Na0H + CuS0
4
→ Cu(OH)
2
+ Na
2
S0
4
Cu(OH)
2
+ 2 HO-OH → [Cu(HO-OH)]
2+
+ 2OH
-
Wykonanie:
Do probówki odmierza się około 0,5ml 10 % roztworu CuSO
4
następnie dodaje około lml 2M NaOH. Do tak
sporządzonego strąconego roztworu wodorotlenku miedzi (II) dodaje się około 0,5ml badanego alkoholu. W
wyniku zachodzącej reakcji powstaje szafirowy roztwór potwierdzający obecność alkoholu polihydroksylowego.
Rozróżnianie rzędowości alkoholi - próba Lucasa
W próbie Lucasa następuje reakcja podstawienia nukleofilowego, w miejsce OH
-
wprowadzany jest CI
-
Szybkość
reakcji substytucji nukleofilowej zależy od rzędowości alkoholi. Alkohole trzeciorzędowe w obecności
bezwodnego chlorku cynku bardzo szybko reagują z kwasem solnym. Alkohole drugorzędowe reagują wolniej i
zwykle po 5-10 min. pojawia się zmętnienie. Alkohole pierwszorzędowe w tych warunkach nie reagują.
Pozytywny wynik próby Lucasa dają również alkohol allilowy, cynamonowy i benzylowy.
Wykonanie:
Odczynnik Lucasa: 15,5g bezwodnego chlorku cynku rozpuszcza się w 10 ml stężonego kwasu solnego.
Do próbki zawierającej badany alkohol w ilości około 0,2ml dodaje się ok. 2ml odczynnika Lucasa. Probówkę
zamyka się korkiem i mocno wstrząsa. Pozostawia probówkę w statywie i obserwuje czy powstaje warstwa
oleista lub mlecznobiała emulsja pochodząca od wydzielającego się odpowiedniego chlorku alkilowego.
Rozróżnianie rzędowości alkoholi - reakcja ze stężonym HCI
Alkohole drugorzędowe i pierwszorzędowe w reakcji ze stężonym HCI dają roztwór klarowny (brak reakcji).
Alkohole trzeciorzędowe w ciągu kilku minut dają zmętnienie.
Wykonanie:
Do probówki zawierającej około 0,5ml badanej substancji dodaje się nadmiar stężonego HCI wstrząsa i
pozostawia. Powstanie zmętnienia dowodzi obecności alkoholu III.
Utlenianie alkoholi
Reakcji utlenienia za pomocą manganianu(VII) potasu ulegają tylko alkohole I i II rzędowe. Podczas utleniania
KMnO
4
alkoholi I-rzędowych powstają kwasy karboksylowe, natomiast alkohole II-rzędowe utleniają się do
ketonów. W przypadku metanolu produktami utlenienia są C0
2
i H
2
0
Próba z KMnO
4
Roztwór KMnO
4
należy do mocnych utleniaczy, ma on barwę fioletową (jony MnO
4
-
nadają zabarwienie). W
obecności alkoholi I i II rzędowych w środowisku kwasowym zachodzi reakcja redukcji KMnO
4
Następuje
wówczas odbarwienie roztworu (powstają jony Mn
2+
).
Alkohol I rzędowy + KMnO
4
→ kwas karboksylowy + Mn
2+
Alkohol II rzędowy + KMnO
4
→ keton + Mn
2+
Alkohol III rzędowy + KMnO
4
→ brak reakcji
Wykonanie:
Do probówki zawierającej około 0,2ml badanego alkoholu dodaje się 3ml 20% H
2
S0
4
(rozcieńczony wodą w
stosunku 1:5) a następnie kilka kropel (3-5) roztworu 2% KMnO
4
. Probówkę delikatnie ogrzewa się i obserwuje
zmianę barwy roztworu.
Rozróżnianie rzędowości alkoholi - próba Bordwella i Wellmana
W reakcji Bordwella i Wellmana wykorzystuje się kwas chromowy (VI), który pod wpływem alkoholi 1 i II rz. ulega
redukcji (przejście chromu z VI na III stopień utlenienia). Obserwuje się zmianę zabarwienia roztworu z
pomarańczowego na zielone. Alkohole III rz. w tych warunkach nie reagują.
3C
2
H
5
OH + 2H
2
CrO
4
+ 6H
+
→ 3H
3
CCHO + 2Cr
2+
+ 8H
2
O
3(CH
3
)
2
CHOH + 2H
2
CrO
4
+ 6H
+
→ 3(H
3
C)
2
CO + 2Cr
2+
+ 8H
2
O
Wykonanie:
W probówce umieszcza się około lem 3% acetonowego roztworu alkoholu, następnie dodaje się 1 kroplę
odczynnika Bordwella i Wellmana. Mieszaninę delikatnie wytrząsa przez 10 sekund. Należy zaobserwować
zmianę zabarwienia.
Odczynnik Bordwella i Wellmana: lg CrO
3
rozpuszcza się w lem stężonego kwasu siarkowego(VI) i 3 ml wody
Rozróżnianie rzędowości alkoholi - próba Feigla
Próba Feigla pozwala wykryć alkohole Il-rzędowe, które utleniają się do ketonów z wydzieleniem siarkowodoru
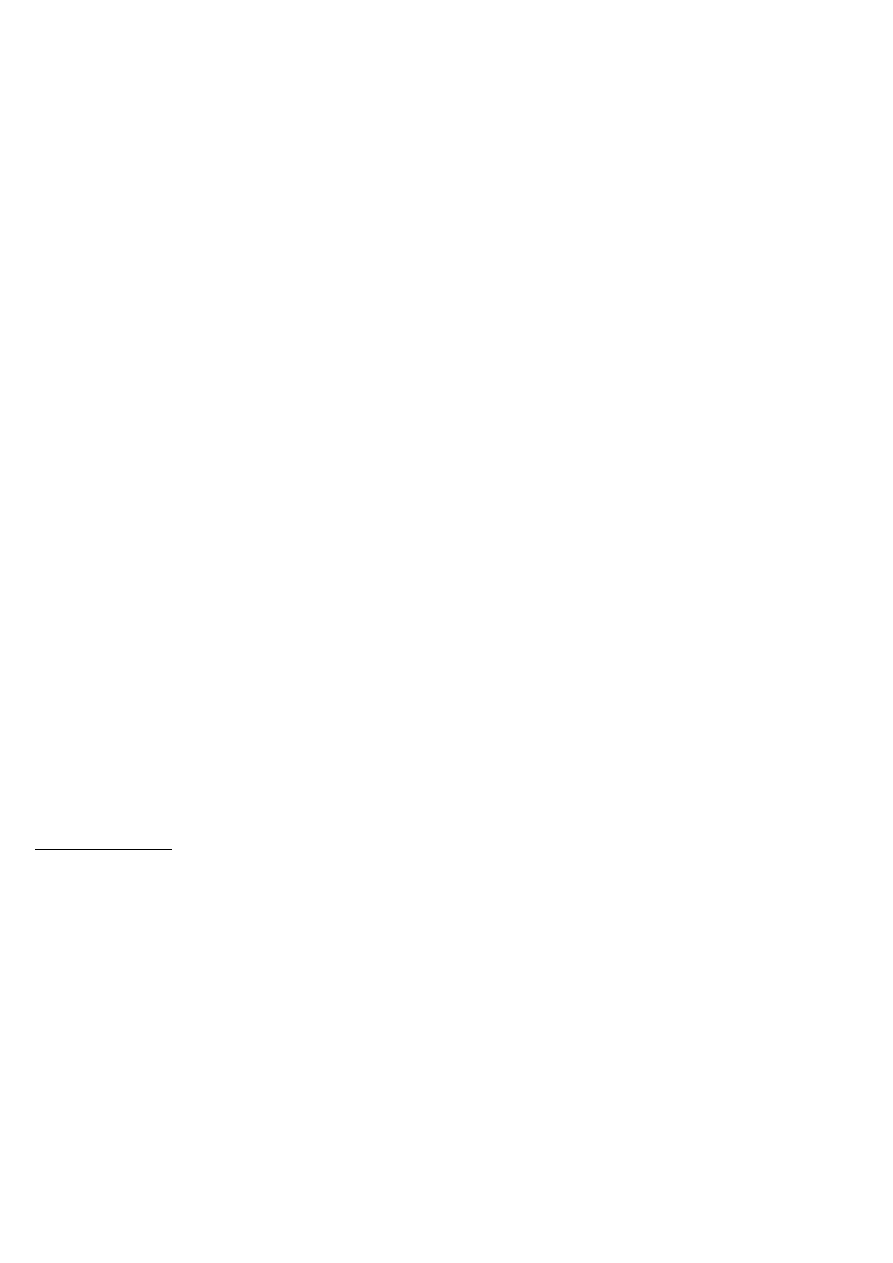
(CH
3
)
2
CHOH + S → (CH
3
)
2
CO +H
2
S
Wykonanie:
Do probówki wprowadza się kroplę badanego alkoholu i kroplę 2% roztworu siarki w CS
2
. Całość umieszcza się
w łaźni olejowej ogrzanej uprzednio do temp. 150°C. Do wylotu probówki należy zbliżyć papierek ołowiawy.
Czernienie papierka wywołane powstającym H
2
S świadczy o obecności alkoholu II-rzędowego.
METODY IDENTYFIKACJI
W celu dalszej identyfikacji alkoholu wykonuje się dla nich odpowiednie stałe pochodne takie jak estry kwasu 3,5
dinitrobenzoesowym, p-nitrobenzoesowego lub fenylokarbaminowego (fenylouretany). Temperatura topnienia dla
otrzymanych stałych pochodnych potwierdza obecność identyfikowanej substancji. Dla niektórych alkoholi
można przeprowadzić reakcję z waniliną lub próbę haloformową.
Reakcja alkoholi z waniliną.
W wyniku reakcji z waniliną powstają charakterystyczne barwy roztworów:
alkohol metylowy - żółty (po chwili ciemnieje) po dodaniu ok. 15 kropel wody zabarwienie fioletowe;
alkohol etylowy - żółty, po dodaniu ok. 15 kropel wody odbarwia się;
alkohol propylowy - ciemnozielony, po dodaniu ok. 15 kropel wody zabarwienie przechodzi w granatowe;
alkohol izopropylowy - czerwone, po dodaniu ok. 20 kropel wody zabarwienie przechodzi w niebiesko-fioletowe;
alkohol izobutylowy - czerwone, po dodaniu ok. lOkropel wody przechodzi w czerwonofioletowe zabarwienie;
alkohol izoamylowy - ciemnobrunatny po dodaniu ok. 15 kropel wody zabarwienie zielone Wykonanie:
Wykonanie:
Do probówek wprowadza się po lml roztworu waniliny oraz 2 krople badanego alkoholu. Następnie do każdej
probówki dodać kilkanaście kropli wody destylowanej. Obserwować zabarwienie powstałych roztworów.
Odczynnik: lg waniliny rozpuszcza się w 200ml stęż. H
2
SO
4
Próba haloformowa – wykrywanie alkoholi zawierających grupę metylową przy węglu z grupą OH.
Próba haloformowa należy do reakcji utlenienia i jest charakterystyczna dla metyloketonów. Pozytywny wynik
dają również etanol, alkohole II rzędowe mające przy tym samym atomie węgla grupę OH i CH
3
oraz aldehyd
octowy.
RCH(CH
3
)OH + I
2
+ 2NaOH → RC(=O)ONa + CHI
3
+ NaI + H
2
O
Kolejne etapy reakcji haloformowej przedstawiono na przykładzie etanolu:
C
2
H
5
OH + NalO → CH
3
CHO + Nal + H
2
O
CH
3
CHO + 3 NalO → CI
3
CHO + 3 NaOH
CI
3
CHO + NaOH → CHI
3
+ HCOONa
Wykonanie:
Do probówki zawierającej około 0,5ml badanego alkoholu dodaje się 2ml 5% NaOH. Zawartość probówki miesza
się, a następnie dodaje 2-3 ml płynu Lugola aż do powstania trwałego, brunatnego zabarwienia roztworu. Po
kilku minutach powinien wydzielić się żółtawy osad jodoformu. Jeśli nie pojawi się osad należy wstawić
probówkę do gorącej wody na kilka minut. Oziębić i obserwować zmiany.
Odczynnik : płyn Lugola - 5g jodku potasu i 2,5 g jodu rozpuszcza się w 25 ml wody destylowanej
ANALIZA FENOLI
Wykrywanie fenoli
Fenole rozpuszczają się w 5% roztworze NaOH, ale nie rozpuszczają się w 5% NaHCO
3.
Badanie rozpuszczalności w 5% NaOH
Rozpuszczanie fenoli w roztworze NaOH polega na reakcji chemicznej w wyniku której powstaje klarowny
roztwór lub wytrąca się osad albo następuje zmiana barwy roztworu.
Wykonanie:
Do probówki zawierającej około O.lg substancji stałej lub 0.2ml substancji ciekłej dodaje się 4ml 5% roztworu
NaOH. Następnie należy delikatnie wytrząsać zawartość i sprawdzić efekt oddziaływania NaOH na analizowaną
substancję. W tych warunkach w przypadku o- i p- wielowodorotlenowych fenoli następuje reakcja utlenienia
tlenem atmosferycznym. Skutkiem tego jest powstanie brązowego zabarwienia roztworu.
Badanie rozpuszczalności w 5% NaHCO
2
W przypadku związków rozpuszczalnych w 5% NaOH należy przeprowadzić próbę rozpuszczenia w 5%NaHCO
3
która pozwala rozróżnić fenole od kwasów karboksylowych. Te ostatnie ze względu na większą kwasowość
reagują z NaHC0
3
przy czym wydziela się wówczas gazowy, bezbarwny produkt reakcji - CO
2
zgodnie z
równaniem: RCOOH +NaHCO
3
→ RCOONa + H
2
O + CO
2
Wykonianie:

Do probówki dodjae się okolo 0,05g badanej substancji stalej lub 0,2 mloraz 2ml 5% roztworu NaHCO
3
i
delikatnie wytrząsa. Należy uważnie obserwować, czy podczas rozpuszczania substancji nie wydzielają się
pęcherzyki gazu.
Badanie odczynu
Wykonanie:
Na szkiełku zegarkowym umieszcza się papierek uniwersalny zwilżony w wodzie destylowanej, a następnie za
pomocą bagietki nanosi na niego kroplę roztworu wodnego badanego związku i odczytuje wartość pH zgodnie z
umieszczoną na opakowaniu skalą. Do oceny odczynu używa się także indykatorów: roztworu błękitu
bromotymolowego (pH 6-7,6) - barwa żółta lub zieleni bromokrezolowej (pH 3,6-5,5) - barwa niebieska lub
niebieskozielona (w przypadku obecności fenolu)
Próba wykrywania fenoli z chlorkiem żelaza (III)
W reakcji z solami żelaza (III) fenole (oprócz niektórych nitrofenoli) dają barwne kompleksy (fioletowe,
granatowe, purpurowe, zielone -barwa kompleksu zależy od podstawników w pierścieniu aromatycznym)
powstające zgodnie z równaniem: 6C
6
H
5
OH + Fe
3+
→ [Fe(C
6
H
5
O)]
3-
+ 6H
+
Reakcja ta zachodzi również dla związków typu -CH
2
C=O ↔ HC=C-OH zdolnych do enolizacji jak również dla
niektórych alkoholokwasów (kwas mlekowy, winowy, glukonowy) a także ich soli, które tworzą z FeCl
3
połączenia
kompleksowe o zabarwieniu żółtym lub zielonkawym.
Wykonanie:
Do probówki dodaje się kilka kropel przygotowanego roztworu fenolu (około 0,1 g rozpuszcza się w wodzie lub
40% etanolu), a następnie dodaje się po jednej kropli 1% roztwór FeCl
3
aż do pojawienia się zabarwienia
(czasem tylko przejściowego). Do drugiej probówki należy dodać sam rozpuszczalnik (woda lub 40% etanol)
oraz taką samą objętość 1% roztworu FeCl
3
- próba ślepa. Zmianę zabarwienia porównuje się wobec próby
ślepej.
UTLENIANIE FENOLI
Fenole w porównaniu do alkoholi łatwiej ulegają reakcji utlenienia, co wykorzystano do ich identyfikacji. W
przypadku rezorcyny - m-didihydroksybenzenu reakcja utlenienia nie zachodzi.
Reakcja z heksacyjanożelazianem(III) potasu – K
3
[Fe(CN)
6
]
Fenole pod wpływem światła i czynników utleniających utleniają się dając barwne reakcje.
Heksacyjanożelazian(III) potasu utlenia fenole do difenoli. Powstający w tej reakcji K
2
H[Fe(CN)
6
] reaguje z FeCl
3
dając błękit pruski - heksacyjanożelazianem(III) potasu
Wykonanie:
Około 0,04 g substancji rozpuszcza się w 2ml wody destylowanej (w przypadku trudno rozpuszczalnych fenoli
dodaje się 5 ml wody destylowanej, wytrząsa i przesącza). Do przygotowanego roztworu dodaje się 5 kropli 5%
K
3
[Fe(CN)
6
] i kroplę 10% FeCl
3
Powstanie zielononiebieskiego zabarwienia (powstanie błękitu pruskiego)
potwierdza obecność fenolu.
Próba Tollensa
Wszystkie fenole redukują amoniakalny roztwór soli srebra z wytworzeniem „lustra srebrowego". Pozytywny
wynik reakcji dają również inne związki łatwo utleniające się jak np. aldehydy.
2AgN0
3
+ 2NaOH → Ag
2
O + 2 NaNO
3
Ag
2
O + 4 NH
3
+H
2
O → 2 [Ag(NH
3
)
2
]OH
C
6
H
4
(OH)
2
+ 2 [Ag(NH
3
)
2
]OH → 4 NH
3
+ 2Ag +C
6
H
4
O
2
Wykonanie:
Do około 0,5ml 5% roztworu AgN0
3
dodaje się jedną kroplę 5% roztworu NaOH, a następnie kroplami,
wstrząsając, 2% roztwór amoniaku do całkowitego rozpuszczenia osadu Ag
2
O (należy unikać nadmiaru). Do tak
przygotowanego odczynnika dodaje się niewielką ilość (około 0,001g) badanej substancji, wstrząsa lub ogrzewa.
Powstanie metalicznego srebra w postaci „lustra" na ściankach probówki, lub szarego osadu w roztworze
potwierdza obecność fenolu.
Reakcja z odczynnikiem Fehlinga
Reakcja z odczynnikiem Fehlinga pozwala na rozróżnienie dihydroksyfenoli szeregu o-i p- od
monopodstawionych.
C
6
H
4
(OH)
2
+ 2CuO → Cu
2
O + H
2
O + C
6
H
4
O
2
Wykonanie:
Do około lem3 odczynnika Fehlinga dodaje się około 10 mg. badanej substancji i ogrzewa. Powstanie
czerwonobrunatnego zabarwienia świadczy o obecności polifenoli o- lub p-.

REAKCJE PIERŚCIENIA AROMATYCZNEGO
Reakcja z bromem
Fenole bardzo łatwo wchodzą w reakcje z bromem. Obecna w cząsteczce fenolu grupa hydroksylowa aktywuje
pierścień fenolowy, przez co łatwiej zachodzi reakcja podstawienia elektrofilowego. Dodanie większej ilości wody
bromowej do oznaczanego fenolu pozwala na otrzymanie białego osadu tribromopochodnej fenolu:
W przypadku fenoli wielowodorotlenowych zawierających grupy OH w położeniu o- i p- dodatkowo zachodzi
reakcja utlenienia do chinonów i powstaje wówczas brązowe zabarwienie pochodzące od produktu reakcji.
C
6
H
5
OH + 3Br
2
→ C
6
H
2
OHBr
3
+ 3HBr
C
6
H
4
(OH)
2
+ 5Br
2
→ C
6
O
2
Br
4
+ 6HBr
Wykonanie:
Do probówki wprowadza się około 0,2ml lub 0,2g fenolu dodaje 5ml wody lub 5ml 10% HC1 (dla fenoli
nierozpuszczalnych w wodzie). Do tak przygotowanego roztworu dodaje się kroplami wodę bromową. Delikatnie
wstrząsając probówką obserwuje się początkowe odbarwianie wody bromowej, a po dodaniu większej ilości
odczynnika następuje wydzielanie osadu lub powstawanie brązowego zabarwienia.
Reakcja sprzęgania z solami diazoniowymi
Reakcja sprzęgania zachodzi z solami diazoniowymi do pozycji p- w fenolu (a gdy ta zajęta jest to do pozycji o-).
Proces sprzęgania przebiega bardzo łatwo i w niskich temperaturach 0°C, a produktami reakcji są związki
azowe. Szybkość reakcji sprzęgania zależy od pH - najszybciej zachodzi przy pH 9-10.
Wykonanie:
Do około 0,05g badanej substancji dodaje się lem3 15% roztworu NaOH i ml kwasu diazobenzenosulfonowego.
Powstanie żółtego, ciemnobrunatnego lub ciemnofioletowego zabarwienia potwierdza obecność fenolu.
Odczynnik 1 g kwasu sulfanilowego rozpuszcza się w 175 ml wody i 21 ml stężonego HC1 i dodaje stopniowo 50
ml 0,7% roztworu NaN0
2
.
Reakcja C- nitrozowania (reakcja Libermanna - indofenolowa)
W reakcji Libermanna zachodzi proces C-nitrozowania badanego fenolu w położeniu p- i powstaje C-
nitrozopochodna która przy nadmiarze fenolu przekształca się w indofenol o barwie zielonej, niebieskiej lub
czerwonej. Po zalkalizowaniu roztworu powstaje anion indofenolu o barwie niebieskozielonej. Podobnie do fenoli
reaguje tiofen. Rezorcyna natomiast w tej reakcji również tworzy C-nitrozopochodne, które z jej nadmiarem dają
rezorufinę o barwie czerwonej. Do przeprowadzenia reakcji używa się stałego NaN0
2
i stężonego kwasu
siarkowego(VI). Negatywny wynik tej reakcji dają nitrofenole i fenole z grupami CHO, COOH i COCH
3
.
Wykonanie:
Do około 0,05g badanej substancji dodaje się kryształek NaN0
2
i kilka kropli stężonego H
2
SO
4
. Obecność fenolu
potwierdza powstanie zabarwienia zielonego, niebieskiego lub czerwonego. W przypadku innych fenoli niż
rezorcyna po dodaniu NaOH powstałe zabarwienie zmienia się na niebieskozielone.
Reakcja z odczynnikiem Marquis'a
Odczynnik Marquis'a służący ogólnie do wykrywania alkaloidów (związków pochodzenia naturalnego
zawierających azot i wykazujących odczyn zasadowy) działa na zasadzie zmiany barw w zależności od badanej
substancji. Jest on powszechnie stosowany przy wykrywaniu narkotyków. Niektóre substancje dają reakcje
barwne, nie będąc alkaloidami, a nawet nie zawierając azotu. Są to cukier który ulega zwęgleniu wobec
stężonego kwasu siarkowego, dając barwę czarną, a także fenole, które ulegają kondensacji z aldehydem
mrówkowym dając produkty o barwie czerwonej lub fioletowej.
Wykonianie:
Do probówki wprowadza się około 0,01 g badanej substancji i dodaje kilka kropel odczynnika Marquis'a. Całość
delikatnie ogrzewa. Powstanie zabarwienia od czerwonego do fioletowego potwierdza obecność fenolu.
Odczynnik Marquis'a: 9 części stężonego 96% kwasu siarkowego(VI) zmieszać z 1 częścią formaliny. Dodanie
metanolu (wtedy: 8cz. kwasu H
2
SO
4
, 1 cz. formaliny, 1 cz. metanolu) powoduje spowolnienie reakcji i możliwość
dokładniejszej obserwacji zmiany barwy.
ALDEHYDY I KETONY
OGÓLNE PRÓBY WYKRYWANIA GRUPY KARBONYLOWEJ
Reakcje dla związków z grupą karbonylową - reakcja z 2,4-dinitrofenylohydrazyną
Związki zawierające grupę
karbonylową (aldehydy i ketony) w
reakcji z 2,4-dinitrofenylohydrazyną
ulegają kondensacji, a powstające
produkty krystaliczne - 2,4-
dinitrofenylohydrazony są
substancjami barwnymi. Reakcja powyższa przebiega wg równania:
Wykonanie:
Do probówki odmierza się 2-3 krople lub 0,1 g badanej substancji rozpuszczonej w jak najmniejszej ilości wody
lub etanolu a następnie 3ml 2,4-dinitrofenylofydrazyny. Probówkę koniecznie należy ogrzać do wrzenia i
schłodzić. Powstający po ochłodzeniu osad żółty, pomarańczowy lub ceglastoczerwony potwierdza obecność
grupy karbonylowej. Jeżeli osad nie powstaje zaraz po schłodzeniu to próbę należy odstawić na 10 min. w
temperaturze pokojowej.
Odczynnik 2,4-dinitrofenylohydrazyny: - 2 g 2,4-dinitrofenylohydrazyny rozpuszcza się w 15ml stęż. H
2
SO
4
Przygotowany roztwór dodaje się powoli do 150 ml etanolu. Należy całość mieszać i chłodzić. Następnie
rozcieńcza się 500 ml wody destylowanej, miesza i sączy.
Reakcje dla związków z grupą karbonylową - reakcja z hydroksylaminą
W reakcji z hydroksylaminą pochodne z grupą karbonylową ulegają kondensacji tworząc oksymy - substancje
krystaliczne. Poniżej przedstawiono równanie reakcji:
(CH
3
)
2
CO + H
2
NOH → (CH
3
)
2
C=NOH +H
2
O
Wykonanie:
0,4g chlorowodorku hydroksyloaminy rozpuszcza się w 2ml wody i dodaje się 2ml IM NaOH i 0,2g badanego
związku. Dla substancji nierozpuszczalnych w wodzie dodaje się etanolu aż do uzyskania klarownego roztworu.
Całość ogrzewa się 15 min w łaźni wodnej, a następnie chłodzi w wodzie z lodem. Jeżeli z zimnego roztworu
osad nie wypada dodaje się wody.
Reakcje charakterystyczne dla aldehydów - reakcje utleniania aldehydów
Próba Tollensa
Wszystkie aldehydy, w odróżnieniu od ketonów, redukują amoniakalny roztwór soli srebra z wytworzeniem
„lustra srebrowego". Jednak im większa masa cząsteczkowa aldehydu tym wolniej zachodzi reakcja Tollensa.
Nie można przeprowadzać tej próby ze związkami tworzącymi sole srebrowe.
2AgN0
3
+ 2NaOH → Ag
2
O + 2 NaNO
3
Ag
2
O + 4 NH
3
+H
2
O → 2 [Ag(NH
3
)
2
]OH
RCHO + 2 [Ag(NH
3
)
2
]OH → 3 NH
3
+ 2Ag +RCOONH
4
Wykonanie:
Do około lem 5% roztworu AgN0
3
dodaje się jedną kroplę 5% roztworu NaOH, a następnie kroplami,
wstrząsając, 2% roztwór amoniaku do całkowitego rozpuszczenia osadu Ag
2
O (należy unikać nadmiaru
amoniaku). Do tak przygotowanego odczynnika - wodorotlenku diaminasrebra(I) dodaje się 3 krople badanej
substancji lub gdy substancja jest stała około 0,05g rozpuszczone w minimalnej ilości alkoholu. Próbkę
pozostawia bez ogrzewania i obserwuje się powstawanie czarnego osadu lub tzw „lustra" na ściankach
probówki. Jeżeli reakcja nie zachodzi na zimno, probówkę ogrzewa się na łaźni wodnej.
Próba Fehlinga
Odczynnik Fehlinga zawiera jon Cu
2+
w postaci związku kompleksowego, który powstaje ze zmieszania
roztworów Fehlinga I i II. Reaguje on wyłącznie z aldehydami alifatycznymi utleniając je do kwasów, a jony
Cu
2+
zostają zredukowane do jonów Cu
+
i powstaje ceglastoczerwony osad Cu
2
O. Pozytywny wynik dają
również aldozy, a-hydroksyketony i kwas mrówkowy. Aldehydy aromatyczne i ketony nie ulegają utlenieniu w tej
reakcji. W środowisku zasadowym dla aldehydów aromatycznych następuje reakcja Cannizzaro.
Wykonanie:
Do probówki wprowadza się po 0,5 ml roztworu Fehling I i
Fehling II po czym dodaje się 0,03 g badanej substancji.
Odstawia na kilka minut w zamkniętej probówce, a następnie
ostrożnie ogrzewa. Powstanie ceglastoczerwonego osadu
świadczy o obecności aldehydu.
Odczynnik Fehlinga
Fehling I: 17.3g CuSO
4
*
5H
2
O w 250ml wody zadany 3 kroplami stężonego H
2
SO
4
Fehling II: 86.5g winianu sodowo-potasowego i 30g NaOH w 250ml wody
Próba Trommera
Do wykrywania aldehydów służy również próba Trommera. W próbie tej wykorzystuje się świeżo strącony
wodorotlenek miedzi(II), który w środowisku zasadowym jest redukowany do ceglastoczerwonego osadu Cu
2
O
zgodnie z równaniem:
Wykonanie:
Do probówki odmierza się około 0,5ml 10 % roztworu CuSO
4
, następnie dodaje około lem
3
2M NaOH. Do tak
sporządzonego strąconego roztworu wodorotlenku miedzi (II) dodaje się około 0,5ml badanego aldehydu i

delikatnie ogrzewa. Po chwili ogrzewania niebieski osad C
U
(OH)
2
zmienia barwę na ceglastoczerwoną.
Potwierdza to obecność aldehydu.
Reakcja z odczynnikiem Schiffa
Odczynnik Schiffa jest to nasycony tlenkiem siarki (IV), bezbarwny lub bladożółty roztwór wodny fuksyny.
Stosuje się go do wykrywania aldehydów oraz cukrów redukujących, w reakcji z którymi przyjmuje barwę
czerwonofioletową. Niektóre ketony i związki nienasycone również reagują z odczynnikiem Schiffa wiążąc kwas
siarkowy (IV). W tych warunkach powstaje jasnoczerwona barwa wolnej fuksyny.
Wykonanie:
Do 1 kropli badanej substancji ciekłej lub 0,05g substancji stałej dodaje się 2ml odczynnika SchifFa i po
dokładnym wymieszaniu odstawia na 5 minut. Wystąpienie czerwonofioletowego zabarwienia potwierdza
obecność aldehydu.
Odczynnik Schiffa:
-
sposób: 0,5 g fuksyny(zasadowej) rozpuszcza się w 500 ml wody, a następnie łączy ze wcześniej
przygotowanym w ilości 500 ml nasyconym SO
2
wodnym roztworem. Mieszaninę pozostawia się na 24 godziny.
-
sposób: 0,2g fuksyny zasadowej rozpuszcza się w 120 ml gorącej wody, następnie chłodzi i przenosi do kolby
miarowej o poi. 200 ml dodaje roztwór sporządzony z 2 g bezwodnego Na
2
S0
3
i 20 ml wody oraz 2 ml 36% HC1
i uzupełnia wodą do kreski. Tak przygotowany odczynnik jest trwały przez 1 miesiąc.
Reakcje specyficzne dla ketonów
Reakcja Legała
Próba Legała jest charakterystyczna dla metylo- i metylenoketonów, które tworzą z
pentacyjanonitrozylożelazianem(III) sodu (Na
2
[Fe(CN)
5
NO]) barwne C - nitrozoketony występujące w postaci
jonów kompleksowych.
Wykonanie
Do probówki wprowadza się 1-2 krople wodnego lub etanolowego roztworu badanej substancji oraz 1-2 krople
2% roztworu pentacyjanonitrozylżelazianu(III) sodu. Zawartość probówki miesza się i pozostawia na kilka minut.
Następnie dodaje się kroplę 2M NaOH. Powstanie brunatnoczerwonego zabarwienia potwierdza obecność
metyloketonów. Zabarwienie zmienia się na czerwone bądź niebieskie po dodaniu 1-2 kropli lodowatego
CH
3
COOH.
Reakcja Zimmermanna
Ketony a zwłaszcza metyloketony oraz związki zawierające grupę -CH
2
CO oraz niektóre aldehydy w środowisku
alkalicznym reagują z m-dinitrobenzenem dając barwne produkty. W reakcji tej w pierwszym etapie zachodzi
reakcja przyłączenia ketonu przez aktywną grupę metylenową do cząsteczki m-dinitrobenzenu w pozycję 4, a
następnie w środowisku reakcji następuje utlenienie powstałego związku do barwnego produktu (w środowisku
alkalicznym m- dinitrobenzen ulega redukcji do m-nitrofenylohydroksylaminy).
Wykonanie:
Do probówki wprowadza się 2 ml metanolowego roztworu badanej substancji oraz kilka kropli 2% odczynnika
Zimmermanna i 1-2 krople 10% NaOH. Powstanie fioletowego zabarwienia potwierdza obecność ketonu.
Odczynnik: 2% roztwór m-dinitrobenzenu w metanolu
Reakcja z wodorosiarczanem(IV) sodu
Reakcję tę dają aldehydy i metyloketony. Aldehydy o małych cząsteczkach mogą dawać produkty rozpuszczalne
w wodzie.
Wykonanie:
i Do probówki wprowadza się 0,5 ml badanej substancji i ok. 5ml nasyconego roztworu NaHSO
3
. Probówkę
zatyka korkiem i intensywnie wytrząsa przez kilka minut. Potwierdzeniem obecności aldehydu lub metyloketonu
jest powstanie obfitego białego osadu.
Próba jodoformowa
Reakcja jest charakterystyczna dla metyloketonów, aldehydu octowego, etanolu i alkoholi drugorzędowych
zawierających grupę hydroksylową i metylową przy tym samym atomie węgla.
Wykonanie:
Do probówki wprowadza się 0,5 ml badanej substancji i 1 ml płynu Lugola (roztworu jodu w jodku potasu), a
następnie po kropli 5% NaOH aż roztwór się odbarwi się (należy unikać nadmiaru NaOH). Wytrącają się b.
drobne żółte kryształki jodoformu (trijodometanu) o specyficznym zapachu co potwierdza obecność
metyloketonu.
KWASY KARBOKSYLOWE

OGÓLNE PRÓBY WYKRYWANIA KWASU KARBOKSYLOWEGO
Próba z wodorowęglanem sodu - NaHCO
3
Próba z wodorowęglanem sodu pozwala odróżnić kwasy karboksylowe od fenoli.
RCOOH + NaHC0
3
→ RCOONa + C0
2
t+ H
2
0
ArOH + NaHC0
3
—> brak objawów reakcji
Wykonanie:
Do probówki dodaje się około 1 ml 5% roztworu NaHCC>3 i kroplę lub 0.0lg substancji badanej. Wydzielanie się
pęcherzyków CO2 wskazuje na obecność kwasu.
Próba ze wskaźnikiem uniwersalnym
Do przeprowadzenia tej próby używa się wodnego roztworu badanego kwasu i papierka uniwersalnego. Do
związków nierozpuszczalnych w wodzie należy najpierw dodać kilka kropli alkoholu lub acetonu a następnie
dopiero wody. Równolegle przygotowuje się próbę kontrolną z wodą i użytym rozpuszczalnikiem.
Wykonanie:
0, 1 ml lub 0,05 g badanej substancji rozpuszcza się na szkiełku zegarkowym w około 1 ml
wody destylowanej.
Do przygotowanego roztworu zanurza się papierek wskaźnikowy i odczekuje minutę. Porównanie zabarwienie
papierka ze wzorcową skalą barw odpowiadających określonemu zakresowi pH dostarcza informacji o
charakterze badanej substancji.
Próba z fenoloftaleiną
Związki o charakterze kwasowym odbarwiają zasadowy roztwór fenoloftaleiny.
Wykonanie:
Na szkiełku zegarkowym umieszcza się jedną kroplę 0,01M NaOH, jedną kroplę etanolowego roztworu
fenoloftaleiny i 4 krople wody, a następnie 4 krople lub niewielką ilość dobrze sproszkowanej badanej substancji.
Odbarwienie fenoloftaleiny potwierdza charakter kwasowy badanego związku.
Próba jodan - jodek
Próba jodan - jodek wykonywana jest do identyfikacji słabych kwasów. Podczas przeprowadzania reakcji jodan -
jodek w obecność kwasu powstaje wolny jod, który powoduje niebieskie zabarwienie skrobi.
5I
-
+10
3
-
+ 6H
+
→ 3H
2
0 + 3I
2
Wykonanie:
Do probówki zawierającej około 5mg badanej substancji lub dodaje się (nasycony roztwór w 2 kroplach etanolu)
zadaje się w probówce 2 kroplami 2% roztworu KI i 2 kroplami 4% roztworu KIO3. Probówkę zamyka się
zwitkiem waty i ogrzewa przez minutę we wrzącej łaźni wodnej. Po oziębieniu dodaje się 4 krople 0.1% roztworu
skrobi. W obecności kwasów powstaje wolny jod, który zabarwia skrobię na kolor fioletowy lub
fioletowoniebieski.
REAKCJE DLA KWASÓW MONOKARBOKSYLOWYCH
Próba na kwas mrówkowy
Kwas mrówkowy w odróżnieniu od pozostałych kwasów karboksylowych posiada właściwości redukujące.
Wykonanie:
Do probówki zawierającej około 1 ml roztworu kwasu mrówkowego dodaje się kilka kropli roztworu sublimatu
(HgCl) i ogrzewa we wrzącej łaźni wodnej do pojawienia się białego osadu kalomelu (Hg
2
Cl
2
).
Próba na właściwości redukujące kwasu mrówkowego
W wyniku utleniania kwasu mrówkowego otrzymuje się kwas węglowy, który rozkłada się do ditlenku węgla i
wody.
HCOOH + (KmnO
4
+ H
+
) → CO
2
+ H
2
O
Wykonanie:
Do probówki zawierającej około 1 ml kwasu mrówkowego dodaje się 2 ml nasyconego roztworu KMnO
4
i 1 ml
2M H
2
SO
4
. Widoczne wydzielanie CO
2
na zimno potwierdza obecność kwasu mrówkowego.
Próba na właściwości redukujące kwasu mrówkowego
Wykonanie:
Do probówki zawierającej około 0,5 ml 1% roztworu AgN0
3
dodaje się 0,5 ml kwasu mrówkowego i lekko
ogrzewa. Pojawienie się szarego osadu srebra potwierdza obecność kwasu mrówkowego
Wykrywanie kwasu octowego
3CH
3
COOH + 3NaOH → 3CH
3
COONa + H
2
O
3CH
3
COONa + FeCl
3
→ Fe(CH
3
COO)
3
+ 3NaCl
Podobnie jak kwas mrówkowy , propionowy tak i kwas octowy dają pozytywną reakcję z FeCl
3
. Pod wpływem
tego odczynnika w obecności wymienionych kwasów powstaje czerwone zabarwienie roztworu.

REAKCJE KWASÓW AROMATYCZNYCH
Reakcja kwasu benzoesowego z chlorkiem żelaza (III).
Wykonanie:
Do probówki wlewa się 2 ml roztworu kwasu benzoesowego i dodaje 2 krople 0,5 M roztworu NaOH celem
zobojętnienia roztworu wobec papierka wskaźnikowego. Następnie dodaje się kroplami 1 ml l%roztworu FeCl
3
.
Powstaje jasno pomarańczowy galaretowaty osad benzoesanu żelaza.
Wykrywanie pierścienie aromatycznego
UWAGA! Próbę wykonać pod digesterium. Reakcja może zachodzić gwałtownie - zachować ostrożność,
wykonywać w ostateczności.
Związki zawierające pierścień aromatyczny ulegają reakcji nitrowania w środowisku kwaśnym tworząc żółte
nitrowe pochodne.
Wykonanie:
Do probówki odmierza się około 0,5ml roztworu badanego, dodaje około 0,5ml stężonego HNO
3
a następnie
kilka kropel stężonego H
2
SO
4
. Zawartość probówki bardzo ostrożnie ogrzewać. Pojawienie się żółtego
zabarwienia potwierdza obecność pierścienia aromatycznego.
REAKCJE KWASÓW DIKARBOKSYLOWYCH
Próba na wykrywanie kwasu szczawiowego - reakcja z rezorcyną
Kwasy 1,2 - dikarboksylowe oraz ich pochodne (estry, bezwodniki, imidy) reagują z rezorcyną w obecności
stężonego kwasu siarkowego (VI). Powstają wówczas barwniki typu fluoresceiny.
Wykonanie:
Do probówki zawierającej 1 ml wodnego roztworu kwasu szczawiowego wrzuca się 2-3
kryształki rezorcyny. Całość miesza aż do rozpuszczenia rezorcyny. Następnie ostrożnie po ściance probówki
wkrapla się lem stęż. H
2
SO
4
. Powstanie niebieskiego pierścienia potwierdza obecność kwasu szczawiowego.
Próba na wykrywanie kwasu szczawiowego - utlenianie za pomocą KMnO
4
Oznaczanie kwasu szczawiowego opiera się na reakcji, w której manganian(VII) w środowisku kwasu
siarkowego(VI) utlenia jony szczawianowe do ditlenku węgla:
2Mn0
4
-
+ 5C
2
0
4
2-
+ 16H
+
→ 2Mn
2+
+ 10C0
2
+ 8H
2
0
W wyniku tej reakcji obserwuje się odbarwienie dodawanych porcji titranta. Na początku przebieg reakcji jest
powolny. Dopiero po upływie czasu niezbędnego do powstania jonów manganu (II), które katalizują reakcje
utleniania jonów szczawianowych, obserwuje się wzrost szybkości reakcji analitycznej.
Wykonanie:
Do probówki wprowadza się 0,5 ml wodnego roztworu badanej substancji (kwasu szczawiowego) i 1,5 ml 16%
H
2
SO
4
i kilka kropel 1% KMnO
4
. Całość ogrzewa do temperatury 70°C. kwasu. W przypadku obecności kwasu
szczawiowego następuje odbarwienie roztworu KMnO
4
.
Rozkład kwasu szczawiowego
Wykonanie:
0,1 g substancji ogrzewa się w suchej probówce. W przypadku kwasu szczawiowego następuje rozkład z
wydzieleniem HCOOH i CO
2
. Obecność powstałego kwasu mrówkowego można wykryć za pomocą wcześniej
podanych metod.
Izomeryzacja kwasu maleinowego do kwasu fumarowego
Kwas maleinowy ma konfigurację cis (Z), łatwo tworzy bezwodnik kwasowy i rozpuszcza się w wodzie . Kwas
fumarowy ma konfigurację trans (E) i nie tworzy bezwodnika kwasowego. W przeciwieństwie do kwasu
maleinowego jest trudno rozpuszczalny w wodzie.
Wykonanie:
Do kolby o poj. 50 ml zaopatrzonej w chłodnicę zwrotną wprowadza się około 0,5 g kwasu maleinowego
rozpuszczonego w 5 ml ciepłej wody destylowanej i dodaje 1 ml stężonego kwasu solnego. Całość ogrzewa się
do łagodnego wrzenia w przez 30 min. W trakcie reakcji z roztworu reakcyjnego wypadają kryształki kwasu
fumarowego. Roztwór pozostawia się do ostygnięcia w temp. pokojowej. Wydzielony kwas fumarowy sączy się
na lejku Buchnera i przemywa l0 ml zimnej wody. Osad pozostawia się do wysuszenia Otrzymany produkt
można identyfikować na podstawie temperatury topnienia (kwas fumarowy topi się przy 286- 287°C).
PRÓBA NA HYDROKSYKWASY
Próba Uffelmana na wykrywanie kwasu mlekowego
Próba Uffelmana polega na wiązaniu przez kwas mlekowy żelaza zawartego w odczynniku Uffelmana (roztwór
fenolu z dodatkiem chlorku żelaza(III)). W wyniku reakcji fenolu z FeCl
3
powstaje fenolan żelaza(III) o fioletowym

zabarwieniu. W obecności kwasu mlekowego fioletowe zabarwienie przechodzi w żółte, gdyż powstaje mleczan
żelaza. Próba ta stosowana jest do wykrywania kwasu mlekowego w soku żołądkowym. Podobna reakcja
zachodzi z kwasem solnym.
Wykonanie:
Do probówki wlewa się około 1 ml 1% roztworu fenolu dodaje jedną kroplę roztworu l%FeCl
3
. Do zabarwionego
na kolor fioletowy roztworu dodaje kilka kropel badanego roztworu kwasu mlekowego. Barwa fioletowa zmienia
się na żółtą. Równolegle wykonuje się analogiczną próbę, używając zamiast kwasu mlekowego kwasu solnego.
W tym przypadku nastąpi odbarwienie roztworu, lecz nie wystąpi żółte zabarwienie roztworu.
Utlenianie kwasu mlekowego
W wyniku utleniania hydroksykwasu otrzymuje się ketokwas, który analogicznie do ketonów reaguje z
fenylohydrazyną, tworząc fenylohydrazony - ciała o wysokiej temperaturze topnienia, trudno rozpuszczalne.
Dzięki temu służą one do wyodrębniania ketonów z mieszanin innych związków.
Wykonanie:
W kolbce stożkowej umieszcza się 0,5 ml
3
kwasu mlekowego, dodaje 1 kroplę fenoloftaleiny i zobojętnia 0,5 M
roztworem NaOH. Następnie dodaje się 12 ml 1% roztworu KMnO
4
i kolbkę odstawia na około 20 minut. Kwas
mlekowy utlenia się w tych warunkach do kwasu pirogronowego, a fioletowa barwa KMnO
4
zanika. Zawartość
kolby przesącza się na lejku Buchnera, przesącz wykorzystuje się do dalszej analizy.
Wykrywanie obecności kwasu pirogronowego:
Do otrzymanego przesączu ,zawierającego kwas pirogronowy, w ilości 3 ml dodaje się 0,5 ml
roztworu
chlorowodorku fenylohydrazyny. Z roztworu wytrąca się żółty osad fenylohydrazonu kwasu pirogronowego.
CH
3
C(OH)COOH → CH
3
C(=O)COOH + H
2
0
CH
3
C(=O)COOH + H
2
N-NH-C
6
H
5
→ CH
3
C(COOH)=N-NH-C
6
H
5
Próba na kwas salicylowy - próba z FeCl
3
Wykonanie:
Kilka kryształków kwasu salicylowego rozpuszcza się w 1 ml wody i dodaje 3-4 krople roztworu 1% FeCl
3
.
Podobnie jak w roztworze fenoli pojawienie się fioletowego zabarwienia, które nie zmienia się po dodaniu 1 ml
etanolu potwierdza obecność fenolokwasu.
Próba na kwas salicylowy - próba z CaO
Kwas salicylowy ogrzewany z CaO rozkłada się do fenolu i CO
2
C
6
H
4
(OH)COOH + CaO/temp. → C
6
H
5
OH + CaC0
3
Wykonanie:
W suchej probówce ogrzewa się około 0,5 g badanej substancji z około 0,5 g CaO. Powstawanie
charakterystycznego dla fenoli zapachu potwierdza obecność kwasu salicylowego. Dodatkowo otrzymany fenol
można identyfikować w reakcji z FeCl
3
Próba na kwas acetylosalicylowy - próba z FeCl
3
Kwas acetylosalicylowy należy poddać reakcji hydrolizy a następnie przeprowadzić próbę z FeCl
3
Wykonanie:
0,01g badanej substancji wraz z kilkoma ml wody ogrzewa się do wrzenia w ciągu 1 min. Do ochłodzonego
roztworu dodaje się 3-4 kropli 3% FeCl
3
Powstanie ciemnofioletowego zabarwienia potwierdza pośrednio
obecność kwasu acetylosalicylowego.
REAKCJE NA NIENASYCONE KWASY KARBOKSYLOWE - NIENASYCONE KWASY TŁUSZCZOWE
Przyłączanie halogenu do nienasyconych kwasów tłuszczowych
Jod (lub inne halogeny) łatwo przyłączają się w miejscu podwójnego wiązania, w wyniku czego brunatny roztwór
jodu odbarwia się i powstaje bezbarwny halogenokwas.
Wykonanie:
Do 3 kropli oliwy (lub nienasyconego kwasu karboksylowego) dodaje się kroplami odczynnik Hubla (roztwór jodu
i chlorku rtęci(II) w alkoholu). Płyn odbarwia się po pewnym czasie w temperaturze pokojowej lub natychmiast po
ogrzaniu. Potwierdza to obecność nienasyconego kwasu tłuszczowego.
Utlenianie wiązań podwójnych w nienasyconych kwasach tłuszczowych
Wiązania podwójne łatwo ulegają utlenieniu pod wpływem utleniaczy, a także chociaż znacznie wolniej, pod
wpływem tlenu atmosferycznego. Cząsteczka kwasu tłuszczowego, w miejscu podwójnego wiązania, ulega
rozbiciu na dwie cząsteczki zawierające grupy aldehydowe. Reakcja ta zachodzi podczas jełczenia tłuszczów, a
gromadzące się aldehydy nadają im przykry smak i zapach.
Wykonanie:

Do probówki zawierającej kilka kropli oliwy dodaje się 1 ml roztworu 5% Na
2
C0
3
celem rozpuszczenia badanej
substancji. Po rozpuszczeniu oliwy wkrapla się 2%KMnO
4.
Odbarwienie dodanego roztworu KmnO
4
potwierdza
obecność wiązań wielokrotnych.
AMINY
POTWIERDZENIE OBECNOŚCI AZOTU
Metoda Willa i Varrentrappa.
Szereg związków organicznych zawierających w swym składzie azot ulega rozkładowi w odpowiednim
środowisku z wydzieleniem amoniaku (NH
3
), który może być wykryty po charakterystycznym zapachu (nie
polecam) lub przy udziale zwilżonego w wodzie uniwersalnego papierka, który umieszczony przy wylocie
probówki zabarwia się na kolor niebieskozielony
Metodą tą można wykrywać azot związany w grupie aminowej pierwszorzędowej -C-NH
2
, amidowej –CONH
2
oraz -C=NH w grupie iminowej lub –(CO)
2
NH w grupie imidowej.
H
2
N-CO-NH
2
+ 2NaOH → Na
2
CO
3
+ 2NH
3
Wykonanie oznaczenia:
W suchej probówce ogrzewamy płomieniem palnika gazowego taką samą ilość badanej próbki (np. 0,1 lub 0,2 g)
i wapna sodowanego (równocząsteczkowa mieszanina NaOH i Ca(OH)
2
). W trakcie ogrzewania dochodzi do
powstania m.in. amoniaku, który pod wpływem temp. ulatnia się zabarwiając zwilżony wodą papierek
uniwersalny.
Metoda Lassaigne’a
Próba Lassaigne’a jest metodą pozwalającą na wykrycie azotu na ogół niezależnie od sposobu jego związania z
atomami innych pierwiastków w cząsteczce.
C + N + Na NaCN
2NaCN + FeSO
4
Fe(CN)
2
+ Na
2
SO
4
Fe(CN)
2
+ 4NaCN Na
4
[Fe(CN)
6
]
3Na
4
[Fe(CN)
6
] + 4FeCl
3
Fe
4
[Fe(CN)
6
]
3
+ 12NaCl
Wykonanie oznaczenia:
W pierwszym etapie analizy w suchej probówce stapiamy z niewielką ilością sodu badaną próbkę związku
organicznego. W wyniku tego procesu powstaje cyjanek sodu. Po rozżarzeniu probówki do czerwoności
wkładamy ją do małej zlewki zawierającej 10 cm
3
wody destylowanej. Podczas wykonywania tej czynności
należy używać okularów ochronnych. Po pęknięciu probówki i wyługowaniu jej zawartości wodą otrzymany
roztwór przesączamy do małej zlewki. Następnie do probówki z przesączem, zawierającym cyjanek sodu,
dodajemy kilka kryształków siarczanu (VI) żelaza (II). Całość ogrzewa się w płomieniu palnika przez kilka minut,
w wyniku reakcji powstaje cyjanek żelaza(II), który reagując z nadmiarem cyjanku sodu daje
heksacyjanożelazian(II) sodu. Otrzymany roztwór zakwaszamy rozcieńczonym 10% kwasem solnym (HCl). Na
koniec roztwór traktujemy kilkoma kroplami 10% roztworu chlorku żelaza(III) (FeCl
3
). Jeżeli badana próbka
zawierała azot to pojawia się wówczas ciemnoniebieskie zabarwienie lub nawet osad pochodzący od
heksacjanożelazianu(II) żelaza(III), zwanego błękitem pruskim.
UWAGA! Często zabarwienie pochodzące od błękitu pruskiego pojawia się przed dodaniem roztworu chlorku
żelaza (III), ponieważ w warunkach reakcji dochodzi do utlenienia (tlenem z powietrza) wodorotlenku
żelazowego (II) do wodorotlenku żelazowego (III), który po zakwaszeniu kwasem solnym przechodzi w chlorek
żelaza (III).
STWIERDZENIE ZASADOWEGO CHARAKTERU AMIN
Papierek Kongo należy zabarwić na niebiesko za pomocą 10% kwasu solnego (HCl), a następnie nanieść kroplę
badanej substancji – w przypadku obecności aminy obserwuje się zmianę zabarwienia na czerwony (pH
zasadowe).
Papierek uniwersalny pod wpływem r-ru amin zabarwia się na kolor niebiesko-szary
Uwaga! Aminy aromatyczne 2
o
reagują słabo, a 3
o
dają wynik negatywny.
ROZRÓŻNIANIE RZĘDOWOŚCI AMIN – METODA HINSBERGA
W metodzie tej wykorzystywana jest reakcja z chlorkiem benzenosufonowym lub para-toluenosulfonowym.
Utworzone pochodne tosylowe (toluenosulfonylowe) 1
o
amin są rozpuszczalne w ługach, 2
o
amin są
nierozpuszczalne w ługach, a 3
o
aminy nie reagują z chlorkiem kwasu toluenosulfonowego.
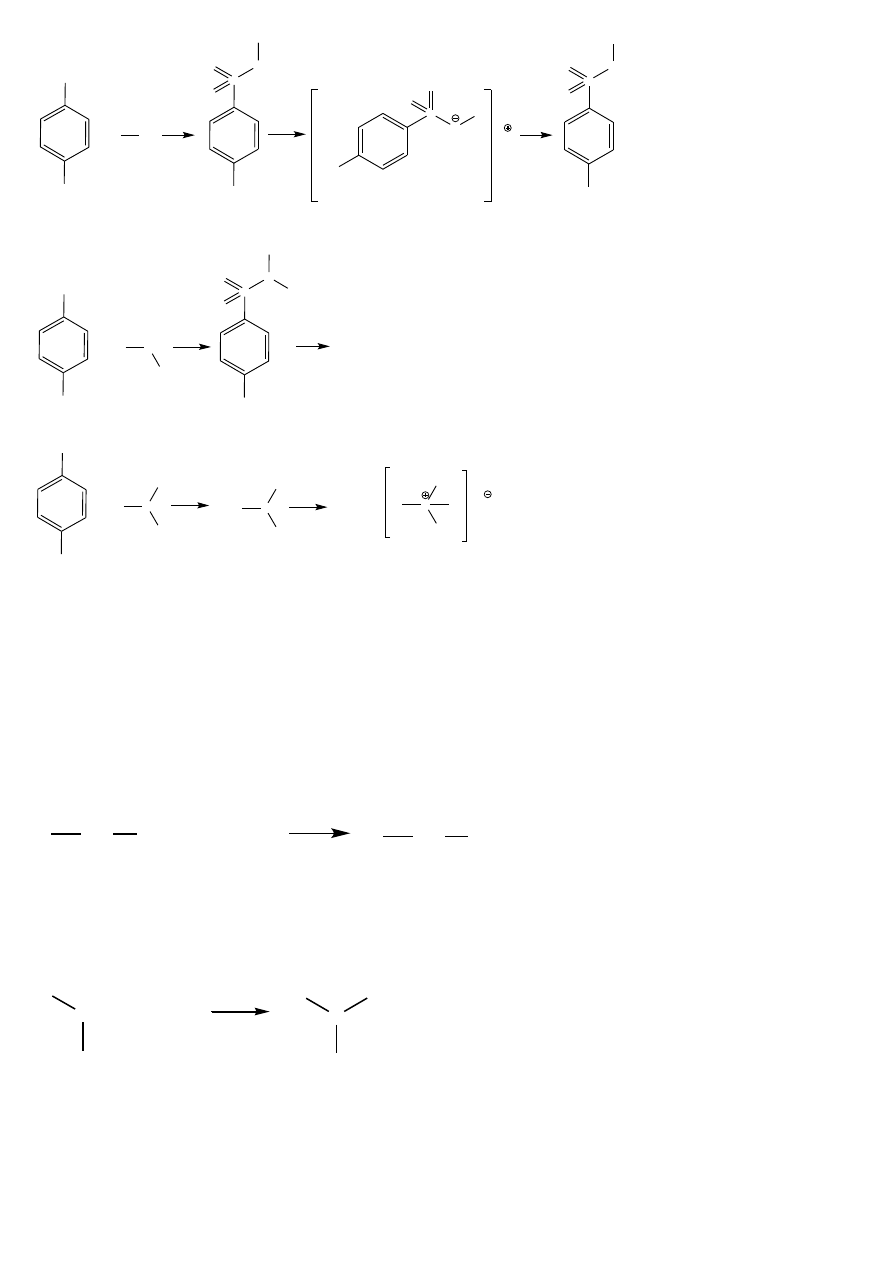
+
NaOH
CH
3
SO
2
Cl
R
NH
2
CH
3
S
NH
O
O
R
H
3
C
S
N
O
O
R
Na
+
CH
3
SO
2
Cl
R
NH
CH
3
S
N
O
O
R
R
R
+
CH
3
SO
2
Cl
R
N
R
R
Nie rozpuszcza sie w r-rze NaOH
ani w r-rze HCl
Reakcja nie zachodzi
NaOH
HCl
CH
3
S
NH
O
O
R
przezroczysty roztwór
nierozpuszczalny
R
N
R
R
OH
-
H
+
przezroczysty roztwór
R
N
R
R
H
Cl
lub HCl
Wykonanie oznaczenia:
Około 0,5g lub 0,5 ml badanej aminy rozpuszcza się w około 1 ml etanolu, dodaje ok. 0,3 g chlorku kwasu
toluenosulfonowego, a następnie ogrzewa do wrzenia. Po ochłodzeniu należy dodać nadmiar stężonego kwasu
solnego (HCl) – UWAGA!!!!, utworzony sulfonamid wytrąca się w postaci osadu, tworzy się olej lub nie
obserwuje się żadnej zmiany. Po zlaniu r-ru znad osadu lub oleju, należy go spłukać do probówki ok. 5 ml wody
a do otrzymanej zawiesiny należy dodać 2-3 ml 10% r-ru wodorotlenku sodu (NaOH). Po dokonanej obserwacji
dla potwierdzenia można dodać kroplami 10% r-ru kwasu solnego (HCl) do uzyskania odczynu kwaśnego.
ROZRÓŻNIANIE RZĘDOWOŚCI AMIN – REAKCJA Z KWASEM AZOTOWYM (III)
1
o
aminy alifatyczne ulegają pod wpływem HNO
2
oksydatywnej deaminacji. Powstaje alkohol oraz obficie
wydziela się azot.
R
CH
2
NH
2
+
HNO
2
R
CH
2
OH
+ N
2
H
2
O
+
Wykonanie oznaczenia:
Do probówki zawierającej około 0,2 ml aminy należy dodać 0,5 ml 10% r-ru kwasu solnego i dodawać kroplami
10% r-r azotanu (III) sodu (NaNO
2
), chłodząc w wodzie z lodem. Wywiązywanie się pęcherzyków azotu
wskazuje na obecność 1
o
aminy alifatycznej. Po ogrzaniu do wrzenia i ochłodzeniu należy przeprowadzić próbę
na obecność alkoholu.
2
o
aminy alifatyczne tworzą w reakcji z HNO
2
N-nitrozoaminy, które mają postać żółto lub
żółtopomarańczowych olejów.
NH
R
R
+ HNO
2
N
R
R
NO
H
2
O
+
Wykonanie oznaczenia:
Do probówki zawierającej około 0,2 ml aminy należy dodać 0,5 ml 10% r-ru kwasu solnego (HCl) i dodawać
kroplami 10% r-r azotanu (III) sodu (NaNO
2
), chłodząc w wodzie z lodem. Powstaje żółty lub pomarańczowy olej.
3
o
aminy alifatyczne nie reagują z kwasem azotowym (III).
1
o
aminy aromatyczne tworzą w niskiej temp. bezbarwne sole diazoniowe, rozpuszczalne w wodzie, które
wykrywa się poprzez sprzęganie w środowisku zasadowym z fenolem (np. 2-naftolem) z którym tworzą barwniki
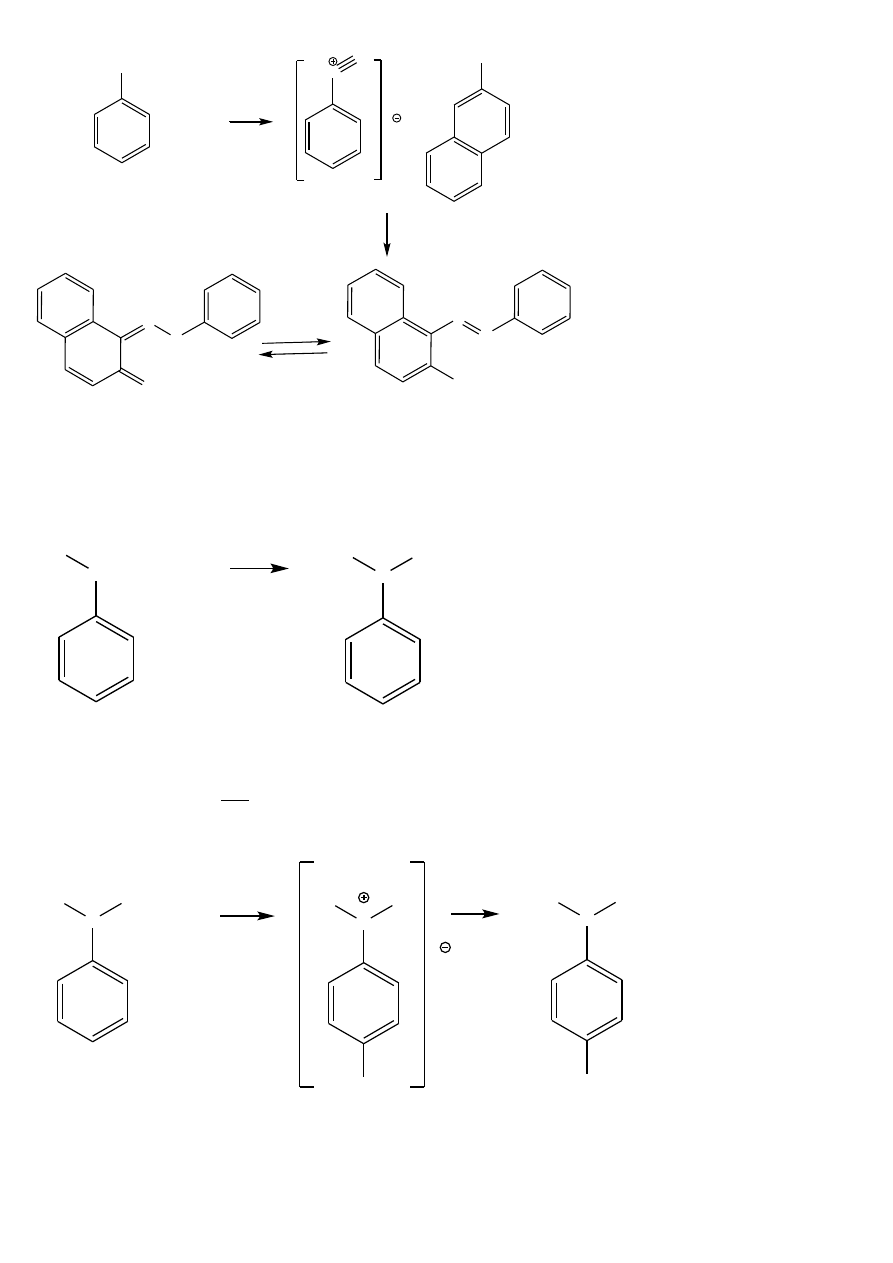
azowe.
NH
2
+ HNO
2
N
N
Cl
+
ONa
N
N
OH
N
H
N
O
- NaCl
Wykonanie oznaczenia:
Niewielka ilość substancji należy rozpuścić w ok. 3 ml 10% r-ru kwasu solnego chłodząc w wodzie z lodem, a
następnie dodawać kroplami 10% r-r azotanu (III) sodu (NaNO
2
), chłodząc w wodzie z lodem. Po dodaniu ok. 1
ml 10% zasadowego r-ru 2-naftolu powstaje czerwone zabarwienie lub pomarańczowy osad. Należy pamiętać o
lekko zasadowym środowisku reakcji sprzęgania (optymalne pH wynosi 9-10).
2
o
aminy N-aromatyczne reagując z kwasem azotowym (III) tworzą trudno rozpuszczalne krystaliczne
nitrozoaminy, które nie mają charakteru zasadowego.
NH
+ HNO
2
H
3
C
N
H
3
C
NO
+ H
2
O
Wykonanie oznaczenia:
Do probówki zawierającej około 0,2 ml aminy należy dodać 0,5 ml 10% r-ru kwasu solnego i dodawać kroplami
10% r-r azotanu (III) sodu (NaNO
2
), chłodząc w wodzie z lodem. Powstaje żółty osad N-nitrozoaminy.
3
o
aminy aromatyczne podstawione w pozycji para- nie reagują z kwasem azotowym (III).
3
o
aminy aromatyczne NIE podstawione w pozycji para- reagują z kwasem azotowym (III) tworząc para-
nitrozopochodne aminy w postaci soli amoniowej (chlorowodorku) o barwie żółtopomarańczowej. Po
zalkalizowaniu wodnego r-ru soli wydziela się wolna zasada o barwie zielonej.
N
+ HNO
2
H
3
C
H
N
H
3
C
CH
3
CH
3
HCl
NO
Cl
N
H
3
C
CH
3
NO
NaOH
Wykonanie oznaczenia:
Do probówki zawierającej około 0,2 ml aminy należy dodać 0,5 ml 10% r-ru kwasu solnego i dodawać kroplami
10% r-r azotanu (III) sodu (NaNO
2
), chłodząc w wodzie z lodem. Powstaje żółty osad N-nitrozoaminy.
REAKCJA DLA AMIN 1
o
ALIFATYCZNYCH I AROMATYCZNYCH –
REAKCJA NINHYDRYNOWA
1
o
aminy tworzą z ninhydryną o charakterze iminowym (zasadę Schiffa), który w wieloetapowej reakcji ulega
rozpadowi zazwyczaj z wytworzeniem 2-amino-3-hydroksy-1H-inden-1-onu, który następnie reagując z
cząsteczką ninhydryny daje barwny związek. Reakcji tej ulegają 1
o
aminy oraz aminokwasy i aminocukry.
O
O
OH
OH
+
H
2
N
R
O
O
NR
-
O
O
H
2
N
O
O
OH
OH
+
-
O
O
N
O
O
purpura Ruhemanna
Wykonanie oznaczenia:
Odmierzyć do probówki ok. 1 ml r-ru aminy, dodać około 0.5 ml 0,2% roztworu ninhydryny w etanolu i ogrzać do
wrzenia we wrzącej łaźni wodnej. Pojawia się charakterystyczne czerwone zabarwienie.
REAKCJA DLA AMIN 1
o
ALIFATYCZNYCH I AROMATYCZNYCH –
REAKCJA IZONITRYLOWA
Aminy alifatyczne oraz aromatyczne pierwszorzędowe reagują z chloroformem w środowisku silnie alkaliczny,
tworząc odpowiednie izonitryle o bardzo nieprzyjemnym zapachu.
R
NH
2
+
R
N
+
3H
2
O
+
CHCl
3
+ 3KOH
CH
3KCl
Wykonanie oznaczenia:
Do paru kropli badanej aminy dodać 0,5 ml chloroformu, jedno ziarno wodorotlenku potasu (KOH) a następnie
ogrzać. Wydziela się nieprzyjemn zapach izonitrylu.
REAKCJA DLA AMIN 1
o
ALIFATYCZNYCH – PRÓBA RIMINIEGO
Aminy alifatyczne pierwszorzędowe dają z nitroprusydkiem sodu i acetonem w ciągu około 2 min. zabarwienie
fioletowe.
Wykonanie oznaczenia:
Do r-ru 2 kropli aminy w 1 ml acetonu dodaje się ok. 3 ml wody, a następnie 2 krople 1% nitroprusydku sodu.
REAKCJA DLA AMIN 2
o
ALIFATYCZNYCH – PRÓBA SIMONA
Aminy alifatyczne drugorzędowe dają z nitroprusydkiem sodu i aldehydem octowym w środowisku węglanu
sodu (Na
2
CO
3
) barwne połączenia (niebieskie do fioletowego).
Wykonanie oznaczenia:
Do kropli aminy dodaje się kroplę mieszaniny nitroprusydku sodu oraz aldehydu octowego, a następnie dodaje
się 2% r-r węglanu sodu.
REAKCJA DLA AMIN 3
o
ALIFATYCZNYCH I AROMATYCZNYCH – Z KWASEM CYTRYNOWYM W
BEZWODNIKU OCTOWYM
Zarówno trzeciorzędowe aminy alifatyczne, jak i aromatyczne reagują z kwasem cytrynowym w bezwodniku
octowym dając czerwonofioletowe połączenia.
Wykonanie oznaczenia:
Do kilku kropli aminy dodaje się kroplę r-ru zawierającego 2% roztwór kwasu cytrynowego w bezwodniku
octowym, całość ogrzewa się na łaźni wodnej.
AMINOKWASY I BIAŁKA
REAKCJA NINHYDRYNOWA
Aminokwasy oraz białka dają barwną reakcję z etanolowym roztworem ninhydryny. Reakcja ta nie jest
specyficzna wyłącznie dla aminokwasów. Amoniak oraz część związków zawierających I-rzędową grupę

aminową dają z ninhydryną charakterystyczne zabarwienie. Aminokwasy, peptydy i białka powodują iż powstaje
zabarwienie niebieskie, fioletowe, czerwono-fioletowe lub czerwone.
Wykonanie oznaczenia:
Ok. 50 mg aminokwasu należy rozpuścić w ok. 0,5 ml 0,2% etanolowego roztworu
ninhydryny. Zabarwieniepowstaje natychmiast lub dopiero w następstwie ogrzania mieszaniny do wrzenia.
REAKCJA DEAMINACJIIDEKARBOKSYLACJI
a-Aminokwasy ulegają deaminacji i dekarboksylacji pod wpływem czynników utleniających (podbromianu lub
podchlorynu sodu). Końcowymi produktami reakcji są: amoniak oraz aldehyd uboższy o jeden atom węgla niż
wyjściowy aminokwas. Aldehyd powstaje przez dekarboksylację tworzącego się pośrednio a-ketokwasu.
Utworzony aldehyd można wykryć np. w reakcji z odczynnikiem Schiffa.
Wykonanie oznaczenia:
Około 50 mg substancji miesza się z ok. 0,5 ml nasyconego roztworu podchlorynu sodu, probówkę można
łagodnie ogrzać. Następnie dodaje się kilka kropli odczynnika Schiffa (roztwór fuksyny w kwasie siarkowym (IV)).
O obecności aminokwasu świadczy różowa lub czerwona barwa.
REAKCJA Z SOLAMI MIEDZI
Alifatyczne a-aminokwasy oraz aminokwasy aromatyczne z grupą -NH
2
w bocznym łańcuchu dają barwne
kompleksy z jonami metali, np. w reakcji z siarczanem miedzi (II) tworzą kompleksy o zabarwieniu
ciemnoniebieskim:
Wykonanie oznaczenia:
Do wodnego roztworu aminokwasu należy dodać kroplami roztwór CuSO
4
. Probówkę można łagodnie ogrzać.
Roztwór przyjmuje ciemnoniebieskie zabarwienie. Aby właściwie zinterpretować wynik należy równolegle
wykonać ślepą próbę.
WYKRYWANIE SIARKI
Stwierdzenie obecności jonów siarczkowych (S
2-
) w przesączu uzyskanym po stopieniu związku z sodem, jest
pośrednim dowodem na obecność siarki w badanym związku. Poniżej podano dwie metody identyfikacji jonów
siarczkowych (reakcja z pentacyjanonitrozylożelazianem (III) sodu, reakcja z HC1).
Reakcja z pentacyjanonitrozylożelazianem (III) sodu (tzw. nitroprusydkiem sodu)
Wykonanie oznaczenia:
Do probówki zawierającej ok. 1 ml przesączu otrzymanego po stopieniu analizowanej substancji z sodem dodaje
się 2-3 krople świeżo sporządzonego 1% roztworu nitroprusydku sodu. W przypadku obecności jonów S
2-
powstaje rozpuszczalne w wodzie połączenie kompleksowe o intensywnie fioletowo-czerwonym zabarwieniu.
Na
2
S+Na
2
[Fe(CN)
5
NO] → Na
4
[Fe(CN)
5
NOS]
Próba ta jest bardzo czuła i pozwala wykryć śladowe ilości jonów siarczkowych.
Reakcja z HC1
Wykonanie oznaczenia:
Do probówki zawierającej ok. 1 ml przesączu otrzymanego po stopieniu analizowanej substancji z sodem dodaje
się kroplami 10% HC1 do uzyskania pH w granicach 1-3 (wobec papierka wskaźnikowego). Przy dużym stężeniu
jonów S
2-
wyczuwalny jest nieprzyjemny zapach siarkowodoru.
Na
2
S + 2HC1→ 2NaCl + H
2
S
WYKRYWANIE GRUP TIOLOWYCH
Grupy tiolowe -SH tworzą z pentacyjanonitrozylożelazianem (III) sodu (nitroprusydkiem sodu)w środowisku
zasadowym związek kompleksowy o zabarwieniu czerwono-fioletowym, według przedstawionej reakcji:
[Fe
3
(CN)
5
NO]
2-
+ NH
3
+ R-SH -> [Fe
2
(CN)
5
NOS-R]
3-
+ NH
4
+
Wykonanie oznaczenia:
Do wodnego roztworu badanej substancjidodaje się 5 kropli 10% amoniaku, po czym wkrapla się świeżo
sporządzony 1-2% roztwór nitroprusydku sodu - powstaje zabarwienie czerwone lub czerwono-fioletowe.
REAKCJA KSNATOROTEINOWA
Aminokwasy aromatyczne jak i białka zwierające w swoim składzie aminokwasy aromatyczne reagują ze
stężonym kwasem azotowym (V) tworząc nitrowe pochodne tych aminokwasów o charakterystycznym żółtym
zabarwieniu. W środowisku zasadowym pochodne odszczepiająbarwne aniony nitrofenolanowe.
Wykonanie oznaczenia:

Do ok. 0,5 ml roztworu aminokwasu aromatycznego lub rozcieńczonego roztworu białka dodaje się 0,5 ml
stężonego HNO
3
. Powstaje żółte zabarwienie. W wypadku braku zabarwienia próbkę można ostrożnie ogrzać.
Po ostudzeniu próbkę alkalizuje się 5% roztworem NaOH. Powstaje zabarwienie pomarańczowe.
UWAGA!!! Stężony HNO
3
jest odczynnikiem żrącym, wszystkie reakcje, które wymagają jego użycia należy
wykonywać pod digestorium.
REAKCJA BIURETOWA
Obecność wiązania peptydowego (-CO-NH-) charakterystycznego dla białek wykrywa się za pomocą tzw. reakcji
biuretowej. Daje ją również mocznik (po ogrzaniu) oraz związki, które posiadają dwa wiązania amidowe w
cząsteczce jak diamid kwasu szczawiowego i malonowego.Z siarczanem miedzi (II) w roztworze zasadowym
substancje te dają barwne związki kompleksowe. Tworzenie biuretu z mocznika:
ogrzewanie
2NH
2
-CO-NH
2
→ NH
2
-CO-NH-CO-NH
2
+ NH
3
Wykonanie oznaczenia:
Do roztworu lub zawiesiny białka w wodzie dodaje się 1 ml 10% roztworu NaOH i 1-2 krople roztworu C
U
SO
4
.
Roztwór barwi się na kolor fioletowy (lub czerwono-fioletowy).
REAKCJE STRĄCENIOWE
Charakterystyczną właściwością białek jest możliwość wytrącania ich z roztworów za pomocą kationów lub
anionów. Gdy wytrącanie białka z roztworu zachodzi pod wpływem roztworów soli, mówimy wtedy o tzw.
wysalaniu. Po dodaniu do roztworu białka nasyconego roztworu soli jak np. (NH
4
)
2
SO
4
, MgSO
4
, Al
2
(SO
4
)
3
,
zachodzi zobojętnianie ładunków elektrycznych cząsteczek białka przez jony o przeciwnym znaku. Obserwuje
się powstanie osadu. Białko może być ponownie przeprowadzone w postać rozpuszczoną gdy jego cząsteczki
ponownie uzyskają swój ładunek elektryczny. Dzieje się tak po rozcieńczeniu osadu wodą.
Wykonanie oznaczenia:
Do probówki zawierającej ok. 0,5 ml roztworu białka dodaje się taką samą ilość nasyconego roztworu MgSO
4
.
Wytrąca się biały osad, który rozpuszcza się po dodaniu wody.
DENATURACJA BIAŁKA
Denaturacja polega na trudno odwracalnej lub nieodwracalnej zmianie struktury II- i III- rzędowej białka.
Zachodzi pod wpływem różnych czynników jak: podwyższona temperatura, kwasy, zasady, niektóre odczynniki -
95% etanol, aceton.
Wykonanie oznaczenia:
-
probówkę zawierającą ok. 0,5 ml roztworu białka umieścić we wrzącej łaźni wodnej. Powstaje biały osad, który
jest nierozpuszczalny w wodzie.
-
do probówki zawierającej ok. 0,5 ml roztworu białka dodać ok. 0,5 ml etanolu. Po kilku minutach wytrąca się
osad.
WĘGLOWODANY
Reakcja Molischa
Reakcja ta polega na odwodnieniu cukru pod wpływem stężonego H
2
SO
4
do pochodnej furfuralowej, która z
kolei reaguje z P-naftolem tworząc barwne połączenie. Dodatni wynik reakcji dają sacharydy, aldehydy, kwasy
organiczne oraz aceton.
Wykonanie oznaczenia:
Do probówki zawierającej ok. 1 ml wodnego roztworu próbki dodać 2 krople 10% rozt. P-naftolu (odczynnik
Molischa). Następnie dodać 1 ml stęż. H
2
SO
4
, wlewając po ściankach probówki tak, aby ciecze się nie
zmieszały. Na granicy faz pojawiają się charakterystyczne pierścienie o barwie niebieskiej lub fioletowej.
ODRÓŻNIANIE MONO-DISACHARYDÓW
Reakcja Barfoeda
Mono-, jak i disacharydy mają właściwości redukujące, jednak związki te różnią się szybkością reakcji.
Przykładem jest reakcja z odczynnikiem Barfoeda, polegająca na redukcji jonów Cu
2+
do Cu
+
. Monosacharydy
reagują natychmiast, a disacharydy po uprzedniej hydrolizie.
Wykonanie oznaczenia:
Do niewielkiej ilości roztworu cukru dodać 1 ml odczynnika Barfoeda (roztwór Cu(CH
3
COO)
2
w kwasie octowym),
po czym mieszaninę ogrzewać na łaźni wodnej. Pojawienie się ceglastoczerwonego osadu Cu
2
O w czasie do 2
min. świadczy o obecności monosacharydu. W przypadku braku zabarwienia próbkę należy ogrzewać do 15
min. aż pojawi się ceglastoczerwony osad świadczący o obecności disacharydu.
ODRÓŻNIANIE ALDOZ OD KETOZ
Próba Seliwanowa

Pod wpływem HC1 ketozy ulegają odwodnieniu znacznie łatwiej niż aldozy. Powstały 5- hydroksymetylofurfural
tworzy z rezorcyną (odczynnik Seliwanowa) związek kompleksowy o zabarwieniu wiśniowym.
Wykonanie oznaczenia:
Do 1 ml próbki dodać 1 ml odczynnika Seliwanowa (roztwór 50 mg rezorcyny w 100 ml 12% HC1). Probówkę
ogrzewać na łaźni wodnej. Obecność ketozy potwierdza pojawienie się barwy wiśniowej.
ODRÓŻNIANIE PENTOZ OD HEKSOZ
Cukry różniące się liczbą atomów węgla można odróżnić jedynie na drodze specyficznych reakcji dających
produkt o charakterystycznym zabarwieniu. Przykładem jest poniższa reakcja.
Wykonanie oznaczenia:
1 ml mieszaniny aniliny i kwasu octowego ogrzać do wrzenia, po czym dodać kilka kryształów cukru i 3 krople
stęż. HC1. Pentozy dają czerwone zabarwienie, metylopentozy - żółtoczerwone, a heksozy dajja zabarwienie
zielonkawe.
TWORZENIE OSAZONÓW
Cukry reagują z fenylohydrazyną dając krystaliczne osazony (1,2-fenylohydrazony). Produkt reakcji wykazuje
właściwości fizykochemiczne charakterystyczne dla poszczególnych cukrów. Należy zwrócić uwagę, że epimery
o różnej konfiguracji przy C2 lub C3 dają identyczne osazony i tą reakcją nie można ich odróżnić.
Dodatni wynik reakcji dają także inne związki zawierające układ a-hydroksykarbonylowy.
Wykonanie oznaczenia:
Do 100 mg próbki cukru dodać 200 mg fenylohydrazyny, 300 mg octanu sodu oraz 2 ml wody. Probówkę
zatkaną watą ogrzewać na łaźni wodnej. Po pewnym czasie (do pół godziny) wydziela się krystaliczny osazon.
Po odsączeniu, przekrystalizowaniu i wysuszeniu osad wykazuje charakterystyczną postać krystaliczną i
temperaturę topnienia.
Wyszukiwarka
Podobne podstrony:
4 Analiza progu rentownosci id Nieznany (2)
dodatkowe8 analiza 2011 12 id 1 Nieznany
B14 analiza plu przedzialy id 7 Nieznany
Cw Analiza finansowa bankow id Nieznany
analizator stanow logicznych id Nieznany (2)
analiza dzialan promocyjnych id Nieznany (2)
analiza wynikow w statystyce id Nieznany (2)
Analiza finansowa dzwignie id 6 Nieznany
Banaszkiewicz S, Kukułka R, Manek M Analiza związków organicznych
analiza dyskryminacyjna 2011 id Nieznany (2)
5 Analiza wyniku finansowego id Nieznany (2)
prawo pracy zwiazki zawodow id Nieznany
analiza istrumentalna kolo 2 id Nieznany (2)
analiza strategiczna bakoma id Nieznany (2)
Analiza spoBki budownictwo id 6 Nieznany
analiza strategiczna space id 6 Nieznany
LABOLATORIUM – METODY ANALIZY ZWIĄZKÓW ORGANICZNYCH, Uczelnia, Semestr 6, Metody analizy zwi�?zków o
cw 3, Analiza piwa (teoria) id Nieznany
więcej podobnych podstron