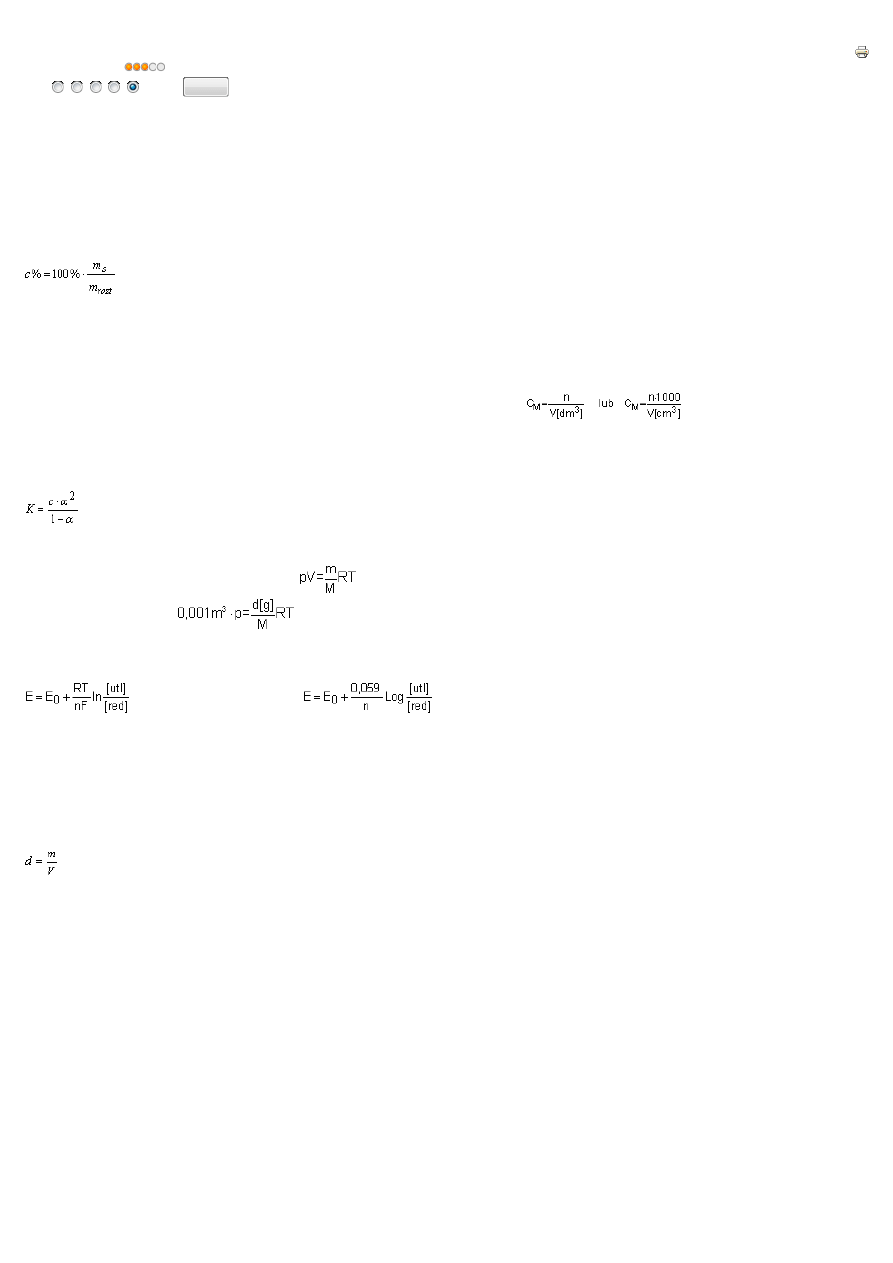
Strona 1
Podstawowe wzory chemiczne
2011-05-02 12:53:35
http://www.chemia.sos.pl/index.php/wzory-w-chemii.html?tmpl=component&print=1&page=
Podstawowe wzory chemiczne
Ocena u
ż
ytkowników:
/ 95
Słaby
Ś
wietny
Oce
ń
WZORY STOSOWANE W CHEMII
Przedstawionych tu wzorów wcale nie musimy si
ę
uczy
ć
na pami
ęć
. Wszystkie da si
ę
łatwo wyprowadzi
ć
, ale te kilka podstawowych warto zna
ć
, cho
ć
by po to by nie traci
ć
czasu na
ich wyprowadzanie.
Cz
ę
sto wzór podany jest w formie "zakamuflowanej". Na przykład gdy podawane jest st
ęż
enie roztworu: 5mol/dm
3
, g
ę
sto
ść
: 1,301g/cm
3
, odpowiednie wzory na obliczanie tych
wielko
ś
ci mo
ż
emy odgadn
ąć
z ich miana.
mol
/dm
3
- oznacza,
ż
e musimy wzi
ąć
n moli i podzieli
ć
przez obj
ę
to
ść
V (dm
3
jest mianem obj
ę
to
ś
ci). Wzór na g
ę
sto
ść
- [g] to miano masy
m, a [cm
3
] jest mianem obj
ę
to
ś
ci V. Czyli wzór na g
ę
sto
ść
to m/V
St
ęż
enie procentowe roztworu:
Roztwór o st
ęż
eniu
x
% oznacza,
ż
e w 100g roztworu znajduje si
ę
x
g substancji rozpuszczonej
gdzie:
m
rozt
- masa roztworu m
roz
=m
s
+m
rozp
m
s
- masa substancji
St
ęż
enie molowe roztworu:
Roztwór o st
ęż
eniu
n
mol
/dm
3
oznacza,
ż
e w 1dm
3
roztworu znajduje si
ę
n
moli substancji rozpuszczonej.
n - liczba moli substancji
V - obj
ę
to
ść
roztworu
Prawo rozcie
ń
cze
ń
Ostwalda:
je
ż
li st
ęż
enie c jest du
ż
e a
α
jest małe wzór upraszcza si
ę
do K=c
.
α
2
Prawo stanu gazu doskonałego (wzór Clapeyrona)
PV=nRT Wzór ten mo
ż
e podlega
ć
ró
ż
nym modyfikacjom:
. Gdy znana jest g
ę
sto
ść
gazu, przyjmuje si
ę
,
ż
e V=1dm
3
(0,001m
3
), a masa gazu m równa jest warto
ś
ci
g
ę
sto
ś
ci. Wzór przyjmie posta
ć
:
. Wzór ten pozwala obliczy
ć
mas
ę
cz
ą
steczkow
ą
gazu gdy znana jest jego g
ę
sto
ść
w okre
ś
lonej temperaturze T i przy
okre
ś
lonym ci
ś
nieniu p
Wzór Nernsta
lub cz
ę
sto podaje si
ę
go w postaci:
Wzór empiryczny Najprostrzy wzór zwi
ą
zku, w którym ilo
ś
ci atomów s
ą
najmnieszymi liczbami całkowitymi:
C
6
H
8
- wzór cz
ą
steczkowy C
3
H
4
- wzór empiryczny
C
4
H
8
- wzór cz
ą
steczkowy CH
2
- wzór empiryczny
N
2
O
4
- wzór cz
ą
steczkowy NO
2
- wzór empiryczny
g
ę
sto
ść
roztworu:
gdzie:
m - masa substancji
V - obj
ę
to
ść
jak
ą
zajmuje substancja
g
ę
sto
ść
gazu:
d=m/V, ale w warunkach normalnych 1mol ka
ż
dego gazu zajmuje obj
ę
to
ść
22,4dm
3
. G
ę
sto
ś
c gazu w warunkach normalnych mo
ż
emy obliczy
ć
z tej zale
ż
no
ś
ci: d=M/22,4dm
3
.
Zale
ż
no
ść
ta pozwala równie
ż
obliczy
ć
mas
ę
molow
ą
gazu gdy znana jest jego obj
ę
to
ść
.
Stała (liczba)Avogadro
N
0
=6,023
.
10
23
Obj
ę
to
ść
molowa gazu:
V
0
=22,4dm
3
Ci
ś
nienie normalne:
P
0
=1013hPa = 101300Pa
Stała gazowa:
R=8,314J
.
mol
-1.
K
-1

Strona 2
Podstawowe wzory chemiczne
2011-05-02 12:53:35
http://www.chemia.sos.pl/index.php/wzory-w-chemii.html?tmpl=component&print=1&page=
warunki normalne:
P=1013hPa, T=273K
warunki standardowe:
P=1013hPa, T=293K
« poprzednia
nast
ę
pna »
Wyszukiwarka
Podobne podstrony:
Podstawy obliczeń chemicznych 6
matematyka podstawowe wzory i Nieznany
pdf wykład 02 budowa materii, podstawowe prawa chemiczne 2014
Podstawowe wzory i tablice geometria figur płaskich
MODELE CZĄSTECZEK I WZORY CHEMICZNE
podstawy obliczen chemicznych i Nieznany
Podstawowe prawa chemiczne
Podstawowe wzory pochodnych
zadania2 preznosc pary nasyconej oraz gestosc cieczy i gazow, Technologia chemiczna, Podstawy techno
zadania4 lepkosc mieszanin gazow i cieczy pod niskim i umiarkowanym cisnieniem, Technologia chemiczn
zadania5 lepkosc gazow i cieczy pod wysokim cisnieniem, Technologia chemiczna, Podstawy technologii
Wzory chemiczne
matma Matematyka podstawowe wzory
Statystyka - podstawowe wzory, Statystyka wzory
Matematyka Podstawowe wzory i przykłady
inz chem sciaga egz, podstawy inżynierii chemicznej
Wzory stat, Statystyka - podstawowe wzory
więcej podobnych podstron