
1
Podstawy chemii nieorganicznej – egzamin 2013
2
Podstawy chemii nieorganicznej – egzamin 2013
Grupa 111
1. Obliczyć siłę jonową roztworu Cr(ClO4)3 o stężeniu 0,50M
Cr(ClO4)3 → Cr^3+ + 3ClO4^-
[Cr]=0,5 M
[ClO
4
]= 3*0,5M = 1,5 M
I = 0,5*(0,5*3^2 + 1,5*1^2) = 3 M
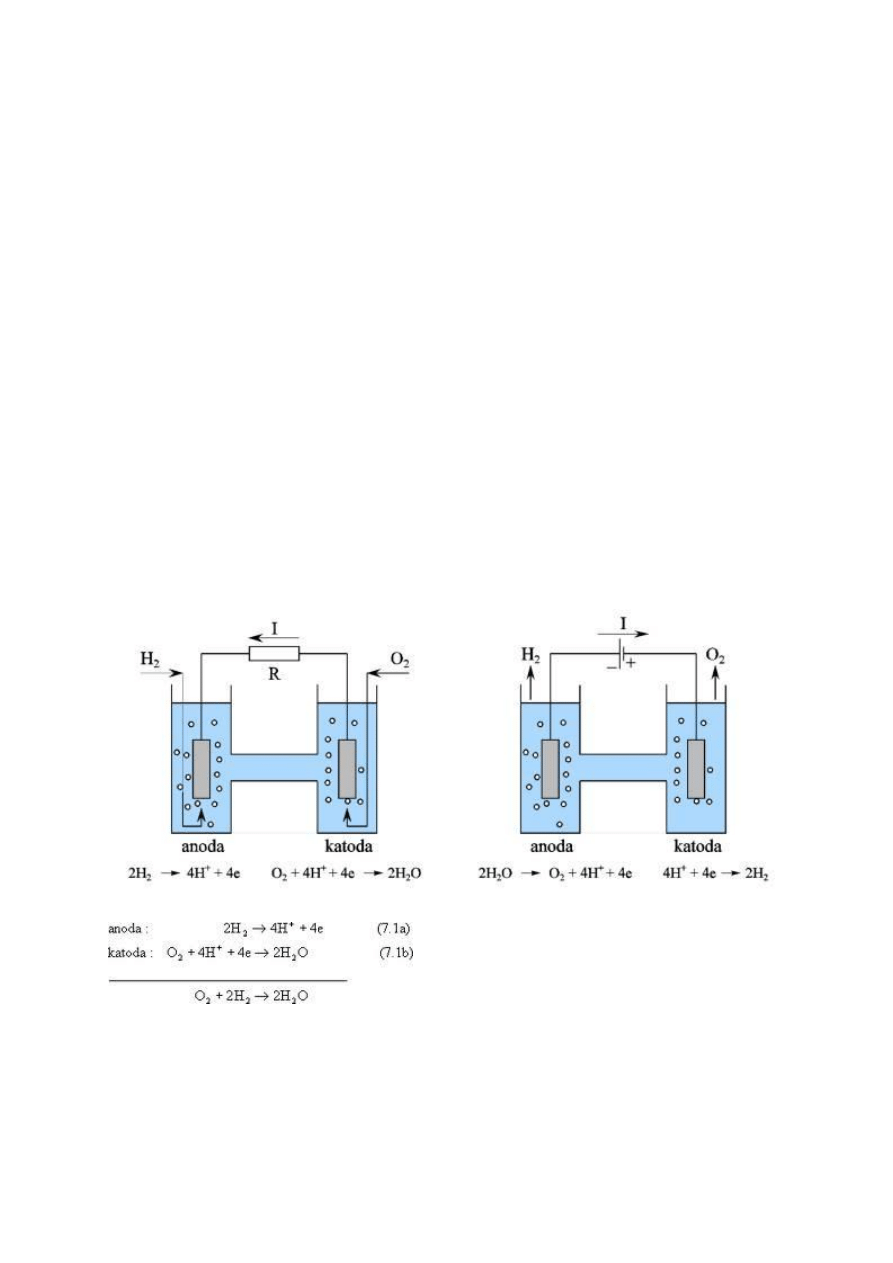
2. W ogniwie wodorowo-tlenowym zachodzi reakcja:
a) 3H
2
O = 3H
2
+ O
3
b) H
2
+ O
2
= H
2
O
2
c) 2H
2
O = 2H
2
+ O
2
d) 2H
2
+ O
2
= 2H
2
O
3. Obliczyć jakie powinno być natężenie prądu w r-rze CdSO4, jeżeli na katodzie
wydzieliło się 0,50g kadmu w czasie 15 minut. M
CdSO4
=112,41g/mol.
0,96A
3
Podstawy chemii nieorganicznej – egzamin 2013
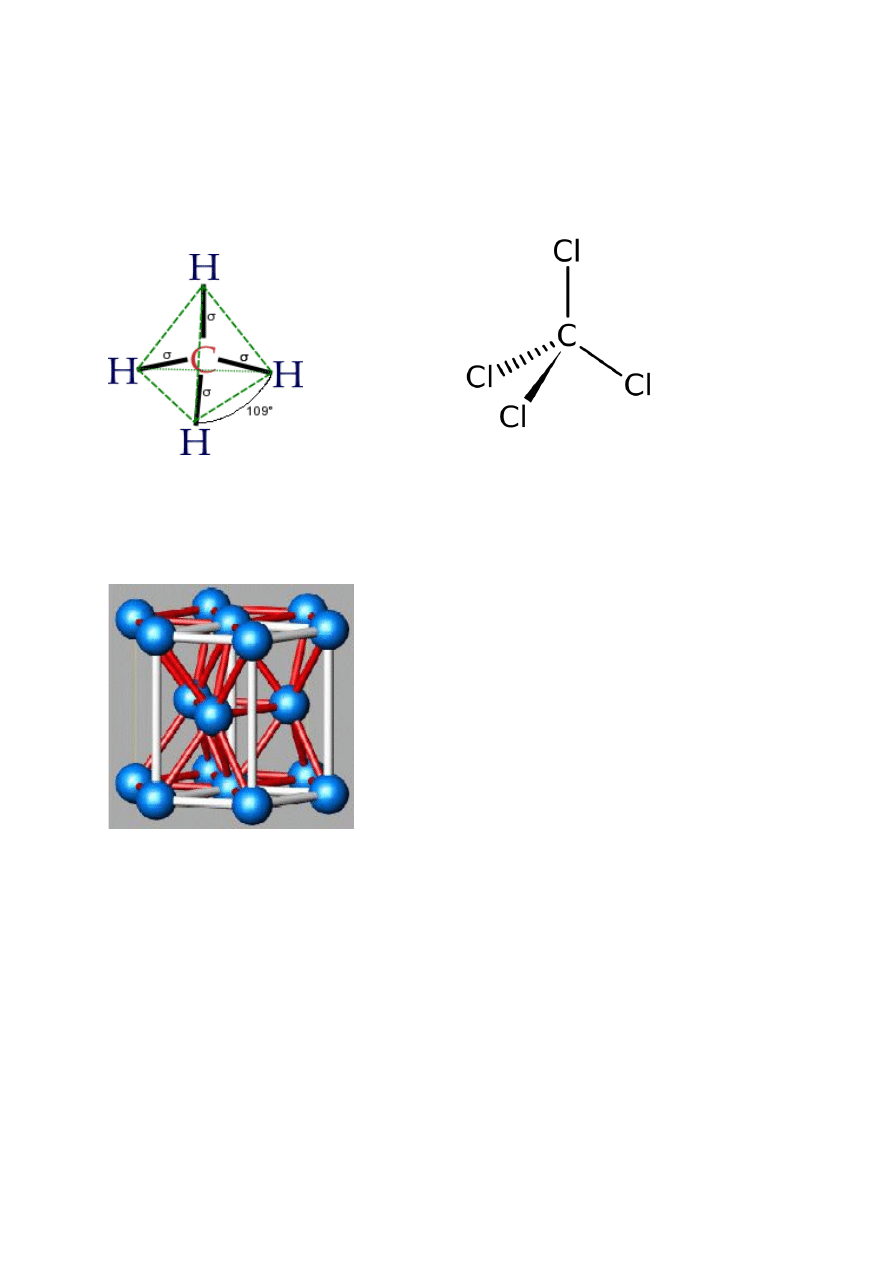
4. Jakie elementy symetrii występują w CH
4
i CCl
4
osie C3, osie C2, osie S4, płaszczyzny symetrii (nie ma środka inwersji)
5. Ile atomów ma komórka A3
6
6. Alotropia jest zjawiskiem:
a) pierwiastków tylko w postaci mieszaniny ich izotopów
b) dwu- i wieloatomowych cząsteczek pierwiastka w fazie gazowej
c) identycznej struktury różnych związków tego samego pierwiastka
d) różnych odmian tego samego pierwiastka niezależnie od ich stanu
skupienia i właściwości
7.W reakcji platyny z “wodą królewską”

4
Podstawy chemii nieorganicznej – egzamin 2013
aPt + bHNO3 + cHCl = dH2PtCl6 + eNO +fH2O
współczynniki stechiometryczne a i c są równe:
a) 3 i 12
b) 3 i 18
c) 4 i 16
d) 4 i 12
3Pt + 4HNO3 + 18HCl --> 3H2PtCl6 + 4NO + 8H2O
Pt + 6Cl- - 4e → PtCl6 /*3 (po prawo Pt na +4 stopniu utlenienia)
NO3 + 4H+ + 3 e → NO + 2H2O /*4 (po lewo azot na +5stopnu, po prawo na
+2 )
3Pt + 18 Cl- + 4 NO3 → 3 PtCl6 + 4NO + 8H2O
3 Pt + 4 HNO3 + 18 HCl → 3 H2PtCl6 + 4 NO + 8 H2O
8.Jaki jest rozkład elektronów d w oktaedrycznym kompleksie [Co(NO2)
6
]
3-
pomiędzy
dwa poziomy energetyczne (t
2g
- niższy, e
g
- wyższy), jeżeli różnica ich energii Δ jest
większa od energii sparowania spinów?
a) (t2g)
4
(eg)
2
b) (t2g)
5
(eg)
1
c) (t2g)
2
(eg)
4
d) (t2g)
6
(eg)
0
9. Wodorki litowców
a) są utleniaczami
b) są reduktorami
c) w stanie stopionym nie przewodzą prądu elektrycznego
d) są reduktorami i stopione przewodzą prąd
10. Wskaż podstawową cechę półprzewodnika samoistnego:
a) obecność domieszki ułatwiającej przeniesienie elektronów z pasma podstawowego
do pasma przewodnictwa

5
Podstawy chemii nieorganicznej – egzamin 2013
b) niezależność liczby elektronów przewodnictwa od temperatury
c) wzrost przewodnictwa elektrycznego ( zmniejszenie oporu) wraz ze wzrostem
temperatury
d) przejście w temperaturze 0 K w stan nadprzewodnictwa
11. Tlenkami o charakterze kwasowym są:
a) CO, P
2
O
5
, MgO
b) B
2
O
3
, SO
2
, SeO
3
c) CaO, Bi
2
O
3
, FeO
d) ZnO, Cr
2
O
3
, PbO
tlenki kwasowe to tlenki niemetali
12. Stopień dysocjacji słabego kwasu jest równy 0,010. Jakie jest pH roztworu jeżeli
stała dysocjacji kwasu jest równa 4,0*10^-4?
a) 2,30
b) 2,70
c) 2,00
d) 1,70
nie było podanej poprawnej odpowiedzi:
a=H+/Co =>H+=Co*a Ka=[H+]*Co*a/a-1 => Ka=[H+]*a/a-1 =>[H+]=0,0404
pH=1,4
13. Jednordzeniowe karbonylki metali przejściowych spełniają regułę, że suma
liczby elektronów walencyjnych atomu centralnego i liczby elektronów
dostarczanych przez cząsteczki CO jest równa 18, co odpowiada liczbie elektronów
w zewnętrznej powłoce atomów najbliższego gazu szlachetnego. Wyjątkiem od
“reguły 18” jest:
a) Mo(CO)
6
b) V(CO)
6
c) Ni(CO)
4
d) Cr(CO)
6
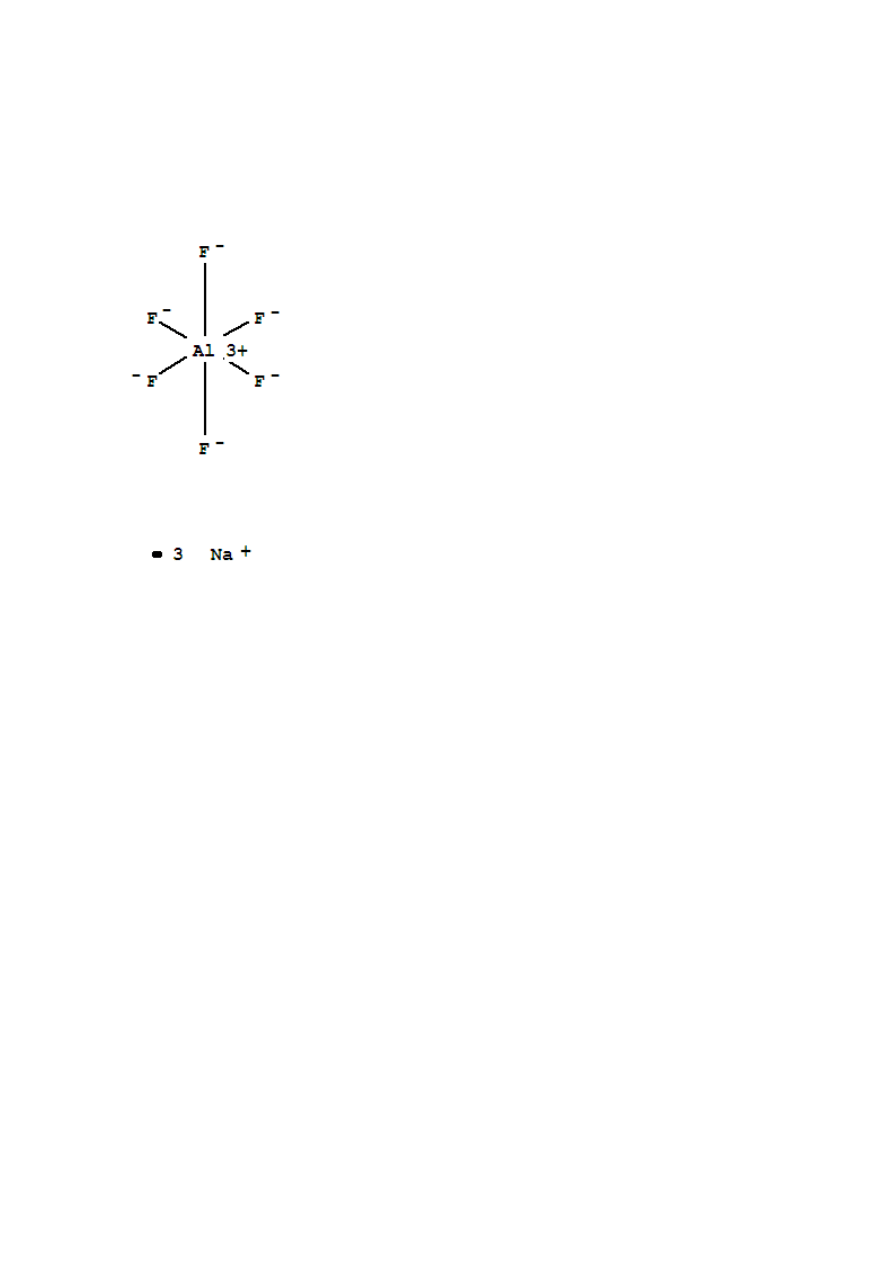
6
Podstawy chemii nieorganicznej – egzamin 2013
14. Jaki jest wzór kriolitu:
heksafluoroglinian(III) sodu (Na
3
[AlF
6
])
15. Na jakim stopniu utlenienia najczęściej występują lantanowce
a)2
b)3
c)4
d)7

7
Podstawy chemii nieorganicznej – egzamin 2013
Grupa 333
1. Jaka jest siła jonowa w 0,5M roztworze Na
3
PO
4
?
a) 1,5
b) 3,0
c) 2,0
d) 6,0
2. Jaka reakcja zachodzi w ogniwie:
Pt|O
2
(p=101,3kPa)| OH
-
|| H
+
| H
2
(p=101,3kPa)| Pt:
a) H
2
+ O
2
= H
2
O
2
b) 2H
2
O = 2H
2
+ O
2
c) 3H
2
O = 3H
2
+ O
3
d) 2H
2
+ O
2
= 2H
2
O
Ogniwa paliwowe
Wiemy, że każdą reakcję redoks można rozdzielić na reakcje połówkowe i
wykorzystać do utworzenia ogniwa galwanicznego. A ponieważ każdy proces
spalania jest taką reakcją, podjęto próby wykorzystania energii reakcji spalania do
wytwarzania elektryczności. Okazało się, że doskonale do tego celu nadaje się wodór
i metan (CH4). Spalanie wodoru można zapisać reakcją;
2H
2(g)
+ O
2(g)
--> 2H
2
O
(c)
którą można podzielić na reakcje połówkowe. W kwaśnym roztworze przebiegają one
następująco:
anoda: 2H
(g)
+ 4OH
-(aq)
--> 2H
2
O
(c)
+ 4e
-
katoda: O
2(g)
+ 4e
-
+ 2H
2
O
(c)
--> 4OH
-
3. Jakie powinno być natężenie prądu, aby z roztworu Cr
2
(SO
4
)
3
wydzielić na
katodzie 0,86g chromu w czasie 12,5 min? MCr=52,00g/mol, F=9,65*10
4
C

8
Podstawy chemii nieorganicznej – egzamin 2013
a) 2,6 A
b) 6,4 A
c) 8,0 A
d) 12,0 A
4. Elementami symetrii w cząsteczce amoniaku są:
a) środek symetrii, oś dwukrotna C
2
, dwie wertykalne płaszczyzny symetrii
b) oś trójkrotna C
3
, 3 osie C
2
, 3 wertykalne i 1 horyzontalna
c) oś trójkrotna C
3
, 3 horyzontalne płaszczyzny symetrii
d) oś trójkrotna C
3
, 3 wertykalne płaszczyzny symetrii
5. Na jedną komórkę elementarną regularną ściennie (zewnętrznie) centrowaną
przypada węzłów:
a) 4
b) 6
c) 8
d) 14
6. Polimorfizm to:
a) występowanie różnych pierwiastków w takiej samej strukturze krystalograficznej
b) występowanie różnych związków chemicznych w takiej samej strukturze
krystalograficznej
c) występowanie kilku odmian związku chemicznego o różnej strukturze
krystalograficznej
d) występowanie kilku odmian związku chemicznego o takiej samej strukturze
krystalograficznej
7. Heksacyjanożelazian (III) potasu ma wzór:
a) K
3
[Fe(CN)
6
]
b) K
4
[Fe(SCN)
6
]

9
Podstawy chemii nieorganicznej – egzamin 2013
c) Fe(CN)
3
* 3KCN
d) K
4
[Fe(CN)
6
]
8.Dodanie do czystego germanu niewielkiej ilości indu spowoduje powstanie:
a) półprzewodnika typu “n” ?
b) nadprzewodnika
c) półprzewodnika typu “p”
d) izolatora
9. Jaki jest rozkład elektronów d w oktaedrycznym kompleksie [Mn(CN)
6
]
2-
pomiędzy
dwa poziomy energetyczne (t
2g
- niższy, e
g
- wyższy), jeżeli różnica ich energii Δ jest
większa od energii sparowania spinów?
a) (t
2g
)
4
(e
g
)
1
b) (t
2g
)
5
(e
g
)
0
c) (t
2g
)
3
(e
g
)
2
d) (t
2g
)
2
(e
g
)
3
10. W reakcji złota z roztworem cyjanku sodu
aAu + bNaCN + cO
2
+ dH
2
O = eNa[Au(Cn)
2
] + fNaOH
współczynniki stechiometryczne a i c są równe:
a) 8 i 4
b) 4 i 2
c) 2 i 2
d) 4 i 1
11. Ligandy z donorowymi atomami tlenu w teorii twardych i miękkich kwasów i
zasad są
a) miękkimi zasadami

10
Podstawy chemii nieorganicznej – egzamin 2013
b) twardymi zasadami
c) miękkimi kwasami
d) twardymi kwasami
12. Tlenkami o właściwościach obojętnych są:
a) K
2
O, CuO, CoO
b) TeO
2
, SiO
2
, CO
2
c) Al
2
O
3
, SnO, ZnO
d) N
2
O, NO, CO
http://pl.wikipedia.org/wiki/Tlenki_oboj%C4%99tne
13. Które z wymienionych pierwiastków tworzą tlenki i wodorotlenki amfoteryczne
a) Al, Cr, Zn, Sn
b) N, P, S, Se
c) Mg, C, I, H
d) Na, K, Rb, Cs
14. Produktem redukcji rudy żelaza w wielkim piecu jest:
a) surówka
b) austenit (Fe3C)
c) stal austenityczna
d) stal stopowa z dodatkami innych metali
15. Hydroksoapatyt, Ca
5
(PO
4
)
3
OH i fluoroapatyt, 3Ca
3
(PO
4
)
2
*CaF to:
a) sole kompleksowe
b) hydroksosól i sól podwójna
c) sole mieszane

11
Podstawy chemii nieorganicznej – egzamin 2013
d) sole podwójne

12
Podstawy chemii nieorganicznej – egzamin 2013
Grupa 555
1. Heksacyjanożelazian(III) żelaza(II) to:
a) Fe
3
[Fe(CN)
6
]
2
b) Fe
3
[Fe(SCN)
6
]
2
c) Fe(CN)
3
*Fe(CN)
2
d) Fe
2
[Fe(CN)
6
]
3
2. Jaki jest rozkład elektronów d w oktaedrycznym kompleksie [Ni(CN)
6
]
4-
pomiędzy
dwa poziomy energetyczne (t
2g
- niższy, e
g
- wyższy), jeżeli różnica ich energii Δ jest
większa od energii sparowania spinów?
a) (t
2g
)
4
(e
g
)
4
b) (t
2g
)
6
(e
g
)
2
c) (t
2g
)
4
(e
g
)
2
d) (t
2g
)
6
(e
g
)
1
3. W reakcji rtęci z “wodą królewską”
aHg + bNO
3-
+ cCl
-
+ dH
+
= eHgCl
42-
+fNO + gH
2
O
Współczynniki stechiometryczne c i d są równe:
a) 4 i 8
b) 4 i 4
c) 8 i 8
d) 12 i 8
4. Ligandy fluorkowe w teorii twardych i miękkich kwasów i zasad są:
a) miękkimi kwasami
b) twardymi kwasami
c) miękkimi zasadami

13
Podstawy chemii nieorganicznej – egzamin 2013
d) twardymi zasadami
5. Na podstawie przynależności krzemu i jodu do odpowiednich grup układu
okresowego można zaproponować następujące wzory tlenków tych pierwiastków na
najwyższych stopniach utlenienia:
a) M
2
O
7
i M
2
O
3
b) MO
3
i MO
2
c) MO
2
i M
2
O
7
d) MO
3
i M
2
O
5
6. Które z wymienionych pierwiastków tworzą tlenki i wodorotlenki amfoteryczne?
a) Al, Cr, Zn, Sn
b) N, P, S, Se
c) Mg, C, I, H
d) Na, K, Rb, Cs
7. Elektrolizę wykorzystuje się do oczyszczania metalu w procesie
pirometalurgicznego otrzymywania:
a) żelaza
b) miedzi
c) cynku
d) chromu
8. Hydroksoapatyt, Ca
5
(PO
4
)
3
OH i fluoroapatyt, 3Ca
3
(PO
4
)
2
*CaF to:
a) sole kompleksowe
b) hydroksosól i sól podwójna
c) sole mieszane
d) sole podwójne

14
Podstawy chemii nieorganicznej – egzamin 2013
9. Jaka jest siła jonowa w 0,50M roztworze Co(ClO
4
)
2
?
a) 1,50
b) 3,00
c) 2,00
d) 6,00
10. W ogniwie wodorowo-tlenowym zachodzi reakcja:
a) 3H
2
O = 3H
2
+ O
3
b) H
2
+ O
2
= H
2
O
2
c) 2H
2
O = 2H
2
+ O
2
d) 2H
2
+ O
2
= 2H
2
O
11. Jakie powinno być natężenie prądu, aby z roztworu AgNO
3
wydzielić na katodzie
0,50g srebra w czasie 15 min? M
Ag
=107,87g/mol, F=9,65*10
4
C
a) 0,48A
b) 0,76A
c) 0,51A
d) 0,19A
wychodzi 0,497 A
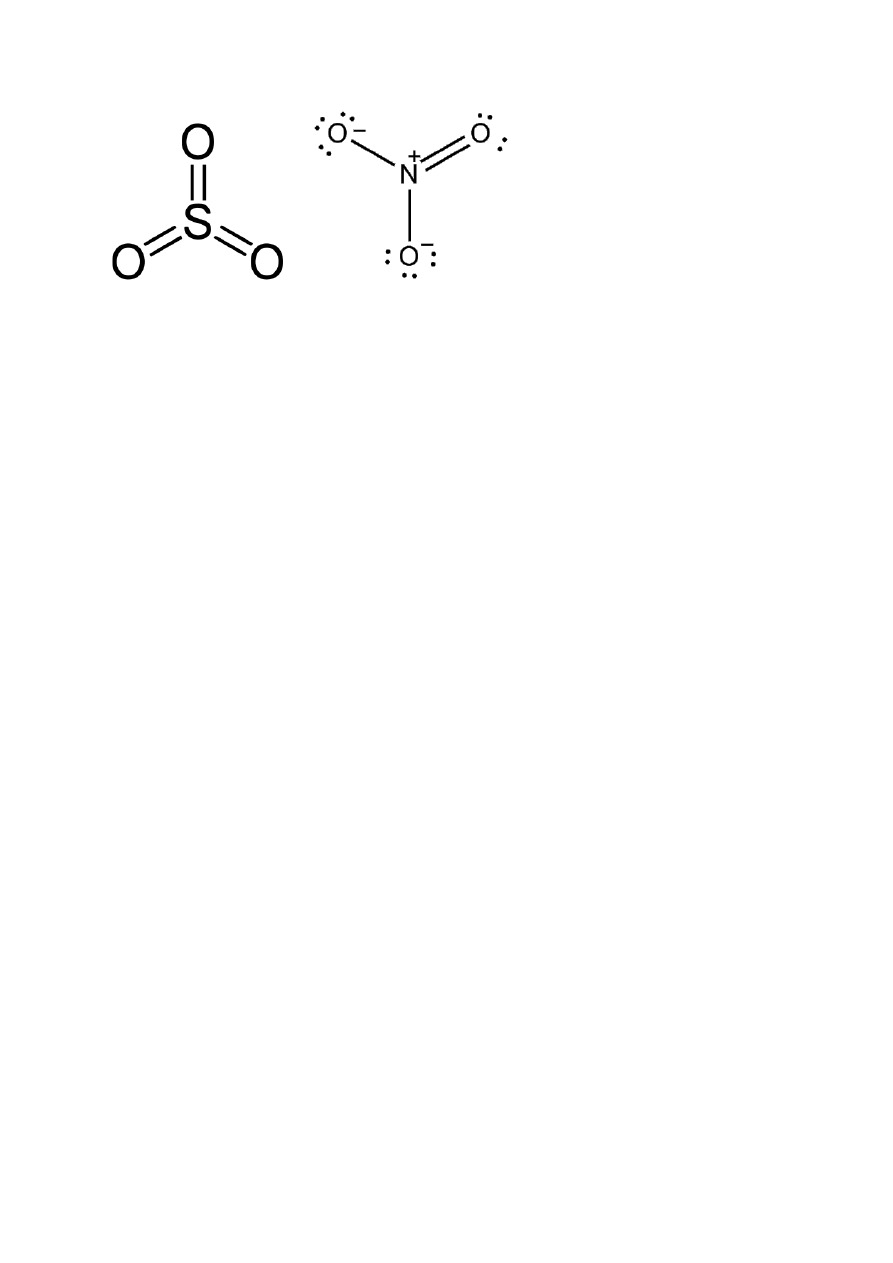
12. Które z niżej wymienionych elementów symetrii występują w strukturze
geometrycznej cząsteczki SO
3
i jonu NO
3-
?
a) osie C
3
,C
2
i S
6
b) osie C
3
,C
2
i S
3
, płaszczyzny symetrii δ
c) osie C
3
,C
2
i środek inwersji i
d) osie C
3
,C
2
i tylko jedna płaszczyzna symetrii δ
15
Podstawy chemii nieorganicznej – egzamin 2013
13. Na jedną komórkę heksagonalną prymitywną przypada:
a) 6 atomów
b) 3 atomy
c) 2 atomy
d) 12 atomów
14. Alotropia jest zjawiskiem:
a) pierwiastków tylko w postaci mieszaniny ich izotopów
b) dwu- i wieloatomowych cząsteczek pierwiastka w fazie gazowej
c) identycznej struktury różnych związków tego samego pierwiastka
d) różnych odmian tego samego pierwiastka niezależnie od ich stanu
skupienia i właściwości
15. Dodanie do czystego germanu niewielkiej ilości arsenu spowoduje powstanie:
a) półprzewodnika typu “n”
b) nadprzewodnika
c) półprzewodnika typu “p”
d) dobrego przewodnika

16
Podstawy chemii nieorganicznej – egzamin 2013
Grupa 777
1. W reakcji platyny z “wodą królewską”
aPt + bHNO
3
+ cHCl = dH
2
PtCl
6
+ eNO +fH
2
O
współczynniki stechiometryczne a i c są równe:
a) 3 i 12
b) 3 i 18
c) 4 i 16
d) 4 i 12
2. Jaki jest rozkład elektronów d w oktaedrycznym kompleksie [Co(NO
2
)
6
]
3-
pomiędzy dwa poziomy energetyczne (t
2g
- niższy, e
g
- wyższy), jeżeli różnica ich
energii Δ jest większa od energii sparowania spinów?
a) (t
2g
)
4
(e
g
)
2
b) (t
2g
)
5
(e
g
)
1
c) (t
2g
)
2
(e
g
)
4
d) (t
2g
)
6
(e
g
)
0
3. Niektóre lantanowce wstępują na +4 stopniu utlenienia. Są to:
a) cer, prazeodym i terb
b) tylko cer
c) tylko terb
d) cer i terb
4, Wodorki litowców
a) są utleniaczami
b) są reduktorami
c) w stanie stopionym nie przewodzą prądu elektrycznego

17
Podstawy chemii nieorganicznej – egzamin 2013
d) nie reagują z wodą i kwasami
5. Cechą półprzewodnika samoistnego jest:
a) przewodnictwo typu “n” i “p”
b) brak zależności liczby elektronów przewodnictwa od temperatury
c) tylko przewodnictwo typu “n”
d) wzrost oporu elektrycznego wraz ze wzrostem temperatury
6. Tlenkami o charakterze kwasowym są:
a) CO, P
2
O
5
, MgO
b) B
2
O
3
, SO
2
, SeO
3
c) CaO, Bi
2
O
3
, FeO
d) ZnO, Cr
2
O
3
, PbO
Tlenki kwasowe to tlenki niemetali.
7. Stopień dysocjacji słabego kwasu jest równy 0,010. Jakie jest pH roztworu jeżeli
stała dysocjacji kwasu jest równa 4,0*10^-4?
a) 2,30
b) 2,70
c) 2,00
d) 1,70
Wychdziło pH=1,4.
8. Jaka jest siła jonowa w 0,75M roztworze Na2SO4?
a) 1,50
b) 3,00
c) 2,25
d) 6,00

18
Podstawy chemii nieorganicznej – egzamin 2013
9. Jaka reakcja zachodzi w ogniwie:
Pt|O
2
(p=101,3kPa)| OH
-
|| H
+
| H
2
(p=101,3kPa)| Pt:
a) H
2
+ O
2
= H
2
O
2
b) 2H
2
O = 2H
2
+ O
2
c) 3H
2
O = 3H
2
+ O
2
d) 2H
2
+ O
2
= 2H
2
O
10. Jednordzeniowe karbonylki metali przejściowych spełniają regułę, że suma
liczby elektronów walencyjnych atomu centralnego i liczby elektronów
dostarczanych przez cząsteczki CO jest równa 18, co odpowiada liczbie elektronów
w zewnętrznej powłoce atomów najbliższego gazu szlachetnego. Wyjątkiem od
“reguły 18” jest:
a) Mo(CO)
6
b) V(CO)
6
c) Ni(CO)
4
d) Cr(CO)
6
11. Jakie powinno być natężenie prądu, aby z roztworu Cr
2
(SO
4
)
3
wydzielić na
katodzie 0,86g chromu w czasie 12,5 min? MCr=52,00g/mol, F=9,65*10
4
C
a) 2,6A
b) 6,4A
c) 8,0A
d) 12A
12. Wszystkie elementy symetrii w cząsteczce wody:
a) środek symetrii, oś dwukrotna C
2
b) oś C
2
, jedna wertykalna i jedna horyzontalna płaszczyzna symetrii
c) oś dwukrotna, dwie płaszczyzny symetrii
d) płaszczyzna symetrii
19
Podstawy chemii nieorganicznej – egzamin 2013
13. Komórka regularna wewnętrznie centrowana zawiera:
a) jeden atom
b) dziewięć atomów
c) dwa atomy
d) osiem atomów
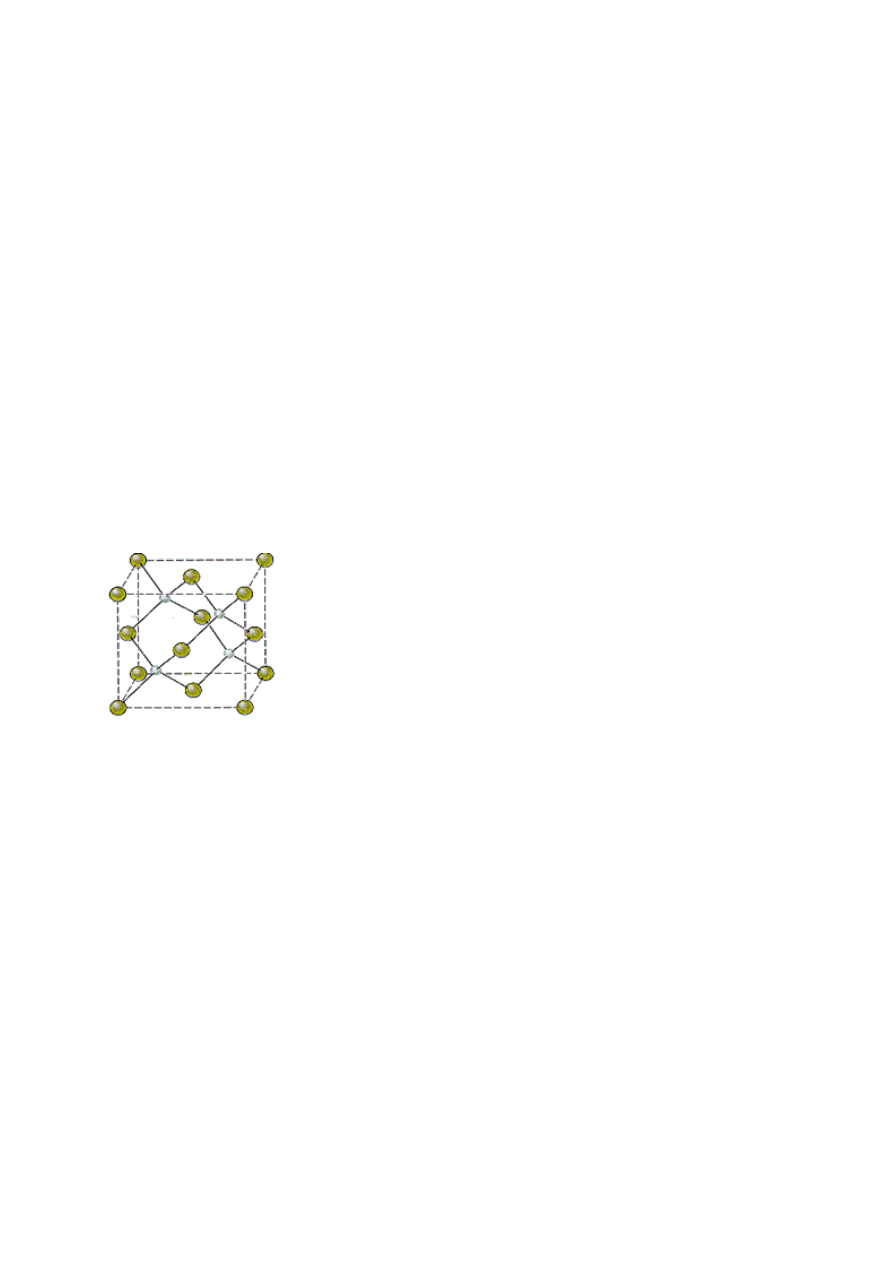
14. W strukturze diamentu atomy węgla zajmują pozycję:
a) takie jak w komórce A1
b) takie jak w komórce A1 z wypełnionymi lukami oktaedrycznymi
c) takie jak w komórce A2 z wypełnionymi lukami tetraedrycznymi
d) takie jak w komórce A1 z wypełnioną połową luk tetraedrycznych
15. Dodanie do czystego germanu niewielkiej ilości galu spowoduje powstanie:
a) półprzewodnika typu “p”
b) nadprzewodnika
c) półprzewodnika typu “n”
d) izolatora
Wyszukiwarka
Podobne podstrony:
Podstawy chemii nieorganicznej egzamin 13
sciaga egz nieorg, podstawy chemii nieorganicznej
,podstawy chemii nieorganicznej L, Pojemność buforu
Egzamin z Chemii nieorganicznej, Egzamin z Chemii nieorganicznej
,podstawy chemii nieorganicznej L,Równowagi w roztworach elektrolitów
,podstawy chemii nieorganicznej L, Pojemność buforu
,podstawy chemii nieorganicznej L,stała dysocjacji słabego elektrolitu
program, podstawy chemii nieorganicznej, Chemia nieorganiczna laboratorium, MOJE
sciaga egz nieorg2, podstawy chemii nieorganicznej
,podstawy chemii nieorganicznej L,Równowagi w roztworach elektrolitów
Bufory sprawko, podstawy chemii nieorganicznej, Chemia nieorganiczna laboratorium, MOJE
jastrzab lomozik bregier jarzebowska podstawy chemii nieorg
Bufory sprawko, Biotechnologia PWR, Semestr 2, Podstawy chemii nieorganicznej Laboratorium, Instrukc
więcej podobnych podstron