
CHOROBY ZAKAŹNE
WETERYNARIA W PRAKTYCE
28
www.weterynaria.elamed.pl
LIPIEC-SIERPIEŃ • 4/2008
sma phagocytophilum w tkankach klesz-
czy, zwierząt i ludzi stwierdzano w Pol-
sce Północnej, Północno-Wschodniej,
Wschodniej, Południowo-Wschodniej,
Zachodniej oraz Centralnej (7, 10-13,
17-22). Na podstawie danych literaturo-
wych można przypuszczać, że całe tery-
torium naszego kraju objęte jest zasię-
giem występowania A. phagocytophilum
i najprawdopodobniej pokrywa się z za-
sięgiem występowania kleszcza I. ricinus,
który jest najczęściej występującym ga-
tunkiem kleszcza w Polsce (23).
P
ATOGENEZA
Do zakażenia dochodzi po upływie oko-
ło 48 godzin żerowania kleszcza (1). Pa-
togen uwolniony wraz ze śliną kleszcza
zostaje zdeponowany w miejscu jego
przyczepu. Następnie riketsje wnikają
do komórek śródbłonka lokalnych na-
czyń włosowatych (ryc. 1, s. 30), gdzie
tworzą charakterystyczne morule (sku-
piska wielu bakterii wewnątrz komór-
ki). Komórki śródbłonka pełnią w tym
wypadku również funkcję komórek pre-
zentujących antygen. Rozwijające się
miejscowe ognisko zapalne oraz IL-8
wydzielana przez komórki śródbłonka
działają chemotaktycznie i aktywują-
co na neutrofile. Aktywowane granulo-
cyty rozpoczynają fagocytozę. Riketsje
A. phagocytophilum są wiązane i fagocy-
towane za pośrednictwem liganda se-
lektyny P (PSGL-1), a po przedostaniu
się do wnętrza komórki żernej ulegają
namnożeniu (24, 25). Przetrwanie zaraz-
ków wewnątrz neutrofilów jest możliwe
dzięki różnym mechanizmom. U riket-
sji z rodziny Anaplasmataceae występu-
je zmniejszona biosynteza lipidu A oraz
peptydoglikanu, co powoduje obniże-
nie bakteriobójczej aktywności leuko-
cytów. Równocześnie bakterie te bloku-
ją łączenie się fagosomu z lizosomem,
uniemożliwiając w ten sposób powstanie
Anaplazmoza granulocytarna jest cho-
robą psów, koni, przeżuwaczy, gryzoni
oraz człowieka. Powodowana jest przez
Gram-ujemne, wewnątrzkomórkowe
bakterie z gatunku Anaplasma phagocyto-
philum, należące do rodziny Anaplasma-
taceae, rzędu Rickettsiales (1, 2). Choroba
po raz pierwszy została opisana w la-
tach 30. XX wieku w Szkocji u owiec
jako gorączka odkleszczowa (tick-bor-
ne fever). Jej występowanie stwierdzo-
no również w Europie u bydła w latach
50. oraz w Europie i Ameryce Północ-
nej u psów w latach 80. ubiegłego wie-
ku. Do niedawna uważano, że choroba
ta powodowana jest u psów przez gatu-
nek Ehrlichia phagocytophila, u koni przez
Ehrlichia equi, natomiast u ludzi przez
HGE agent (Human Granulocytic Ehrli-
chiosis agent), jednak w 2001 roku prze-
prowadzono przeklasyfikowanie rzędu
Rickettsiales i wyżej wymienione riketsje
na podstawie analizy sekwencji genu dla
16S rRNA zaliczono do jednego gatun-
ku nazwanego A. phagocytophilum (1, 3).
W Europie wektorem A. phagocytophi-
lum jest kleszcz pospolity Ixodes ricinus.
Rezerwuar zarazka stanowią domowe
i dzikie przeżuwacze oraz dzikie gryzo-
nie (1). Dotychczas w Europie anapla-
zmozę granulocytarną u psów stwierdza-
no w: Polsce, Szwecji, Norwegii, Wielkiej
Brytanii, Grecji, Austrii, Szwajcarii, Sło-
wenii, Niemczech, Bułgarii, Hiszpanii
i we Włoszech (4, 5, 6, 7, 8, 9). W Pol-
sce występowanie A. phagocytophilum od-
notowano u kleszcza I. ricinus oraz u lu-
dzi, psów, saren, jeleni, żubrów i dzików
(7, 10-15). Występowanie anaplazmozy
granulocytarnej badano w różnych czę-
ściach Polski, jednak dotychczas tego
typu badania u psów przeprowadzono
jedynie w Polsce północnej i central-
nej, gdzie odsetek zarażonych osobni-
ków wynosił odpowiednio 1% oraz 0,5%
(7, 16). Występowanie DNA Anapla-
dr n. wet. Wojciech Zygner
Zakład Parazytologii i Inwazjologii Katedry Nauk Przedklinicznych
Wydziału Medycyny Weterynaryjnej SGGW w Warszawie
Abstract
Canine granulocytic anaplasmosis is
a tick-borne disease caused by ricket-
tsia Anaplasma phagocytophilum. Fe-
ver, reluctance to move and anorexia
are clinical signs of the disease. The
disease plays a significant role in vete-
rinary practice because it is zoonosis.
In Poland the pathogen was detected
in humans, dogs, roe-deer, deer, bison,
wild boar and Ixodes ricinus ticks.
Key words
Anaplasma phagocytophilum, ticks,
dogs, diagnosis, treatment
Streszczenie
Anaplazmoza granulocytarna psów jest
chorobą przenoszoną przez kleszcze,
powodowaną przez riketsje Anaplasma
phagocytophilum. Choroba objawia się
gorączką, niechęcią do ruchu i brakiem
apetytu. Jej istotne znaczenie w praktyce
weterynaryjnej wynika z faktu, że jest to
zoonoza. W Polsce patogen wykrywany
był u ludzi, psów, saren, jeleni, żubrów,
dzików i kleszczy Ixodes ricinus.
Słowa kluczowe
Anaplasma phagocytophilum, kleszcze,
psy, rozpoznawanie, leczenie
Anaplazmoza
granulocytarna
psów
CHOROBY ZAKAŹNE
WETERYNARIA W PRAKTYCE
30
www.weterynaria.elamed.pl
LIPIEC-SIERPIEŃ • 4/2008
fagolizosomu, jednak sam mechanizm
nie jest do końca wyjaśniony (6, 24). In-
nym mechanizmem ograniczającym za-
bicie bakterii jest obniżenie w neutrofi-
lach ekspresji białka RAC-2, biorącego
udział w aktywacji oksydazy NADPH
katalizującej powstawanie anionu po-
nadtlenkowego, o właściwościach tok-
sycznych dla sfagocytowanych drobno-
ustrojów. To prowadzi do upośledzenia
fagocytozy i stwarza możliwość rozwoju
wtórnych infekcji (26). Rozprzestrzenie-
nie się patogenu w organizmie jest uła-
twione przez przedłużenie życia zakażo-
nych granulocytów obojętnochłonnych,
na drodze zahamowania ich apopto-
zy (27). Zarazek rozprzestrzenia się wraz
z krwią i limfą po całym organizmie, co
prowadzi do zakażenia komórek prekur-
sorowych dla neutrofilów w szpiku kost-
nym (1, 25). A. phagocytophilum namna-
ża się w krążących neutrofilach, tworząc
morule, a zakażone komórki docierają
do różnych narządów, jak np. wątroba,
śledziona, płuca czy nerki (1). Upośle-
dzenie funkcji neutrofilów paradoksal-
nie nasila reakcję zapalną w narządach
spowodowaną przedłużoną degranulacją
granulocytów obojętnochłonnych pro-
wadzącą do uszkodzenia tkanek. Rów-
nocześnie zainfekowane granulocyty po-
przez ekspresję chemokin prozapalnych
prowadzą do włączenia się do reakcji za-
palnej innych komórek układu odporno-
ściowego. Powstające zatem uszkodzenia
tkanek powodowane są nie przez sam
patogen, lecz przez własną odpowiedź
immunologiczną (28, 29). Równocze-
śnie w przebiegu anaplazmozy granu-
locytarnej dochodzi do obniżenia od-
porności wynikającej między innymi ze
zmniejszenia liczby limfocytów CD4+, co
obserwowano u zakażonych owiec (30).
Rozwijający się proces zapalny prowadzi
do aktywacji makrofagów. W przebie-
gu anaplazmozy granulocytarnej psów
dochodzi również do rozwoju zapalenia
naczyń, zapalenia płuc, jelit, mięśni, sta-
wów oraz wystąpienia ognisk zapalnych
w ośrodkowym układzie nerwowym.
Stwierdzano również u psów występo-
wanie niedokrwistości i małopłytkowo-
ści o podłożu immunologicznym oraz
zespołu rozsianego wykrzepiania we-
wnątrznaczyniowego (1, 31). W przebie-
gu anaplazmozy granulocytarnej u ludzi
sporadycznie obserwowano również za-
palenie mięśnia sercowego (32).
O
BJAWY
KLINICZNE
I
LABORATORYJNE
Okres inkubacji choroby wynosi od kil-
ku dni do dwóch tygodni. Objawy kli-
niczne u psów są niespecyficzne, a cho-
roba na ogół ma przebieg przewlekły
o umiarkowanym nasileniu. Najczęst-
szymi objawami są: wysoka gorączka,
apatia i brak apetytu. Częstymi obja-
wami są również wymioty oraz biegun-
ka (1, 6). W badaniu klinicznym ob-
serwuje się bladość błon śluzowych
połączoną z wybroczynami oraz powięk-
szenie węzłów chłonnych. Stwierdza się
również niekiedy przyspieszenie tętna
i oddechów oraz obrzęki obwodowych
odcinków kończyn (5, 31). Obserwo-
wano również kulawizny i ataki padacz-
kowe. W przypadku zaawansowanej
choroby mogą wystąpić krwawienia,
wstrząs oraz niewydolność wielonarzą-
dowa. U chorych psów może pojawić się
powiększenie śledziony i wątroby (1).
Ponadto u ludzi chorych na anaplazmo-
zę granulocytarną opisywano kaszel,
bóle stawów i mięśni (33). Późno rozpo-
znana choroba o ciężkim przebiegu spo-
radycznie kończy się śmiercią zarówno
u psów, jak i u ludzi (31, 34).
W badaniach laboratoryjnych stwier-
dzane są małopłytkowość o różnym
stopniu nasilenia oraz leukopenia, spo-
wodowane głównie limfopenią i neutro-
penią (1). Odnotowywano również nie-
dokrwistość, zarówno normocytarną,
normobarwliwą, jak i makrocytarną, poli -
chromatyczną oraz obecność sferocytów
i krwinek różnej wielkości, a także mo-
nocytozę i eozynofilię (4, 31, 35). Stwier-
dzano, że obniżenie liczby trombocytów
i krwinek czerwonych może mieć podło-
że immunologiczne (31, 36). W rozmazie
krwi można obserwować obecność mo-
ruli wewnątrz neutrofilów, jednak wy-
stępują one przejściowo i ich brak nie
wyklucza obecności patogenu (31, 35).
W badaniach biochemicznych surowicy
krwi obserwowano nieznaczny wzrost
aktywności fosfatazy zasadowej, trans-
aminazy alaninowej i kinazy kreatyno-
wej oraz wzrost stężenia bilirubiny, białka
całkowitego i obniżenie stężenia albu-
min (1, 31). U ludzi chorych na anapla-
zmozę granulocytarną stwierdzano rów-
nież wzrost aktywności transaminazy
asparaginianowej oraz dehydrogenazy
mleczanowej (33).
R
OZPOZNAWANIE
W rozpoznaniu choroby najczęściej wy-
korzystywane są badanie metodą PCR,
test immunofluorescencji pośredniej
oraz ELISA. Materiałami do badań me-
todą PCR mogą być krew, maź stawowa
oraz płyn mózgowo-rdzeniowy. Z me-
tod wykorzystywanych w diagnostyce
anaplazmozy granulocytarnej metoda
PCR jest najczulsza i najbardziej spe-
cyficzna. W przypadku badania suro-
wicy na obecność przeciwciał skiero-
wanych przeciwko A. phagocytophilum
postawienie rozpoznania możliwe jest
w przypadku minimum czterokrotnego
wzrostu miana przeciwciał w ciągu 4 ty-
godni od początku wystąpienia choro-
by. Zdarzają się jednak przypadki reakcji
krzyżowych, w których wynik pozytyw-
ny jest skutkiem wykrycia przeciwciał
przeciwko innym riketsjom z rodzaju
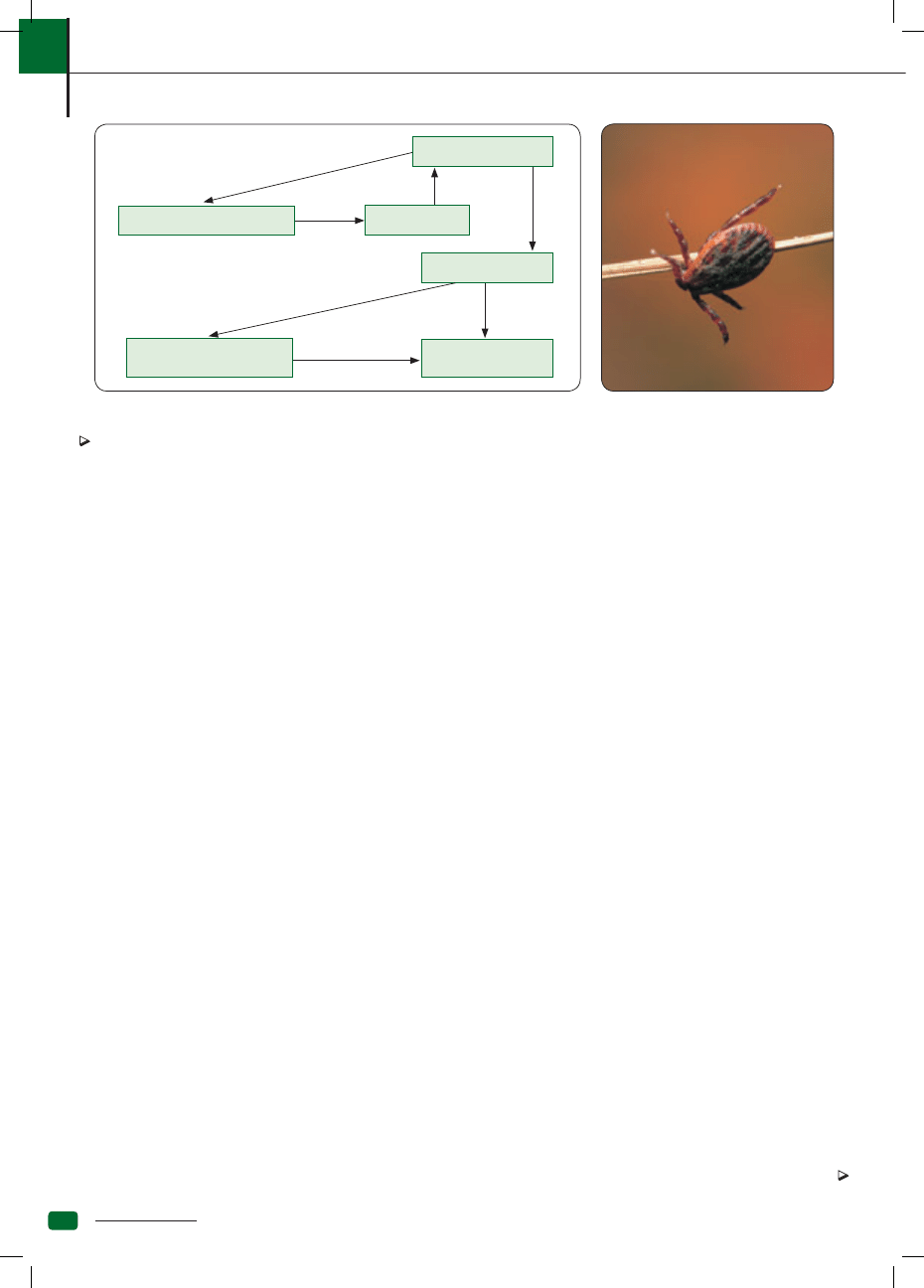
Ryc. 1. Patogeneza anaplazmozy granulocytarnej
Anaplazmoza granulocytarna psów jest chorobą
przenoszoną przez kleszcze
A. phagocytophilum
Komórki śródbłonka naczyń
Zakażone neutrofile
Zahamowanie apoptozy
Przedłużona degranulacja
Wątroba, śledziona,
płuca, nerki
Uszkodzenie
narządów
Neutrofile
Fagocytoza
IL-8

CHOROBY ZAKAŹNE
WETERYNARIA W PRAKTYCE
32
www.weterynaria.elamed.pl
LIPIEC-SIERPIEŃ • 4/2008
Ehrlichia bądź Anaplasma (1). Inną wadą
testów serologicznych są fałszywie nega-
tywne wyniki we wczesnej fazie choro-
by (5). Według opracowanych kryteriów
rozpoznania anaplazmozy granulocytar-
nej (Center for Disease Control and Pre-
vention, Atlanta, USA) diagnozę można
postawić w przypadku dodatniego wy-
niku badania metodą PCR, czterokrot-
nego wzrostu miana przeciwciał bądź
też w przypadku stwierdzenia obecno-
ści moruli wewnątrz neutrofilów, jed-
nak w ostatnim przypadku wymagane
jest potwierdzenie wyniku testem sero-
logicznym. Badanie mikroskopowe ma
również bardzo niską czułość i najczę-
ściej obecność riketsji wewnątrz granu-
locytów stwierdzana jest przypadkowo.
W rozpoznaniu anaplazmozy granulocy-
tarnej testem wykonywanym z wyboru
jest badanie metodą PCR (1, 31).
Z
WALCZANIE
W leczeniu przyczynowym anaplazmozy
granulocytarnej psów lekiem stosowa-
nym z wyboru jest doksycyklina w dawce
10 mg/kg/dobę doustnie w 1 bądź 2 daw-
kach przez 10-21 dni. Ze względu na
drażniące działanie doksycykliny na ślu-
zówkę przewodu pokarmowego lek po-
daje się wraz z pokarmem. Niewiele jest
leków mających zastosowanie w leczeniu
przyczynowym tej choroby, większość
z nich nie działa na bakterie wewnątrz-
komórkowe. Udokumentowano również
działanie bójcze wobec A. phagocytophilum
chloramfenikolu i ryfampicyny. Chlo-
ramfenikol ze względu na liczne działa-
nia niepożądane i toksyczne bardzo rzad-
ko jest stosowany ogólnie. W przypadku
zwierząt młodych doksycyklina również
jest uważana za lek z wyboru, pomimo jej
działania uszkadzającego szkliwo zębów
i hamującego wzrost kości (1). W przy-
padku stwierdzenia niedokrwistości bądź
małopłytkowości o podłożu immunolo-
gicznym stosowane są również glikokor-
tykosteroidy, jednak ich użycie jest dys-
kusyjne ze względu na immunosupresję
w przebiegu anaplazmozy granulocytar-
nej (30, 31).
Zapobieganie chorobie polega na sto-
sowaniu preparatów zawierających aka-
rycydy. W ochronie psów przed inwazją
kleszczy zastosowanie znajdują prepara-
ty: w postaci oprysków, stosowane miej-
scowo preparaty typu spot-on oraz obroże
impregnowane akarycydami. Substan-
cjami czynnymi stosowanymi w prepa-
ratach przeciwko kleszczom u psów są:
fipronil należący do grupy fenylopirazoli,
amitraza będąca pochodną formamidyny,
propoksur należący do karbaminianów
oraz permetryna i flumetryna należące
do pyretroidów (37).
Dotychczas nie opracowano skutecz-
nej szczepionki przeciwko anaplazmozie
granulocytarnej (1).
P
ODSUMOWANIE
Anaplazmoza granulocytarna jest rzad-
ko rozpoznawaną chorobą u psów w Pol-
sce. Dane literaturowe pozwalają przy-
puszczać, że choroba może występować
u psów na terenie całego kraju. Najpraw-
dopodobniej rezerwuarem anaplazmozy
granulocytarnej w Polsce są dzikie prze-
żuwacze, na co może wskazywać wyso-
ki odsetek zakażeń (48-75%) obserwo-
wany u saren, jeleni i żubrów (13, 14).
Dotychczas stwierdzono w Polsce niski
odsetek zakażeń u psów i prawdopodob-
nie nie stanowią one rezerwuaru choro-
by (7, 16). W praktyce weterynaryjnej
anapalzmoza granulocytarna jest jednak
istotną jednostką chorobową ze wzglę-
du na fakt, że jest to zoonoza. U ludzi
przeciwciała przeciwko A. phagocytophi-
lum stwierdzano u 5,4-20,6%, przy czym
wyższy odsetek wyników pozytywnych
dotyczył pracowników leśnych nara-
żonych na inwazje kleszczy żerujących
na dzikich przeżuwaczach (11, 19, 20).
Wydaje się, że również u psów wyż-
szy odsetek zakażeń może dotyczyć
psów wyjeżdżających do lasów wraz
z ich właścicielami. Rzadziej stwierdza-
ne zakażenia A. phagocytophilum u ludzi
w miastach mogą być związane ze spo-
radycznymi wizytami na terenach zale-
sionych, jak również z zawleczeniami
zakażonych młodocianych stadiów roz-
wojowych kleszczy do miast wraz z ludź-
mi i towarzyszącymi im zwierzętami, ta-
kimi jak psy. Nie można wykluczyć, że
w miastach rezerwuarem anaplazmozy
granulocytarnej mogą być ludzie, psy
oraz dzikie gryzonie, których w Polsce
nie badano pod kątem występowania
A. phagocytophilum, jednak stwierdzono,
iż wysoki odsetek zakażonych dzikich
gryzoni, u których żerują larwy I. ricinus,
występuje w Szwajcarii (38).
Niespecyficzne objawy choroby utrud-
niają jej rozpoznanie, które jest istotne
ze względu na jej zoonotyczny potencjał.
Według autora choroba powinna być po-
dejrzewana u psów z wysoką gorączką
wyjeżdżających do lasów w sezonie wy-
stępowania kleszczy.
Piśmiennictwo
1. Harrus S., Waner T., Bjoersdorff A.,
Shaw S.: Ehrlichiosis and anaplasmosis. [W:]
Shaw S.E., Day M.J. (eds): Arthropod-borne
Infectious Diseases of the Dog and Cat. Man-
son Publishing, Barcelona 2005.
2. Taylor M.A., Coop R.L., Wall R.L.: Veteri-
nary Parasitology. 3
rd
ed. Blackwell Publi-
shing, Ames, Iowa 2007.
3. Rymaszewska A.: Pozycja systematyczna
Anaplasma phagocytophilum. [W:] Skotar-
czak B.: Biologia molekularna patogenów
przenoszonych przez kleszcze. Wydawnictwo
Lekarskie PZWL, Warszawa 2006.
4. Jensen J., Simon D., Escobar H.M., Sol-
ler J. T., Bullerdiek J., Beelitz P., Pfister K.,
Nolte I.: Anaplasma phagocytophilum in Dogs
in Germany. “Zoonozes and Public Health”,
2007, 54: 94-101.
5. Kirtz G., Meli M., Leidinger E., Ludwig P.,
Thum D., Czettel B., Kolbl S., Lutz H.:
Anaplasma phagocytophilum infection in
a dog: identifying the causative agent using
PCR. “Journal of Small Animal Practice”,
2005, 46: 300-303.
6. Lillini E., Macri G., Proietti G., Scarpul-
la M.: New Findings on Anaplasmosis Caused
by Infection with Anaplasma phagocytophilum.
“Annals of the New York Academy of Sci-
ences”, 2006, 1081: 360-370.
7. Skotarczak B., Adamska M., Suproń M.:
Blood DNA analysis for Ehrlichia (Anapla-
sma) phagocytophila and Babesia spp. of dogs
from Northern Poland. “Acta Veterinaria
Brno”, 2004, 73: 347-351.
8. Solano-Gallego L., Llull J., Osso M., He-
garty B., Breitschwerdt E.: A serological stu-
dy of exposure to arthropod-borne pathogens
in dogs from norheastern Spain. “Veterinary
Research”, 2006, 37: 231-244.
9. Tsachev I., Petrov V., Flaming K., Brown C.:
First Detected Case of Anaplasma phagocyto-
philum in a dog in Bulgaria. “Revue de Me-
dicine Veterinarie” (in press).
10. Grzeszczuk A., Stańczak J.: High prevalen-
ce of Anaplasma phagocytophilum infection
in ticks removed from human skin in North-
-Eastern Poland. “Annals of Agricultu-
ral and Environmental Medicine”, 2006,
13; 45-48.
11. Grzeszczuk A., Stańczak J., Kubica-Bier-
nat B., Racewicz M., Kruminis-Łozow-
ska W., Prokopowicz D.: Human anaplasmo-
sis in North-Eastern Poland: seroprevalence in
humans and prevalence in Ixodes ricinus ticks.
“Annals of Agricultural and Environmen-
tal Medicine”, 2004, 11: 99-103.
12. Grzeszczuk A., Ziarko S., Kovalchuk O.,
Stańczak J.: Etiology of tick-borne febrile il-
lnesses in adult residents of north-eastern Po-
land: Report from a prospective clinical study.
“International Journal of Medical Micro-
biology”, 2006, 296(S1): 242-249.
13. Grzeszczuk A., Ziarko S., Prokopowicz D.,
Radziwon P.M.: Zakażenie żubrów z Pusz-
czy Białowieskiej bakteriami Anaplasma pha-
gocytophilum. „Medycyna Weterynaryjna”,
2004, 60: 600-601.
14. Rymaszewska A., Adamska M.: Wystę-
powanie DNA Anaplasma phagocytophilum
w materiale zwierzęcym z Pomorza Zachod-
niego. [W:] Skotarczak B.: Biologia moleku-
larna patogenów przenoszonych przez kleszcze.
Wydawnictwo Lekarskie PZWL, Warsza-
wa 2006.
35
CHOROBY ZAKAŹNE
WETERYNARIA W PRAKTYCE
35
www.weterynaria.elamed.pl
LIPIEC-SIERPIEŃ • 4/2008
15. Tylewska-Wierzbanowska S., Chmielew-
ski T., Kondrasiuk M., Hermanowska-
-Szpakowicz T., Sawicki W., Sułek K.: First
cases of acute human granulocytic ehrlichiosis in
Poland. „European Journal of Clinical Mi-
crobiology and Infectious Diseases”, 2001,
20: 196-198.
16. Zygner W.: Występowanie DNA Babesia
canis canis, Borrelia burgdorferi s.l., Ana-
plasma phagocytophilum oraz Hepatozo-
on canis we krwi psów i tkankach kleszczy
pasożytujących u psów w Warszawie. Praca
doktorska, Wydział Medycyny Weteryna-
ryjnej SGGW, Warszawa. 2007.
17. Stańczak J., Gabre R.M., Kruminis-Ło-
zowska W., Racewicz M., Kubica-Bier-
nat B.: Ixodes ricinus as a vector of Borrelia
burgdorferi sensu lato, Anaplasma phagocy-
tophilum and Babesia microti in urban and
suburban forests. “Annals of Agricultur-
al and Environmental Medicine”, 2004,
11: 109-114.
18. Grzeszczuk A.: Anaplasma phagocytophi-
lum in Ixodes ricinus ticks and human granu-
locytic anaplasmosis seroprevalence among fo-
restry rangers in Białystok region. “Advances
in Medical Sciences”, 2006, 51: 283-286.
19. Tomasiewicz K., Modrzewska R., Bu-
czek A., Stańczak J., Maciukajć J.: The risk
of exposure to Anaplasma phagocytophilum
infection in mid-eastern Poland. “Annals of
Agricultural and Environmental Medici-
ne”, 2004, 11: 261-264.
20. Cisak E., Chmielewska-Badora J., Zwo-
liński J., Wójcik-Fatla A., Polak J., Dutkie-
wicz J.: Risk of tick-borne bacterial diseas-
es among workers of Roztocze National Park
(South-Eastern Poland). “Annals of Agricul-
tural and Environmental Medicine”, 2005,
12: 127-132.
21. Skotarczak B., Rymaszewska A., Wodec-
ka B., Sawczuk M., Adamska M., Macie-
jewska A.: PCR detection of granulocytic Ana-
plasma and Babesia in Ixodes ricinus ticks and
birds in west-central Poland. “Annals of Ag-
ricultural and Environmental Medicine”,
2006, 13: 21-23.
22. Zygner W., Jaros S., Wędrychowicz H.: Pre-
valence of Babesia canis, Borrelia afzelii, and
Anaplasma phagocytophilum infection in hard
ticks removed from dogs in Warsaw (central
Poland). “Veterinary Parasitology”, 2008,
153: 139-142.
23. Siuda K.: Kleszcze polski (Acari: Ixodida), cz. II,
Systematyka i rozmieszczenie. Polskie Towa-
rzystwo Parazytologiczne, Warszawa 1993.
24. Allen L.A.: Mechanism of pathogenesis: eva-
sion of killing by polymorphonuclear leukocytes.
“Microbes and Infection”, 2003, 5: 1329-
1335.
25. Munderloh U.G., Lynch M.J., Herron M.J.,
Palmer A.T., Kurtti T.J., Nelson R.D., Good-
man J.L.: Infection of endothelial cells with Ana-
plasma marginale and A. phagocytophilum. “Ve-
terinary Microbiology”, 2004, 101: 53-64.
26. Garyu J.W.A., Choi K-S., Grab D.J., Dum-
ler J.S.: Defective Phagocytosis in Anaplasma
phagocytophilum-Infected Neutrophils. “Infec-
tion and Immunity”, 2005, 73: 1187-1190.
27. Choi K-S., Park J.T., Dumler J.S.: Ana-
plasma phagocytophilum Delay of Neutrophil
Apoptosis through the p38 Mitogen-Activated
Protein Kinase Signal Pathway. “Infection
and Immunity” 2005, 73: 8209-8218.
28. Choi K.S., Grab D.J., Dumler J.S.: Anapla-
sma phagocytophilum Infection Induces Pro-
tracted Neutrophil Degranulation. “Infection
and Immunity”, 2004, 72: 3680-3683.
29. Scorpio D.G., von Loewenich F.D., Go-
bel H., Bogdan C., Dumler J.S.: Innate
Immune Response to Anaplasma phagocyto-
philum Contributes to Hepatic Injury. “Cli-
nical and Vaccine Immunology”, 2006,
13: 806-809.
30. Woldehiwet Z.: Anaplasma phagocytophilum
in Ruminants in Europe. “Annals of the New
York Academy of Sciences”, 2006, 1078:
446-460.
31. Bexfield N.H., Villiers E.J., Herrtage M.E.:
Immune-mediated haemolytic anaemia and
thrombocytopenia associated with Anaplasma
phagocytophilum in a dog. “Journal of Small
Animal Practice”, 2005, 46: 543-548.
32. Malik A., Jameel M.N., Ali S.S., Mir S.: Hu-
man Granulocytic Anaplasmosis Affecting the
Myocardium. “Journal of General Internal
Medicine”, 2005, 20: C8-C10.
33. Lotric-Furlan S., Rojko T., Petrovec M.,
Avsic-Zupanc T., Strle F.: Epidemiological,
clinical and laboratory characteristics of pa-
tients with human granulocytic anaplasmosis
in Slovenia. “Wiener Klinische Wochen-
schrift“, 2006, 118: 708-713.
34. Blanco J.R., Oteo J.A: 2002. Human granu-
locytic ehrlichiosis in Europe. Clinical Micro-
biology and Infection, 8: 763-772.
35. Skotarczak B.: Canine ehrlichiosis. „Annals
of Agricultural and Environmental Medi-
cine”, 2003, 10: 137-141.
36. Lewis D.C.: Disorders of Platelet Num-
ber. [W:] Day M., Mackin A., Littlewo-
od J. (eds.).: Manual of Canine and Feline
Haematology and Transfusion Medicine. BSA-
VA, Gloucester 2000.
37. Wall R., Pitts K.: Arthropod vectors of in-
fectious disease: biology and control. [W:]
Shaw S.E., Day M.J. (eds). Arthropod-borne
Infectious Diseases of the Dog and Cat. Man-
son Publishing, Barcelona 2005, 11-22.
38. Liz J.S., Anderes L., Sumner J.W., Mas-
sung R.F., Gern L., Rutti B., Brossard M.:
PCR Detection of Granulocytic Ehrlichiae in
Ixodes ricinus Ticks and Wild Mammals in
Western Switzerland. “Journal of Clinical
Microbiology”, 20003, 8: 1002-1007.
dr n. wet. Wojciech Zygner
Zakład Parazytologii i Inwazjologii
Katedra Nauk Przedklinicznych
Wydział Medycyny Weterynaryjnej
SGGW w Warszawie
02-786 Warszawa, ul. Ciszewskiego 8
e-mail: wojciechzygner@o2.pl
32
Document Outline
Wyszukiwarka
Podobne podstrony:
anaplazmoza granulocytarna Ca i Eq
CYNK-GRANULAT, BHP KARTA CHARAKTERYSTYKI SUBSTANCJI NIEBEZPIECZNEJ
1 Sklad granulometryczny listopad 2008
4 Określanie składu granulometrycznego gruntu analiza sitowa
Grupa granulometryczna - ćwiczenia, gleboznawstwo
Is sludge retention time a decisive factor for aerobic granulation in SBR
Analiza sitowa polega na określeniu składu granulometrycznego gruntu
Analiza granulometryczna, budownictwo pk, sem2, geologia
granulaty
10 Kret w granulkach
sprawozdanie Mechanika Gruntow skład granulometryczny oznaczenie
Analiza granulometryczna
Podzia materiau glebowego na frakcje i grupy granulo metryczne, Podział materiału glebowego na frakc
analiza granulometryczna
Granulocytopoeza, studia-biologia, Licencjat, sem 5-6, Hematologia z prof Witewską
Analiza granulometryczna 2
więcej podobnych podstron