Ćwiczenie 1 Kontrola skuteczności chemicznych środków dezynfekujących
Materiały:
Płytka Petriego z agarem
Pipeta Pasteura
Głaszczka
Zawiesina Escherichia coli
Krążki bibuły
Środki dezynfekujące (70% etanol, 3% woda utleniona, 2% r-r nadmanganianu potasu,
2% jodyna, Rivanol, 5% r-r fenolu, Domestos)
Wykonanie:
1. Szalkę podzielić na 4 sektory i ponumerować je od 1 do 4
2. Pobrać pipetą ok. 0,5 ml zawiesiny E. coli (przepłukując uprzednio pipetę kilka razy
zawiesiną bakterii)
3. Za pomocą głaszczki rozprowadzić zawiesinę po całej płytce, następnie przechylić
płytkę i tą samą pipetą
zebrać nadmiar zawiesiny.
4. Krążki bibuły namoczyć w roztworach środków dezynfekujących.
Nasączone krążki bibuły umieszczać w oznaczonych sektorach wg tabeli
Nr sektora
Roztwór
Wynik
1
70% etanol
2
3% woda utleniona
3
2% r-r nadmanganianu potasu
4
2% jodyna
5
5% r-r fenolu
6
Rivanol
7
Domestos
8
Woda destylowana
5. Szalkę umieścić na 24 godziny w temp. 37˚C

Ćwiczenie 2: Badanie skuteczności sterylizacji z zastosowaniem promieniowaniem UV
Materiały:
2 płytki Petriego z agarem bakteriologicznym
Zawiesina E. coli
Pipeta Pasteura
Głaszczka
Lampa UV
Wykonanie:
1. Pobrać pipetą ok. 0,5 ml zawiesiny E. coli (przepłukując uprzednio pipetę kilka razy
zawiesiną bakterii)
2. Za pomocą głaszczki rozprowadzić zawiesinę po całej płytce, następnie przechylić
płytkę i tą samą pipetą
zebrać nadmiar zawiesiny.
3. Naświetlać promieniami UV w następujący sposób:
Czas naświetlania UV
Wynik
0 sekund
10 sekund
30 sekund
1 minuta
2 minuty
5 minut
10 minut
15 minut
4. Szalki umieścić na 24 godziny w temp. 37˚C.
Ćwiczenie 3: Występowanie drobnoustrojów
Naturalna mikroflora człowieka
Materiały:
Płytka Petriego z agarem
Wykonanie:
Płytkę podzielić na dwie części (A i B)
A. Test czystych rąk:
1. Część A podzielić na 4 części
2. W warunkach jałowych dokonać odcisku opuszku kciuka:
a. Nie umytego
b. Umytego mydłem i wytartego ręcznikiem jednorazowym
c. Umytego zgodnie z metodą Ayliffa
d. Umytego etanolem
B. Posiew z wymazu:
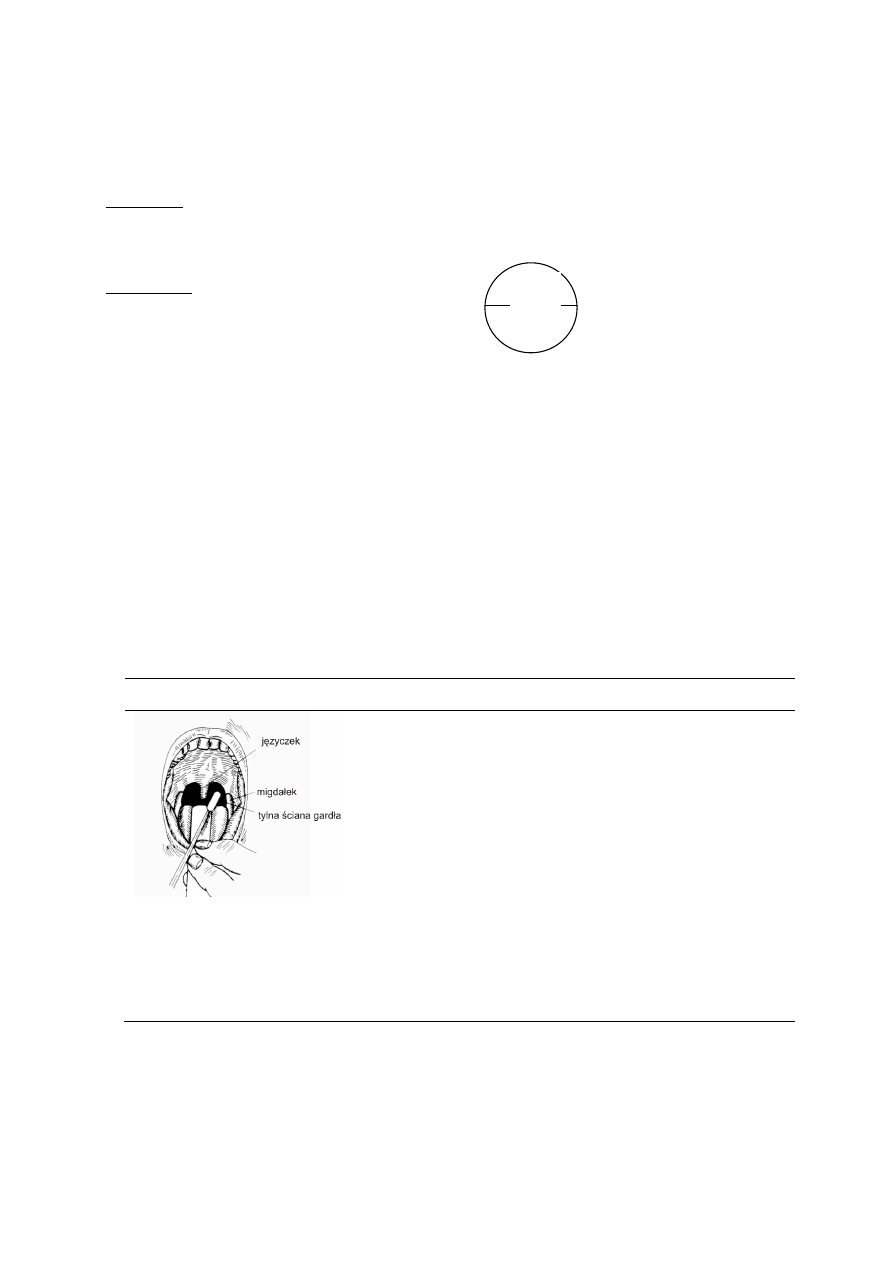
1. Pobrać wymaz z gardła lub nosa wg zaleceń Krajowego Ośrodka ds. Grypy
Schemat wykonania wymazu
Procedura
Za pomocą szpatułki docisnąć język ku
dołowi (pozwoli to uniknąć kontaminacji
wymazu śliną)
za pomocą suchego sterylnego patyczka
wymazowego energicznie potrzeć obie
powierzchnie migdałków oraz tylna ścianę
gardła (bez dotykania powierzchni jamy
ustnej)
zwracając szczególną uwagę na miejsca
zapalnie zmienione.
A
B

delikatnie odchylić głowę do tyłu i
przytrzymać za podbródek.
Drugą ręką umieścić koniec suchego
sterylnego patyczka wymazowego w
prawym nozdrzu.
Wymaz powinien być pobrany energicznie,
aby mieć pewność, iż zawiera on zarówno
komórki, jak i śluz z wnętrza nozdrza.
2. Wykonać posiew redukcyjny wg schematu:
3. Szalkę opisać i umieścić na 24 godziny w temp. 37˚C.
Mikroflora powierzchni
1. sterylny tampon z waty ująć w opalona pęsetę, zanurzyć w kolbce z 20 ml soli
fizjologicznej, nadmiar płynu odcisnąć i zrobić dokładny wymaz z dowolnej
powierzchni (np.stołu, podłogi, parapetu)
2. tampon umieścić w kolbce z płynem, wytrząsać ok. 5 minut i po tym czasie pobrać
jałowo 1 ml płynu i posiać na szalkę z agarem odżywczym
3. Hodować 4 dni w temp. 30˚C
4. .po tym czasie zliczyć kolonie, a następnie korzystając ze wzoru policzyć ile
mikroorganizmów (X) występuje na badanej powierzchni:
X= liczba kolonii
× 20
Mikroflora powietrza
1. szalkę z agarem odżwczym otworzyć na 10 minut, po tym czasie płytki zamknąć i
wstawić do cieplarki na 4 dni w temp. 30˚C,
2. po 4 dniach zliczyć kolonie a następnie korzystając ze wzoru Omeliańskiego (w
modyfikacji Gogoberidze) policzyć ile mikroorganizmów (X) występuje w powietrzu:
X =
×
× × , ×
a – średnia liczba kolonii mikroorganizmów;
r – promień szalki Petriego (cm);
t – czas ekspozycji (min);
0,2 – współczynnik przeliczeniowy czasu ekspozycji
Wyszukiwarka
Podobne podstrony:
Mikrobiologia i parazytologia zestaw 19, Pielęgniarstwo, II rok, Mikrobiologia i parazytologia
Mikrobiologia i parazytologia zestaw 9, Pielęgniarstwo, II rok, Mikrobiologia i parazytologia
Mikrobiologia i parazytologia zestaw 18, Pielęgniarstwo, II rok, Mikrobiologia i parazytologia
Mikrobiologia i parazytologia zestaw 8, Pielęgniarstwo, II rok, Mikrobiologia i parazytologia
Mikrobiologia i parazytologia zestaw 17, Pielęgniarstwo, II rok, Mikrobiologia i parazytologia
Mikrobiologia i parazytologia zestaw 16, Pielęgniarstwo, II rok, Mikrobiologia i parazytologia
Mikrobiologia i parazytologia zestaw 3, Pielęgniarstwo, II rok, Mikrobiologia i parazytologia
Mikrobiologia i parazytologia zestaw 10, Pielęgniarstwo, II rok, Mikrobiologia i parazytologia
Mikrobiologia i parazytologia zestaw 20, Pielęgniarstwo, II rok, Mikrobiologia i parazytologia
Mikrobiologia i parazytologia zestaw 14, Pielęgniarstwo, II rok, Mikrobiologia i parazytologia
Mikrobiologia i parazytologia zagadnienia do zaliczenia, Pielęgniarstwo, II rok, Mikrobiologia i par
Mikrobiologia i parazytologia zestaw 15, Pielęgniarstwo, II rok, Mikrobiologia i parazytologia
Mikrobiologia i parazytologia zagadnienia dozaliczenia, Pielęgniarstwo, II rok, Mikrobiologia i para
Mikrobiologia i parazytologia zestaw 7, Pielęgniarstwo, II rok, Mikrobiologia i parazytologia
Mikrobiologia i parazytologia zestaw 4, Pielęgniarstwo, II rok, Mikrobiologia i parazytologia
Mikrobiologia i parazytologia zestaw 11, Pielęgniarstwo, II rok, Mikrobiologia i parazytologia
Mikrobiologia i parazytologia zestawy pytań, Pielęgniarstwo, II rok, Mikrobiologia i parazytologia
Mikrobiologia i parazytologia zestaw 2, Pielęgniarstwo, II rok, Mikrobiologia i parazytologia
Mikrobiologia i parazytologia zestaw 6, Pielęgniarstwo, II rok, Mikrobiologia i parazytologia
więcej podobnych podstron