Przemiany gazu
doskonałego
Przemianą gazu doskonałego nazywamy proces
zachodzący dla stałej masy gazu. W wyniku procesu
zmianie ulegają pewne parametry stanu gazu, przy
czym jeden z parametrów pozostaje stały.
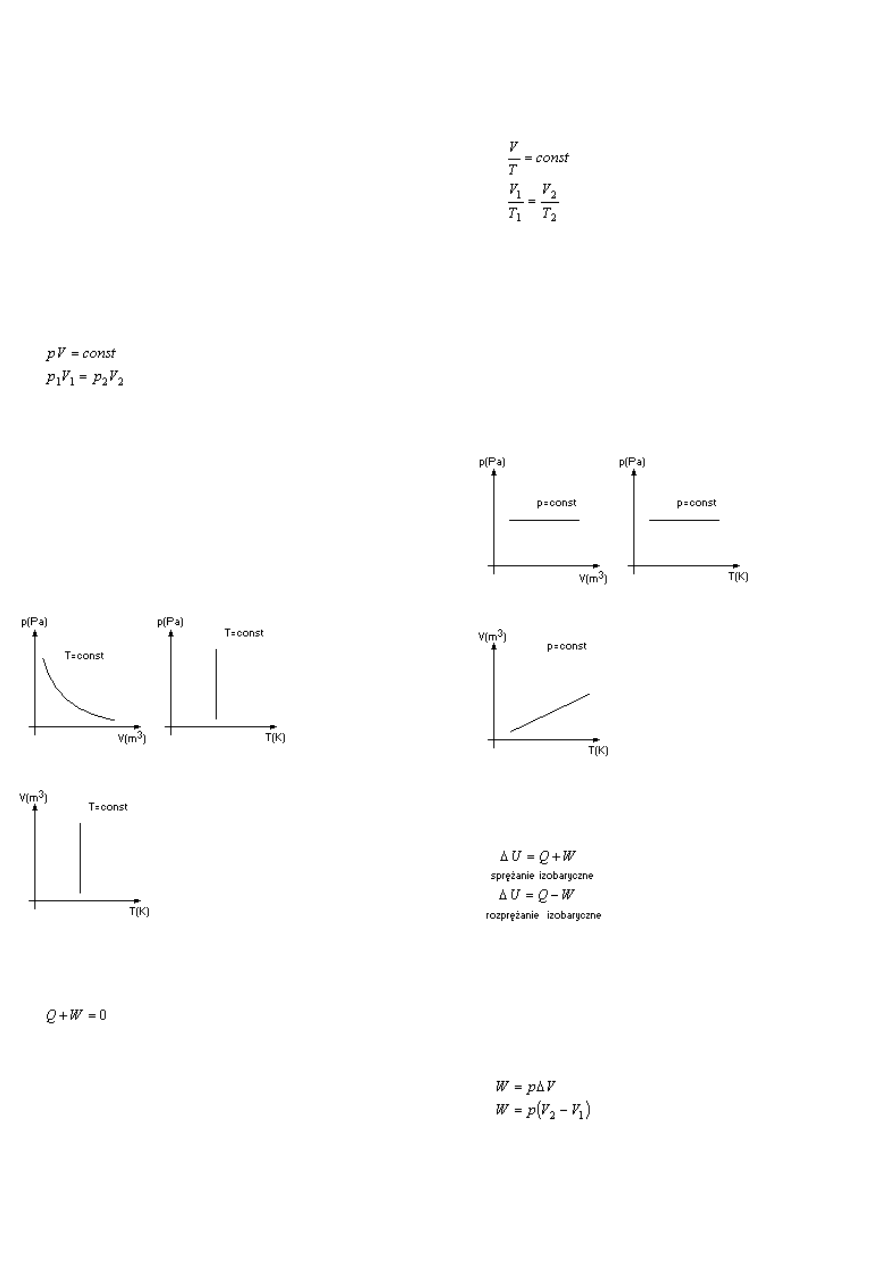
Przemiana izotermiczna
Podczas tej przemiany temperatura gazu nie zmienia
się(T=const).
Prawo Boyle'a-Mario
Dla danej stałej masy gazu iloczyn jego ciśnienia i
objętości jest wielkością stałą.
Izoterma to dowolna zależność właściwości układu
fizycznego otrzymana przy stałej temperaturze.
Przykładem izotermy jest krzywa przedstawiająca
zależność ciśnienia od objętości gazu dla ustalonej
temperatury, czyli przemiana izotermiczna
Wykresy przemiany izotermicznej w układach
współrzędnych przedstawiają izotermy
p-V, p-t
V-T
I zasada termodynamiki dla przemiany izotermicznej
przybiera postać:
Przykładem takiej przemiany jest bardzo powolne
sprężanie gazu w naczyniu o ściankach dobrze
przewodzących ciepło (temperatura gazu jest wówczas
równa temperaturze otoczenia).
Przemiana izobaryczna
Podczas tej przemiany ciśnienie gazu nie ulega zmianie
(p=const)
Prawo Guy-Lusaca:
Dla danej stałej masy gazu iloraz jego objętości i
temperatury bezwzględnej jest wielkością stałą.
Izobara to dowolna zależność właściwości układu
fizycznego otrzymana przy stałym ciśnieniu.
Przykładem izobary jest krzywa przedstawiająca
zależność ciśnienia od objętości gazu dla ustalonego
ciśnienia, czyli przemiana izobaryczna
Wykresy przemiany izobarycznej w układach
współrzędnych przedstawiają izobary
p-V p-T
V-T
I zasada termodynamiki dla przemiany izobarycznej
przybiera postać:
Przykładem takiej przemiany jest ogrzewanie gazu w
szczelnym naczyniu, które zamknięte jest ruchomym
tłokiem mogącym się swobodnie przesuwać.
Praca w przemianie izobarycznej
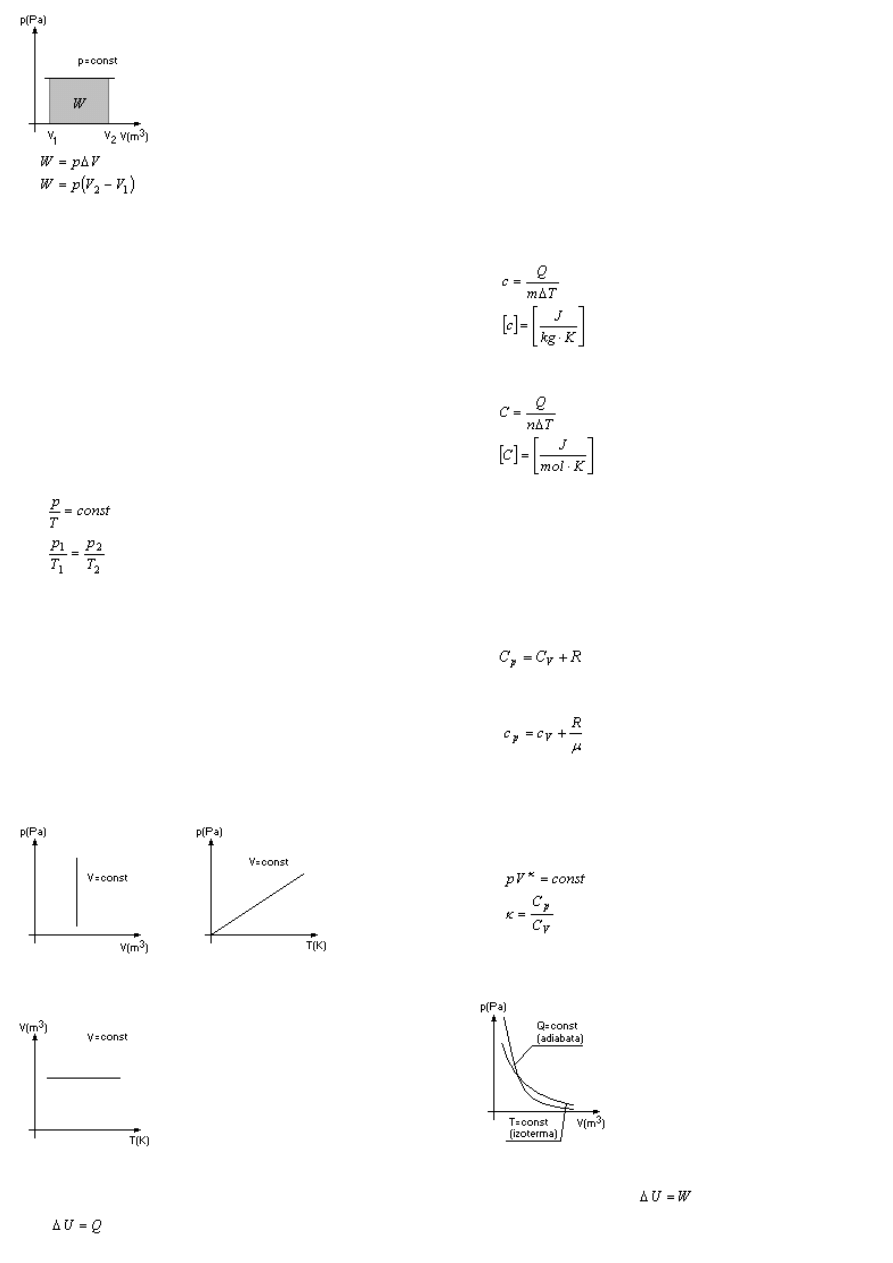
Pole powierzchni pod wykresem przemiany w układzie
p-V ma sens fizyczny pracy wykonanej przez gaz
Przemiana izochoryczna
Podczas tej przemiany objętość gazu nie ulega zmianie
(V=const)
Prawo Charlesa:
Dla danej stałej masy gazu iloraz jego ciśnienia i
temperatury bezwzględnej jest wielkością stałą.
Izochora to dowolna zależność właściwości układu
fizycznego otrzymana przy stałej objętości. Przykładem
izochory jest krzywa przedstawiająca zależność
ciśnienia od objętości gazu dla ustalonej objętości, czyli
przemiana izochoryczna
Wykresy przemiany izochorycznej w układach
współrzędnych przedstawiają izochory
p-V p-T
V-T
I zasada termodynamiki dla przemiany izochorycznej
przybiera postać:
W przemianie izochorycznej objętość nie ulega
zmianie, więc gaz nie wykona pracy. Dochodzi do
wymiany ciepła. Przykładem takiej przemiany jest
ogrzewanie gazu w szczelnie zamkniętym naczyniu,
zbudowanym z materiału o bardzo małej
rozszerzalności cieplnej.
Ciepło właściwe i molowe
Ciepło właściwe informuje, jaka ilość ciepła należy
dostarczyć substancji o masie 1kg, aby zwiększyć jej
temperaturę o 1K
Ciepło molowe informuje, jaka ilość ciepła należy
dostarczyć jednemu molowi gazu, aby go ogrzać o 1K
Ciepło molowe przy stałym ciśnieniu i objętości
Jeżeli gaz ogrzewany jest przy stałym ciśnieniu, to
mówimy o cieple molowym przy stałym ciśnieniu. Gdy
ogrzewany jest przy stałej objętości to mówimy o cieple
molowym przy stałej objętości. Dal tego samego gazu
zachodzi związek miedzy jednym a drugim ciepłem
Dla ciepła właściwego powyższy związek będzie mieć
postać
Przemiana adiabatyczna
Podczas tej przemiany gaz nie wymienia ciepła z
otoczeniem (Q=const)
Wykresem przemiany adiabatycznej w układzie p-V
jest adiabata, która przypomina izotermę, ale jest
bardziej stroma.
I zasada termodynamiki dla przemiany adiabatycznej
przybiera postać:

Entropia - jest to termodynamiczna
funkcja stanu, określająca kierunek
przebiegu procesów spontanicznych
(samorzutnych) w odosobnionym
układzie termodynamicznym.
o
parametry stanu:
2. temperatura
3. ciśnienie
4. objętość
Układ termodynamiczny - przestrzeń w której
zachodzi przykładowy proces.
zamknięty - to taki w którym nie dochodzi do
wymiany masy ani energii między układem a
otoczeniem. Np. gaz w szczelnym cylindrze.
otwarty - to taki w którym układ wymienia masę
lub energię z otoczeniem. Np. organizmy żywe.
Entropia - wzór:
ΔS = 1/T * ΔQ
S- entropia
Q- ciepło
T- temperatura
Entropia jest dodatnia gdy ciału dostarczane jest ciepło
z otoczenia.
Entropia może być ujemna - wówczas gdy ciało oddaje
ciepło do otoczenia.
Wyszukiwarka
Podobne podstrony:
więcej podobnych podstron