Strona 1
Odpowiedzi 5.2.
2011-05-02 12:46:03
http://www.chemia.sos.pl/index.php/nieorganiczna/39-stezenia/91-odp-52.html?tmpl=component&print=1&page=
Odpowiedzi 5.2.
Ocena u
ż
ytkowników:
/ 0
Słaby
Ś
wietny
Oce
ń
5.2. St
ęż
enie procentowe
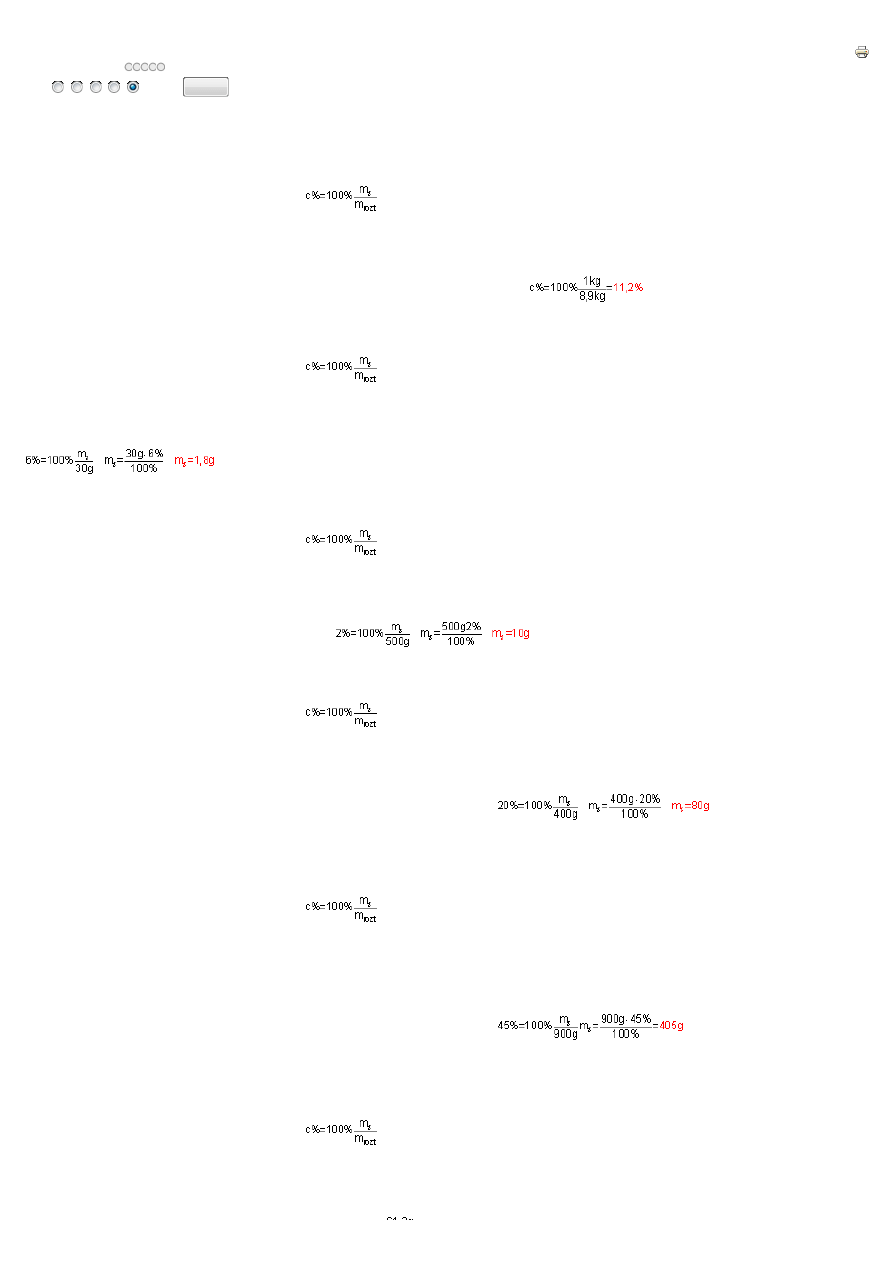
5.2-1.
St
ęż
enie procentowe okre
ś
la jaka ilo
ść
substancji przypada na 100g cało
ś
ci (pro cent – na 100). Czyli roztwór x% oznacza,
ż
e w 100g roztworu znajduje si
ę
x g substancji
rozpuszczonej. St
ęż
enie procentowe liczone jest ze wzoru:
gdzie:
m
s
– masa substancji rozpuszczonej
m
rozt
– masa roztworu, czyli masa rozpuszczalnika i masa substancji rozpuszczonej
10dm
3
acetonu (10000cm
3
) to (d=m/V) m=dV=0,79g/cm
3.
10000cm
3
=7900g. Masa rozpuszczalnika wynosi 7,9kg, masa substancji rozpuszczonej (masa lakieru) wynosi 1kg, wi
ę
c
masa roztworu m
rozt
=7,9kg+1kg=8,9kg. Podstawiaj
ą
c dane do wzoru na st
ęż
enie procentowe otrzymamy:
Otrzymany roztwór zawiera 11,2% lakieru.
5.2-2.
St
ęż
enie procentowe okre
ś
la jaka ilo
ść
substancji przypada na 100g cało
ś
ci (pro cent – na 100). Czyli roztwór x% oznacza,
ż
e w 100g roztworu znajduje si
ę
x g substancji
rozpuszczonej. St
ęż
enie procentowe liczone jest ze wzoru:
gdzie:
m
s
– masa substancji rozpuszczonej
m
rozt
– masa roztworu, czyli masa rozpuszczalnika i masa substancji rozpuszczonej
Po odparowaniu rozpuszczalnika zostanie tylko substancja rozpuszczona (m
s
). Podstawiaj
ą
c dane do wzoru na st
ęż
enie procentowe i przekształcaj
ą
c go wzgl
ę
dem m
s
otrzymamy:
Po odparowaniu całkowicie rozpuszczalnika z 30g 6% roztworu NaCl otrzymamy 1,8g NaCl
5.2-3.
St
ęż
enie procentowe okre
ś
la jaka ilo
ść
substancji przypada na 100g cało
ś
ci (pro cent – na 100). Czyli roztwór x% oznacza,
ż
e w 100g roztworu znajduje si
ę
x g substancji
rozpuszczonej. St
ęż
enie procentowe liczone jest ze wzoru:
gdzie:
m
s
– masa substancji rozpuszczonej
m
rozt
– masa roztworu, czyli masa rozpuszczalnika i masa substancji rozpuszczonej
masa roztworu m
rozt
=500g (0,5kg); c%=2%, masa substancji m
s
=
?
Podstawiaj
ą
c dane do wzoru na st
ęż
enie procentowe otrzymamy:
W 0,5kg 2% roztworu znajduje si
ę
10g soli.
5.2-4.
St
ęż
enie procentowe okre
ś
la jaka ilo
ść
substancji przypada na 100g cało
ś
ci (pro cent – na 100). Czyli roztwór x% oznacza,
ż
e w 100g roztworu znajduje si
ę
x g substancji
rozpuszczonej. St
ęż
enie procentowe liczone jest ze wzoru:
gdzie:
m
s
– masa substancji rozpuszczonej
m
rozt
– masa roztworu, czyli masa rozpuszczalnika i masa substancji rozpuszczonej
m
rozt
=400g, c%=20%, m
s
=
?
.
Podstawiaj
ą
c dane do wzoru na st
ęż
enie procentowe i przekształcaj
ą
c go wzgl
ę
dem m
s
otrzymamy:
Mas
ę
wody (rozpuszczalnika) obliczymy odejmuj
ą
c mas
ę
substancji od masy roztworu: m
rozp
=m
rozt
‑
m
s
=400g-80g=320g.
W 400g 20% roztworu znajduje si
ę
80g substancji rozpuszczonej i 320g wody.
5.2-5.
St
ęż
enie procentowe okre
ś
la jaka ilo
ść
substancji przypada na 100g cało
ś
ci (pro cent – na 100). Czyli roztwór x% oznacza,
ż
e w 100g roztworu znajduje si
ę
x g substancji
rozpuszczonej. St
ęż
enie procentowe liczone jest ze wzoru:
gdzie:
m
s
– masa substancji rozpuszczonej
m
rozt
– masa roztworu, czyli masa rozpuszczalnika i masa substancji rozpuszczonej.
Je
ż
eli g
ę
sto
ść
roztworu d=0,9g/cm
3
, to masa tego roztworu (d=m/V) m
rozt
=d
.
V=1000cm
3.
0,9g/cm
3
=900g.
c%=45%, m
s
=
?
.
Podstawiaj
ą
c dane do wzoru na st
ęż
enie procentowe i przekształcaj
ą
c go wzgl
ę
dem m
s
otrzymamy:
. Masa roztworu wynosi m
rozt
=900g,
masa substancji m
s
=405g, wi
ę
c masa rozpuszczalnika (wody) m
rozp
=m
rozt
-m
s
=900g-405g=495g.
1dm
3
45% roztworu o g
ę
sto
ś
ci 0,9g/cm
3
zawiera 495g wody.
5.2-6.
St
ęż
enie procentowe okre
ś
la jaka ilo
ść
substancji przypada na 100g cało
ś
ci (pro cent – na 100). Czyli roztwór x% oznacza,
ż
e w 100g roztworu znajduje si
ę
x g substancji
rozpuszczonej. St
ęż
enie procentowe liczone jest ze wzoru:
gdzie:
m
s
– masa substancji rozpuszczonej
m
rozt
– masa roztworu, czyli masa rozpuszczalnika i masa substancji rozpuszczonej
W 1dm
3
(1000cm
3
) roztworu o g
ę
sto
ś
ci 1,02g/cm
3
znajduje si
ę
62,2g H
2
O
2
. Masa tego roztworu (d=m/V) m
rozt
=dV=1000cm
3.
1,02g/cm
3
=1020g.
Strona 2
Odpowiedzi 5.2.
2011-05-02 12:46:03
http://www.chemia.sos.pl/index.php/nieorganiczna/39-stezenia/91-odp-52.html?tmpl=component&print=1&page=
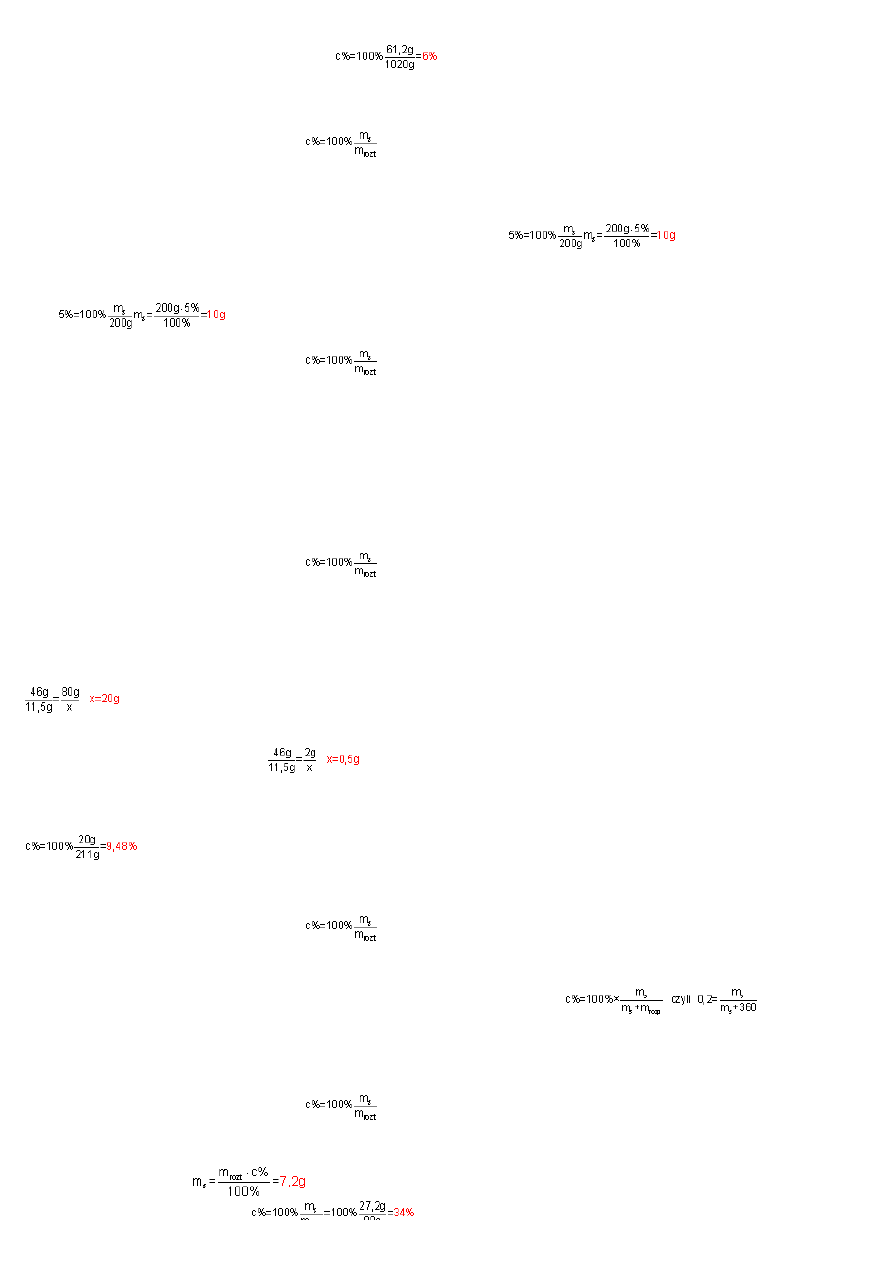
Podstawiaj
ą
c dane do wzoru na st
ęż
enie procentowe otrzymamy:
Roztwór nadtlenku wodoru jest 6% wzgl
ę
dem H
2
O
2
.
5.2-7.
St
ęż
enie procentowe okre
ś
la jaka ilo
ść
substancji przypada na 100g cało
ś
ci (pro cent – na 100). Czyli roztwór x% oznacza,
ż
e w 100g roztworu znajduje si
ę
x g substancji
rozpuszczonej. St
ęż
enie procentowe liczone jest ze wzoru:
gdzie:
m
s
– masa substancji rozpuszczonej
m
rozt
– masa roztworu, czyli masa rozpuszczalnika i masa substancji rozpuszczonej
Masa roztworu m
rozt
=200g; c%=5%; m
s
=
?
.
Podstawiaj
ą
c dane do wzoru na st
ęż
enie procentowe i przekształcaj
ą
c wzór wzgl
ę
dem m
s
otrzymamy:
Ilo
ść
moli NaOH potrzebn
ą
do sporz
ą
dzenia 200g 5% roztworu obliczymy ze wzoru n=m/M, gdzie m – masa NaOH (10g), M – masa molowa NaOH (40g/
mol
). Podstawiaj
ą
c do
wzoru otrzymamy: n=10g/40g/
mol
=0,25mol.
W celu sporz
ą
dzenia 200g 5% roztworu NaOH nale
ż
y wzi
ąć
0,25mola NaOH.
5.2-8.
St
ęż
enie procentowe okre
ś
la jaka ilo
ść
substancji przypada na 100g cało
ś
ci (pro cent – na 100). Czyli roztwór x% oznacza,
ż
e w 100g roztworu znajduje si
ę
x g substancji
rozpuszczonej. St
ęż
enie procentowe liczone jest ze wzoru:
gdzie:
m
s
– masa substancji rozpuszczonej
m
rozt
– masa roztworu, czyli masa rozpuszczalnika i masa substancji rozpuszczonej
Korzystaj
ą
c z definicji st
ęż
enia procentowego wiemy,
ż
e w 100g 96% roztworu kwasu znajduje si
ę
96g czystego kwasu.
96g H
2
SO
4
to (n=m/M) n=96g/98g/
mol
=0,98mol.
Ta ilo
ść
kwasu znajduje si
ę
w 100g roztworu o g
ę
sto
ś
ci d=1,84g/cm
3
. Obj
ę
to
ść
tego roztworu (d=m/V) V=m/d=100g/1,84g/cm
3
=54,3cm
3
=0,0542dm
3
.
St
ęż
enie molowe C
M
=n/V
rozt
(ilo
ść
moli substancji w 1dm
3
roztworu). Podstawiaj
ą
c dane do wzoru na st
ęż
enie molowe otrzymamy: C
M
=0,98mol/0,0542dm
3
=18,05mol/dm
3
.
96% kwas siarkowy jest 18,05M
5.2-9.
St
ęż
enie procentowe okre
ś
la jaka ilo
ść
substancji przypada na 100g cało
ś
ci (pro cent – na 100). Czyli roztwór x% oznacza,
ż
e w 100g roztworu znajduje si
ę
x g substancji
rozpuszczonej. St
ęż
enie procentowe liczone jest ze wzoru:
gdzie:
m
s
– masa substancji rozpuszczonej
m
rozt
– masa roztworu, czyli masa rozpuszczalnika i masa substancji rozpuszczonej
Po wprowadzeniu sodu do wody, reaguje on z ni
ą
tworz
ą
c wodorotlenek sodu:
2Na + 2H
2
O
→
2NaOH + H
2
Z równania reakcji wynika,
ż
e 46g (2mole) sodu reaguj
ą
z wod
ą
daj
ą
c 80g (2mole) NaOH, to
11,5g sodu utworzy x g NaOH, co mo
ż
na zapisa
ć
:
. Powstały wodorotlenek sodu (m
s
=20g) rozpu
ś
ci si
ę
w wodzie, ale z równania reakcji wynika,
ż
e wydziela si
ę
jeszcze wodór, czyli masa roztworu nieznacznie
zmaleje. Z równania reakcji wynika,
ż
e:
W reakcji z 46g (2mole) sodu wydziela si
ę
2g wodoru, to
w reakcji 11,5 g sodu wydzieli si
ę
x g wodoru, czyli:
Masa substancji m
s
=20g, masa roztworu zgodnie z prawem zachowania masy b
ę
dzie równa masie wody, masie wrzuconego do niej sodu i pomniejszona o wydzielony w reakcji
wodór (nie ma potrzeby oblicza
ć
ile wody przereagowało z sodem i odejmowa
ć
t
ę
mas
ę
od masy rozpuszczalnika. Zgodnie z prawem zachowania masy lewa strona równania
reakcji musi by
ć
równa prawej stronie równania reakcji). Masa roztworu m
rozt
=11,5g+200g-0,5g=211g. Podstawiaj
ą
c dane do wzoru na st
ęż
enie molowe otrzymamy:
Otrzymany roztwór jest 9,48% wzgl
ę
dem NaOH.
5.2-10.
St
ęż
enie procentowe okre
ś
la jaka ilo
ść
substancji przypada na 100g cało
ś
ci (pro cent – na 100). Czyli roztwór x% oznacza,
ż
e w 100g roztworu znajduje si
ę
x g substancji
rozpuszczonej. St
ęż
enie procentowe liczone jest ze wzoru:
gdzie:
m
s
– masa substancji rozpuszczonej
m
rozt
– masa roztworu, czyli masa rozpuszczalnika i masa substancji rozpuszczonej m
rozt
=m
s
+m
rop
Podstawiaj
ą
c dane do wzoru na st
ęż
enie procentowe otrzymamy: , a po przekształceniu wzgl
ę
dem m
s
otrzymamy:
0,2m
s
+0,2
.
360=m
s
, czyli
m
s
=90g
.
Celem otrzymania 20% roztworu nale
ż
y odwa
ż
yc 90g substancji i rozpu
ś
ci
ć
j
ą
w 360g wody.
5.2-11.
St
ęż
enie procentowe okre
ś
la jaka ilo
ść
substancji przypada na 100g cało
ś
ci (pro cent – na 100). Czyli roztwór x% oznacza,
ż
e w 100g roztworu znajduje si
ę
x g substancji
rozpuszczonej. St
ęż
enie procentowe liczone jest ze wzoru:
gdzie:
m
s
– masa substancji rozpuszczonej
m
rozt
– masa roztworu, czyli masa rozpuszczalnika i masa substancji rozpuszczonej.
W roztworze wyj
ś
ciowym było wi
ę
c
soli. Po dodaniu 20g soli masa substancji m
s
=27,2g, natomiast masa roztworu m
rozt
=80g (60g+20g). St
ęż
enie
procentowe otrzymanego roztworu wynosi wi
ę
c
Strona 3
Odpowiedzi 5.2.
2011-05-02 12:46:03
http://www.chemia.sos.pl/index.php/nieorganiczna/39-stezenia/91-odp-52.html?tmpl=component&print=1&page=
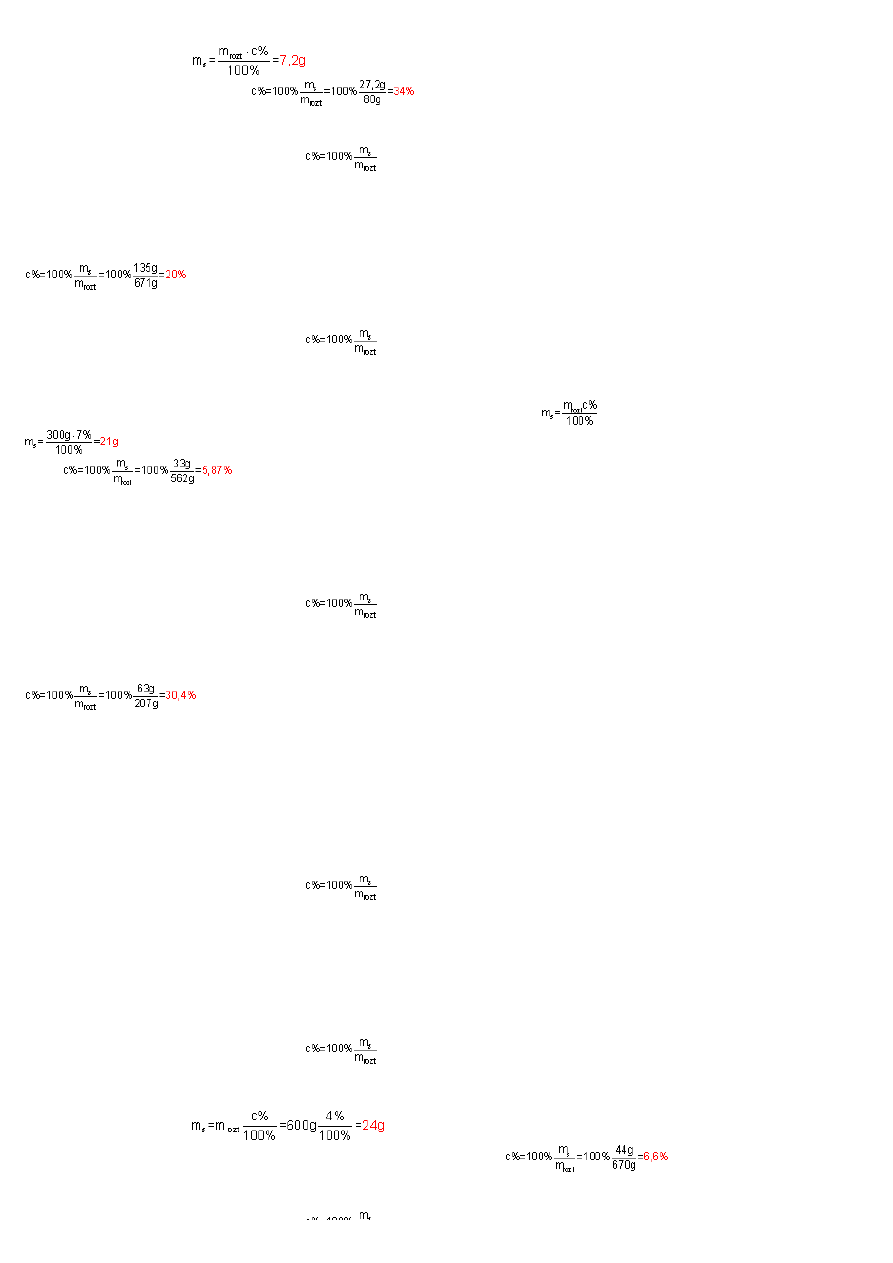
W roztworze wyj
ś
ciowym było wi
ę
c
soli. Po dodaniu 20g soli masa substancji m
s
=27,2g, natomiast masa roztworu m
rozt
=80g (60g+20g). St
ęż
enie
procentowe otrzymanego roztworu wynosi wi
ę
c
5.2-12.
St
ęż
enie procentowe okre
ś
la jaka ilo
ść
substancji przypada na 100g cało
ś
ci (pro cent – na 100). Czyli roztwór x% oznacza,
ż
e w 100g roztworu znajduje si
ę
x g substancji
rozpuszczonej. St
ęż
enie procentowe liczone jest ze wzoru:
gdzie:
m
s
– masa substancji rozpuszczonej
m
rozt
– masa roztworu, czyli masa rozpuszczalnika i masa substancji rozpuszczonej.
W 171g CuCl
2
.
2H
2
O oprócz substancji znajduje si
ę
dodatkowo woda krystalizacyna. W 1 molu dwuwodnego chlorku miedzi(II), czyli w 171g znajduje si
ę
36g wody. Czystej,
bezwodnej substancji w tej masie jest m
s
=171-36=135g. Masa roztworu m
rozt
=500+171=671g. Podstawiaj
ą
c dane do wzoru na st
ęż
enie procentowe otrzymamy:
5.2-13.
St
ęż
enie procentowe okre
ś
la jaka ilo
ść
substancji przypada na 100g cało
ś
ci (pro cent – na 100). Czyli roztwór x% oznacza,
ż
e w 100g roztworu znajduje si
ę
x g substancji
rozpuszczonej. St
ęż
enie procentowe liczone jest ze wzoru:
gdzie:
m
s
– masa substancji rozpuszczonej
m
rozt
– masa roztworu, czyli masa rozpuszczalnika i masa substancji rozpuszczonej
Przekształcaj
ą
c wzór na st
ęż
enie procentowe wzgl
ę
dem m
s
obliczymy mas
ę
substancji w 300g 7% roztworu:
. Podstawiaj
ą
c dane do wzoru otrzymamy:
. Po dodaniu 12g kwasku cytrynowego do roztworu m
s
=21+12=
33g
. Masa powstałego roztworu m
rozt
=300+12+250=
562g
. St
ęż
enie tak powstałego roztworu
wynosi:
5.2-14.
Kwas azotowy jest kwasem jednozasadowym (jeden
mol
kwasu reaguje z jednym molem zasady), dysocjuj
ą
cym w wodzie w 100% (mocny kwas):
HNO
3
→
H
+
+ NO
3
-
Czyli na 1 cz
ą
steczk
ę
kwasu azotowego przypada 8 cz
ą
steczek wody, lub na 1
mol
kwasu azotowego(V) przypada 8 moli wody. 1
mol
kwasu wa
ż
y 63g, natomiast 8 moli wody
wa
ż
y 144g.
St
ęż
enie procentowe okre
ś
la jaka ilo
ść
substancji przypada na 100g cało
ś
ci (pro cent – na 100). Czyli roztwór x% oznacza,
ż
e w 100g roztworu znajduje si
ę
x g substancji
rozpuszczonej. St
ęż
enie procentowe liczone jest ze wzoru:
gdzie:
m
s
– masa substancji rozpuszczonej
m
rozt
– masa roztworu, czyli masa rozpuszczalnika i masa substancji rozpuszczonej
Substancj
ą
jest kwas azotowy (63g), natomiast roztworem kwas azotowy i woda (63+144=207g).
5.2-15.
NaCl i Na
2
SO
4
jako sole w wodzie dysocjuj
ą
całkowicie:
NaCl
→
Na
+
+ Cl
-
Na
2
SO
4
→
2Na
+
+ SO
4
2-
Z równa
ń
reakcji dysocjacji wynika,
ż
e z jednego mola NaCl powstaje 1
mol
jonów sodowych, natomiast z 1 mola Na
2
SO
4
powstaj
ą
dwa mole jonów sodowych. Sole te nale
ż
y
odwa
ż
y
ć
w stosunku 1mol NaCl (58,4g) do 0,5mola Na
2
SO
4
(71g), czyli 58,4:71=
1:1,22
5.2-16.
St
ęż
enie procentowe okre
ś
la jaka ilo
ść
substancji przypada na 100g cało
ś
ci (pro cent – na 100). Czyli roztwór x% oznacza,
ż
e w 100g roztworu znajduje si
ę
x g substancji
rozpuszczonej. St
ęż
enie procentowe liczone jest ze wzoru:
gdzie:
m
s
– masa substancji rozpuszczonej
m
rozt
– masa roztworu, czyli masa rozpuszczalnika i masa substancji rozpuszczonej
W 100g roztworu znajduje si
ę
10g NaCl, 10g NaBr oraz 10g KCl. Przeliczaj
ą
c mase na ilosci moli ze wzoru n=m/M otrzymamy: 0,17mola NaCl, 0,097mola NaBr, oraz 0,13mola KCl.
Sole te w wodzie dysocjuj
ą
na jony, wi
ę
c w roztworze znajduje si
ę
: 0,17+0,097=
0,267mola
jonów sodowych, 0,17+0,13=
0,3mola
jonów chlorkowych, 0,13mola jonów potasowych
oraz 0,097 mola jonów bromkowych. Z oblicze
ń
wynika,
ż
e molowo najwi
ę
cej w roztworze jest jonów chlorkowych. Natomiast masowo (m=nM) w roztworze znajduje si
ę
nast
ę
puj
ą
ca ilo
ść
jonów: 6,14g jonów sodowych,
10,64g
jonów chlorkowych, 5,08g jonów potasowych, oraz 7,76g jonów bromkowych.
5.2-17.
St
ęż
enie procentowe okre
ś
la jaka ilo
ść
substancji przypada na 100g cało
ś
ci (pro cent – na 100). Czyli roztwór x% oznacza,
ż
e w 100g roztworu znajduje si
ę
x g substancji
rozpuszczonej. St
ęż
enie procentowe liczone jest ze wzoru:
gdzie:
m
s
– masa substancji rozpuszczonej
m
rozt
– masa roztworu, czyli masa rozpuszczalnika i masa substancji rozpuszczonej
W 600g 4% roztworze znajduje si
ę
substancji ropuszczonej. Je
ż
eli dodano 20g soli, to masa substancji rozpuszczonej wynosi m
s
=24g
+20g=
44g
. Masa roztworu m
rozt
=600g+20g+50g=
670g
. St
ęż
enie procentowe otrzymanego roztworu:
5.2-18.
St
ęż
enie procentowe okre
ś
la jaka ilo
ść
substancji przypada na 100g cało
ś
ci (pro cent – na 100). Czyli roztwór x% oznacza,
ż
e w 100g roztworu znajduje si
ę
x g substancji
rozpuszczonej. St
ęż
enie procentowe liczone jest ze wzoru:
gdzie:
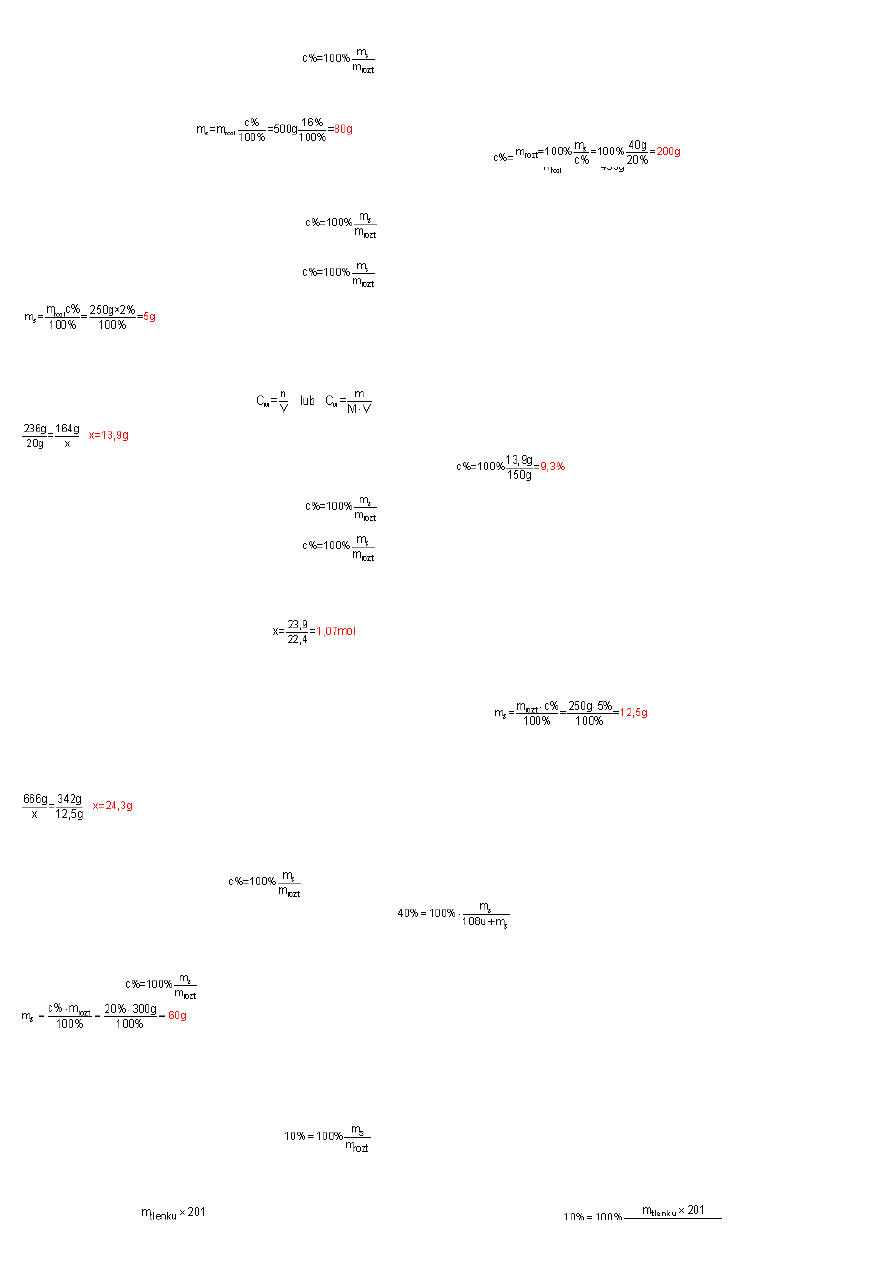
Strona 4
Odpowiedzi 5.2.
2011-05-02 12:46:03
http://www.chemia.sos.pl/index.php/nieorganiczna/39-stezenia/91-odp-52.html?tmpl=component&print=1&page=
rozpuszczonej. St
ęż
enie procentowe liczone jest ze wzoru:
gdzie:
m
s
– masa substancji rozpuszczonej
m
rozt
– masa roztworu, czyli masa rozpuszczalnika i masa substancji rozpuszczonej
W 500g 16% roztworze znajduje si
ę
soli. Po dodaniu 40g soli, masa substancji rozpuszczonej wynoci m
s
=80g+40g=
120g
. Po odparowaniu 87g
wody, masa roztworu wynosi: m
rozt
=500g+40g-87g=
453g
. St
ęż
enie otrzymanego roztworu wynosi:
5.2-19.
St
ęż
enie procentowe okre
ś
la jaka ilo
ść
substancji przypada na 100g cało
ś
ci (pro cent – na 100). Czyli roztwór x% oznacza,
ż
e w 100g roztworu znajduje si
ę
x g substancji
rozpuszczonej. St
ęż
enie procentowe liczone jest ze wzoru:
gdzie:
m
s
– masa substancji rozpuszczonej
m
rozt
– masa roztworu, czyli masa rozpuszczalnika i masa substancji rozpuszczonej
Przekształcaj
ą
c wzór na st
ęż
enie procentowe wzgl
ę
dem m
s
obliczam mas
ę
substancji:
Mas
ę
rozpuszczalnika obliczam z zale
ż
no
ś
ci m
rozt
=m
rozp
+m
s
, czyli m
rozp
=m
rozt
-m
s
=250g-5g=
245g
.
Aby otrzyma
ć
250g 2% roztworu sodu nale
ż
y 5g sody rozpu
ś
ci
ć
w 245g wody.
5.2-20.
St
ęż
enie molowe roztworu liczone jest ze wzoru:
:
gdzie: n –liczba moli substancji,
V – obj
ę
to
ść
roztworu w dm
3
lub: m – masa substancji
M – masa molowa substancji
St
ęż
enie procentowe okre
ś
la jaka ilo
ść
substancji przypada na 100g cało
ś
ci (pro cent – na 100). Czyli roztwór x% oznacza,
ż
e w 100g roztworu znajduje si
ę
x g substancji
rozpuszczonej. St
ęż
enie procentowe liczone jest ze wzoru:
gdzie:
m
s
– masa substancji rozpuszczonej
m
rozt
– masa roztworu, czyli masa rozpuszczalnika i masa substancji rozpuszczonej
Przyjmuj
ą
c,
ż
e chlorowodór odmierzono w warunkach normalnych, czyli z prawa Avogadro (w warunkach normalnych 1mol gazu zajmuje obj
ę
to
ść
22,4dm
3
) obliczam ilo
ść
moli
chlorowodoru:
1mol chlorowodoru zajmuje obj
ę
to
ść
22,4dm
3
, to
x moli chlorowodoru zajmuje obj
ę
to
ść
23,9dm
3
, czyli
. Ta ilo
ść
chlorowodoru wa
ż
y (n=m/M) m=nM=
39g
. Masa roztworu to masa substancji – 39g oraz masa
rozpuszczalnika – 350
rozpuszczonej. St
ęż
enie procentowe liczone jest ze wzoru:
gdzie:
m
s
– masa substancji rozpuszczonej
m
rozt
– masa roztworu, czyli masa rozpuszczalnika i masa substancji rozpuszczonej
Cukier jest substancj
ą
, wi
ę
c m
s
=40g, c%=20%, m
rozt
=?
Podstawiaj
ą
c dane do wzoru na st
ęż
enie procentowe i przekształcaj
ą
c wzór wzgl
ę
dem m
rozt
otrzymamy:
Masa roztworu jest sum
ą
mas rozpuszczalnika i substancji: m
rozt
=m
s
+m
rozp
, czyli masa rozpuszczalnika m
rozp
=m
rozt
-m
s
=200g-40g=
160g
. Je
ż
eli znana jest g
ę
sto
ść
rozpuszczalnika (d=m/V), po przekształceniu wzoru na g
ę
sto
ść
mo
ż
emy obliczy
ć
obj
ę
to
ść
rozpuszczalnika: V=m/d, czyli V=160g/1g/cm
3
=160cm
3
=0,16dm
3
.
W celu otrzymania 20% roztworu z 40g cukru nale
ż
y go rozpu
ś
ci
ć
w 160g wody (0,16dm
3
wody).
5.2-41.
St
ęż
enie procentowe okre
ś
la jaka ilo
ść
substancji przypada na 100g cało
ś
ci (pro cent – na 100). Czyli roztwór x% oznacza,
ż
e w 100g roztworu znajduje si
ę
x g substancji
rozpuszczonej. St
ęż
enie procentowe liczone jest ze wzoru:
gdzie:
m
s
– masa substancji rozpuszczonej
m
rozt
– masa roztworu, czyli masa rozpuszczalnika i masa substancji rozpuszczonej.
Po rozpuszczeniu 20g Ca(NO
3
)
2
.
4H
2
O w 130g wody, masa roztworu wyniesie 150g. Jednak
ż
e masa substancji nie wynosi 20g, poniewa
ż
w tej masie znajduje si
ę
równie
ż
woda
krystalizacyjna.
W 236g (1 molu) Ca(NO
3
)
2
.
4H
2
O znajduje si
ę
164g Ca(NO
3
)
2
, to
w 20g Ca(NO
3
)
2
.
4H
2
O znajduje si
ę
x g Ca(NO
3
)
2
, czyli
m
s
=13,9g, m
rozt
=150g. Podstawiaj
ą
c te dane do wzoru na st
ęż
enie procentowe otrzymamy:
Otrzymany roztwór jest 9,3% wzgl
ę
dem azotanu(V) wapnia.
5.2-42.
St
ęż
enie procentowe okre
ś
la jaka ilo
ść
substancji przypada na 100g cało
ś
ci (pro cent – na 100). Czyli roztwór x% oznacza,
ż
e w 100g roztworu znajduje si
ę
x g substancji
rozpuszczonej. St
ęż
enie procentowe liczone jest ze wzoru:
gdzie:
m
s
– masa substancji rozpuszczonej
m
rozt
– masa roztworu, czyli masa rozpuszczalnika i masa substancji rozpuszczonej.
Podstawiaj
ą
c dane do wzoru na st
ęż
enie procentowe i przekształcaj
ą
c go wzgl
ę
dem m
s
otrzymamy:
Nale
ż
y odwa
ż
y
ć
12,5g bezwodnego siarczanu(VI) glinu. Mas
ę
uwodnionego siarczanu(VI) glinu policzymy uwzgl
ę
dniaj
ą
c nast
ę
puj
ą
c
ą
proporcj
ę
:
w 666g (1
mol
) Al
2
(SO
4
)
3
.
18H
2
O znajduje si
ę
342g Al
2
(SO
4
)
3
, to
w x g Al
2
(SO
4
)
3
.
18H
2
O znajduje si
ę
12,5g Al
2
(SO
4
)
3
, czyli:
W celu sporz
ą
dzenia 250g 5% roztworu siarczanu glinu nale
ż
y odwa
ż
y
ć
24,3g Al
2
(SO
4
)
3
.
18H
2
O.
5.2-43.
St
ęż
enie procentowe liczone jest ze wzoru:
. Masa roztworu to masa rozpuszczalnika i masa substancji rozpuszczonej. Masa rozpuszczalnika, to masa 6
cz
ą
steczek wody m
rozp
=6
.
18u=
108u
. Podstawiaj
ą
c dane do wzoru otrzymamy:
, a po przekształceniu wzgl
ę
dem m
s
otrzymamy: 43,2u+0,4m
s
=m
s
, czyli
m
s
=
72u
.
5.2-44.
St
ęż
enie procentowe
. Maj
ą
c mas
ę
roztworu i jego st
ęż
enie, po przekształceniu wzoru na st
ęż
enie procentowe wzgl
ę
dem m
s
, obliczam mas
ę
substancji:
Nale
ż
y odwa
ż
y
ć
zatem 60g gliceryny oraz 240g (240cm
3
) wody. G
ę
sto
ść
gliceryny d=m/V czyli V=m/d=60g/1,2g/cm
3
=
50cm
3
.
5.2-45.
Kwas chlorowy(VII) powstaje z tlenku chloru(VII) w reakcji z wod
ą
:
Cl
2
O
7
+ H
2
O
→
2HClO
4
St
ęż
enie procentowe tego kwasu liczone jest ze wzoru:
. Zauwa
ż
my,
ż
e masa roztworu równa jest masie wody i masie wprowadzonego tlenku chloru(VII),
natomiast masa substancji rozpuszczonej równa jest masie powstałego kwasu chlorowego(VII). Mo
ż
emy wi
ę
c zapisa
ć
:
m
rozt
=200g+m
tlenku
, oraz m
s
=m
kwasu
.
Zauwa
ż
my,
ż
e ze 183g tlenku chloru(VII) powstaje 201g kwasu
czyli z m
powstanie
g kwasu. Podstawiaj
ą
c dane do wzoru na st
ęż
enie procentowe otrzymamy:
. Po rozwi
ą
zaniu równania







Wyszukiwarka
Podobne podstrony:
więcej podobnych podstron