
1
ćwiczenie 7
ANALIZA ODDZIAŁYWAŃ DNA/BIAŁKO Z WYKORZYSTANIEM TECHNIK
EMSA I FOOTPRINTING
Analiza oddziaływań DNA/białko ma zasadnicze znaczenie w badaniach takich procesów jak transkrypcja,
replikacja oraz naprawa DNA. Aby zrozumieć mechanizm regulacji transkrypcji należy poznać białka pełniące
funkcje czynników transkrypcyjnych (aktywatory, represory) oraz sekwencje DNA (promotory, terminatory,
enhancery, silencery), z którymi czynniki te oddziałują. Ponieważ wiele czynników transkrypcyjnych jest
odpowiedzialnych za regulację określonych grup genów, np. związanych z cyklem komórkowym, aktywność tych
białek ma zasadniczy wpływ na przebieg podstawowych procesów komórkowych, takich jak: proliferacja,
różnicowanie, apoptoza lub onkogeneza.
EMSA
Test EMSA (ang. Electrophoretical Mobility Shift Assay), zwany również techniką retardacji, wykorzystywany
jest do badań oddziaływań zachodzących pomiędzy białkami a kwasami nukleinowymi. Technika ta wykorzystuje
fakt, że kompleksy DNA/białko migrują w żelach poliakryloamidowych (PAA) z mniejszą szybkością niż same
cząsteczki DNA (Rys. 1). Badane fragmenty DNA, np. promotory, po wyznakowaniu radioaktywnym izotopem,
poddawane są kompleksacji, czyli inkubacji z odpowiednim białkiem. Do eksperymentu można używać zarówno
pełne ekstrakty białkowe, czyli mieszaniny zawierające wszystkie białka obecne w danej tkance, jak i białko
oczyszczone z ekstraktu (homogenne) lub białko rekombinowane, czyli uzyskane z nadekspresji w bakteriach.
Mieszaninę reakcyjną po kompleksacji rozdzielamy w natywnych żelach poliakryloamidowych a pozycję
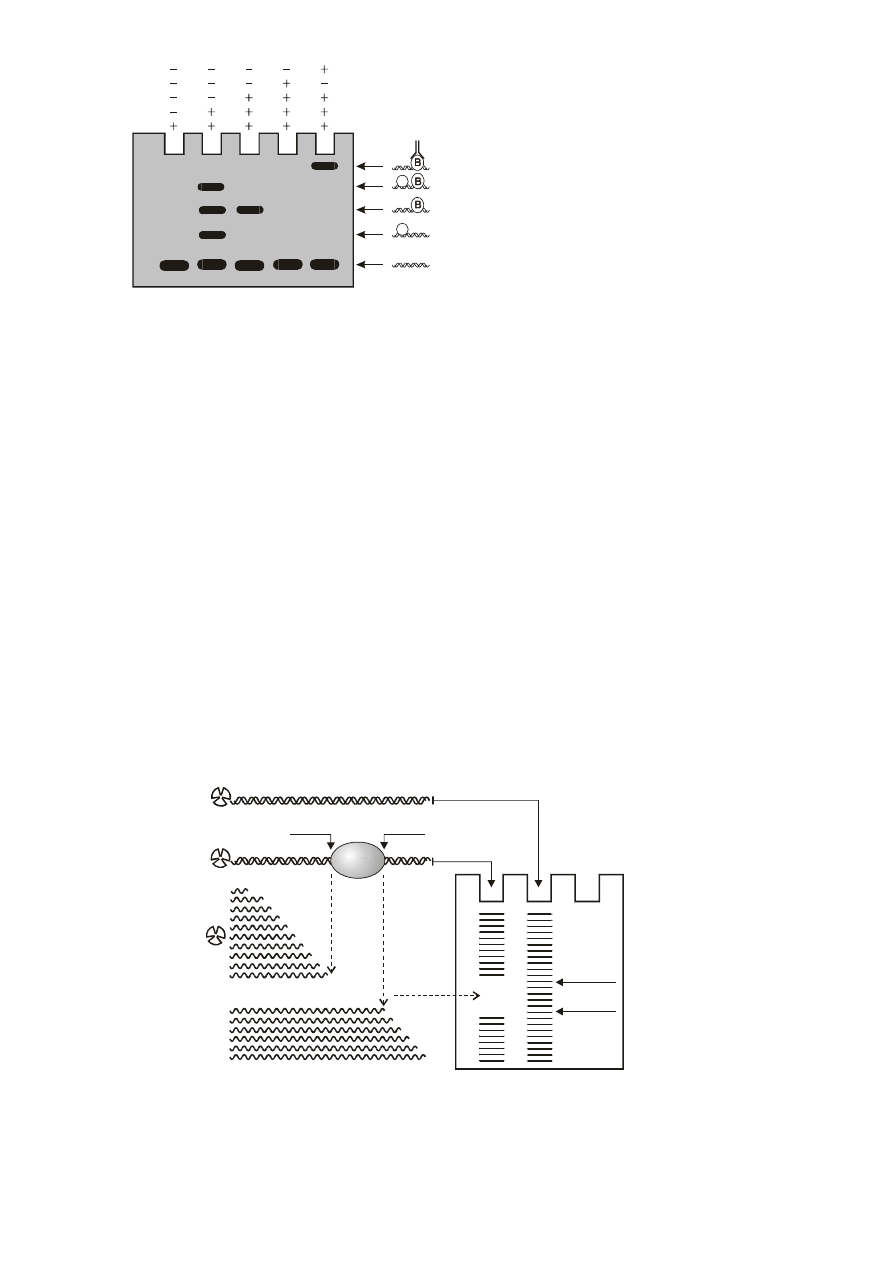
kompleksów DNA/białko identyfikujemy za pomocą autoradiografii. EMSA umożliwia uzyskanie następujących
informacji na temat oddziaływań DNA/białko:
1. Poznanie, czy badany fragment DNA oddziałuje z białkiem dodanym do reakcji. O oddziaływaniu świadczy
przesunięcie prążka znakowanego DNA w stosunku do próby kontrolnej, pozbawionej białek. Jeżeli w badanym
fragmencie DNA będziemy wprowadzać mutacji, które zniosą zdolność badanej cząsteczki do oddziaływań z
białkiem, możemy tą drogą zidentyfikować pozycje nukleotydowe uczestniczące bezpośrednio w wiązaniu
białka.
2. Ustalenie, jaki jest stopień specyficzności oddziaływań DNA/białko. W każdej komórce, oprócz białek
rozpoznających określony, tzw. specyficzny motywy sekwencji nukleotydowej, znajdują się również białka,
które wiążą się niespecyficznie z DNA, niezależnie od jego sekwencji. Specyficzność oddziaływań można
ustalić dodając dodatkowo do reakcji DNA pełniący funkcję kompetytora. W przeciwieństwie do badanego
fragmentu DNA, kompetytory nie są znakowane, a więc ich kompleksy z białkami nie są widoczne w żelu.
Stosowane są następujące typy kompetytorów:
- kompetytor niespecyficzny służący do eliminacji z żelu prążków niespecyficznych. Jest to DNA, o sekwencji
innej niż badany fragment DNA, np. syntetyczny poli dIxdC. Wiążą się z nim białka o niskiej specyficzności
oddziaływań z DNA. Białka niespecyficzne, po związaniu z tym kompetytorem, nie będą mogły oddziaływać z
DNA badanym (znakowanym), w wyniku czego na żelu nie będą widoczne kompleksy niespecyficzne (Rys.1,
kieszonka 3).
- kompetytor specyficzny służący do eliminacji z żelu prążków specyficznych. Jest to nieznakowany DNA o
sekwencji identycznej z DNA badanym (znakowanym). Dodany reakcji wiążę białka specyficzne
uniemożliwiając ich oddziaływanie ze znakowanym DNA. W efekcie, w próbach zawierających ten
kompetytor nie widzimy kompleksów specyficznych, które są obecne w próbach pozbawionych tego
kompetytora. Wynik ten potwierdza wysoką specyficzność tych kompleksów (Rys.1, kieszonka 4).
3. Ustalenie warunków, w jakich dochodzi do wiązania danego białka z DNA, tj. pH, stężenie poszczególnych
soli, temperatura, obecność kofaktorów lub innych białek.
4. Identyfikacja znanych białek wiążących się do badanego DNA. Badając oddziaływanie danego fragmentu
DNA z pełnym ekstraktem białkowym należy liczyć się z tym, że mogą się do niego wiązać poznane wcześniej
białka. Aby się o tym przekonać należy do reakcji dodać przeciwciała rozpoznające określone białko co
spowoduje opóźnienie migracji całego kompleksu (DNA/białko/przeciwciało) w stosunku do próby kontrolnej
(DNA/białko) (Rys.1, kieszonka 5).
5. EMSA umożliwia również monitorowanie obecności danego białka na kolejnych etapach jego oczyszczenia. W
tym przypadku na żel nakładane są różne frakcje białek po rozdziale chromatograficznym i kompleksacji z
badanym fragmentem DNA.
2
przeciwciało
kompetyt. specyf.
kompetyt. niespec
ekstrakt białkowy
DNA znakowany
A
A
Ż
E
L
P
O
LI
A
K
R
Y
L
O
A
M
ID
O
W
Y
Rys.1. Układ prążków testu EMSA w żelu poliakryloamidowym.
Footprinting
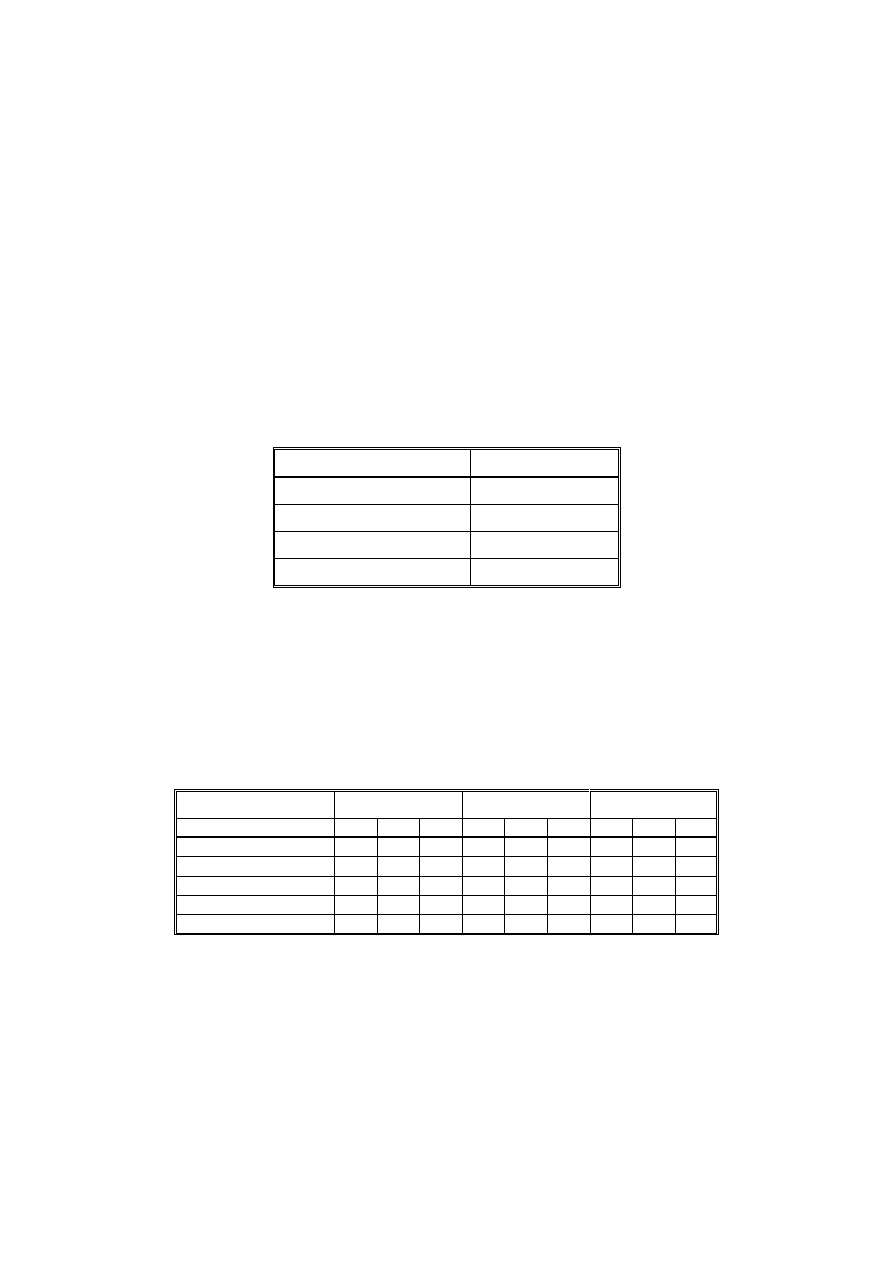
Technika ta stosowana jest w celu poznania, które nukleotydy danej sekwencji DNA, np. promotora, wiążą się bezpośrednio z
badanym białkiem. Wykonanie tego testu obejmuje następujące etapy:
1. Wyznakowanie jednego końca badanego fragmentu DNA, np. z wykorzystaniem kinazy polinukleotydowej.
2. Kompleksacja DNA z białkiem. Do tego celu można użyć zarówno oczyszczone białko, jak i ekstrakt w którym znajduje
się białko oddziałujące z badanym fragmentem DNA.
3. Trawienie. Preparat poddany zostaje hydrolizie z wykorzystaniem endonukleazy I. Warunki trawienia należy dobrać tak,
aby w wyniku reakcji uzyskać wszystkie warianty trawienia, tzn. wszystkie możliwe długości cząsteczek DNA od
znacznika do poszczególnych pozycji nukleotydowych. Ponieważ białko związane z DNA uniemożliwia trawienie
zajętego obszaru, nie dojdzie do powstania odcinków DNA o długościach odpowiadających odległości od znacznika do
pozycji związanych przez białko. Jako kontrolę należy przygotować trawienie znakowanego fragmentu DNA, który nie
był poddany kompleksacji z białkiem.
4. Rozdział elektroforetyczny. Preparaty po reakcji poddawane są denaturacji w celu uzyskania form jednoniciowych, a
następnie rozdziałowi w denaturującym żelu poliakryloamidowym. W żelu należy również rozdzielić preparat służący jako
marker mas cząsteczkowych, który pozwoli na określenie wielkości poszczególnych frakcji DNA. Po zakończeniu
rozdziału żel należy poddać ekspozycji na błonie radiologicznej w celu wizualizacji znakowanych fragmentów DNA. Te
fragmenty DNA, które powstały w wyniku trawienia preparatu a które nie zawierają na 5’końcu radioaktywnego
znacznika, nie będą widoczne na żelu.
5. Interpretacja wyniku. Znakowane cząsteczki DNA powinny być widoczne jako seria prążków rozdzielonych z
rozdzielczością do 1 nukleotydu. Obszar na w żelu, w którym brak jest prążków, odzwierciedla miejsce wiązania DNA z
białkiem. Wielkość frakcji odpowiadających odległości od znacznika do miejsca wiązania białka może zostać odczytana
po porównaniu do markera mas cząsteczkowych.
50 z
50 pz
55 z
55 pz
białko
fragmenty DNA
po trawieniu
DNA po kompleksacji
z białkiem
DNA kontrolny
Rys.2. Schemat wykonania testu foot printing.
3
Wykonanie testu EMSA
W eksperymencie badane będą trzy fragmenty DNA, Fr. I –84-35; Fr. II –34+16; Fr. III +17+66, reprezentujące różne
obszary badanego promotora. Numeracja arabska określa zakres sekwencji DNA w stosunku do miejsca startu transkrypcji,
czyli pierwszego nukleotydu ulegającego transkrypcji (+1). Fragmenty te poddawane będą reakcji z ekstraktem białkowym,
uzyskanym z tkanki w której dochodzi do ekspresji badanego genu. Każda reakcja prowadzona jest w trzech wariantach:
a. próba kontrolna - bez białek
b. reakcja z ekstraktem białkowym
c. reakcja z białkami i kompetytorem niespecyficznym, którym jest syntetyczny DNA - poli dIxdC.
Celem eksperymentu jest ustalenie, do którego fragmentu DNA wiąże się specyficzne białko.
Sprzęt i odczynniki
– Sprzęt do elektroforezy PAA
– składniki żelu PAA (Tab.1)
– katalizatory: TEMED i APS 10%
– buf. TGE
– EMSA buf.
– poli dIdC (1mg/ml)
– ekstrakty białkowe
– znakowany DNA
– ekran ochronny
– bibuła Watman 3MM
– folia do suszenia
– nożyczki
– kaseta do ekspozycji RTG
– suszarka do żeli
– tipsy i eppendorfówki
Postępowanie
1. Szybki elektroforetyczne umyć wodą z detergentem i przetrzeć etanolem. Po wysuszeniu złożyć szyby wraz z
przekładkami.
2. Z roztworów wyjściowych przygotować 10 ml roztworu o podanym składzie.
roztwory wyjściowe stężenia końcowy
akryloamid (39:1) 20%
5%
bufor TGE 10X
0,5 X
Glicerol 40%
4%
H
2
O
do 10 ml
3. Część roztworu przeznaczyć na przygotowanie żelu uszczelniającego, tzw. „korka”. 1/10 roztworu, czyli 1 ml, przenieść
do probówki eppendorfa a następnie dodać do niej katalizatory reakcji polimeryzacji (2
μl TEMEDu i 10 μl APS). Całość
wstrzyknąć za pomocą pipety automatycznej pomiędzy szybki elektroforetyczne tak, aby w dolnej części uformowała się
jednolita warstwa poliakryloamidu.
4. Po spolimeryzowaniu żelu uszczelniającego, do pozostałej części mieszaniny poliakryloamidu dodać 9
μl TEMED i 90μl
APS.
5. Mieszaninę wylać pomiędzy szybki i umieścić w górnej części grzebień dla uformowania się kieszonek.
6. Szyby ze spolimeryzowanym żelem umieścić w aparacie elektroforetycznym. Do aparatu nalać bufor elektoforetyczny
(0,5 X TGE).
7. Przygotować 9 mieszanin reakcyjnych dodając do probówek Eppendorfa następujące składniki:
Fragment DNA
I (–84-35)
II (–34+16)
III (+17+66)
Nr próby
1 2 3 4 5 6 7 8 9
1. H
2
O (
μl)
2 2 - 2 2 - 2 2 -
2. bufor 2xst. (
μl)
5 - - 5 - - 5 - -
3. polidIdC (
μl)
- - 2 - - 2 - - 2
4. białko (
μl)
- 5 5 - 5 5 - 5 5
5. DNA badany (
μl)
3 3 3 3 3 3 3 3 3
Poszczególne składniki należy dodawać, wg podanej kolejności. W podanym przykładzie nie dodajemy buforu reakcyjnego do
reakcji zawierającej białka, gdyż został on już dodany do mieszanin białkowych na etapie przygotowania ekstraktów. DNA
badany dodajemy dopiero po 5 minutowej inkubacji białek z kompetytorem. Uwaga: do reakcji podajemy znakowany
radioaktywnie DNA! Należy zachować ostrożność!
8. Mieszaninę reakcyjną inkubować przez 10 min w temp. pokojowej.
9. Próby nałożyć do kieszonek żelu.
10. Elektroforezę prowadzić przy 100V do momentu, gdy barwnik osiągnie dolną część żelu.
11. Żel przenieść na bibułę, przykryć folią i przenieść do suszarki próżniowej ustawionej na temp +80
o
C.
12. Wysuszony żel przenieść do kasety. W ciemni nałożyć na żel błonę rentgenowską z ekranem wzmacniającym.
13. Po zakończeniu ekspozycji trwającej ok. 18 godz. wywołać radiogram i wykonać analizę uzyskanych wyników.
Wyszukiwarka
Podobne podstrony:
Improve your digital footprint
Footprints 1 portfolio unit 2
Nial Fuller Price?tion The Footprint of Money
tommy emmanuel footprints version 2
FootprintsNo12
Mammals Footprints 1
Footprints
dinosaur footprint bookmarks
tommy emmanuel footprints
Footprint of Cinderella Philip Wylie
więcej podobnych podstron