Postępy Biochemii 58 (3) 2012
235
Małgorzata Czaplińska
*
Jan Czepas
Krzysztof Gwoździński
Zakład Badań Struktur Biopolimerów, Katedra
Biofizyki Molekularnej, Uniwersytet Łódzki,
Łódź
*
Zakład Badań Struktur Biopolimerów,
Katedra Biofizyki Molekularnej, Uniwersytet
Łódzki, ul. Pomorska 141/143, 90-236 Łódź;
e-mail: czaplinska.malgorzata@gmail.com
Artykuł otrzymano 22 listopada 2011 r.
Artykuł zaakceptowano 20 kwietnia 2012 r.
Słowa kluczowe: flawonoidy, podział flawo-
noidów, właściwości przeciwutleniające, wła-
ściwości przeciwnowotworowe
Wykaz skrótów: ADA — adenozynodeami-
naza; ALL (ang. acute lymphoblastic leukaemia)
— ostra białaczka limfoblastyczna; AML (ang.
acute myeloid leukaemia) — ostra białaczka szpi-
kowa; AP-1 (ang. activator protein 1) — czynnik
transkrypcyjny AP-1; Bax (ang. Bcl-2 associated
X protein) — białko X związane z Bcl-2; Bcl-XL
— białko antyapoptotyczne; BCR (ang. B cell
receptor) — receptor limfocytów B; EGFR (ang.
epidermal growth factor receptor) — receptor na-
skórkowego czynnika wzrostu; EpRE (ang.
electrophile-responsive element) — element kon-
trolujący ekspresję genów kodujących enzymy
detoksykacyjne; FAK (ang. focal adhesion kinase)
— kinaza ogniskowo-adhezyjna; GABA (ang.
γ-aminobutyric acid) — kwas γ-aminomasłowy;
HDL (ang. high density lipoproteins) — lipopro-
teiny o wysokiej gęstości; HTZ – hormonalna
terapia zastępcza; IAP (ang. inhibitor of apop-
tosis protein) — białko inhibitorowe apoptozy;
LDL (ang. low density lipoproteins) — lipoprote-
iny o małej gęstości; NADPH (ang. nicotinamide
adenine dinucleotide phosphate reduced) — zredu-
kowana forma fosforanu dinukleotydu niko-
tynamidoadeninowego; NF-κB (ang. nuclear
factor κB) — jądrowy czynnik transkrypcyjny
κB; OUN (ang. central nervous system) — ośrod-
kowy układ nerwowy; PAL (ang. phenylalanine
ammonia-lyase) — amoniakoliaza fenyloalani-
nowa; P-gp (ang. p-glycoprotein) — glikopro-
teina P; PKC (ang. protein kinase C) — kinaza
białkowa C; PLA
2
(ang. phospholipase A
2
) — fos-
folipaza A
2
; PST — sulfotransferaza fenolowa;
PTK (ang. protein tyrosine kinase) — kinaza tyro-
zynowa; RFT — reaktywne formy tlenu; SHBG
(ang. sex hormone binding globulin) — białko
wiążące hormony płciowe
Budowa, właściwości przeciwutleniające i przeciwnowotworowe flawonoidów
STRESZCZENIE
F
lawonoidy należą do substancji pochodzenia roślinnego, które występują m.in. w owocach
i warzywach. Do flawonoidów należą: flawony, flawonole (3-hydroksyflawony), flawanony,
flawanole (flawan-3-ole, flawanonole), antocyjanidyny, izoflawony i neoflawonoidy. Dzięki spe-
cyficznej budowie flawonoidy mogą chronić komórkę przed reaktywnymi formami tlenu (RFT)
generowanymi w organizmie. Ich właściwości przeciwutleniające związane są ze zdolnością do
zmiatania RFT (w tym rodników tlenopochodnych), udostępniania atomu wodoru lub elektro-
nu, chelatowania jonów metali przejściowych (głównie miedzi i żelaza), stymulacją właściwości
przeciwutleniających enzymów przez wzrost ich aktywności, dotyczy to m.in. dysmutazy po-
nadtlenkowej, peroksydazy glutationowej i katalazy. Flawonoidy hamują aktywność enzymów
proutleniających, lipooksygenazy, cyklooksygenazy, oksydazy ksantynowej oraz mają wpływ
na produkcję indukowalnej syntazy tlenku azotu. Związki te regenerują również rodnik askor-
bylowy i tokoferyloksylowy do odpowiednich witamin. Wykazują działanie przeciwwirusowe,
przeciwalergiczne, przeciwzapalne i przeciwnowotworowe, ograniczają także rozwój chorób
neurodegeneracyjnych (choroba Alzheimera, Parkinsona) i miażdżycy. Wykazują efekt ochron-
ny przed szkodliwym działaniem promieniowania nadfioletowego. W pracy omówiono wła-
ściwości przeciwutleniające, działanie przeciwnowotworowe flawonoidów, uwzględniając ich
działanie na enzymy naprawcze DNA, zatrzymanie cyklu komórkowego, uaktywnianie szlaków
apoptozy oraz hamowanie procesu karcenogenezy przez inaktywację niektórych kancerogenów.
WPROWADZENIE
Flawonoidy należą do grupy związków pochodzenia roślinnego. Występują
w wielu owocach (aronii, owocach cytrusowych, jagodach, borówkach, winogro-
nach, czereśniach, itp.) oraz warzywach (np. cebuli, pomidorach, papryce, soi,
brokułach), obecne są także w ziarnach kakaowca i kawy, w liściach zielonej her-
baty, winie oraz oliwie z oliwek [1,2]. Pełnią one rolę atraktantów, funkcję barwni-
kową (nie wszystkie) i przeciwutleniającą, a także naturalnych insektycydów oraz
fungicydów. Wykazują dSziałanie przeciwwirusowe, przeciwalergiczne, prze-
ciwzapalne, przeciwmiażdżycowe i przeciwnowotworowe [3-5]. Ponadto, chro-
nią młode rośliny przed szkodliwym działaniem promieniowania nadfioletowe-
go w czasie syntezy chlorofilu oraz przed atakiem ze strony owadów i grzybów.
Flawonoidy są uważane za jedne z najlepszych substancji o właściwościach prze-
ciwutleniających, które wspomagają endogenne systemy o takim działaniu [1,6].
Wykazują korzystne efekty zdrowotne oraz opóźniają procesy starzenia się [7-9].
Ich ochronne działanie stwierdzono m.in. w doświadczeniach z wykorzystaniem
linii komórkowych PC12 (model choroby Parkinsona), jak również w badaniach
procesu apoptozy indukowanej amyloidem-b w komórkach neuronów (model
choroby Alzheimera) [10]. Należy jednak podkreślić, że w wielu pracach badaw-
czych (in vivo i in vitro) stosowane są ekstrakty roślinne, a nie wyizolowane flawo-
noidy. Ekstrakty te często stanowią złożone mieszaniny, w skład których (oprócz
flawonoidów) wchodzą również inne składniki, takie jak fenole (kwasy fenolo-
we), taniny, chalkony [11]. Stąd też, nie zawsze można jednoznacznie stwierdzić,
który ze składników wchodzących w skład ekstraktu wykazuje wpływ dominu-
jący. Z drugiej strony, wszystkie wymienione substancje charakteryzują się tak-
że (w mniejszym lub większym stopniu) właściwościami przeciwutleniającymi,
przeciwwirusowymi, przeciwmiażdżycowymi, przeciwnowotworowymi, itp.
Do pozytywnych aspektów działania flawonoidów należą uszczelnianie naczyń
krwionośnych poprzez hamowanie aktywności enzymów proteolitycznych (ela-
stazy, hialuronidazy), co prowadzi do wzmocnienia tkanki łącznej w śródbłonku
naczyń, zwiększenia ich elastyczności i uszczelnienia ścianek. Takie działanie pro-
wadzi do efektu przeciwwysiękowego i przeciwobrzękowego [12,13].
BUDOWA CHEMICZNA I BIOSYNTEZA
Podstawową strukturą flawonoidów wg nomenklatury IUPAC jest heterocy-
kliczny układ chromanu (benzo-γ-piranu) z grupą ketonową w pozycji cztery
(chroman-4-on lub benzopiron). Po wprowadzeniu podstawnika fenylowego w
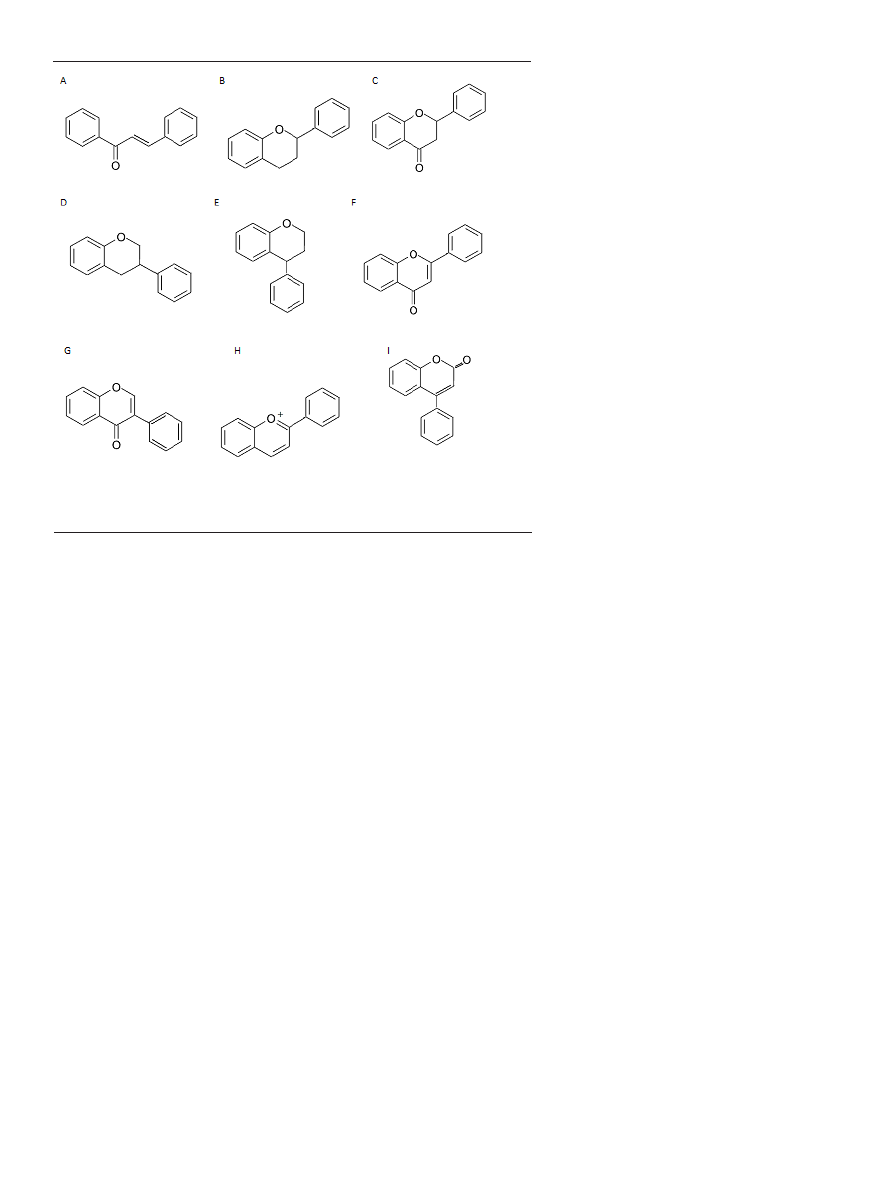
236
www.postepybiochemii.pl
pozycję dwa powstają odpowiednio, 2-fenylochroman i 2-fe-
nylochroman-4-on (Ryc. 1). Do tej grupy należą flawanole,
np. flawan-3-ol i flawan-4-ol oraz flawano-2,3-diole (leukocy-
janidyny) oraz flawonoidy posiadajace grupę karbonylową
w pozycji cztery (2-fenylochroman-4-on), czyli flawanony
oraz flawanonole oparte na strukturze 3-hydroksy-2-feny-
lochromanonu-4 (czasem zapisywany jako 3-hydroksy-2,3-
dihydrofenylochromen-4-on). Natomiast flawony (2-fenylo-
chromen-4-on) i flawonole (3-hydroksyflawony; pochodne
3-hydroksy-2-fenylochromen-4-onu) posiadają wiązanie
podwójne w pierścieniu chromanu. Z kolei izoflawony
posiadają podstawnik fenylowy w pozycji trzy pierścienia
chromanu (3-fenylochromen-2-on-4 lub 3-fenylochromen-
-4-on). Neoflawonoidy, które są pochodnymi 4-fenylokuma-
ryny posiadają podstawnik fenylowy w pozycji cztery, a gru-
pę karbonylową w pozycji dwa (4-fenylochromen-3-on-2).
Inną grupę pochodnych chromenu stanowią antocyjanidyny,
sole flawyliowe (2-fenylochromenyliowe) z podstawnikiem
fenylowym w pozycji dwa, ładunkiem dodatnim zloka-
lizowanym na atomie tlenu, zawierające dwa wiązania pod-
wójne w pierścieniu heterocyklicznym chromanu.
W wielu pracach dotyczących flawonoidów stosowane
są również oznaczenia literowe dla każdego z pierścieni od-
dzielnie. Literami A i B oznaczone są pierścienie benzenowe,
a literą C pierścień heterocykliczny piranu. Takie oznaczenia
stosowane są dla prostych flawonoidów i mają charakter hi-
storyczny związany z ich biosyntezą, w której jednym z sub-
stratów jest chalkon. Nazewnictwo takie jest oczywiście do-
puszczone, tak jak nazwy zwyczajowe odpowiednich grup
flawonoidów oraz samych flawonoidów. W niniejszej pracy
uwzględniono pierścień heterocykliczny chromanu (wg no-
menklatury IUPAC), podobnie jak ma to miejsce w innych
związkach heterocyklicznych złożonych z
dwóch pierścieni, takich na przykład jak chi-
nolina, indol, adenina i akrydyna.
Prekursorem flawonoidów jest chalkon
(Ryc. 1), powstający na drodze biosyntezy z
fenyloalaniny. Synteza zaczyna się od kwasu
szikimowego będącego związkiem wyjścio-
wym w biosyntezie aminokwasów aroma-
tycznych (fenyloalanina, tyrozyna, trypto-
fan). Fenyloalanina w wyniku deaminacji jest
przekształcana do kwasu cynamonowego
przy udziale amoniakoliazy fenyloalaninowej
(PAL). Następnie 4-hydroksylaza cynamono-
wa katalizuje reakcję wprowadzenia grupy –
OH do pierścienia benzenowego i powstanie
kwasu kumarowego (4-hydroksycynamono-
wego). Kolejno ligaza kwasu kumarowego-
:koenzym A przekształca p-kumarynian do
odpowiedniego estru CoA aktywując go do
reakcji z malonylo-CoA. W wyniku kondensa-
cji jednej cząsteczki 4-kumaroilo-CoA i trzech
cząsteczek malonylo-CoA w obecności syn-
tazy chalkonu powstaje chalkon. W kolejnej
reakcji następuje cyklizacja chalkonu do fla-
wanonu przy udziale izomerazy chalkon-fla-
wanon. Na tym etapie główny szlak syntezy
rozgałęzia się na kilka dróg syntez, prowadzą-
cych do innych klas flawonoidów. Utlenianie
przebiega w obecności hydroksyhydrolazy, a
następnie kolejno biorą udział dwa enzymy: 3’-hydroksyla-
za flawonoidowa oraz 3’,5’-hydroksylaza. Kolejnym etapem
jest redukcja przy udziale reduktazy dihydroflawonolu-4 do
leukocyjanidyny, utlenianej przez syntazę antocyjanidynową
(dioksygenazę leukocyjanidynową) do antocyjanidyn. Do tej
grupy związków należą antocyjanidyny (cyjanidyny), leuko-
antocyjanidyny i katechiny [14,15].
Ogromna różnorodność flawonoidów, obecnie znanych
jest ponad 5000 związków (niektórzy podają nawet 8000),
wynika z faktu, że atomy węgla w pierścieniu chromanu
(heterocyklicznym) lub benzenowym mogą ulegać reakcjom
podstawienia (hydroksylacji lub metoksylacji). Natomiast
wolne grupy hydroksylowe mogą być poddane glikozylacji
(tworząc glikozydy), a także acylacji [16-18]. Dotychczas po-
znane pochodne występujące w przyrodzie różnią się mię-
dzy sobą: liczbą i pozycją grup hydroksylowych w obu pier-
ścieniach, różnym stopniem utlenienia atomu węgla w po-
zycji dwa (najczęściej) pierścienia heterocyklicznego, typem
wiązania glikozydowego (O-glikozydowe, C-glikozydowe)
z cukrami prostymi lub złożonymi, kwasami cukrowymi i
innymi kwasami organicznymi (np. octowy, malonowy, fe-
rulowy, galusowy i in.). W większości naturalnych flawono-
idów pierścień heterocykliczny występuje prawie zawsze z
grupami hydroksylowymi lub rzadziej z grupami metoksy-
lowymi w pozycji 3, 5 i 7, a w pierścieniu benzenowym pod-
stawniki te lokują się w pozycjach 3’,4’, czasem 5’,6’. Flawo-
noidy mogą ulegać kondensacji tworząc oligomery (dimery,
trimery, tetramery, pentamery) lub polimery złożone z 14-15
cząsteczek monomerów (taniny). W roślinach flawonoidy
występują najczęściej w postaci glikozydów: ramnozydów,
glukoramnozydów, galaktozydów i arabinozydów [19].
Rycina 1. Wzory strukturalne różnych grup flawonoidów: A. chalkon, prekursor flawonoidów; B. fla-
wan; C. flawanony; D. izoflawany; E. neoflawany; F. flawony; G. izoflawony; H. jon flawyliowy; I. neo-
flawony (nazewnictwo wg IUPAC).
Postępy Biochemii 58 (3) 2012
237
Reszta cukrowa przyłączona jest do aglikonu poprzez atom
tlenu (wiązanie O-glikozydowe) w pozycji C3, jeśli go nie ma
przy tym atomie węgla, wówczas w pozycji C7, rzadziej w
pozycjach C5, C3’, C4’, czy C5’. Sporadycznie powstają wią-
zania C-glikozydowe w pozycji C8, np. witeksyna, (8-C-glu-
kozyd apigeniny) i orientyna. Znane są również pochodne
C-glikozydowe z resztami cukrowymi w pozycjach C2 i C6.
Stwierdzono, in vitro, że zablokowanie przez resztę cukrową
grup hydroksylowych w glikozydach wpływa na ich słabsze
właściwości przeciwutleniające w porównaniu do odpowied-
nich aglikonów [19]. O właściwościach przeciwutleniających
flawonoidów decyduje obecność grup hydroksylowych w
obu pierścieniach, izomeria ich położenia oraz obecność po-
dwójnego wiązania i grupy karbonylowej w pierścieniu he-
terocyklicznym. Silniejszy potencjał przeciwutleniający wy-
kazują flawonoidy posiadające większą liczbę grup hydrok-
sylowych oraz położenie ich w pozycji para. Stwierdzono
ponadto, że różnice we właściwościach przeciwutleniających
zależą również od rodzaju reszty sacharydowej obecnej w
cząsteczce. Zaobserwowano, że glikozylacja grupy hydrok-
sylowej przy węglu w pozycji trzy cząsteczką monosachary-
du nie obniża zdolności przeciwutleniających flawonoidów
in vivo, natomiast aktywność przeciwutleniająca jest istotnie
niższa w przypadku glikozylacji resztą disacharydową [19].
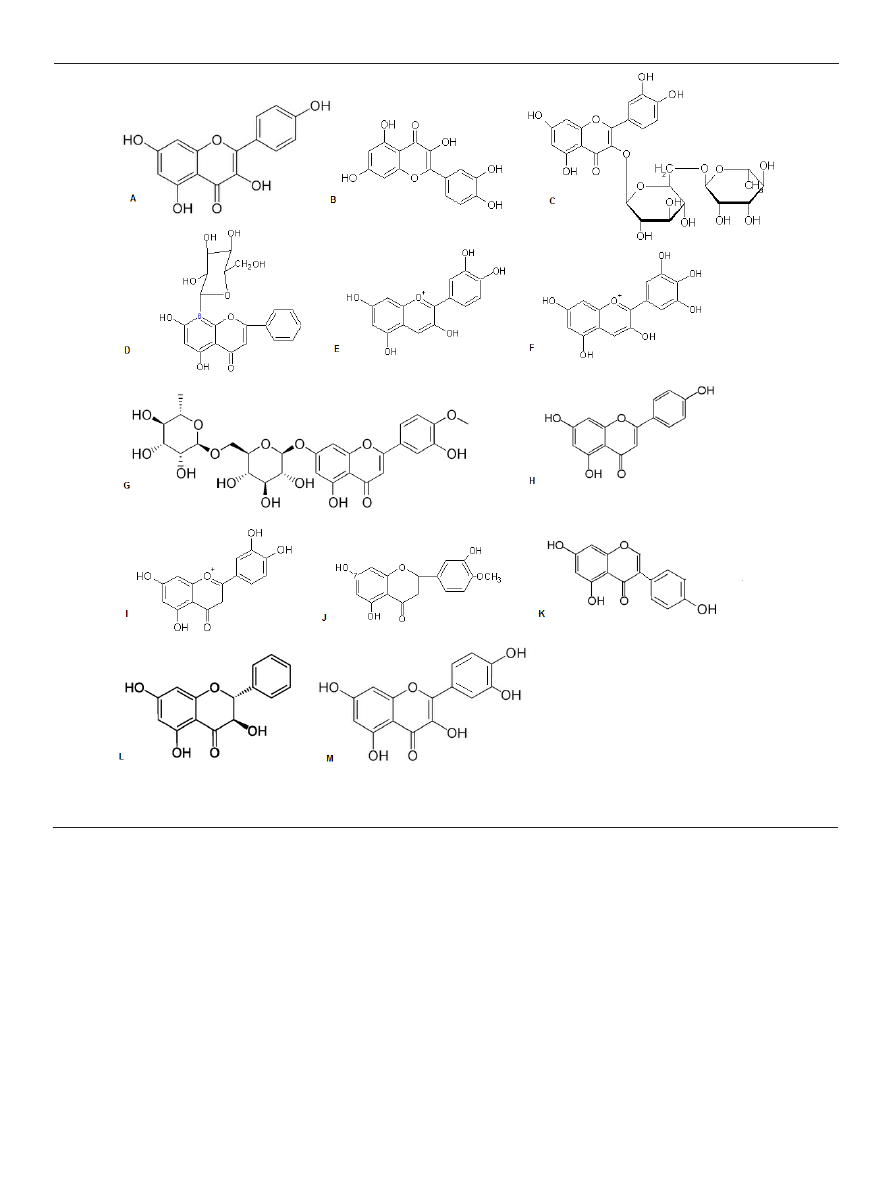
Badacze wyróżniają następujące klasy powszechnie wy-
stępujących flawonoidów [20] (Ryc. 2):
— flawan-3-ole (pochodne 3-hydroksy-2-fenylochroman-
-4-onu): (+) katechina, gallokatechina, (-) epikatechina, (-)
epigallokatechina oraz estry kwasu galusowego, np. 3-galu-
san epigallokatechiny; wykazują właściwości przeciwutle-
Rycina 2. Wzory chemiczne: A. kemferol; B. kwercetyna; C. rutyna; D. witeksyna; E. cyjanidyna; F. delfinidyna; G. diosmina; H. apigenina; I. hesperedyna; J. hesperetyna;
K. genisteina; L. pinobanksyna; M. taksyfolina.

238
www.postepybiochemii.pl
niające i ochronne przed utlenianiem cząstek LDL, a także
w ochronie szpiku przed promieniowaniem jonizującym
[21,22];
— flawonole (pochodne 3-hydroksy-2-fenylochromen-
-4-onu): kwercetyna, kemferol, mirycetyna, fisetyna, mo-
ryna oraz glikozydy, np. izokwercetyna, rutyna, kemfery-
tryna, mirycetyna. Podobnie jak inne flawonoidy, katechiny
posiadają właściwości przeciwutleniające, przeciwmiaż-
dżycowe, przeciwnowotworowe oraz chronią skórę przed
promieniowaniem UV [4,5,23];
— antocyjany (kationy 2-fenylochromenyliowe) są solami
oksoniowymi (kationowymi pochodnymi flawyliowymi):
cyjanidyna, pelargonidyna, delfinidyna, malwidyna, peoni-
dyna; posiadają właściwości przeciwutleniające, przeciwno-
wotworowe, przeciwzapalne, przeciwobrzękowe. Hamują
procesy starzenia, stany zapalne [24,25]. Ich właściwości
przeciwutleniające związane są m.in. z efektywnym hamo-
waniem enzymatycznej i nieenzymatycznej peroksydacji
lipidów w porównaniu z klasycznymi przeciwutleniacza-
mi, m.in. z α-tokoferolem [26]. W roślinach pełnią rolę filtru
ochronnego przed promieniowaniem słonecznym (również
UV). Hamują agregację płytek krwi, przeciwdziałają utle-
nianiu lipoprotein o małej gęstości (LDL). Z cukrami tworzą
odpowiednie 3-glikozydy;
— flawony (2-fenylochromen-2-on-4 lub 2- fenylochromen-
-4-on): apigenina, tangeretyna, bajkaleina, wogonina, lute-
olina; wpływają na przepływ wieńcowy w mięśniu serco-
wym, przeciwzapalnie, przeciwalergicznie. Tonizują pracę
serca, obniżają podwyższone ciśnienie krwi. Przedłużają i
wzmagają działanie witaminy C. Uszczelniają i wzmacniają
naczynia krwionośne;
— flawanony (2-fenylochroman-4-on lub 2,3-dihydro-2-fe-
nylochromen-4-on): naringenina, naringina, hesperetyna,
hesperydyna, narirutyna, taksyfolina, poncyryna, rutyna;
nadają gorzki smak owocom, są obecne w grejpfrutach, ale
np. niewielkie stężenia naringeniny wykryto również w po-
midorach. Działają estrogennie, przeciwzapalnie i obniżają
poziom cholesterolu [27-29];
— izoflawony (3-fenylochromen-2-on-4 lub 3-fenylochro-
men-4-on): daidzeina, genisteina, glicyteina, biochanina A;
działają estrogennie, hamują wzrost komórek raka piersi
(zarówno estrogenozależnych, jak i estrogenoniezależnych),
chronią rośliny przed atakiem grzybów [30,31]. Wpływają
hamująco na rozwój raka gruczołu mlekowego, osteopo-
rozę oraz choroby układu krążenia; wykazują zdolność do
wiązania się z receptorami estrogenowymi α i β (ERα i β)
[32];
— neoflawonoidy (4-fenylokumaryna lub 4-fenylochro-
men-2-on): dalbergina, dalbergichromen, niwetyna.
WŁAŚCIWOŚCI FIZYKOCHEMICZNE
Flawonoidy są najczęściej substancjami stałymi o barwie
żółtej lub bezbarwnymi, wyjątkiem są wielobarwne anto-
cyjanidyny. W formie glikozydów są często rozpuszczalne
w wodzie i etanolu, natomiast nierozpuszczalne w eterze,
chloroformie i benzenie. Aglikony zaś są prawie nieroz-
puszczalne w wodzie, z wyjątkiem katechin i antocyjani-
dyn, rozpuszczają się natomiast w rozpuszczalnikach orga-
nicznych. Hydroliza kwaśna glikozydów flawonoidowych
prowadzi do otrzymania aglikonu i części cukrowej, jest
ona stosowana w badaniach tych związków. Do identyfika-
cji poszczególnych flawonoidów wykorzystuje się spektro-
skopię w nadfiolecie i świetle widzialnym, spektroskopię w
podczerwieni oraz radiospektroskopię (spektroskopię ma-
gnetycznego rezonansu jądrowego) [15].
Obecność dodatkowych grup np. nitrowej w pierścieniu
aromatycznym podnosi toksyczność flawonoidów. Z kolei
dodatkowa grupa karbonylowa zwiększa rozpuszczalność
związków w wodzie, co ułatwia wydalanie z moczem, a także
ułatwia ich metabolizm [33]. Nitrofenole podstawione w pozy-
cji para-, wywołują efekty cyto- i embriotoksyczne, kancero- i
mutagenne [34]. Podstawienie drugiej grupy hydroksylowej w
położeniu orto- lub para- [35] oraz grupy metoksylowej, sulfo-
nowej i acetylowej zmniejsza toksyczność fenoli [33].
WŁAŚCIWOŚCI PRZECIWUTLENIAJĄCE
Podczas oddziaływania różnych drobnoustrojów na orga-
nizm oraz podczas rozwoju zakażenia dochodzi do aktywacji
fagocytów przez lipopolisacharyd (LPS), konsekwencją jest
wybuch tlenowy prowadzący do wytwarzania dużych ilości
reaktywnych form tlenu takich jak, anionorodnik ponadtlen-
kowy, nadtlenek wodoru, tlenek azotu oraz kwas chlorowy
(I) (podchlorawy), które podczas dalszych przemian stano-
wią źródło innych RFT, np. nadtlenoazotynu. Mechanizm
właściwości przeciwutleniających flawonoidów jest złożony.
Z jednej strony wpływ ma obecność w cząsteczce znacznej
liczby grup hydroksylowych (głównie w pozycjach C3, C5,
C7, C3’, C4’), z drugiej strony wiązania podwójnego w po-
zycji C2, a także grupy karbonylowej w pozycji C4. Choć
nie wszystkie flawonoidy posiadają wiązanie podwójne
oraz grupę karbonylową, to również wykazują właściwości
przeciwutleniające. Potencjał przeciwutleniający zależy od
liczby i położenia grup hydroksylowych w pierścieniu hete-
rocyklicznym i aromatycznym [34]. Spośród obecnych w czą-
steczce grup hydroksylowych szczególnie istotna jest obec-
ność dwóch grup w pierścieniu benzenowym (B) w pozycji
orto- [17,36]. Hydroksylacja pierścienia heterocyklicznego w
pozycjach 5 i 7 może podwyższać właściwości przeciwutle-
niające flawonoidów, co na przykład ma miejsce w kwercety-
nie mającej grupy hydroksylowe w tych pozycjach w stosun-
ku do flawonoidów, które posiadają tylko jedną taką grupę,
np. fisetyna, daidzeina [37,38].
Elementy struktury flawonoidów decydujące o ich wyso-
kiej aktywności przeciwutleniającej, zgodnie z postulatami
Borsa, są następujące:
— obecność ugrupowania katecholowego w pierścieniu
benzenowym (B) w połączeniu z grupą hydroksylową w
położeniu C3 sprzyja właściwościom przeciwutleniającym.
W przypadku braku grupy hydroksylowej w pozycji C3
rolę tę przejmują grupy hydroksylowe w pierścieniu ben-
zenowym (C3’, C4’) uaktywnione (wzrost gęstości elektro-
nowej) przez grupy hydroksylowe w pierścieniu heterocy-
klicznym (C5 i C7);

Postępy Biochemii 58 (3) 2012
239
— ugrupowanie pirogalolowe (trihydroksylowe) w pier-
ścieniu benzenowym (B) nadaje cząsteczce wyższą aktyw-
ność przeciwutleniającą niż katecholowe;
— podwójne wiązanie pomiędzy węglem C2 i C3 przyczy-
nia się do wzrostu zdolności wychwytywania rodników,
ponieważ po reakcji powstają bardziej trwałe rodniki fenok-
sylowe niż w przypadku kiedy nie ma wiązania podwójne-
go;
— grupa karbonylowa w połączeniu z podwójnym wiąza-
niem pomiędzy atomami węgla (C2 i C3 w pierścieniu hete-
rocyklicznym), wzbogaca pierścień piranu w kolejne wiąza-
nie podwójne sprzężone i prowadzi do wyższej efektywno-
ści flawonoidu w zdolności do wychwytywania rodników
dzięki delokalizacji elektronów w tym pierścieniu;
— grupy hydroksylowe w pozycjach C5 i C7 pierścienia
heterocyklicznego mogą nasilać właściwości przeciwutle-
niające cząsteczki flawonoidu, szczególnie w przypadku
obecności grupy w położeniu C4’ w pierścieniu benzeno-
wym [39].
Ponadto wykazano, że flawonoidy zawierające w czą-
steczce ugrupowanie pirogalolowe (np. epigallokatechina)
charakteryzuje wyższa aktywność przeciwutleniająca w po-
równaniu ze związkami z ugrupowaniem katecholowym
(np. epikatechina) w warunkach niskiego pH. Obecność resz-
ty kwasu galusowego w cząsteczce katechiny (np. galusan
epikatechiny w porównaniu do epikatechiny) wpływa na
podwyższenie aktywności przeciwutleniającej flawonoidu
[40].
Stwierdzono, że flawonoidy charakteryzują się następu-
jącymi właściwościami przeciwutleniającymi:
— hamują powstawanie RFT [38,41,42] poprzez obniżenie
aktywności oksydazy ksantynowej, enzymu katalizującego
powstawanie anionorodnika ponadtlenkowego [43]. Obni-
żają także aktywność błonowej oksydazy NADPH [44,45]
oraz mieloperoksydazy, enzymu katalizującego wytwarza-
nie anionu chloranu (I) (podchlorynowego);
— chelatują jony metali przejściowych, głównie miedzi i
żelaza, będące katalizatorami reakcji Fentona i/lub Habera-
-Weissa prowadzących do powstania rodnika hydroksylo-
wego [46,47];
— zmiatają anionorodniki ponadtlenkowe, rodniki wodo-
ronadtlenkowe, hydroksylowe, lipoksylowe, nadtlenkowe
oraz wygaszają tlen singletowy [41];
— przerywają kaskady reakcji wolnorodnikowych prowa-
dzących do peroksydacji lipidów w licznych komórkach i
organellach komórkowych, w mitochondriach, mikroso-
mach [18];
— wpływają na utrzymanie askorbinianu w cytosolu oraz
tokoferolu w błonach biologicznych poprzez redukcję od-
powiednich rodników: askorbylowego i tokoferyloksylo-
wego [48];
— przyczyniają się do wzrostu aktywności enzymów prze-
ciwutleniających: dysmutazy ponadtlenkowej, peroksyda-
zy glutationowej i katalazy [38,49] oraz regeneracji utlenio-
nych form przeciwutleniaczy o małej masie cząsteczkowej:
askorbinianu, α-tokoferolu, β-karotenu i innych [38];
— hamują enzymy związane z enzymatycznym utlenia-
niem lipidów, fosfolipazę A
2
, cyklooksygenazę oraz lipook-
sygenazę;
— stabilizują błony biologiczne na skutek obniżania ich
płynności [50], hamują utlenianie α-tokoferolu w komór-
kach oraz regenerują utlenioną jego formę;
— zmiatają tlenek azotu oraz nadtlenozaotyn [51].
Właściwości przeciwutleniające flawonoidów potwier-
dzono in vivo [52,53]. Stwierdzono wpływ na zniwelowanie
stresu oksydacyjnego wywołanego dużym wysiłkiem fizycz-
nym. Flawonoidy podawane ochotnikom zmniejszały po-
ziom TBARS i kinazy kreatynowej w porównaniu do osób
poddanych wysiłkowi bez podawania flawonoidów [54].
Wykazano też pozytywny wpływ epikatechiny w związku z
rozwojem chorób serca. W indukowanej miażdżycy u szczu-
rów, kakao podawane w równoważnej dawce w stosunku
do człowieka (dwóch ciemnych czekolad dziennie) znacząco
hamowało rozwój miażdżycy, obniżało poziom cholesterolu
i chroniło lipoproteiny o małej gęstości przed utlenieniem
[55]. Flawonoidy zawarte w fasoli „mung” obniżały istotnie
poziom MDA, aktywność dehydrogenazy mleczanowej oraz
syntezę syntazy tlenku azotu w warunkach stresu cieplnego
[56]. Stwierdzono, że spożywanie flawonoidów wraz z dietą
przyczynia się do wzrostu zdolności pojemności przeciwu-
tleniającej organizmu. Przejawia się to przede wszystkim
wyższą aktywnością enzymów (dysmutazy ponadtlenkowej,
peroksydazy glutationowej i katalazy), obserwowaną głów-
nie w wątrobie, jelicie cienkim i płucach [38,57,58]. Ponadto
flawonoidy zwiększają wchłanianie askorbinianu z przewo-
du pokarmowego, a także stabilizują jego cząsteczkę [59].
Flawonoidy przyczyniają się do obniżenia poziomu RFT,
niwelując ich wpływ na składniki komórki, takie jak lipi-
dy, białka i kwasy nukleinowe. Stwierdzono, że flawonoidy
wykazują zdolność do hamowania peroksydacji lipidów za-
równo in vitro, jak i in vivo, w licznych komórkach i organel-
lach komórkowych, mitochondriach i mikrosomach [60,61].
Wykazano, że lokalizują się one w warstwie błonowej po-
między dwuwarstwą lipidową i fazą wodną zwiększając
jej stabilność, co czyni błony bardziej odpornymi na dzia-
łanie czynników utleniających [51,58]. Wykazują również
inny wpływ na nieenzymatyczną, jak i enzymatyczną pe-
roksydację lipidów [51,62]. Dzięki lokalizacji na powierzch-
ni dwuwarstwy lipidowej mogą one hamować utlenianie
α-tokoferolu w komórce oraz regenerować α-tokoferol
utleniony do formy rodnikowej. Stwierdzono, że 3-hydrok-
syflawony oraz izoflawony i ich pochodne znacznie silniej
hamują w komórkach peroksydację lipidów niż α-tokoferol.
Efekt przeciwutleniający flawonoidów in vitro, zależy od
wielu czynników, a generalnie od sposobu inicjacji peroksyda-
cji lipidów, rozpuszczalności poszczególnych flawonoidów w

240
www.postepybiochemii.pl
fazie lipidowej, czyli od współczynnika podziału lipid-woda.
Jeśli reakcja utleniania jest katalizowana przez jony metali, to
różne metale wykazują inne powinowactwo do odpowiednich
flawonoidów, zatem różna będzie także trwałość utworzo-
nych kompleksów. Ma to wpływ na dostępność jonów metali
jako katalizatorów reakcji wolnorodnikowych. Znaczenie ma
również użyty utleniacz, np. wodoronadtlenek t-butylowy,
wodoronadtlenek kumenu, czy 2,2’-bis(2-amidynopropan
(AAPH). Wykazano, na przykład, że kwercetyna wykazywa-
ła największą skuteczność przeciwutleniającą w indukowanej
jonami żelaza peroksydacji błon komórek mózgu (kwercetyna
> rutyna > hesperetyna), ale była już mniej skuteczna w przy-
padku peroksydacji linolenianu (rutyna > hesperetyna > kwer-
cetyna) [60]. Na właściwości przeciwutleniające flawonoidów
ma również wpływ szlak inicjacji peroksydacji, enzymatyczna
lub nieenzymatyczna [61,62]. Flawonoidy z dwoma lub trze-
ma grupami hydroksylowymi w pierścieniu benzenowym (B),
czyli kwercetyna, mirycetyna, luteolina oraz galusan epigallo-
katechiny wykazywały skuteczność w hamowaniu peroksy-
dacji lipidów indukowanej jonami żelaza w komórkach jelita
(Caco-2). Z kolei kemferol, genisteina i daidzeina nie chroniły
lipidów przed utlenianiem [63].
Flawonoidy przyczyniają się również do obniżenia ak-
tywności enzymów (fosfolipazy A
2
, cyklooksygenazy, li-
pooksygenazy), biorących udział w enzymatycznej perok-
sydacji błonowych fosfolipidów [38]. Proces peroksydacji
zaczyna się od fosfolipazy A
2
(PLA
2
), która katalizuje hy-
drolizę fosfolipidów z uwolnieniem kwasu arachidonowe-
go. Uwolniony kwas arachidonowy ulega dalszym prze-
mianom na drodze reakcji katalizowanych przez cyklook-
sygenazy i lipooksygenazy. Stwierdzono, że flawonoidy
wykazują zdolność obniżania aktywności enzymów obu
tych grup [64,65] i, że wiele spośród badanych flawonoidów
wykazuje wysoką selektywność względem lipooksygenz
lub cyklooksygenaz, a niektóre z nich modyfikują aktyw-
ność tych enzymów w stopniu zbliżonym [38].
Flawonoidy, podobnie jak inne przeciwutleniacze mogą w
pewnych warunkach wykazywać efekt proutleniający. Do-
tyczy to zwłaszcza wysokich stężeń niefizjologicznych. Na
przykład flawonoidy mające ugrupowanie pirogalolowe lub
katecholowe, w obecności jonów miedzi (II) ulegają autoutle-
nieniu, co w konsekwencji prowadzi do wytworzenia rodni-
ka semichinonowego (semichinonu). Powstały jon miedzi (I)
redukuje tlen cząsteczkowy do anionorodnika ponadtlenko-
wego, którego dysmutacja prowadzi do nadtleneku wodoru
[66,67]. Jon Cu (I) jest również katalizatorem reakcji typu Fen-
tona/Habera-Weissa. Utleniona forma flawonoidu w postaci
semichinonu lub benzochinonu, ulega nieenzymatycznej re-
dukcji z udziałem NADH i w konsekwencji, rozpoczyna cykl
reakcji redoks, w wyniku którego wytwarzane są duże ilości
reaktywnych form tlenu [65]. Semichinony reagują z tlenem
cząsteczkowym generując anionorodniki ponadtlenkowe i w
konsekwencji nadtlenek wodoru. Wytwarzanie H
2
O
2
stwier-
dzono w przypadku flawonoidów z resztą pirogalolową (baj-
kaleina) oraz galusanu epigallokatechiny [67-69]. Wspomnia-
na kwercetyna oraz hesperetyna, naringenina oraz moryna
wykazywały właściwości proutleniające w limfocytach [70].
Flawonoidy można zaliczyć do inhibitorów topoizome-
razy II; wykazano ich wpływ na rozwój białaczek niemow-
lęcych przez działanie hamujące na topoizomerazę II, które
powoduje wzrost ilości uszkodzeń w rejonie BCR (ang. Bre-
akpoint Cluster Region) genu MLL. Translokacje chromoso-
mowe w obrębie tego genu występują w około 80% biała-
czek dziecięcych ALL (ang. Acute Lymphoid Leukaemia) i w
65% AML (ang. Acute Myeloid Leukaemia). Dodatkową cechą,
wskazującą na rolę flawonoidów przy powstawaniu biała-
czek dziecięcych, jest ich zdolność do przenikania przez
barierę łożyska, bowiem obecność związków flawonowych
stwierdza się w tkankach płodowych [71]. Ostatnio opubli-
kowano prace wykazujące związek pomiędzy właściwo-
ściami redoks flawonoidów a ich działaniem na topoizome-
razy. Wykazano, że 3-galusan epigallokatechiny i myrycety-
na powodowały powstawanie kompleksów topoizomerazy
I i II z DNA w komórkach. Możliwy mechanizm działania
polega na wytwarzaniu H
2
O
2
przez flawonoidy posiadające
w cząsteczce ugrupowanie pirogalolowe i indukcji apopto-
zy przez tą RFT, w wyniku czego dochodzi do formowania
apoptotycznych kompleksów topoizomeraza-DNA [72].
Flawonoidy mogą chronić lipoproteiny o małej gęstości
(LDL) przed utlenianiem [73,74] oraz prowadzić do wzro-
stu stężenia lipoprotein o dużej gęstości (HDL) [75]. Znane
i udokumentowane jest działanie ochronne takich flawono-
idów jak, hiperozyd i witeksyna na mięsień sercowy [76,77]
oraz ich działanie ochronne w stosunku do witaminy C i
innych związków łatwo ulegających utlenianiu, a będących
ważnymi przeciwutleniaczami. Flawonoidy wpływają na
ośrodkowy i obwodowy układ nerwowy, działanie to wy-
nika z powinowactwa do receptorów benzodiazepinowych
GABA i aktywowania tych receptorów [78,79]. Inne badania
wykazały, że szkodliwe działanie enzymu, syntazy tlenku
azotu wpływające na niedokrwienie mózgu jest hamowane
przez flawonoidy z grupy flawan-3-oli [80].
DZIAŁANIE PRZECIWNOWOTWOROWE
Działanie przeciwnowotworowe flawonoidów jest moż-
liwe nie tylko dzięki ich właściwościom przeciwutleniają-
cym, ale również dzięki innym mechanizmom związanym
z indukcją apoptozy, obniżeniem aktywności białkowej
kinazy tyrozynowej, działaniem hamującym prolifererację
komórek, angiogenezę i metastazę. Flawonoidy modelują
również aktywność enzymów związanych z przekazywa-
niem sygnału przez błonę komórkową, mają też związek z
transformacją komórek i wzrostem guzów.
Flawonoidy mają wpływ na aktywność enzymów I i II
fazy biotransformacji endo- i egzogennych związków, czy
blokowanie replikacji DNA przez hamowanie aktywności
enzymów biorących udział w tym procesie (np. polimerazy II
DNA, topoizomerazy I i II). Kwercetyna i kemferol są inhibi-
torami polimerazy II DNA. Luteolina hamuje aktywność topo-
izomerazy I [81]. Flawonoidy przez blokowanie cyklu komór-
kowego (fazy G1/S lub G2/M) mogą hamować proliferację
oraz indukować apoptozę komórek nowotworowych. Jest to
możliwe, ponieważ związki te wykazują wpływ na aktywność
białek odpowiedzialnych za regulację cyklu komórkowego
(np. cykliny), białek pro- i antyapoptotycznych (np. p21, p53,
czy Bcl-2) oraz enzymów odpowiedzialnych za biotransfor-
mację mutagenów i kancerogenów [82]. Na uwagę zasługuje
zdolność flawonoidów do modulowania aktywności enzy-

Postępy Biochemii 58 (3) 2012
241
mów odpowiedzialnych za metabolizm ksenobiotyków. Jeśli
chodzi o enzymy I fazy biotransformacji, flawonoidy mogą
zarówno aktywować, jak i hamować aktywność różnych
izoform cytochromu P-450 (np. genisteina) [50]. Są one także
odpowiedzialne za pobudzenie aktywności enzymów II fazy.
Zaobserwowano, że działanie niektórych flawonoidów, np.
tangeretyny podwyższa aktywność transferazy glutationowej
oraz UDP-glukuronowej [82-84]. Wykazano, że kwercetyna,
fisetyna, mirycetyna, kemferol, chryzyna, kurkumina, geniste-
ina, apigenina i kwas elagowy hamują aktywność formy P sul-
fotransferazy fenolowej (PST), która pośredniczy w reakcjach
sulfonowania, będących jednym z etapów aktywacji takich
substancji kancerogennych, jak aromatyczne węglowodory
hydroksymetylopolicykliczne, alkohole allilowe i benzylowe,
N-hydroksyaryloaminy [85]. Wykazano również, że ekstrakty
z zielonej i czarnej herbaty, zawierające znaczne ilości katechin,
silnie podwyższają aktywność S-transferazy glutationowej,
oksydoreduktazy NAD(P)H:chinon i UDP-glukuronylotrans-
ferazy [83,86]. Enzymy te uczestniczą w detoksykacji przy-
spieszając usuwanie z organizmu substancji kancerogennych.
Aktywność proutleniająca flawonoidów może prowadzić do
utworzenia reaktywnych metabolitów chinonowych, których
obecność wpływa na aktywację ekspresji genów enzymów II
fazy detoksykacji zależną od EpRE [87,88]. W ten sposób reak-
tywne metabolity flawonoidów mogą wywoływać pozytyw-
ny efekt w postaci indukcji ważnych enzymów
detoksykacji
organizmu [89]. Obniżenie aktywności cytochromu P-450, a
także indukcja enzymów fazy II, wpływa na przyspieszenie
usuwania związków prokancerogennych, lecz jednocześnie
powoduje nasilenie metabolizmu wielu związków o działaniu
terapeutycznym.
Wykazano, że flawan-3-ole mają wpływ na przekaźnic-
two sygnałów w komórkach, na przykład hamują aktywność
czynnika transkrypcyjnego NF-kB [90]. 3-galusan epigallo-
katechiny oprócz bezpośredniego wpływu na enzymy bio-
rące udział w procesie nowotworzenia, jest zdolny do mo-
dyfikowania metabolizmu komórkowego przez obniżenie
aktywności czynników AP-1 i NF-κB, pod których kontrolą
znajduje się wiele genów regulujących proliferację, apoptozę
oraz angiogenezę. Hamujące działanie flawonoidów na AP-1
i NF-κB wynika nie tylko z ich właściwości przeciwutlenia-
jących, ale również zdolności do hamowania aktywności ki-
naz, które odpowiedzialne są za aktywację czynnika NF-κB
poprzez jego fosforylację i odłączenie od inhibitora (I-κB);
hamowania aktywności kinaz MAP, które aktywują czynnik
AP-1 [40,91]. Sugeruje się, że flawonoidy wiążą się z centrum
aktywnym tych enzymów, konkurując z ATP.
Flawonoidy mają wpływ na trzy główne kinazy białko-
we: PKC, EGFR oraz FAK, które odgrywają ważną rolę w
biologii nowotworów. Wykazują wpływ na wzrost komó-
rek nowotworowych, co jest związane z aktywnością kina-
zy białkowej zaangażowanej w regulację proliferacji oraz
apoptozy [92,93]. Przeprowadzone badania wykazały, że
kwercetyna jest najbardziej skutecznym inhibitorem kinazy
PKC [94]. Flawonoid ten obniżał aktywność procesu fos-
forylacji wirusa Rous sarcoma in vivo i in vitro [95]. Z kolei
genisteina hamowała wzrost i różnicowanie komórek HL-
60 człowieka oraz obniżała aktywność kinazy tyrozynowej
EGFR w komórkach A431 [96]. Przypuszcza się, że geni-
steina może być odpowiedzialna za kontrolę cyklu komór-
kowego w liniach komórkowych raka sutka oraz prostaty
[97-99].
Aktywność białkowej kinazy C, katalizującej fosforylację
reszty seryny oraz reszty treoniny, uczestniczącej w powsta-
waniu stanów zapalnych oraz nowotworowych, jest in vitro
obniżana przez flawonoidy, np. kwercetynę w stężeniach
rzędu 50 mM, które są trudne do osiągnięcia in vivo [100].
Jednak niektóre flawonoidy obniżają aktywność enzymów,
nie wykorzystując mechanizmu kompetycyjnego, jak ma
to miejsce podczas hamowania aktywności kinaz histono-
wych [101]. Również aktywność kinaz tyrozynowych (PTK)
jest hamowana przez flawonoidy, szczególnie genisteinę i
kwercetynę [36]. Stwierdzono, że najsilniej aktywność fos-
forylaz hamuje kwercetyna i fisetyna, podczas gdy hespe-
retyna, będąca flawanonem, stymuluje ich aktywność [36].
Zgromadzone dotychczas dane dotyczące przeciwnowo-
tworowego działania flawonoidów nie są jednoznaczne. Do-
kładny mechanizm ich przeciwnowotworowego działania
poznano głównie w układach doświadczalnych in vitro, jak
również in vivo i tylko dla kilku flawonoidów, np. genisteiny
i daidzeiny, w mniejszym stopniu kwercetyny, czy luteoliny.
Wykazano między innymi, że genisteina i daidzeina dostar-
czane w diecie są zdolne do blokowania wzrostu i podziału
komórek zależnego od receptorów EGF oraz do hamowania
angiogenezy. Hamowanie aktywności kinaz tyrozynowych
przez te związki zaburza przekazywanie sygnału między ko-
mórkami i w konsekwencji prowadzi do zaburzenia wzrostu
i podziału komórek, co ma istotne znaczenie w ograniczaniu
namnażania się komórek nowotworowych. Izoflawony mogą
również hamować syntezę aromatazy i jednocześnie pobu-
dzać syntezę globuliny wiążącej hormony płciowe (SHBG).
Takie działanie prowadzi do hamowania wytwarzania an-
drogenów, estrogenów endogennych, a tym samym zahamo-
wania wzrostu nowotworów zależnych od hormonów [102].
Ciekawych wyników dostarczyły badania zastosowania
flawonoidów w chemioterapii nowotworów. Stwierdzono,
że w liniach komórek nowotworowych opornych na dzia-
łanie chemioterapeutyków flawonoidy mogą powodować
wzrost stężenia niektórych z zastosowanych cytostatyków.
Kwercetyna, in vitro zwiększała stężenie doksorubicyny w
komórkach raka piersi, a genisteina cisplatyny. Natomiast
in vivo kwercetyna podwyższała przeciwnowotworowe
działanie cisplatyny i busulfanu, ale nie wpływała na ak-
tywność doksorubicyny i etopozydu [103]. W badaniach in
vitro wykazano również, że apigenina i fisetyna powodo-
wały znaczące podwyższenie stężenia doksorubicyny w ko-
mórkach nowotworowych z nadprodukcją glikoproteiny P
(Pgp) opornych na ten lek, poprzez hamowanie aktywności
Pgp [104]. Jest to korzystny wynik, ponieważ Pgp, podczas
chemioterapii, usuwa cytostatyki z komórek nowotworo-
wych wywołując zjawisko oporności wielolekowej.
Dotychczas opublikowane prace o aktywności biologicz-
nej flawonoidów w stosunku do komórek nowotworowych
są obiecujące i coraz bliższe jest zastosowanie tych związ-
ków w terapii nowotworów. Podjęto już próby wprowadze-
nia niektórych z nich, np. kwercetyny, 3-galusanu katechi-
ny i flawopirydolu do zastosowania klinicznego [103,105].
Efekt przeciwnowotworowego działania flawonoidów za-

242
www.postepybiochemii.pl
leży również od ich dawek oraz częstotliwości podawania.
W przeciwieństwie do danych wskazujących na działanie
przeciwnowotworowe istnieją doniesienia, że flawonoidy
użyte w wysokich stężeniach mogą wpływać na nasilenie
procesów nowotworowych. Wykazano, że może wtedy do-
chodzić do mutacji genowych, aberracji chromosomalnych i
wymiany siostrzanych chromatyd [106].
PODSUMOWANIE
Obecność flawonoidów w diecie, a zwłaszcza zachowa-
nie odpowiednich proporcji w ich spożyciu jest bardzo waż-
nym elementem w profilaktyce powstawania wielu chorób
o etiopatologii wolnorodnikowej, m.in. miażdżycy i cukrzy-
cy, będących główną przyczyną choroby niedokrwiennej
serca, udaru mózgu, chorób naczyń obwodowych, a także
chorób degeneracyjnych i nowotworowych. Szeroki zakres
działania flawonoidów stwarza nadzieję na ich zastosowa-
nie z lekami przeciwnowotworowymi (np.: antracyklinami
i taksanami) w celu wyeliminowania/złagodzenia efektów
ubocznych leków takich jak, kardiotoksyczność, neurotok-
syczność, nefrotoksyczność oraz hepatotoksyczność.
PIŚMIENNICTWO
1. Timberlake CF, Henry BS (1986) Plant pigments as natural foods col-
ors. Endeavour 10: 31-36
2. Ding EL, Hutfless SM, Xin Ding (2006) Chocolate and prevention of
cardiovascular disease: a systematic review. Nutr Metab 3: 1-12
3. Heber D (2008) Food and phytochemicals in human health. Handbook
of Nutrition and Food, Second Edition
4. Chyu KY, Babbidge SM, Zhao X, Dandillaya R, Rietveld AG, Yano J,
Dimayuga P, Cercek B (2004) Different effect of green tea-derived cate-
chin on developing versus established atherosclerosis in apolipoprote-
in E-null mice. Circulation 109: 2448-2453
5. Mittal A, Pate MS, Wylie RC, Tollefsbol TO, Katiyar SK (2004) EGCG
down-regulates telomerase in human breast carcinoma MCF-7 cells,
leading to suppression of cell viability and induction of apoptosis. Int
J Oncol 24: 703-710
6. Smith DA, Banks SW (1988) Formation and biological properties of
isoflavonoid phytoalexins in plant flavonoids in biology and medi-
cine: biochemical, cellular and medicinal properties. Alan R Liss Inc,
New York, 113-119
7. Schmitt-Schillig S, Schaffer S, Weber CC, Eckert GP, Müller WE (2005)
Flavonoids and the aging brain. J Physiol 1: 23-36
8. Spencer J (2008) Food for thought: the role of dietary flavonoids in en-
hancing human memory, learning and neuro-cognitive performance.
Proc Nutr Soc 67: 238-257
9. Letenneur L, Proust-Lima C, Le Gouge A, Dartigues JF, Barberger-Ga-
teau P (2007) Flavonoid intake and cognitive decline over a 10-year
period. Am J Epidem 165: 1364-1371
10. Zhao B (2005) Natural antioxidants for neurogenerative diseases. Mo-
lec Microbiol 31: 283-293
11. Seeram NP, Adams LS, Zhang Y, Lee R, Sand D, Scheuller HS, Heber
D (2006) Blackberry, black raspberry, blueberry, cranberry, red rasp-
berry, and strawberry extracts inhibit growth and stimulate apoptosis
of human cancer cells in vitro. J Agric Food Chem 54: 9329-9339
12. Huxley RR, Neil HA (2003) The relation between dietary flavonol in-
take and coronary heart disease mortality: a meta-analysis of prospec-
tive cohort studies. Eur J Clin Nutr 57: 904-908
13. Rimm EB, Katan MB, Ascherio A (1996) Relation between intake of
flavonoids and risk for coronary heart disease in male health profes-
sionals. Ann Intern Med 125: 384-389
14. Geissmann TA (1962) The chemistry of flavonoid compounds. Per-
gamon Press, Oxford
15. Kohlmünzer S (1998) Farmakognozja, PZWL, Warszawa
16. Mc Michael-Phillips DF, Harding C, Morton M, Roberts SA, Howell A,
Potten CHS, Bunder NJ (1998) Effects of soy-protein supplementation
on epithelial proliferation in the histologically normal human breast.
Am J Clin Nutr 68: 1431-1436
17. Ratty AK, Das NP (1988) Effects of flavonoids on nonenzymatic lipid
peroxidation: strucuture–activity relationship. Biochem Med Metab
Biol 39: 69-79
18. Simon Al, Renouf M, Hendrich S, Murphy P (2005) Human gut mi-
crobial degradation of flavonoids: structure-function relationships. J
Agric Food Chem 53: 4258-4263
19. de Groot H, Rauen U (1998) Tissue injury by reactive oxygen species
and the protective effects of flavonoids. Fundam Clin Pharmacol 12:
249-255
20. Wilska-Jeszka J, Podsędek A (2001) Bioflavonoids as natural antioxi-
dants. Wiad Chem 55: 987-1003
21. Castillo J, Benavente-García O, Lorente J,
Alcaraz M, Redondo A, Or-
tuño A, Del Rio JA (2000) Antioxidant activity and radioprotective
effects against chromosomal damage induced in vivo by X-rays of
flavan-3-ols (Procyanidins) from grape seeds (Vitis vinifera): compara-
tive study versus other phenolic and organic compounds. J Agric Food
Chem 48: 1738-1745
22. Miura Y, Chiba T, Miura S, Tomita I, Umegaki K, Ikeda M, Tomita T
(2000) Green tea polyphenols (flavan 3-ols) prevent oxidative modifi-
cation of low density lipoproteins: an ex vivo study in humans. J Nutr
Biochem 11: 216-222
23. Katiyar S, Elmets CA, Katiyar SK (2007) Green tea and skin cancer:
photo-immunology, angiogenesis and DNA repair. J Nutr Biochem
18: 287-296
24. Korte G, Dreiseitel A, Schreier P, Oehme A, Locher S, Hajak G, Sand
PG (2009) An examination of anthocyjanins and anthocyanidins affin-
ity for cannabinoid receptors. J Med Food 12: 1407-1410
25. Stoner GD, Wang LS, Zikri N, Chen T, Hecht SS, Huang C, Sardo C,
Lechner JF (2007) Cancer prevention with freeze-dried berries and ber-
ries components. Sem Canc Biol 17: 403-410
26. Makowska-Wąs J, Janeczko Z (2004) Biodostępność polifenoli roślin-
nych. Post Fitoter 3: 126-137
27. Dahan A, Altman H (2004) Food-drug interaction: grapefruit juice
augments drug bioavailability - mechanism, extend and relevance.
Eur J Clin Nutr 58: 1-9
28. Erlund I (2002) Chemical analysis and pharmacokinetics of the flavo-
noids quercetin, hesperetin and naringenin in humans. Academic dis-
sertation. Helsinki. National Public Health Institute (KTL) A27
29. Manach C, Gil-Izquierdo A, Bouteloup-Demange C, Rémésy C (2003)
Bioavailability in humans of the flavanones hesperidin and narirutin
after the ingestion of two doses of orange juice. Eur J Clin Nutr 57:
235-242
30. Allred C, Twaddle N, Allred K, Goeppinger T, Churchwell M, Ju Y,
Helefrich W, Doerge D (2005) Soy processing affects metabolism and
disposition of dietary isoflavones in ovariectomized balb/c mice. J Ag-
ric Food Chem, 53: 8542-8550
31. Lundh T (1995) Metabolism of estrogenic isoflavones in domestic ani-
mals. Proc Soc Exp Biol Med 208: 33-39
32. Kuiper G, Lemmen J, Carlosson B, Corton J, Safe S, Van der Saag P,
van der Burg B, Gustafsson J (1998) Interaction of estrogenic chemi-
cals and phytoestrogens with estrogen receptor b. Endocrinology 139:
4252-4263
33. Dreosti IE (2000) Antioxidant polyphenols in tea, cocoa, and wine. Nu-
trition 16: 692-694
34. Glinka Ł, Ochocki J (2004) Flawonoidy i ich syntetyczne pochodne we
współczesnej medycynie schorzeń układu sercowo-naczyniowego i
moczowego. Pol J Cosmet 2: 70-80
35. Rice-Evans CA, Miller NJ, Paganga G (1996) Structure-antioxidant ac-
tivity relationships of flavonoids and phenolic acids. Free Radic Biol
Med 20: 933-956
36. Ross JA, Kasum CM (2002) Dietary flavonoids: bioavailability, meta-
bolic effects, and safety. Annu Rev Nutr 22: 19-34

Postępy Biochemii 58 (3) 2012
243
37. Feldman EB (2002) The scientific evidence for a beneficial health re-
lationship between walnuts and coronary heart disease. J Nutr 132:
1062-1101
38. Middleton E, Kandaswami C, Theoharides T (2000) The effects of plant
flavonoids on mammalian cells: implications for inflammation, heart
disease and cancer. Pharmacol Rev 52: 673-751
39. Amic D, Davidovic-Amic D, Beslo D, Rastija V, Lucic B, Trinajstic N
(2007) SAR and QSAR of the antioxidant activity of flavonoids. Curr
Med Chem 14: 827-845
40. Muzolf M, Szymusiak H, Gliszczyńska-Świgło A, Rietjens IMCM,
Tyrakowska B (2008) pH-dependent radical scavenging capacity of
Green Tea catechins. J Agric Food Chem 56: 816-823
41. Harborne JB, Williams CA (2000) Advances in flavonoid research since
1992. Phytochemistry 55: 481-504
42. Higdon JV, Frei B (2003) Tea catechins and polyphenols: health effects,
metabolism and antioxidant functions. Crit Rev Food Sci Nutr 43: 89-
143
43. Nagao A, Michiko S, Hidetaka K (1999) Inhibition of xanthine oxidase
by flavonoids. Biosci Biotechnol Biochem 63: 1787-1790
44. Aucamp J, Gaspar A, Hara Y, Apostolides Z (1997) Inhibition of xan-
tine oxidase by catechins from tea (Camelia sinensis). Anticancer Res
17: 4381-4385
45. Hodnick WF, Duval DL, Pardini RS (1994) Inhibition of mitochondrial
respiration and cyanide-stimulated generation of ROS by selective fla-
vonoids. Biochem Pharmacol 47: 573-580
46. Abu-Amsha R, Croft KD, Puddey IB, Proudfoot JM, Beilin LJ (1996)
Phenolic content of various beverages determines the extent of inhibi-
tion of human serum and LDL oxidation in vitro: identification and
mechanism of action of some cinnamic acid derivatives from red wine.
Clin Scien 91: 449-458
47. Hadi SM, Asad SF, Singh S, Ahmad A (2000): Putative mechanism for
anticancer and apoptosis-inducing properties of plant-derived poly-
phenolic compounds. IUBMB Life 50: 167-171
48. Hughes RE, Wilson HK (1977) Flavonoids: some physiological and nu-
tritional consideration. Prog Med Chem 14: 285-308
49. Kano K, Mabuchi T, Uno B, Esaka Y, Tanaka T, Linuma M (1994): Su-
peroxide anion radical-induced dioxygenolysis of quercetin as a mim-
ic of quercetinase. J Chem Soc Chem Commun 5: 593-594
50. Arora A, Byrem TM, Nair MG, Strasburg GM (2000) Modulation of
liposomal membrane fluidity by flavonoids and isoflavonoids. Arch
Biochem Biophys 373: 102-109
51. van Acker SA, Tromp MN, Haenen GR, van der Vijgh WJ, Bast A
(1995) Flavonoids as scavengers of nitric oxide radical. Biochem Bio-
phys Res Commun 214: 755-759
52. Ren W, Qiao Z, Wang H, Zhu L, Zhang L (2003) Flavonoids: promising
anticancer agents. Med Res Rev 23: 519-534
53. Heim K, Tagliaferro A, Bobilya D (2002) Flavonoid antioxidants: che-
mistry, metabolism and structure-activity relationships. J Nutr Bio-
chem 13: 572-584
54. Morillas-Ruiz JM, Villegas García JA, López FJ, Vidal-Guevara ML,
Zafrilla P (2006) Effects of polyphenolic antioxidants on exercise-indu-
ced oxidative stress. Clin Nutr 25: 444-453
55. Vinson JA, Proch J, Bose P, Muchler S, Taffera P, Shuta D, Samman
N, Agbor GA (2006) Chocolate is a powerful ex vivo and in vivo antio-
xidant, an antiatherosclerotic agent in an animal model, and a signifi-
cant contributor to antioxidants in the European and American diets. J
Agric Food Chem 54: 8071-8076
56. Cao D, Li H, Yi J, Zhang J, Che H, Cao J, Yang L, Zhu C, Jiang W (2011)
Antioxidant properties of the mung bean flavonoids on alleviating
heat stress. PLoS One 6: e21071
57. Sorata Y, Takahama U, Kimura M (1984) Protective effect of quercetin
and rutin on photosensitized lysis of human erythrocytes in the pres-
ence of hematoporphyrin. Biochim Biophys Acta 799: 313-317
58. Terao J (1999) Dietary flavonoids as antioxidants in vivo: conjugated
metabolites of (-)-epicatechin and quercetin participate in antioxida-
tive defense in blood plasma. J Med Inv 46: 159-168
59. Van Acker FA, Schouten O, Haenen GR, van der Vijgh WJ, Bast A
(2000) Flavonoids can replace alpha-tocopherol as an antioxidant.
FEBS Lett 473: 145-148
60. Pobłocka-Olech L, Marcinkowska K, Krauze-Baranowska M (2006)
Naryngenina i jej pochodne — flawanony o wielokierunkowej aktyw-
ności farmakologicznej. Post Fitoter 1: 16-22
61. Peng IW, Kuo SM (2003) Flavonoid structure affects the inhibition of
lipid peroxidation in Caco-2 intestinal cells. Physiol Concent J Nutr
13: 2184-2187
62. Galveza J, Cruzb J, Zarzueloa A, Cuesta F (1995) Flavonoid inhibition
of enzymic and nonenzymic lipid peroxidation in rat liver differs from
its influence on the glutathione-related enzymes. Int J Exp Clin Pharm
51: 127-133
63. Peng IW, Kuo SM (2003) Flavonoid structure affects the inhibition of
lipid peroxidation in Caco-2 intestinal cells at physiological concentra-
tions. J Nutr 133: 2184-2187
64. Laughton MJ, Evans PJ, Moroney MA, Hoult JRS, Halliwell B (1991)
Inhibition of mammalian 5-lipoxygenase and cyclooxygenase by fla-
vonoids and phenolic dietary additives: relationship to antioxidant
activity and to iron ion-reducing ability. Biochem Pharmacol 42: 1673-
1681
65. Galati G, O’Brien P (2004) Potential toxicity of flavonoids and other
dietary phenolics: Significance for their chemopreventive and antican-
cer properties. Free Radic Biol Med 37: 287-303
66. Mira L, Fernandez M, Santos M, Rocha R, Florêncio
MH, Jennings KR
(2002) Interactions of flavonoids with iron and copper ions: a mecha-
nism for their antioxidant activity. Free Radic Res 36: 1199-1208
67. Heim KE, Tagliaferro AR, Bobilya DJ (2002) Flavonoid antioxidants:
chemistry, metabolism and structure activity relationships. J Nutr Bio-
chem 13: 572-584
68. Hodnick WF, Kung FS, Roettger WJ, Bohmont CW, Pardini RS (1986)
Inhibition of mitochondrial respiration and production of toxic oxygen
radicals by flavonoids: a structure-activity study. Biochem Pharmacol
35: 2345-2357
69. Nakagawa HK, Hasumi JT, Nagai K, Wachi M (2004) Generation of
hydroxideperoxide primarily contributes to the induction of Fe(II)-
dependent apoptosis in Jurkat cells by (−)-epigallocatechin-3-gallate.
Carcinogenesis 25: 1567-1574
70. Yen GC, Duh PD, Tsai HL, Huang SL (2003) Pro-oxidative properties
of flavonoids in human lymphocytes. Biosci Biotechnol Biochem 67:
1215-1222
71. Boos G, Stopper H (2000) Genotoxicity of several clinically used topoi-
somerase II inhibitors. Toxicol Lett 116: 7-16
72. Lopez-Lazaro M, Calderon-Montano JM, Burgos-Moron E, Austin CA
(2011) Green tea constituents (2)-epigallocatechin-3-gallate (EGCG)
and gallic acid induce topoisomerase I– and topoisomerase II–DNA
complexes in cells mediated by pyrogallol-induced hydrogen perox-
ide. Mutagenesis 26: 489-498
73. Kurzer MS, Xu X (1997) Dietary phytoestrogens. Annu Rev Nutr 17:
353-381
74. Olas B, Wachowicz B (2002) Resveratrol and vitamin C as antioxidants
in blood platelets. Thromb Res 106: 143-148
75. Wang Z, Huang Y, Zou J, Cao K, Xu Y, Wu JM (2002) Effects of red
wine and polyphenol resveratrol on platelet aggregation in vivo and in
vitro. Inter J Mol Med 9: 77-79
76. Trumbeckaite S, Bernatoniene J, Majiene D, Jakštas V, Savickas A,
Toleikis A (2006) The effect of flavonoids on rat heart mitochondrial
function. Biomed Pharmacother 60: 245-248
77. Dong L, Fan Y, Shao X, Chen Z (2011) Vitexin protects against myocar-
dial ischemia/reperfusion injury in Langendorff-perfused rat hearts
by attenuating inflammatory response and apoptosis. Food Chem
Toxicol 49: 3211-3216
78. Balcerek M, Matławska I (2006) Wpływ związków fenolowych na re-
ceptory GABA i interakcje z pochodnymi benzodiazepiny. Post Fitoter
52: 3-8

244
www.postepybiochemii.pl
Structure, antioxidative and anticancer properties of flavonoids
Małgorzata Czaplińska
*
, Jan Czepas, Krzysztof Gwoździński
The Division of Biopolymers’ Structure Research, Department of Molecular Biophysics, University of Łódź, 141/ 143 Pomorska St., 90-236 Łódź, Poland
*
e-mail: czaplinska.malgorzata@gmail.com
Key words: flavonoids, classification of flavonoids, antioxidant properties, anticancer properties
ABSTRACT
Flavonoids are compounds occuring in plants, e.g. in fruits and vegetables. Flavonoids have been identified as: flavones, flavanones, flavanols
(flavan-3-ols), flavonols, anthocyanidines, isoflavonoids and neoflavonoids. Their antioxidative properties are connected with their ability to scav-
enge free radicals. Their antioxidant properties are linked to the ability to chelate transitional metal ions, mainly copper and iron and to increase
antioxidant capacity by the stimulation of the activity of important antioxidant enzymes: superoxide dismutase, glutathione peroxidase and catalase.
Flavonoids are able to inhibit the activities of prooxidant enzymes such as cyclooxygenase, lipooxygenase, xanthine oxidase and expression of in-
ducible nitric oxide synthase. These compounds can also regenerate ascorbyl and tocoferoxyl radicals to corresponding vitamins. Pharmacological
properties of flavonoids are manifested in different ways. They display antiviral, anti-allergic, anti-inflammatory and anticancer properties. Flavo-
noids play also a role as inhibitors of neurodegenerative diseases (Alzheimer and Parkinson’s diseases) and ageing. Moreover, protective effects
against ionizing and UV radiation have been shown for flavonoids. In this paper the antioxidative properties and antitumour action of flavonoids,
such as blockade of cell cycle, activation of apoptosis pathways and inhibition of cancerogenesis by inactivation of some carcinogens are reviewed.
79. Miller E, Rutkowski M (2006) Udział i rola ważniejszych czynników
biochemicznych w udarze niedokrwiennym mózgu. Pol Mer Lek 117:
3-15
80. Rotsztejn H (2005) Znaczenie fitoestrogenów w świetle obecnej wie-
dzy. Przegl Menopauz 4: 47-50
81. Webb MR, Ebeler SE (2004) Comparative analysis of topoisomerase
IB inhibition and DNA intercalation by flavonoids and similar com-
pounds: structural determinates of activity. Biochem J 384: 527-541
82. Benavente-Garci’a O, Castillo J (2008) Update on uses and properties
of citrus flavonoids: new findings in anticancer, cardiovascular, and
anti-inflammatory activity. J Agric Food Chem 56: 6185-6205
83. Myhrstad MCW, Carlsen H, Nordström O, Blomhoff R, Moskaug J
(2002) Flavonoids increase the intracellular glutathione level by trans-
activation of the gamma-glutamylcysteine synthetase catalytical sub-
unit promoter. Free Rad Biol Med 32: 386-393
84. Moon YJ, Wang X, Morris ME (2006) Dietary flavonoids: effects on xe-
nobiotic and carcinogen metabolism. Toxicol In Vitro 2: 187-210
85. Steele VE, Kelloff GJ, Balentine D, Boone CW, Mehta R, Bagheri D,
Sigman CC, Zhu S, Sharma S (2000) Comparative chemopreventive
mechanisms of green tea, black tea and selected polyphenol extracts
measured by in vitro bioassays. Carcinogenesis 21: 63-67
86. Weisburger JM (1999) Tea and health: the underlying mechanisms.
Proc Soc Exp Biol Med 220: 271-277
87. Lee-Hilz YY, Boerboom AM, Westphal AH, van Berkel WJ, Aarts JM-
MJG, Rietjens IMCM (2007) Pro-oxidant activity of flavonoids induces
EpRE-mediated gene expression. Chem Res Toxicol 19: 1499-1505
88. Muzolf-Panek M, Tyrakowska B (2010) Znaczenie pro-utleniających
właściwości flawonoidów w indukcji ekspresji genów kodujących en-
zymy detoksykacyjne. Postepy Biochem 56: 284-289
89. Rietjens IMCM, Al Huseiny W, Boersma MG (2011) Flavonoids and
alkenylbenzenes: New concepts in bioactivation studies. Chem-Biol
Interact 192: 87-95
90. Fraga CG, Oteiza PI (2011) Dietary flavonoids: role of (−)-epicatechin
and related procyanidins in cell signaling. Free Rad Biol Med 51: 813-
823
91. Kakeya H, Imoto M, Tabata Y, Iwami J, Matsumoto H, Nakamura K,
Koyano T, Tadano K, Umezawa K (1993) Isolation of novel substrate-
competitive tyrosine kinase inhibition desmal, from the plant Desmos
chinensis. FEBS Lett 320: 169-172
92. Huang YT, Hwang JJ, Lee PP, Ke FC, Huang JH, Huang CJ, Kandas-
wami C, Middleton E Jr, Lee MT (1999) Effects of luteolin and querce-
tin, inhibitors of tyrosine kinase, on growth and metastasis-associated
properties in A431 cells overexpressing epidermal growth factor re-
ceptor. Br J Pharmacol 128: 999-1010
93. Lee LT, Huang YT, Hwang JJ, Lee HPP, Ke FC, Nair MP, Kandaswain
C, Lee MT (2002) Blockade of the epidermal growth factor receptor
tyrosine kinase activity by quercetin and luteolin leads to growth in-
hibition and apoptosis of pancreatic tumor cells. Anticancer Res 22:
1615-1628
94. Ferriola PC, Cody V, Middleton E (1989) Protein kinase C inhibition
by plant flavonoids, kinetic mechanism and structure activity relation-
ships. Biochem Pharmacol 38: 1617-1624
95. Graziani Y, Erikson E, Erikson RL (1983) The effect of quercetin on the
phosphorylation activity of the Rous sarcoma virus transforming gene
product in vitro and in vivo. Eur J Biochem 135: 583-589
96. Constantinou A, Kiguchi K, Huberman E (1990) Induction of differen-
tiation and DNA strand breakage in human HL-60 and K-562 leuke-
mia cells by genistein. Cancer Res 50: 2618-2624
97. Merlino GT, Xu YH, Ishii S, Clark AJ, Semba K, Yamamoto T, Pas-
tan I (1994) Amplification and enhanced expression of the epidermal
growth factor receptor gene in A431 human carcinoma cells. Science
224: 417-419
98. Peterson G, Barnes S (1991) Genistein inhibition of the growth of hu-
man breast cancer cells: independence from estrogen receptors and
the multi-drug resistance gene. Biochem Biophys Res Commun 179:
661-667
99. Pagliacci MC, Smacchia M, Migliorati G, Grignani F, Riccardi C, Nico-
letti I (1994) Growth-inhibitory effects of the natural phyto-oestrogen
genistein in MCF-7 human breast cancer cells. Eur J Cancer 30A: 1675-
1682
100. Navarro-Núñez L, Lozano ML, Martínez C, Vicente V, Rivera J (2010)
Effect of quercetin on platelet spreading on collagen and fibrinogen
and on multiple platelet kinases. Fitoterapia 81: 75-80
101. Kyriakidis SM, Sotiroudis TG, Evangelopoulos AE (1986) Interaction
of flavonoids with rabbit muscle phosphorylase kinase. Biochim Bio-
phys Acta 871: 121-129
102. Fotsis T, Pepper M, Adlercreutz H, Fleischmann G, Hase T, Monte-
sano R, Schweigerer L (1993) Genistein, a dietary-derived inhibitor of
in vitro angiogenesis. Proc Natl Acad Sci USA 90: 2690-2694
103. Lamson DW, Brignall MS (1999) Antioxidants in Cancer Therapy;
Their actions and interactions with oncologic therapies. Altern Med
Rev 4: 304-329
104. Angelini A, Di Ilio C, Castellani ML, Conti P, Cuccurullo F (2010)
Modulation of multidrug resistance p-glycoprotein activity by fla-
vonoids and honokiol in human doxorubicin- resistant sarcoma cells
(MES-SA/DX-5): implications for natural sedatives as chemosensitiz-
ing agents in cancer therapy. J Biol Regul Homeost Agents 24: 197-205
105. Wang HK (2000) The therapeutic potential of flavonoids. Expert Opin
Investig Drugs 9: 2103-2119
106. Sedlacek HH (2001) Mechanisms of action of flavopiridol. Crit Rev
Oncol Hematol 38: 139-170
Wyszukiwarka
Podobne podstrony:
244 id 30870 Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
analiza ryzyka bio id 61320 Nieznany
pedagogika ogolna id 353595 Nieznany
Misc3 id 302777 Nieznany
cw med 5 id 122239 Nieznany
D20031152Lj id 130579 Nieznany
więcej podobnych podstron