
Fizjologia minimalnie przetworzonych owoców i warzyw.
na podstawie Brecht J.K. HortScience 30(1) 1995
W celu zaspokojenia wzrastających wymagań konsumentów przemysł spożywczy (przetwór-
stwo owocowo- warzywne) wprowadza technologie łagodnego przetwarzania warzyw i owo-
ców, w celu otrzymania produktów gotowych albo prawie gotowych do spożycia a jednocze-
śnie świeżych albo o zachowanej świeżości.
Fizjologia minimalnie przetworzonych owoców i warzyw jest właściwie fizjologią tkanek
uszkodzonych mechanicznie (zranionych). Typ przetwarzania, o którym mowa, polega na
usunięciu zanieczyszczeń, obraniu i pokrojeniu we właściwy sposób (w plasterki, w kostkę,
poszatkowaniu) owoców i warzyw. Można więc wnosić, że tak potraktowane tkanki będą się
zachowywać w sposób właściwy dla tych, które zostały mechanicznie uszkodzone albo pod-
dane innym strasom. To zachowanie przejawia się ogólnie rzec biorąc wzrostem tempa oddy-
chania i produkcji etylenu, w niektórych przypadkach indukcją procesów prowadzących do
zaleczania (zabliźniania zranień). Innymi konsekwencjami zranienia są ciemnienie enzyma-
tyczne, oksydacja lipidów, utrata wody.
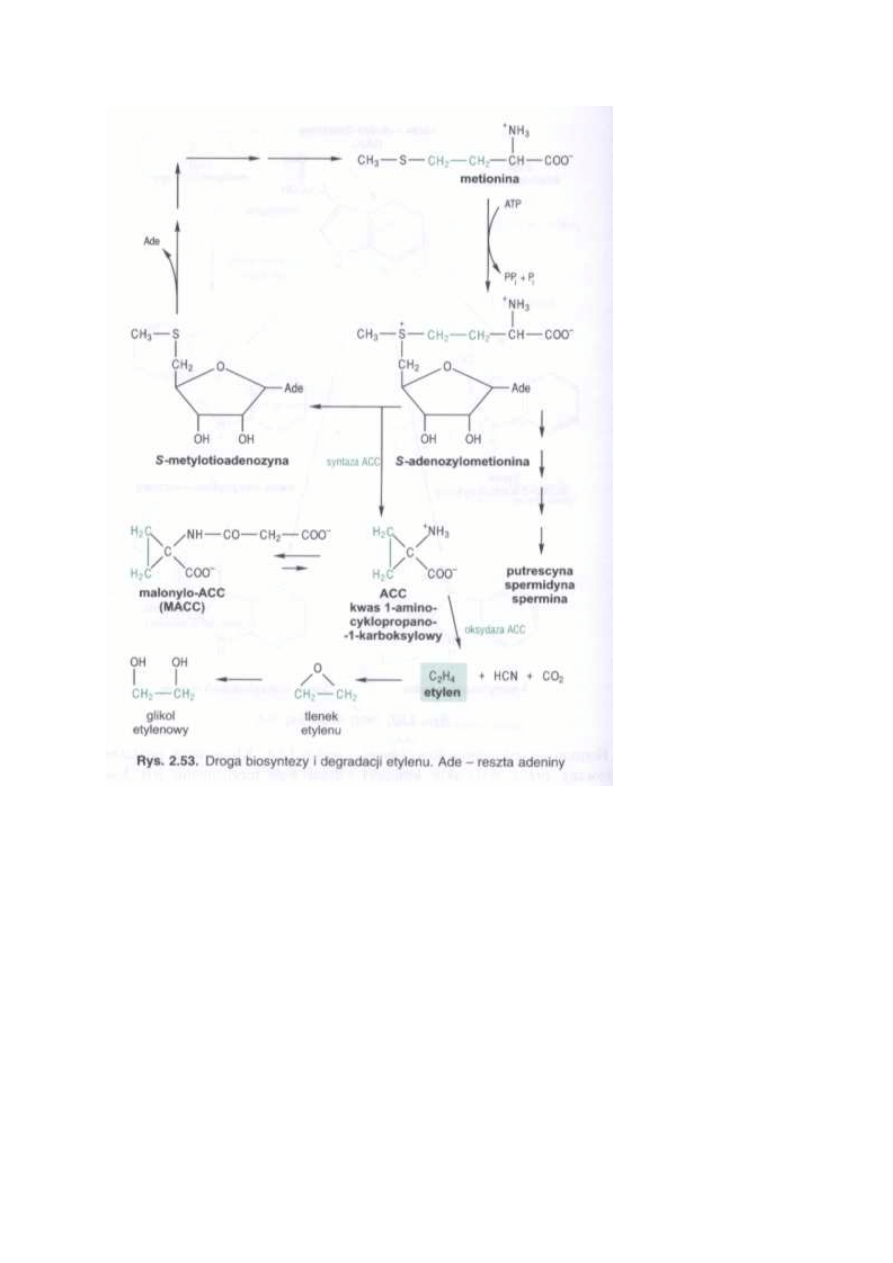
1. Indukcja syntezy etylenu.
Etylen jest najprostszą olefiną występującą w temperaturach biologicznych w stanie gazo-
wym. Jest fizjologicznie aktywny w ilościach śladowych (0,1 ppm). U roślin powstaje z me-
tioniny poprzez S- adenozylometioninę (SAM), w reakcji katalizowanej przez syntazę SAM,
przy udziale ATP. Bezpośrednim prekursorem etylenu jest kwas 1-amino-cyklopropano- 1-
karboksylowy (ACC), syntetyzowany z SAM przy udziale syntazy ACC. Reakcja ta jest uwa-
żana za punkt limitujący syntezę etylenu. Syntaza ACC jest enzymem cytoplazmatycznym, jej
biosynteza i aktywność są kontrolowane przez szereg czynników środowiskowych i we-
wnętrznych, indukujących syntezę różnych form enzymu. W wyniku reakcji katalizowanej
przez syntazę ACC powstaje też metylotioadenozyna, wykorzystywana do regeneracji metio-
niny.
Konwersja kwasu 1- amino-cyklopropano-1-karboksylowego w etylen, zależna od O
2
, jest
katalizowana przez oksydazę ACC, uważaną za enzym konstytucyjny.
Zranienie tkanek roślinnych indukuje produkcję etylenu (zwanego etylenem zranienia albo
stresowym), czasami w ciągu kilku minut od zadziałania stresu, najczęściej w ciągu godziny.
Pik produkcji pojawia się w przeciągu 6 do 12 godzin od zadziałania czynnika. Etylen zranie-
nia może przyspieszać procesy starzenia w tkankach wegetatywnych oraz procesy dojrzewa-
nia owoców klimakterycznych.
Etylen wytwarzany w wyniku mechanicznego uszkodzenia tkanek stymuluje procesy odde-
chowe, powoduje wzrost aktywności enzymów (np. peroksydazy, amoniakoliazy fenyloalani-
ny, oksydazy polifenolowej, poligalakturonazy, α-amylazy), zwiększa przepuszczalność błon,
przyspiesza rozkład chlorofilu w tkankach zielonych (prawdopodobnie przez indukcję syntezy
chlorofilazy).
2.Degradacja lipidów błon komórkowych.
Zranienie tkanek może przyczyniać się do degradacji lipidów wchodzących w skład błon ko-
mórkowych. Prowadzi to do utraty lipidowych składników błony, czego skutkiem może być
zniszczenie kompartymentacji w komórkach. Etylen zranienia może grać rolę w tych proce-
sach poprzez zwiększanie przepuszczalności błon oraz redukowanie biosyntezy fosfolipidów.
Reakcje enzymatyczne katalizowane przez hydrolazy lipidów i fosfolipazę D przyczyniają się
do uwalniania wolnych kwasów tłuszczowych z membran. Kwasy tłuszczowe z kolei mogą
wpływać toksycznie na wiele procesów zachodzących w komórkach, mogą np. powodować
lizę organelli, reagować z białkami unieczynniając je. Lipoksygenaza katalizująca utlenianie
nienasyconych kwasów tłuszczowych generuje wolne rodniki, zdolne do atakowania nienaru-
szonych membran. Enzym ten jest także zaangażowany w wytwarzanie pożądanych i niepo-
żądanych związków lotnych.

3. Wzrost tempa oddychania.
Tkanki zranione charakteryzują się wzmożonym oddychaniem. Jest to konsekwencja produk-
cji etylenu, który stymuluje procesy oddechowe.
4. Ciemnienie enzymatyczne.
Powierzchnia zranionych tkanek owoców i warzyw przebarwia się, w wyniku zajścia procesu
ciemnienia enzymatycznego. Ciemnienie enzymatyczne jest czynnikiem limitującym długość
czasu przechowywania warzyw i owoców minimalnie przetworzonych.
Przyczyną ciemnienia enzymatycznego są reakcje katalizowane przez enzym oksydazę o-
difenolową (enzym ten nazywany jest także polifenolooksydazą, oksydazą katecholową, ka-
techolazą). W wyniku zniszczenia kompartymentacji komórek, dochodzi do zetknięcia enzy-
mu z substratami, którymi są związki fenolowe. W komórkach nieuszkodzonych enzym wy-
stępuje w formie nieczynnej. W momencie zadziałania stresu mechanicznego zranienia do-
chodzi do aktywacji enzymu (mechanizmy aktywacji nie do końca zostały rozpoznane, suge-
ruje się ograniczoną proteolizę i zmiany konformacyjne białka enzymatycznego, stwierdzono
wzrost rozpuszczalności enzymu po aktywacji). Ponadto po zniszczeniu błon biologicznych
enzym styka się ze swoimi substratami, które zwykle w nienaruszonych komórkach zlokali-
zowane są w wakuoli.
Oksydaza o-difenolowa występuje w organellach: chloroplastach, mitochondriach i peroksy-
somach w postaci związanej z błonami, ale stwierdza się także jej obecność w cytozolu w
formie rozpuszczalnej.
Wyróżnia się dwie aktywności enzymu nazywanego polifenolooksydazą (PPO). Jedna z nich
polega na katalizowaniu reakcji utlenienia o-difenoli z udziałem tlenu cząsteczkowego do o-
chinonów (produktem reakcji jest też woda). Jest to tak zwana aktywność katecholazowa
(stąd nazwa enzymu katecholaza, oksydaza o-difenolowa). W nomenklaturze enzymatycznej
enzym ten ma symbol EC 1.10.3.2. Substratami tej reakcji mogą być wszelkie związki feno-
lowe, w których grupy OH znajdują się w położeniu orto, czyli np. katechol. W przypadku
owoców i warzyw bardzo powszechnym substratem tego enzymu jest kwas chlorogenowy
(kwas 5’ kawowochinowy).
Druga z aktywności polega na wstawieniu tlenu do pierścienia aromatycznego w pozycji orto
do istniejącej grupy OH, czyli przekształceniu monofenoli w o-difenole. Powstałe o-fenole
ulegają następnie zwykle utlenieniu do chinonów. Aktywność tę nazywa się krezolazową,
enzym często tyrozynazą, ze względu na to, że substratem jest tyrozyna. Tyrozynaza otrzyma-
ła numer EC 1.14.18.1.
Oksydaza polifenolowa jest miedzioproteiną. W centrum aktywnym posiada dwa atomy mie-
dzi, połączone, każdy z osobna, z trzema resztami histydyny białka enzymatycznego wiąza-
niem koordynacyjnym. Enzym może występować w trzech formach redoks. W formie utle-
nionej met, w której jony Cu
2+
połączone są za pomocą cząsteczki wody; w formie zreduko-
wanej deoksy, w której jednego jonu Cu
+
dołączona jest koordynacyjnie cząsteczka wody,
drugi jon Cu
+
ma wolne miejsce koordynacyjne; w formie utlenowanej oksy
Cu
2+
-O
2
-Cu
2+
.
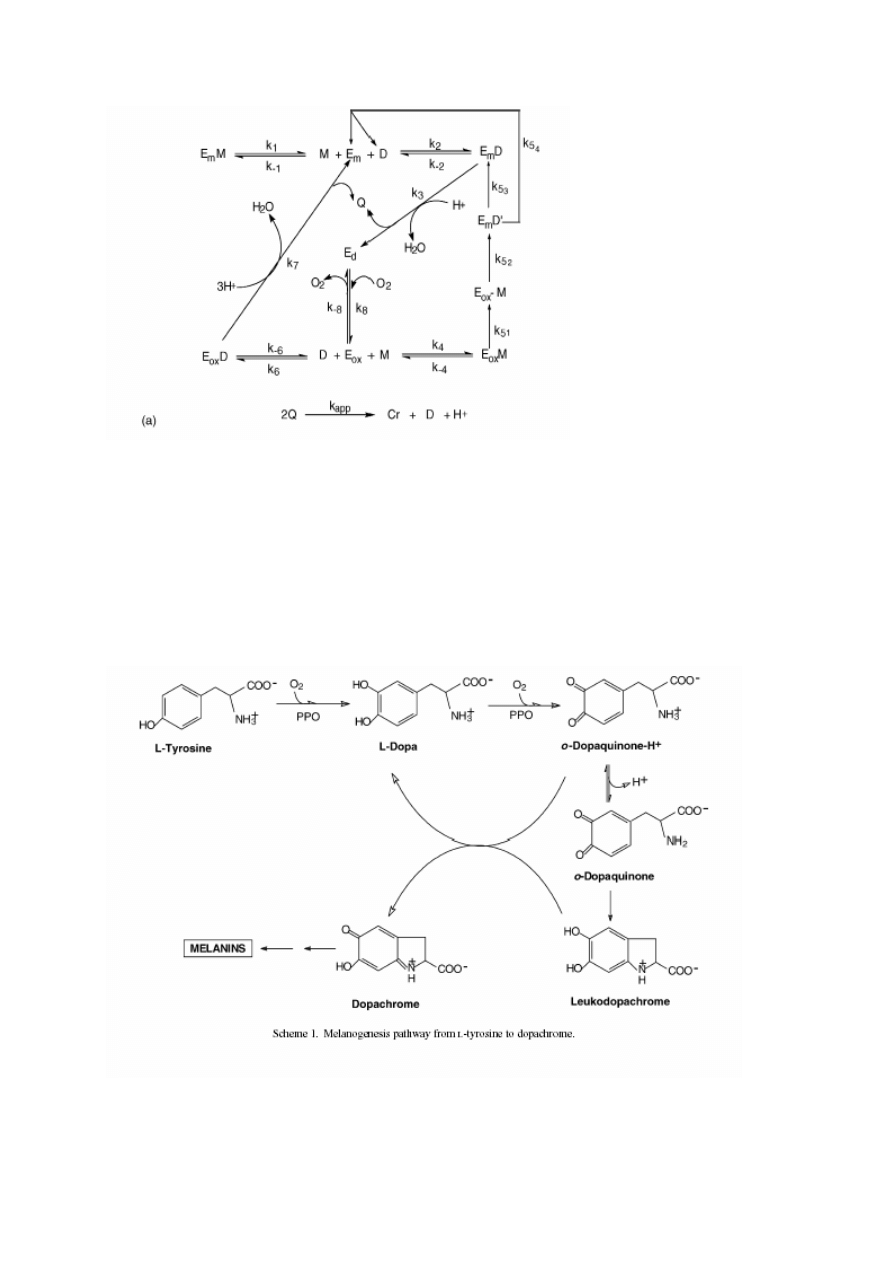
Na schemacie przedstawiono reakcje katalizowane przez tyrozynazę. Ed- forma deoksy en-
zymu przechodzi w formę oksy (E
ox
) po przyłączeniu cząsteczki O
2
. Enzym w formie oksy
może zarówno reagować z o-difenolami (D) jak i monofenolami (M). W wyniku reakcji z
monofenolami powstają o-difenole, które mogą być uwalniane do środowiska (enzym będzie
więc produkował o-difenole), w wyniku czego powstaje forma met enzymu (E
m
) albo mogą
być utlenione do chinonów, generując formę deoksy enzymu. Jeśli forma oksy przereaguje z
o-difenolem powstanie chinon i forma met enzymu. Z kolei forma met jest zdolna do utlenie-
nia o-difenolu do chinonu. Forma met może też związać monofenol tworząc kompleks koń-
cowy E
m
M, nieulegający dalszym przemianom.
Poniżej schemat reakcji utlenienia tyrozyny przez PPO.
Przemiany dopachinonu przebiegają na drodze nieenzymatycznej do wytworzenia brązowych
barwników melaninowych.

W przypadku, w którym PPO utlenia o-difenole, powstały o-chinon ulega wtórnej hydroksy-
lacji, w wyniku czego tworzą się fenole z trzema grupami OH. Powstałe trihydroksyfenole
reagują z o-chinonami. W wyniku tej reakcji powstają hydroksychinony podlegające sponta-
nicznej polimeryzacji do brązowych melanin.
Sposoby ograniczania albo zapobiegania enzymatycznemu ciemnieniu w żywności.
Ciemnienie enzymatyczne pojawia się w obecności trzech składników: tlenu, aktywnego en-
zymu oraz jego substratów. Pozbycie się jednego ze składników zapobiegnie zajściu reakcji.
Ponadto zastosowanie związków redukujących, zdolnych do redukcji chinonów do wyjścio-
wych fenoli też może być skutecznym sposobem zapobiegania reakcji ciemnienia enzyma-
tycznego.
a) cieplna denaturacja PPO
b) chemiczna inhibicja PPO. Bardzo efektywnymi inhibitorami są siarczyny, ale ich sto-
sowanie jest ograniczane, ze względu na to, że mogą być przyczyną powstawania ob-
cego smaku i zapachu po ogrzaniu, przyczyniają się do strat witaminy B
1
a także reak-
cji alergicznych osób cierpiących na astmę. Siarczyny mogą bezpośrednio inaktywo-
wać enzym, mogą też tworzyć produkty (monosulfoniany) z fenolami, których PPO
nie jest zdolna utleniać. Ponadto siarczyny reagują z chinonami tworząc bezbarwne
produkty i zapobiegając dalszym nieenzymatycznym przemianom chinonów w barw-
niki melaninowe. Środki zakwaszające, np. kwas cytrynowy, hamują aktywność en-
zymu poprzez obniżanie pH do wartości poniżej optimum (optymalne wartości pH dla
większości oksydaz o-difenolowych mieszczą się w granicach 4-7). Ponadto obniżenie
pH do wartości niższej od 5 hamuje też istotnie reakcje, w wyniku której powstają
barwniki melaninowe na drodze nieenzymatycznej (czyli etapy ciemnienia następują-
ce po wytworzeniu chinonów). Związki chelatujące (np. EDTA albo wspomniany
kwas cytrynowy) wpływają hamująco na aktywność polifenolooksydazy poprzez
wiązanie jonów miedzi znajdujących się w centrum aktywnym.
c) związki redukujące o-chinony do związków fenolowych hamują ciemnienie enzyma-
tyczne. Kwas askorbinowy i D-izoaskorbinowy są używane w celu zapobiegania
ciemnieniu enzymatycznemu od wielu lat. Uważa się również, że kwas askorbinowy
może bezpośrednio wpływać na aktywność PPO, poprzez redukowanie jonów miedzi
w centrum aktywnym enzymu.
d) wykluczenie tlenu. Najprostszym sposobem wykluczenia obecności tlenu jest zanu-
rzenie w wodzie pokrojonych owoców czy warzyw (tak np. postępuje się z obranymi
ziemniakami przed gotowaniem albo smażeniem). Można pakować owoce lub warzy-
wa minimalnie przetworzone próżniowo. Można powlekać je jadalnymi powłokami
nieprzepuszczalnymi dla tlenu albo zanurzać w roztworze kwasu askorbinowego, któ-
ry jak wiadomo, utleniając się efektywnie usuwa tlen ze środowiska.
Do ciemnienia enzymatycznego przyczynia się pośrednio amoniakoliaza fenyloalaniny (EC
4.3.1.5) - enzym katalizujący kluczową reakcję szlaku fenylopropanoidowego (którego pro-
duktami są kwasy fenylopropenowe- m.in. substraty oksydazy polifenolowej): dezaminację
fenyloalaniny do kwasu trans cynamonowego.

reakcja powstawania kwasu cynamonowego z fenyloalaniny
Enzym ten zlokalizowany jest w cytozolu. Posiada budowę tetrameryczną.
Zarówno etylen jak i zranienie indukują syntezę białka enzymatycznego poprzez różne me-
chanizmy. Wykazano, że mechaniczne uszkodzenie tkanek spichrzowych przyczynia się do
wzrostu aktywności enzymu na drodze syntezy białka, po czasie zwłoki od 3 do 6 godzin.
Aktywność osiąga maksymalną wartość w ciągu 1- 2 dni od zadziałania czynnika.
5. Zabliźnianie zranień
W miejscu zranienia dochodzi do produkcji i odkładania ligniny bądź suberyny, czyli procesu
zaleczania zranień (wound healing), czemu towarzyszy podział komórek leżących pod war-
stwą suberyny i tworzenie perydermy. Pierwszą zmianą obserwowaną na zranionej mecha-
nicznie powierzchni jest wysychanie warstwy uszkodzonych komórek oraz kilku warstw są-
siednich. Suberynizacja kolejnych warstw komórek pojawia się w wielu tkankach, np. w przy-
padku uszkodzenia bulwy ziemniaka, korzeni marchwi, owocu pomidora i ogórka. Lignifika-
cji ulegają zranione skórki pomarańczy.
W procesy zaleczania zranień zaangażowana jest peroksydaza nieswoista, której wzrost ak-
tywności obserwuje się w tkankach zranionych. Peroksydaza ta (EC 1.11.1.7), często określa-
na jest mianem gwajakolowej ze względu na to, że związek ten używany jest jako substrat w
analizach. Enzym ten jest hemoproteiną o grupie prostetycznej w postaci niekowalencyjnie
związanej protoporfiryny IX z Fe
3+
, z przyłączonym glukanem oraz wapniem. Peroksydaza
gwajakolowa zlokalizowana jest w wakuoli, cytozolu i ścianie komórkowej.
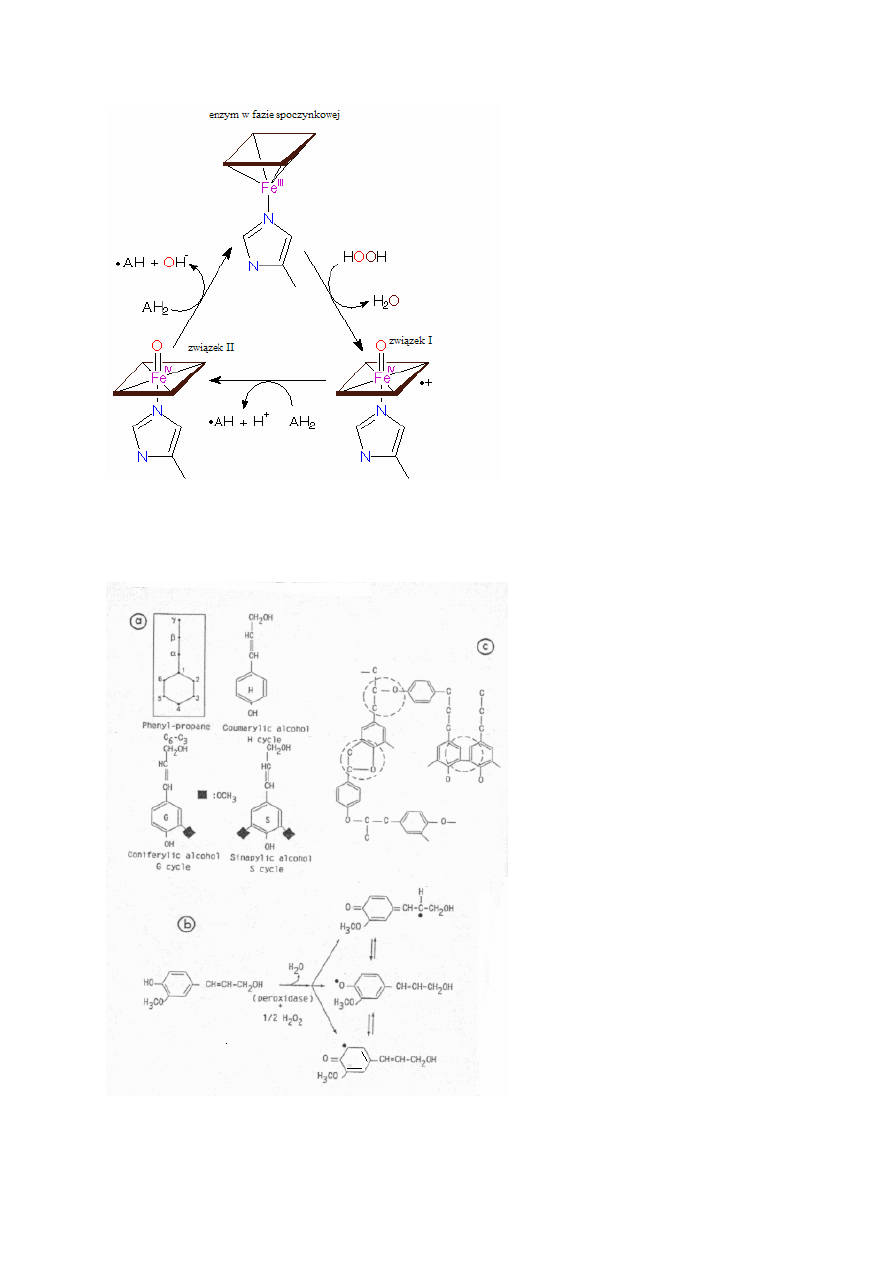
Podstawową reakcją katalizowaną przez ten enzym jest jednowartościowe utlenianie AH
2
przez H
2
O
2
, w wyniku czego powstaje produkt rodnikowy (AH
•
). Dwie cząsteczki tego pro-
duktu reagują ze sobą, tworząc stabilny produkt utlenienia.
2 AH
•
→ AH
2
+ A
Mianem klasycznego cyklu peroksydacyjnego określa się reakcje prowadzące do syntezy po-
limerów ligninowych. Powstałe w wyniku reakcji katalizowanej przez peroksydazę nieswo-
istą rodniki fenoksylowe alkoholi: koniferylowego, kumarylowego i synapilowego, ulegają
spontanicznej polimeryzacji do polimerów fenolowych.
a) wzory strukturalne alkoholi: kumarylowego, koniferylowego i synapilowego
b) rodniki powstające z alkoholi w wyniku akcji peroksydazy i ich formy mezomeryczne
c) fragment proponowanej struktury ligniny
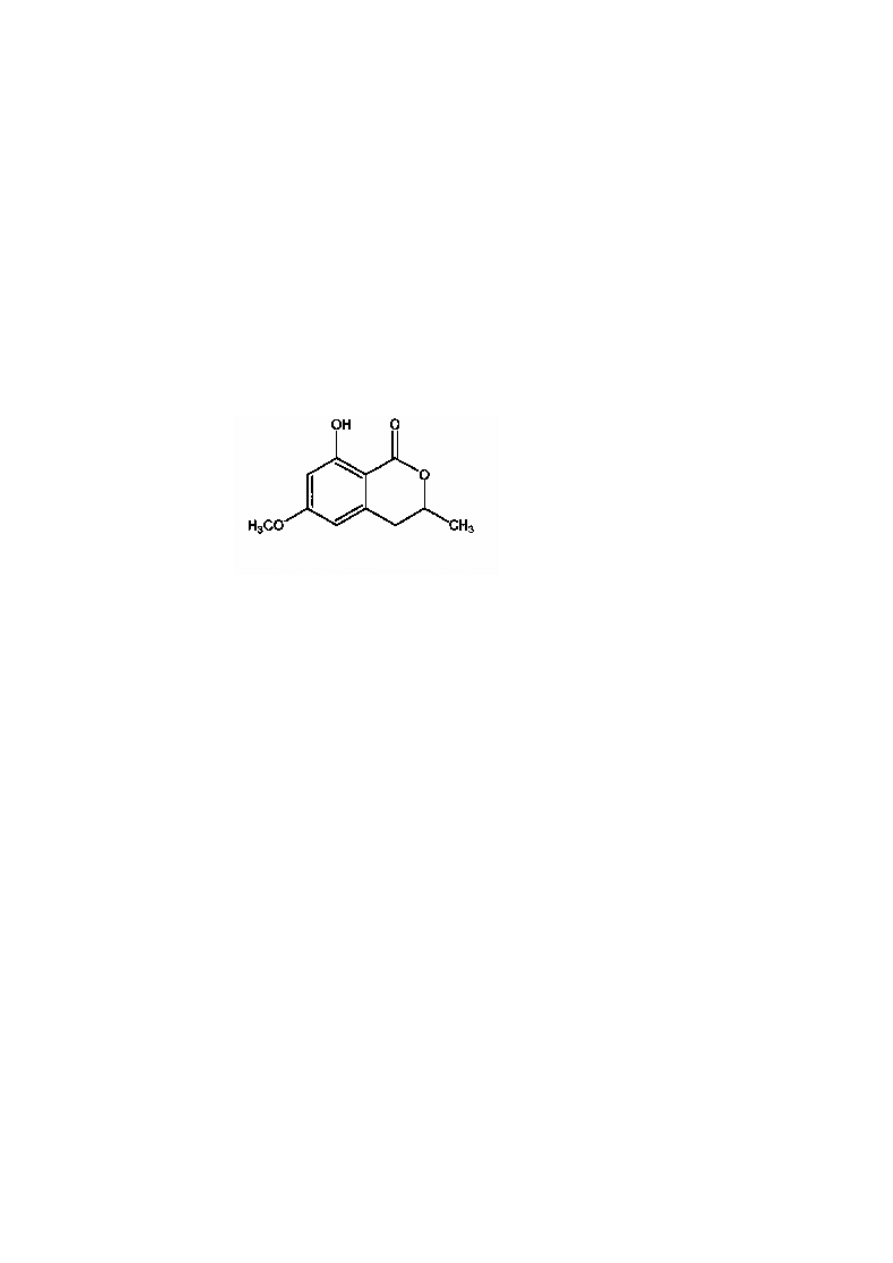
Peroksydaza nieswoista ma także swój udział w reakcji ciemnienia enzymatycznego.
6. Metabolity wtórne
W odpowiedzi na zranienie, rośliny syntetyzują cały wachlarz wtórnych metabolitów, spośród
których wiele jest zaangażowanych w zaleczenie zranień, w odpowiedź na atak patogenów.
W niektórych przypadkach związki te mogą wpływać na smak, zapach, wygląd oraz wartość
odżywczą produktów minimalnie przetworzonych. Składniki produkowane w odpowiedzi na
stres zranienia należą do różnych klas związków: fenoli fenylopropanoidowych, fenoli polike-
tydowych, flawonoidów, terpenoidów, alkaloidów, tanin, glukozynolanów, długołańcucho-
wych kwasów tłuszczowych i alkoholi.
W przypadku zranienia korzeni marchwi syntetyzowany jest związek, będący przyczyną
gorzknienia korzeni- izokumaryna (6-metoksymeleina). Związek ten należy do fenoli polike-
tydowych, których synteza przebiega na drodze kondensacji 1 cząsteczki acetylo- CoA z 3
cząsteczkami malonylo- CoA.
izokumaryna
Izokumaryna nie jest obecna w zdrowych korzeniach marchwi. Syntezę de novo tego związku
wywołuje wiele czynników biotycznych i abiotycznych. Izokumaryna jest zaliczana do fitoa-
leksyn, czyli małocząsteczkowych związków postinfekcyjnych dających reakcje odporno-
ściowe, powstających na skutek zakażenia mikroorganizmami.
Wyszukiwarka
Podobne podstrony:
materialy do cwiczen id 286153 Nieznany
material do cwiczen 2 id 285832 Nieznany
material do cwiczen 4 id 285833 Nieznany
Materialy do cwiczen 1 id 28615 Nieznany
Mikroekonomia materialy do cwiczen id 301168
materialy do cwiczen dla studen Nieznany
Instrukcja do cwiczenia id 2165 Nieznany
7 Materialy do wykladow id 4529 Nieznany (2)
POZYCJE WYJSCIOWE DO CWICZEN id Nieznany
Materialy oprobowanie(1) id 285 Nieznany
materialy do wykladow 1 i 2 id Nieznany
Cwiczenia do kwadryk id 124509 Nieznany
Materialy Pomocnicze (1) id 285 Nieznany
materialy do wykladu 1 i 2 id 2 Nieznany
Enzymologia materiały do ćwiczeń
cwiczenie9 id 125928 Nieznany
odpowiedzi do testu id 332437 Nieznany
Materiały do ćwiczeń z geologii
więcej podobnych podstron