
10.Chemia roztworów
Irena Zubel
Wydział Elektroniki Mikrosystemów i Fotoniki
Politechnika Wrocławska
(na prawach rękopisu)
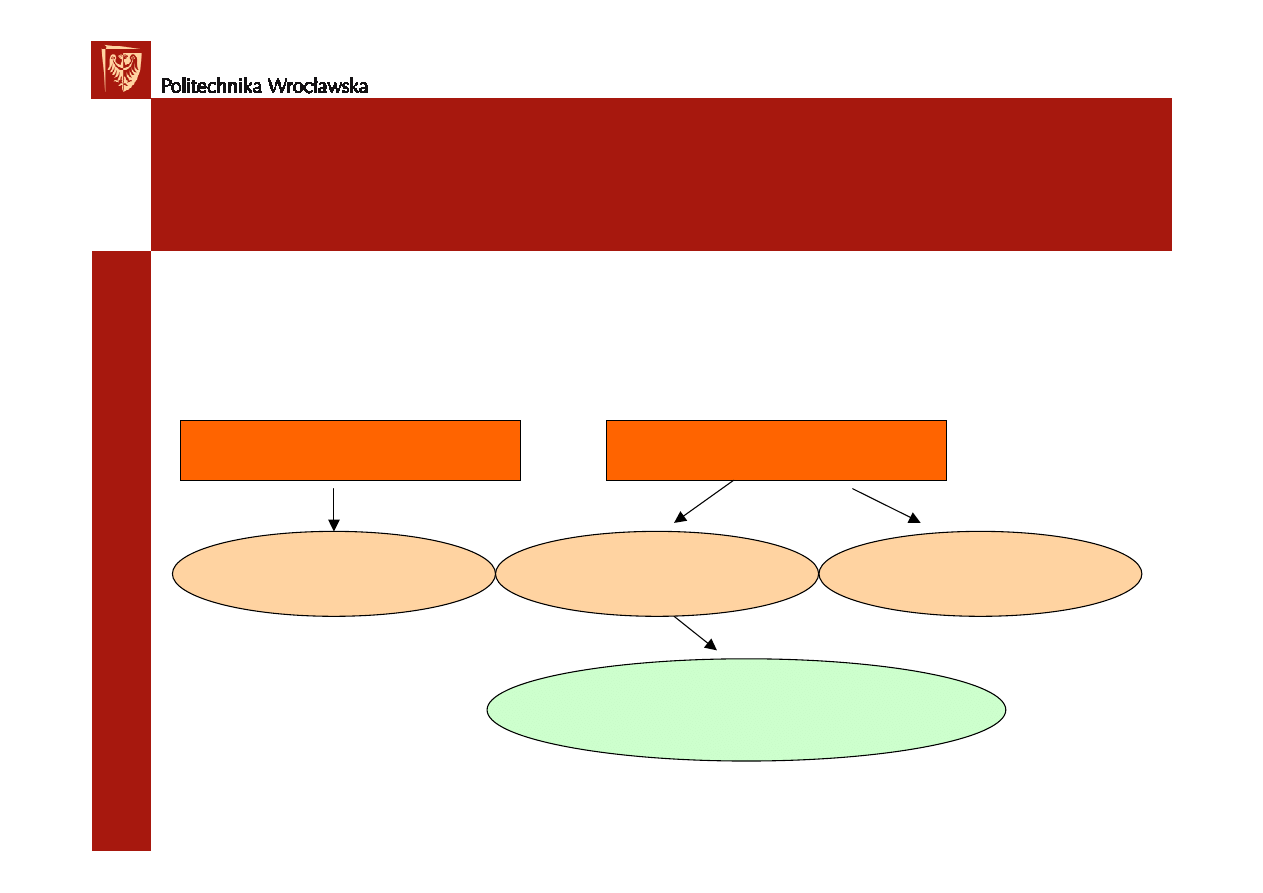
Klasyfikacja roztworów
Roztworem
nazywamy jednorodny układ, zło
ż
ony z rozpuszczalnika i fazy
rozpuszczonej.
Roztwór –układ
dyspersyjny,
zło
ż
ony z
fazy dyspersyjnej
(rozpuszczalnika) i
fazy
zdyspergowanej
(substancji rozpuszczonej)
Układy homogeniczne
Układy heterogeniczne
• Roztwory wodne i niewodne
• Roztwory elektrolitów i nieelektrolitów
roztwory wła
ś
ciwe
roztwory koloidalne
zawiesiny, emulsje
Φ
< 1nm
1nm <
Φ
<200nm
Φ
> 200nm
zole-ciecz+ subst. stała
aerozole – gaz+ subst. stała lub ciecz

Roztwory właściwe. Proces rozpuszczania.
•Rozdrobnienie substancji rozpuszczonej:
Φ
< 1nm
•Rozpuszczalniki: woda, alkohol, aceton…
•Roztwory wyst
ę
puj
ą
: w fazie stałej, w fazie ciekłej, w fazie gazowej
Zajmiemy si
ę
roztworami ciekłymi, wodnymi.
Roztwory wodne:
•roztwory elektrolitów – substancja rozpuszczona w postaci jonów
•roztwory nieelektrolitów – substancja rozpuszczona to cz
ą
steczki elektrycznie
oboj
ę
tne (zwi
ą
zki organiczne, tlenki i wodorki nie reaguj
ą
ce z wod
ą
)
Rozpuszczanie:
Etap I - proces endotermiczny (-C
I
):
- pokonanie sił spójno
ś
ci mi
ę
dzy cz
ą
steczkami substancji rozpuszczanej,
- pokonanie sił spójno
ś
ci mi
ę
dzy cz
ą
steczkami rozpuszczalnika.
Etap II - proces egzotermiczny (+C
II
):
Solwatacja
– przył
ą
czanie polarnych cz
ą
steczek rozpuszczalnika do jonów lub
cz
ą
steczek substancji rozpuszczonej
Hydratacja
– solwatacja w roztworach wodnych
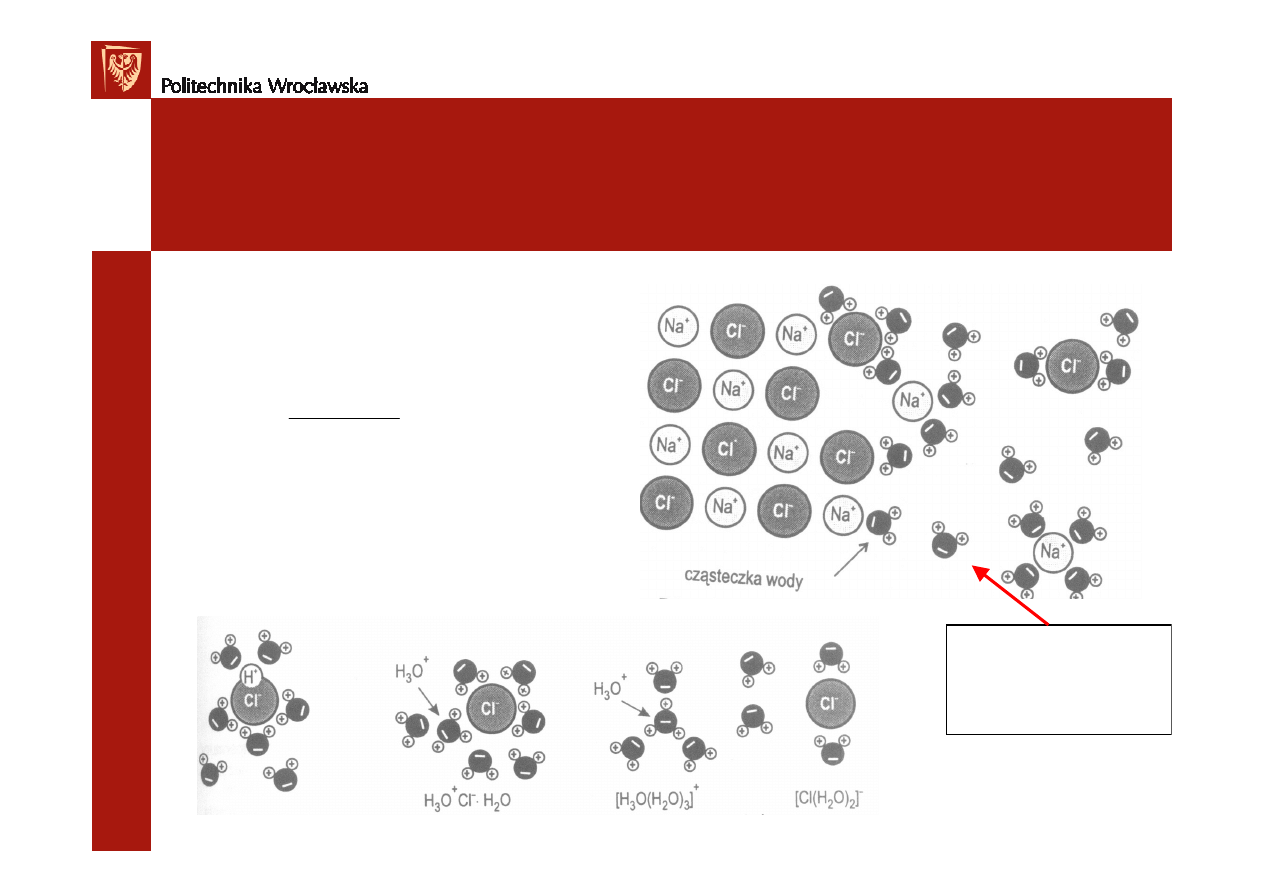
Roztwory właściwe. Proces rozpuszczania.
Rozpuszczanie kryształów o wi
ą
zaniach jonowych
Oddziaływania mi
ę
dzy jonami w o
ś
rodku
o przenikalno
ś
ci dielektrycznej
ε
r
:
Rozpuszczanie substancji o wi
ą
zaniach kowalencyjnych
2
0
2
1
4
r
Q
Q
F
r
ε
πε
⋅
=
Woda:
εεεε
r
= 80 (25
°
C)
Alkohol:
ε
r
=26
Benzen:
ε
r
=2,3
cz
ą
steczka HCl (gaz) - stadium po
ś
rednie -
roztwór
proces
egzotermiczny
-C
I
+C
II
> 0

Rozpuszczania, roztwarzanie, równowaga.
Rozpuszczanie
– jest procesem odwracalnym, mo
ż
na odzyska
ć
rozpuszczon
ą
substancj
ę
przez odparowanie rozpuszczalnika.
Rozpuszczalno
ść
ciał stałych na ogół wzrasta z temperatur
ą
,
rozpuszczalno
ść
gazów – maleje z temperatur
ą
.
Roztwarzanie
- przej
ś
cie substancji stałej do roztworu w wyniku reakcji
chemicznej, zwykle nie jest procesem odwracalnym, np. Na+H
2
O=NaOH+½ H
2
Rozpuszczalno
ść
– masa substancji rozpuszczonej (wyra
ż
ona w gramach),
rozpuszczona w 100 g rozpuszczalnika (T,p=const.), potrzebna do utworzenia
roztworu nasyconego.
Roztwór nasycony
– roztwór zawieraj
ą
cy maksymaln
ą
ilo
ść
substancji
rozpuszczonej (dla T i p = const.) - stan równowagi dynamicznej miedzy
szybko
ś
ci
ą
rozpuszczania i szybko
ś
ci
ą
wydzielania si
ę
substancji rozpuszczonej.
Roztwór przesycony
– roztwór zawieraj
ą
cy nadmiar substancji rozpuszczonej,
która nie krystalizuje z powodu braku zarodków krystalizacji (równowaga pozorna)
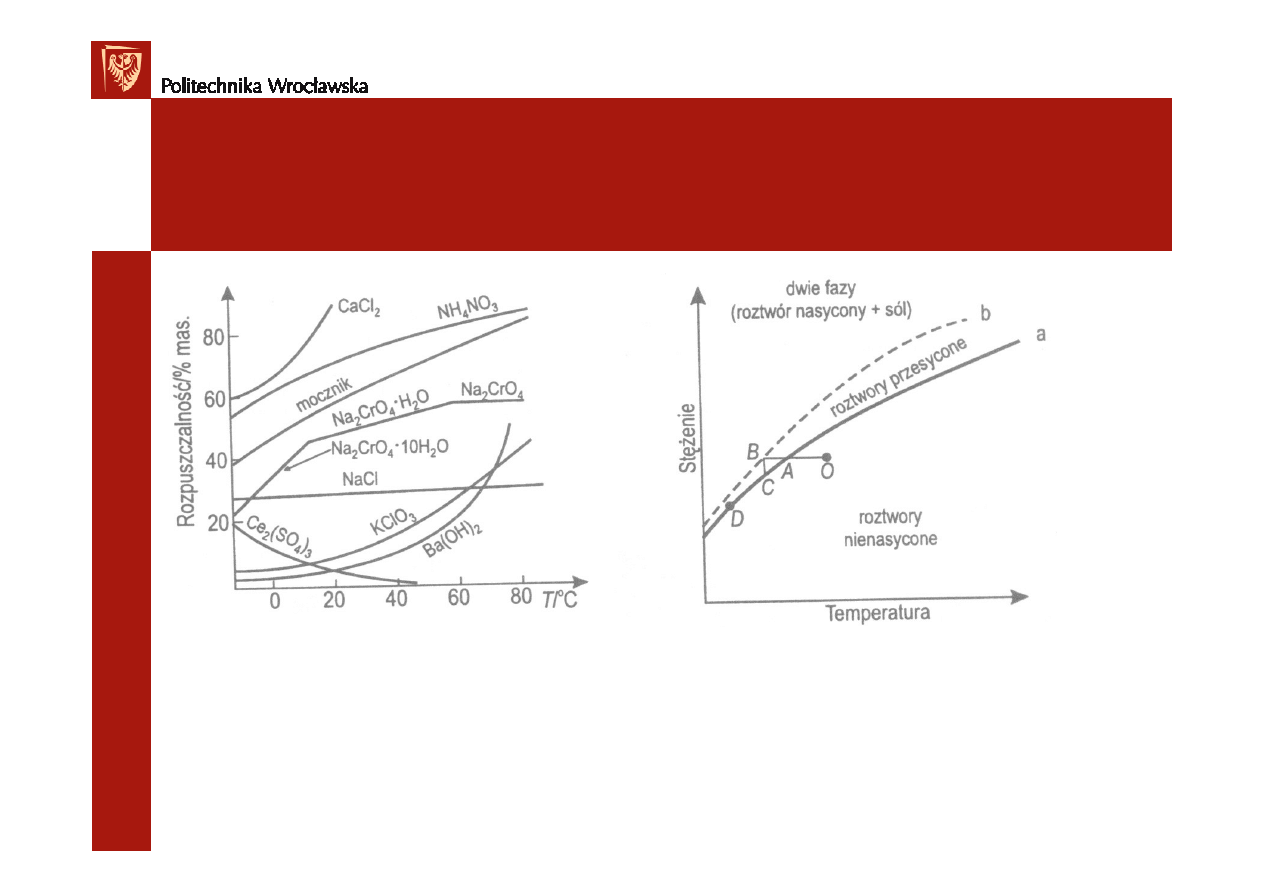
Rozpuszczania, krystalizacja
Rozpuszczalno
ść
= f(T) Rozpuszczalno
ść
+ krystalizacja
krzywa a – rozpuszczalno
ść
krzywa b –maksymalne przesycenie
równowaga pozorna – mi
ę
dzy a i b
OA- ochładzanie roztworu nienasyconego
A- stan nasycenia
AB –przesycenie (zamiast AC)
B – maksymalne przesycenie

Stężenie roztworów
St
ęż
enie procentowe masowe
%
100
%
100
.
rozp
s
s
r
s
p
m
m
m
m
m
C
+
=
=
m
s
–masa subst. rozpuszczonej, [g], [kg]
m
r
– masa roztworu [g], [kg]
m
rozp
. – masa rozpuszczalnika, [g], [kg]
St
ęż
enie procentowe obj
ę
to
ś
ciowe
V
s
–obj. subst. rozpuszczonej [cm
3
],[dcm
3
]
V
r
– obj. roztworu [cm
3
], [dcm
3
]
V
rozp
. – obj rozpuszczalnika [cm
3
], [dcm
3
]
%
100
%
100
.
rozp
s
s
r
s
p
V
V
V
V
V
C
+
=
=
St
ęż
enie roztworu
–stosunek ilo
ś
ci substancji rozpuszczonej do ilo
ś
ci
rozpuszczalnika lub roztworu
St
ęż
enie molowe
]
/
[
3
dcm
mol
V
M
m
V
n
C
r
s
s
r
s
M
⋅
=
=
m
s
–masa subst. rozpuszczonej [g]
n
s
–liczba moli subst. rozpuszczonej [mol]
V
r
– obj. roztworu [dcm
3
]
M
s
– masa molowa subst. rozpuszczonej
[g/mol]

Stężenie roztworów
St
ęż
enie molarne
]
/
[
kg
mol
m
M
m
m
n
C
r
s
s
r
s
m
⋅
=
=
m
s
–masa subst. rozpuszczonej, [g]
n
s
–liczba moli subst. rozpuszczonej, [mol]
m
r
– masa rozpuszczalnika, [kg]
M
s
– masa molowa subst. rozpuszczonej,
[g/mol]
St
ęż
enie normalne
]
/
[
3
dcm
wal
V
G
m
V
n
C
r
s
s
r
G
N
⋅
=
=
m
s
–masa subst. rozpuszczonej [g]
n
G
–liczba gramorównowa
ż
ników subst.
rozpuszczonej [wal]
V
r
– obj. roztworu [dcm
3
]
G
s
– gramorównowa
ż
nik subst.
rozpuszczonej [g/wal]
Ułamek molowy
B
A
A
A
n
n
n
X
+
=
B
A
B
B
n
n
n
X
+
=
1
=
+
B
A
X
X
X
A
– wzgl
ę
dna zawarto
ść
substancji A
X
B
– wzgl
ę
dna zawarto
ść
substancji B
n
A
– liczba moli substancji A
n
B
– liczba moli substancji B

Parametry charakteryzujące roztwory.
1. Pr
ęż
no
ść
par nad roztworem
2. Temperatura wrzenia i krzepni
ę
cia
3. Dyfuzja w roztworach
4. Osmoza
5. Dysocjacja elektrolityczna
6. Aktywno
ść
jonów
7. Stała dysocjacji elektrolitycznej
8. Hydroliza
9. Rozpuszczalno
ść
Roztwór – rozpuszczalnik.
Prężność par nad roztworem.
Prawo Raoulta
– pr
ęż
no
ść
pary nasyconej nad roztworem nielotnej
substancji jest mniejsza ni
ż
nad czystym rozpuszczalnikiem. Wzgl
ę
dne
obni
ż
enie pr
ęż
no
ś
ci pary nad roztworem jest równe ułamkowi molowemu
substancji rozpuszczonej.
roztwór rozpuszczalnik
P < P
0
x
N
n
n
P
P
=
+
=
∆
0
P
0
– ci
ś
nienie pary czystego rozpuszczalnika
P - ci
ś
nienie cz
ą
stkowe rozpuszczalnika nad
roztworem
X – ułamek molowy substancji rozpuszczonej
n – liczba moli substancji rozpuszczonej
N – liczba moli rozpuszczalnika
∆
P = P
0
-P
Samorzutne przechodzenie
rozpuszczalnika do roztworu
rozpuszczalnik
roztwór
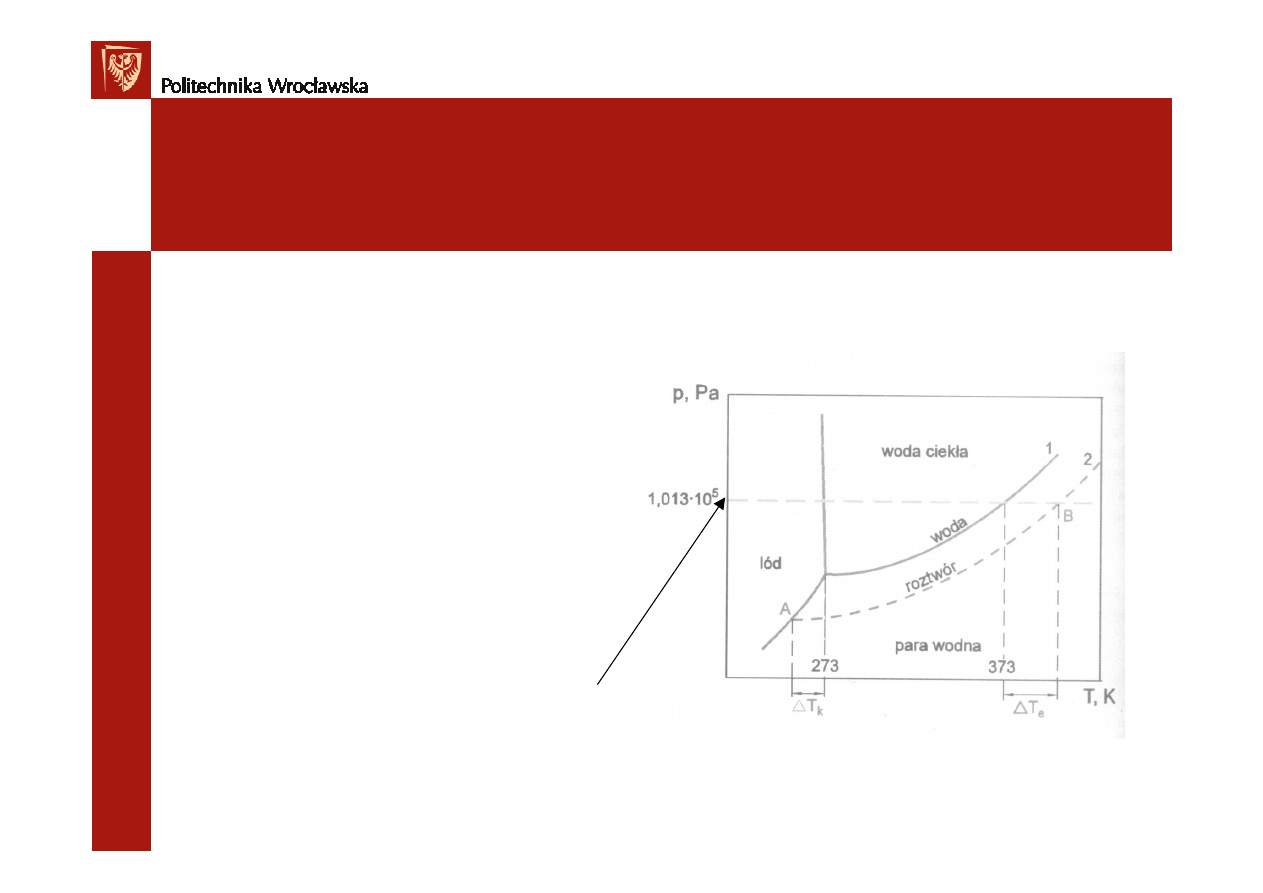
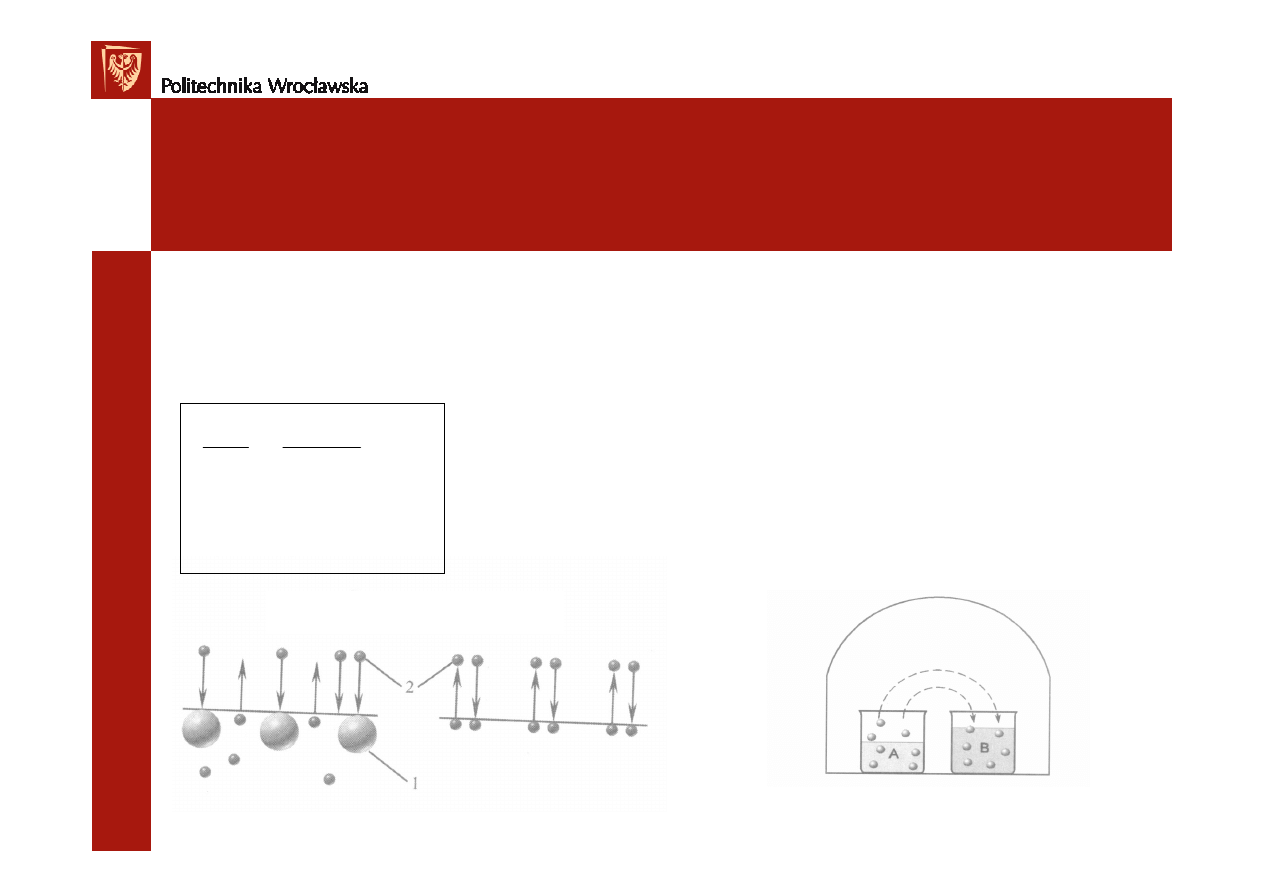
Temperatura wrzenia i krzepnięcia.
Konsekwencja zmiany pr
ęż
no
ś
ci par nad roztworem jest wzrost temperatury
wrzenia i obni
ż
enie temperatur krzepni
ę
cia roztworów w stosunku do czystego
rozpuszczalnika.
1 – pr
ęż
no
ść
pary czystej wody
2 – pr
ęż
no
ść
pary nad roztworem
∆
T
k
–obni
ż
enie temperatury
krzepni
ę
cia roztworu
∆
T
e
– podwy
ż
szenie temperatury
wrzenia roztworu
Diagram fazowy wody i roztworu
ci
ś
nienie atmosferyczne

Temperatura wrzenia i krzepnięcia.
Obni
ż
enie temperatury wrzenia i podwy
ż
szenia temperatury krzepni
ę
cia
s
ą
wprost proporcjonalne do ilo
ś
ci substancji rozpuszczonej w danej
ilo
ś
ci wagowej rozpuszczalnika (do st
ęż
enia molarnego roztworu)
∆
T
k
= E
k
· C
m
r
s
s
k
k
m
M
m
E
T
⋅
⋅
=
∆
m
s
–masa subst. rozpuszczonej, [g]
C
m
–st
ęż
enie molarne roztworu [mol/kg]
m
r
– masa rozpuszczalnika, [kg]
M
s
– masa molowa subst. rozpuszczonej, [g/mol]
E
k
– stała krioskopowa
rozpuszczalnika, molowe
obni
ż
enie temperatury krzepni
ę
cia -zmiana temp.
krzepni
ę
cia, spowodowana dodaniem 1 mola
substancji do1 kg rozpuszczalnika
E
e
– stała ebulioskopwa
rozpuszczalnika, molowe
podwy
ż
szenie temperatury wrzenia -zmiana temp.
wrzenia, spowodowana dodaniem 1 mola substancji
do1 kg rozpuszczalnika
r
s
s
e
e
m
M
m
E
T
⋅
⋅
=
∆
∆
T
e
= E
e
· C
m
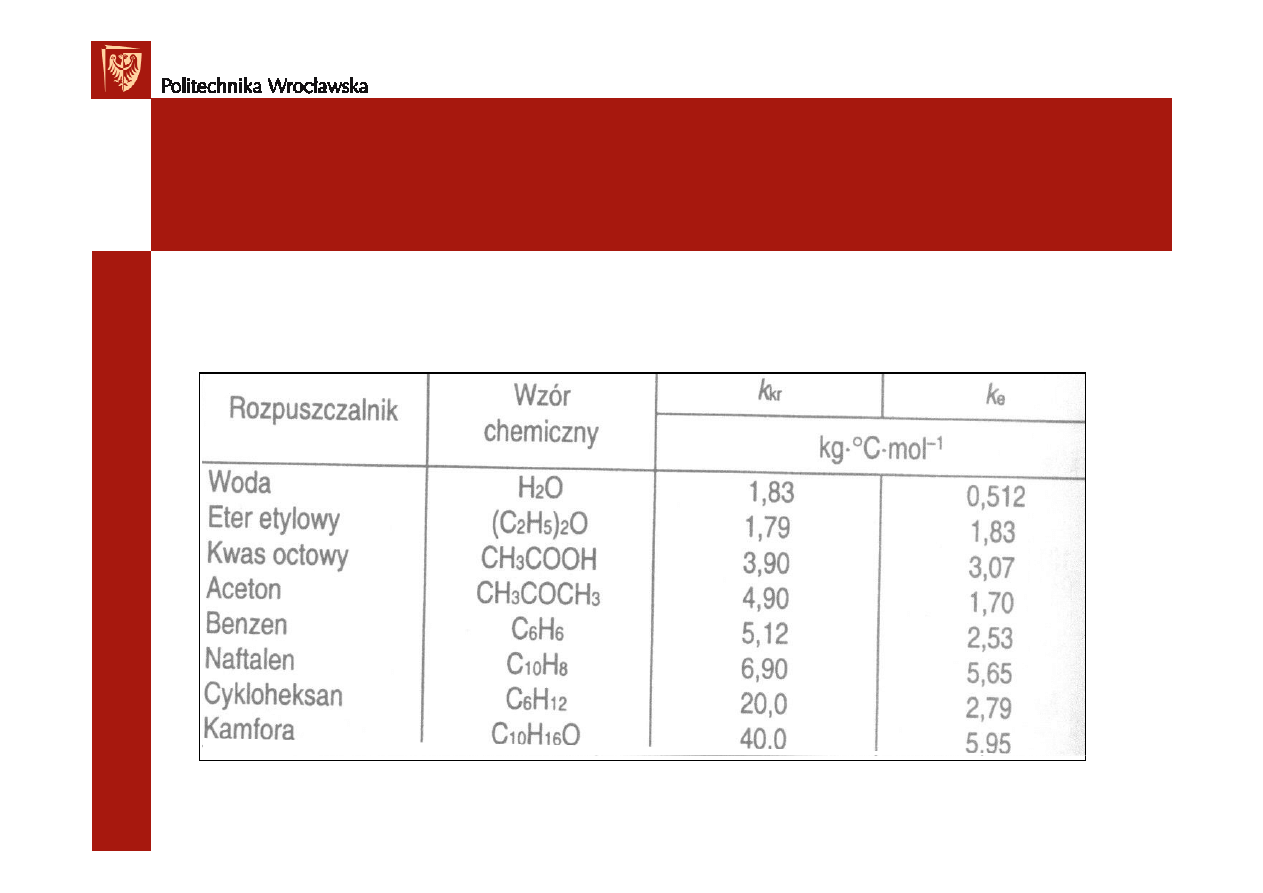
Stałe krioskopowe i ebulioskopowe niektórych rozpuszczalników
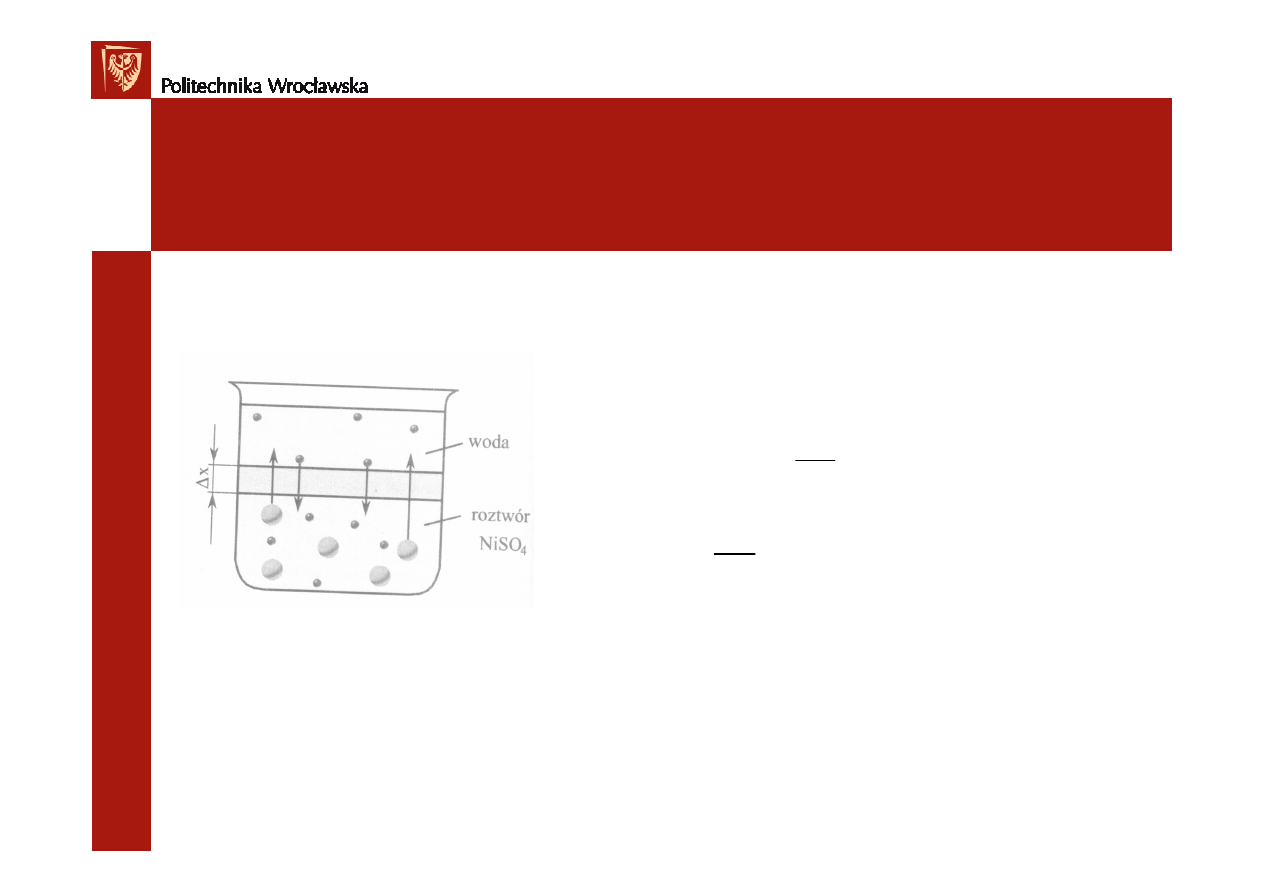
Dyfuzja w roztworach
Dyfuzja
- rozprzestrzenianie si
ę
cz
ą
steczek substancji stałych, ciekłych
lub gazowych, wywołane nieustannym ruchem cz
ą
steczek
Dyfuzja na granicy ciecz- ciecz
Szybko
ść
dyfuzji (prawo Ficka):
dx
dc
S
D
V
⋅
⋅
−
=
dt
dn
V
−
=
dc – ró
ż
nica st
ęż
e
ń
substancji w dwóch warstwach cieczy odległych o dx
S – przekrój warstwy, przez która zachodzi dyfuzja
D – współczynnik dyfuzji
dn/dt –zmiana liczby moli substancji dyfunduj
ą
cej w jednostce czasu przez pow. S
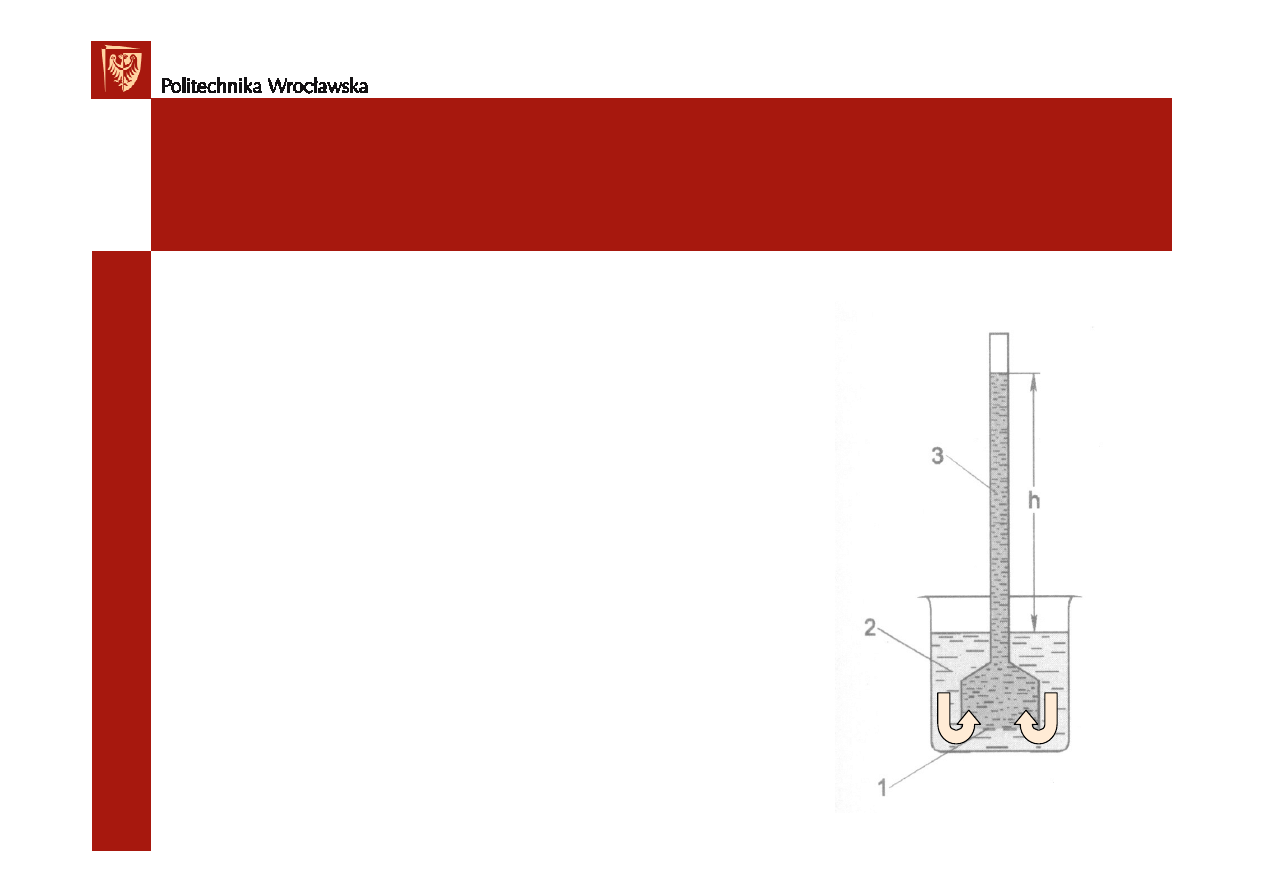
Osmoza
Osmoza
- jednostronna dyfuzja rozpuszczalnika przez błon
ę
półprzepuszczaln
ą
Małe cz
ą
steczki wody przechodz
ą
do roztworu, gdzie
st
ęż
enie wody jest mniejsze. Błona nie przepuszcza du
ż
ych
cz
ą
steczek substancji rozpuszczonej.
Ci
ś
nienie osmotyczne
–je
ż
eli osmoza zachodzi w
zamkni
ę
tym naczyniu (prawo van’t Hoffa):
Π
Π
Π
Π
= c · R · T
błona
półprzepuszczalna
woda
roztwór
Osmometr
C – st
ęż
enie molowe roztworu [mol/dcm
3
]
R – stała gazowa
T - temperatura [K]

Dysocjacja elektrolityczna
Dysocjacja elektrolityczna
– proces rozpadu substancji na jony pod wpływem
rozpuszczalnika
Elektrolity
– substancje, które podczas rozpuszczania rozpadaj
ą
si
ę
na jony
W wodzie – najlepiej dysocjuj
ą
substancje o wi
ą
zaniach jonowych i
kowalencyjnych spolaryzowanych.
wi
ą
zania kowalencyjne
wi
ą
zania jonowe

Dysocjacja elektrolityczna
Schemat dysocjacji:
AB
↔
A
+
+ B
-
lub
A
n
B
m
↔
nA
m+
+ mB
n+
Przykłady:
HNO
3
↔
H
+
+ NO
3
–
Mg(OH)
2
↔
Mg
2+
+ 2OH
-
Ca
3
(PO
4
)
2
↔
3Ca
2+
+ 2PO
4
3-
0
N
N
zd
=
α
Stopie
ń
dysocjacji
–stosunek liczby cz
ą
steczek N
(moli cz
ą
steczek n) rozpadaj
ą
cych si
ę
na jony do
ogólnej liczby cz
ą
steczek (moli cz
ą
steczek)
wprowadzonych do roztworu
%
100
0
⋅
=
n
n
zd
α
lub
1
0
<
<
α
%
100
%
0
<
<
α
Stopie
ń
dysocjacji zale
ż
y od:
•rodzaju elektrolitu
•st
ęż
enia roztworu (wzrasta z rozcie
ń
czeniem
roztworu)
•temperatury (wzrasta ze wzrostem temperatury
•obecno
ś
ci innych substancji w roztworze
W roztworze panuje równowaga
mi
ę
dzy cz
ą
steczkami
niezdysocjowanymi i jonami.

Dysocjacja elektrolityczna.
Moc elektrolitów
Elektrolity mocne
(
α
≈
100%):
•cz
ęść
kwasów nieorganicznych, np. HCl, HBr, HI, H
2
SO
4
, HNO
3
, HClO
4
,
•wodorotlenki litowców i berylowców (z wyj
ą
tkiem Be(OH)
2
i Mg(OH)
2
),
•prawie wszystkie rozpuszczalne sole (wyj
ą
tek: niektóre sole rt
ę
ci, kadmu i cynku).
•Elektrolity słabe
(
α
= kilka%):
•cz
ęść
kwasów nieorganicznych, np. H
2
S, HCN, H
2
CO
3
, H
2
SO
3
, H
3
BO
3
,
•cz
ęść
wodorotlenków nieorganicznych, np. NH
4
OH, wi
ę
kszo
ść
wodorotlenków
metali II- i III- warto
ś
ciowych,
•wi
ę
kszo
ść
kwasów organicznych, np. CH
3
COOH, HCOOH.
•Elektrolity
ś
redniej mocy:
•H
3
PO
4
, H
3
AsO
4
, Mg(OH)
2
.

Aktywność jonów
• Mocne elektrolity s
ą
dobrymi przewodnikami pr
ą
du.
• Przepływ pr
ą
du zwi
ą
zany jest z przepływem masy (jonów)
• Elektrolity nazywane s
ą
przewodnikami elektryczno
ś
ci drugiego rodzaju.
• Przewodnictwo maleje ze wzrostem st
ęż
enia (
α
< 100%) – oddziaływanie
elektrostatyczne mi
ę
dzy jonami ró
ż
noimiennymi.
Aktywno
ść
jonów:
a = f · C
f - współczynnik aktywno
ś
ci
C- st
ęż
enie roztworu.
a – wyznaczane jest do
ś
wiadczalnie na podstawie przewodnictwa (a <
α
, f <1).
f=1
– dla roztworów o niesko
ń
czenie wielkim rozcie
ń
czeniu.
Stopie
ń
dysocjacji elektrolitów mocnych zale
ż
y od st
ęż
enia roztworu.
α
= 1 dla roztworów o du
ż
ym rozcie
ń
czeniu.

Stała dysocjacji elektrolitycznej
W słabych elektrolitach wyst
ę
puje równowaga miedzy cz
ą
steczkami
niezdysocjowanymi i jonami. Jest to równowaga dynamiczna, reakcja dysocjacji
zachodzi w obie strony:
HNO
2
↔
H
+
+ NO
2-
Mg(OH)
2
↔
Mg
+
+ 2OH
-
Miar
ą
mocy słabych elektrolitów jest stała równowagi reakcji dysocjacji.
Stała dysocjacji
–stosunek iloczynu st
ęż
e
ń
jonów do st
ęż
enia cz
ą
steczek
niezdysocjowanych
]
[
]
[
]
[
2
2
2
HNO
NO
H
K
HNO
−
+
⋅
=
]
)
(
[
]
[
]
[
2
2
2
)
(
2
OH
Mg
OH
Mg
K
OH
Mg
−
+
⋅
=
• Stała K jest charakterystyczna dla danego elektrolitu,
• nie zale
ż
y od st
ęż
enia elektrolitu (nie wyznacza si
ę
dla mocnych elektrolitów),
• jej warto
ść
ro
ś
nie ze wzrostem temperatury.

Stała dysocjacji elektrolitycznej
Dysocjacja wielostopniowa
(np. H
2
CO
3
, H
3
PO
4
, Fe(OH)
2
):
Etap I. H
2
CO
3
↔
H
+
+ HCO
3
-
K
1
=4,5·10
-7
Etap II. HCO
3
-
↔
H
+
+ CO
3
-
K
2
=4,7·10
-11
Dysocjacja w kolejnych etapach słabnie: K1>K2>K3
Elektrolity słabe: K< 10
-4
Elektrolity
ś
redniej mocy: 10
-4
<K<10
-2
Elektrolity mocne: K>1 (nie okre
ś
la si
ę
stałej dysocjacji)
H
2
SO
3
K1 = 1,6 · 10
-2
K2 = 6,3 · 10
-8
H
2
SO
4
K1 = ok. 10
3
K2 = 1,2 · 10
-2
HF K = 6,3 · 10
-4
HNO
3
K = 25
H
3
PO
4
K1 = 7,5 · 10
-3
K2 = 6,3 · 10
-8
K3 = 1,3 · 10
-12
Al(OH)
3
K3 = 1,4 · 10
-9
AgOH
K = 1,1 · 10
-4
NH3 (aq) K = 1,8 · 10
-5
Cu(OH)
2
K2 = 1,3 · 10
-4
Fe(OH)
2
K2 = 1,3 · 10
-4
Fe(OH)
3
K2 = 1,8 ·
10-11
K3 = 1,4 · 10
-12
Mg(OH)
2
K2 = 2,5 · 10
-3

Stała dysocjacji elektrolitycznej
Ogólny przypadek dysocjacji wielostopniowej:
Etap I:
A + B
↔
C + D
Etap II: C + D
↔
E + F
Reakcja sumaryczna:
A + B
↔
E + F
]
][
[
]
][
[
1
B
A
D
C
K
=
]
][
[
]
][
[
2
D
C
F
E
K
=
2
1
K
K
K
⋅
=
K
1
=4,5·10
-7
, K
2
=4,7·10
-11
,
K = 2·10
-17
Przypadek ogólny:
aA + bB
↔
cC + dD
b
a
d
c
B
A
D
C
K
]
[
]
[
]
[
]
[
=
Prawo działania mas C. M. Guldberga, P. Waagego

Prawo rozcieńczeń Ostwalda
Prawo rozcie
ń
cze
ń
dotyczy słabych elektrolitów, dysocjuj
ą
cych na jeden jon
dodatni i jeden ujemny.
0
n
n
zd
=
α
Stopie
ń
dysocjacji :
n
0
= c – st
ęż
enie molowe roztworu
c
n
zd
⋅
=
α
c
c
c
c
c
K
⋅
≈
−
=
−
⋅
=
2
2
1
)
1
(
α
α
α
α
α
α
α
<< 1
c
K
=
α
Prawo rozcie
ń
cze
ń
Ostwalda
– zale
ż
no
ść
stopnia dysocjacji słabego elektrolitu
od st
ęż
enia roztworu:
•stopie
ń
dysocjacji słabych elektrolitów wzrasta wraz ze wzrostem rozcie
ń
czenia
roztworu,
•wszystkie roztwory o skrajnie małym rozcie
ń
czeniu s
ą
zdysocjowane całkowicie,
•im wi
ę
ksza warto
ść
stałej dysocjacji, tym wi
ę
ksza warto
ść
stopnia dysocjacji i tym
mocniejszy elektrolit.

Teoria kwasów i zasad.
Teoria jonowa Arrheniusa
Kwas - zwi
ą
zek odszczepiaj
ą
cy w roztworach wodnych jony wodorowe H
+
HA = H
+
+ A
-
Zasada - zwi
ą
zek odszczepiaj
ą
cy w roztworach wodnych jony wodorotlenowe OH
-
MOH = M
+
+ OH
-
Na podstawie tej teorii nie da si
ę
wyja
ś
ni
ć
, dlaczego:
• w roztworach wodnych nie wyst
ę
puj
ą
swobodne protony H
+
lecz hydrony H
3
O
+
(jony hydronowe),
•amoniak NH
3
rozpuszczony w wodzie ma wła
ś
ciwo
ś
ci zasadowe,
•niektóre sole nie zawieraj
ą
ce jonu wodorowego zachowuj
ą
si
ę
w roztworze
wodnym jak kwasy (AsCl
3
, Fe(NO
3
)
3
),
•sole takie jak Na
2
S, KCN nie zawieraj
ą
ce w cz
ą
steczce jonu OH
-
wykazuj
ą
odczyn zasadowy,
•i wiele innych.
Teoria Arrheniusa dotyczy roztworów wodnych i rozpadu substancji na jony pod
wpływem cz
ą
steczek wody.

Teoria kwasów i zasad.
Teoria protonowa Brönsteda i Lowry’ego
Podstaw
ą
definicji kwasu jest zdolno
ść
przechodzenia protonu od cz
ą
steczki
kwasu do cz
ą
steczki wody (rozpuszczalnika).
Kwasem – jest donor protonów
Zasad
ą
– jest akceptor protonów
HCl + H
2
O
↔
H
3
O
+
+Cl
-
NH
3
+ H
2
O
↔
NH
4
+
+OH
-
kwas zasada kwas zasada
zasada kwas zasada kwas
•Dysocjacja to chemiczna reakcja z rozpuszczalnikiem, który mo
ż
e spełnia
ć
role
kwasu lub zasady. Woda jest rozpuszczalnikiem amfoterycznym.
•Powstaj
ą
sprz
ęż
one pary kwas-zasada: HCl - Cl
-
, H
2
O – H
3
O
+
, NH
3
– NH
4
+
.
•Proces dysocjacji polega na współdziałaniu kwasu z zasad
ą
i wytworzeniu
sprz
ęż
onej z nim nowej zasady i nowego kwasu.
•Przej
ś
cie protonu zale
ż
y nie tylko od zdolno
ś
ci kwasu do oddawania protonu,
lecz równie
ż
od zdolno
ś
ci zasady do jego przyjmowania.
•Moc kwasów mo
ż
na porównywa
ć
jedynie w stosunku do tej samej zasady
(rozpuszczalnika)

Teoria kwasów i zasad.
Teoria Lewisa
Zasad
ą
– jest ka
ż
dy donor pary elektronowej (zwi
ą
zek posiadaj
ą
cy woln
ą
par
ę
el.)
Kwasem – jest akceptor pary elektronowej (substancja przyjmuj
ą
ca par
ę
elektronow
ą
z utworzeniem wi
ą
zania koordynacyjnego)
Kwasem jest wi
ę
c proton H
+
(w poprzednich teoriach: HCl, HNO
3
),cz
ą
steczka BF
3
,
jon Co
3+
(jon przył
ą
czaj
ą
cy ligandy).
Zasad
ą
jest cz
ą
steczka NH
3
, posiadaj
ą
ca woln
ą
par
ę
elektronow
ą
, jon F
-
..
H : N :
˙˙
H
H
+ H
+
→
..
H : N : H
˙˙
H
H
+
..
F : B
˙˙
F
F
..
F : B : F
˙˙
F
F
-
+ F
-
→
zasada kwas kwas
kwas zasada zasada
Teoria Arrheniusa jest szczególnym przypadkiem uogólnionych teorii
kwasów i zasad.

Rozpuszczalność i iloczyn rozpuszczalności
prawo działania mas
Stała dysocjacji:
Iloczyn rozpuszczalno
ś
ci okre
ś
la si
ę
dla roztworów nasyconych, pozostaj
ą
cych w
równowadze z nadmiarem substancji rozpuszczanej. Dla substancji słabo
rozpuszczalnej, dysocjuj
ą
cej na jony, ustala si
ę
równowaga:
)
(
)
(
]
[
]
[
]
[
s
y
x
y
x
x
y
s
A
M
A
M
A
M
K
y
x
−
+
⋅
=
M
x
A
y (s)
↔
xM
y+
+ yA
x-
poniewa
ż
[M
x
A
y
]
(s)
= const. - st
ęż
enie substancji w fazie stałej
y
x
x
y
s
A
M
A
M
L
y
x
]
[
]
[
)
(
−
+
⋅
=
Stał
ą
dysocjacji mo
ż
na zast
ą
pi
ć
wyra
ż
eniem:
iloczyn rozpuszczalno
ś
ci
Iloczyn rozpuszczalno
ś
ci
- iloczyn st
ęż
e
ń
jonów trudno rozpuszczalnego
elektrolitu w jego roztworze nasyconym . Jest on miar
ą
rozpuszczalno
ś
ci
substancji w danej temperaturze.

Rozpuszczalność i iloczyn rozpuszczalności
Przykłady
CaSO
4
↔
Ca
+
+ SO
4
2-
L
BaSO4
= [Ca
2+]
·[SO
4
2-
]
L = 9,1·10
-6
AgCl
↔
Ag
+
+ Cl
-
L
AgCl
= [Ag
+
]·[Cl
-
]
L=1,8 ·10
-10
Ag
2
S
↔
2Ag
+
+S
2-
L
Ag2S
= [Ag
+
]
2
·[S
2-
]
L=6,3·10
-50
Na podstawie L mo
ż
emy obliczy
ć
rozpuszczalno
ść
zwi
ą
zku w mol/litr lub w
g/100ml: L
Ag2S
= [Ag
+
]
2
·[S
2-
] = (2x)
2
·x = 4x
3
x- st
ęż
enie jonów S
2-
3
4
L
x
=
[mol/litr]
→
x · M/10 [g/100ml]
M – masa molowa Ag
2
S
Je
ż
eli: [Ag
+
]
2
·[S
2-
] < L – roztwór nienasycony
[Ag
+
]
2
·[S
2-
] =L - roztwór nasycony
[Ag
+
]
2
·[S
2-
] > L – z roztworu wytr
ą
ca si
ę
osad
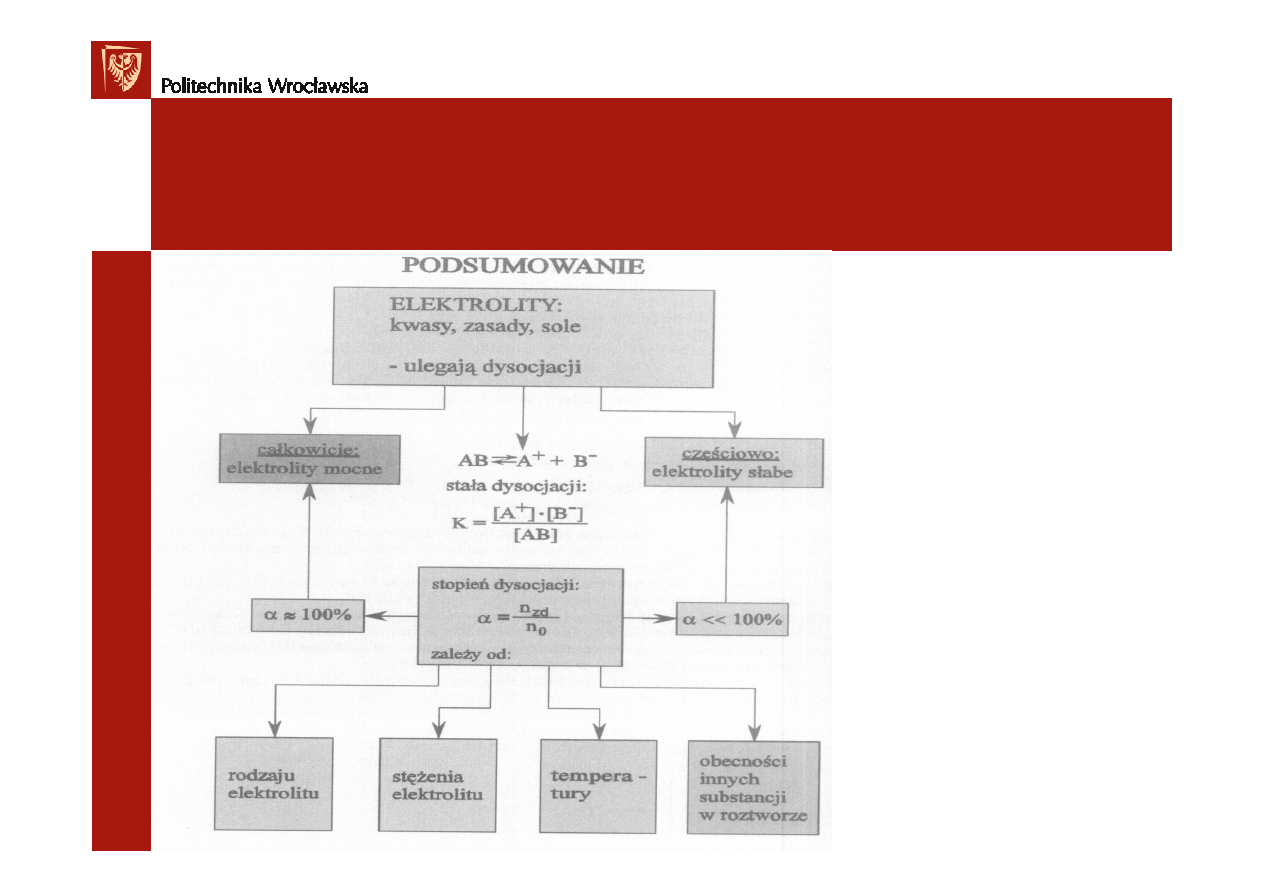
Podsumowanie

Dysocjacja wody, pH roztworów
Woda jest słabym elektrolitem
H
2
O
↔
H
+
+ OH
-
lub
H
2
O
↔
H
3
O
+
+ OH
-
Stała dysocjacji:
16
2
10
8
,
1
]
[
]
[
]
[
2
−
−
+
⋅
=
⋅
=
O
H
OH
H
K
O
H
[H
2
O]=55,55 mol/dm
3
(1000g = n·M
H2O
M
H2O
=18g/mol)
Iloczyn jonowy wody:
L
H2O
= [H
+
]·[OH
-
] =10
-14
[H
+
] = [OH
-
] =10
-7
mol/dm
3
[H
+
] =10
-7
mol/dm
3
- roztwór oboj
ę
tny
[H
+
] > 10
-7
mol/dm
3
- roztwór kwa
ś
ny
[H
+
]< 10
-7
mol/dm
3
- roztwór zasadowy

pH roztworów
pH (współczynnik Sörensena)
– ujemny logarytm ze st
ęż
enia jonów wodorowych
pH = -log [H
+
]
pH =7
- roztwór oboj
ę
tny
pH <7
- roztwór kwa
ś
ny
pH >7
- roztwór zasadowy
St
ęż
enie rzeczywistych elektrolitów:
Cj = f·C
M
·
αααα
·n
C
M
– st
ęż
enie molowe
α
- stopie
ń
dysocjacji
n - liczba jonów powstaj
ą
cych z
jednej cz
ą
steczki elektrolitu
f – współczynnik aktywno
ś
ci jonów
Przykład:
H
2
SO
4
↔
2H
+
+ SO
4
-
C
M
=0,005;
α
=1, f = 1, n=2
[H
+
] = 0,005 ·1 ·2 = 10
-2
mol/cm
3
pH = 2
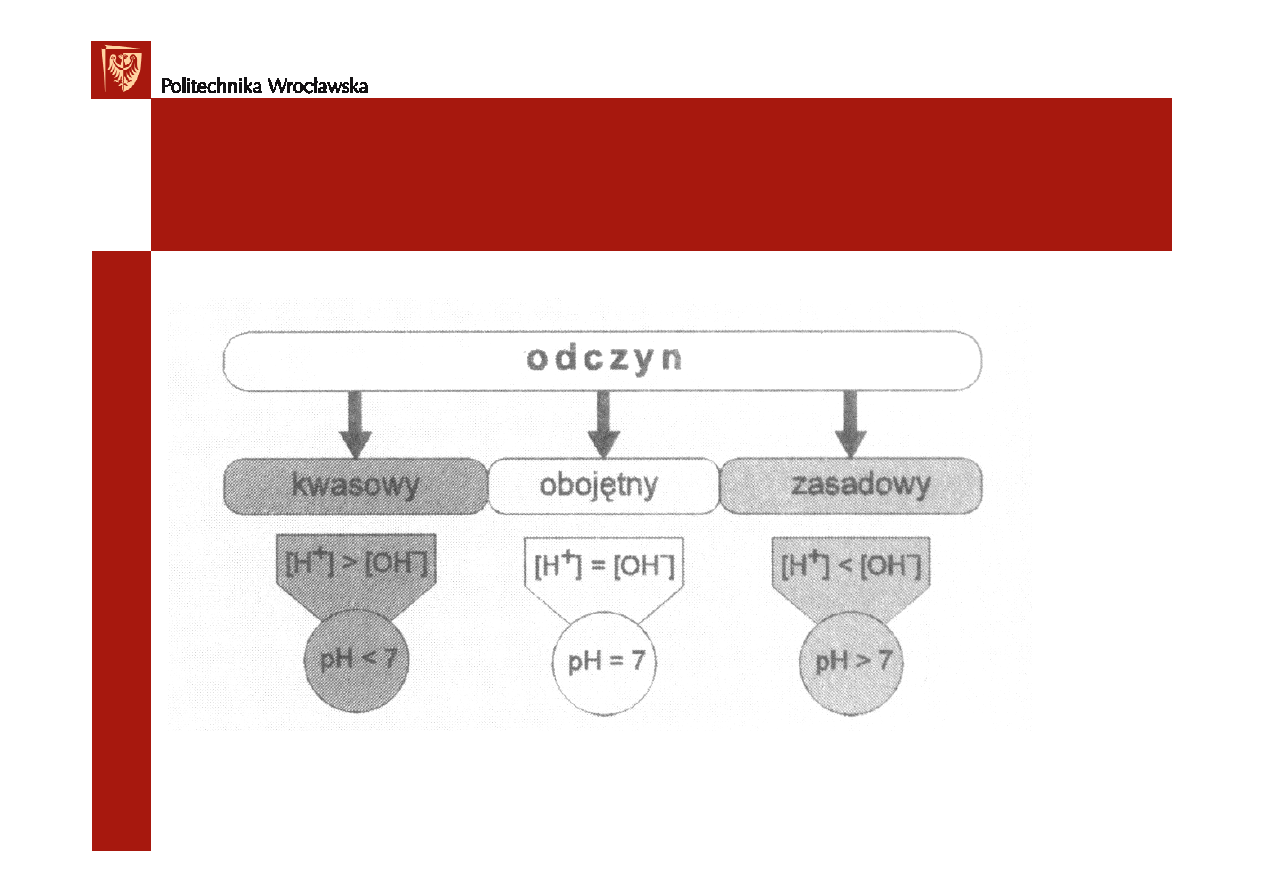
Podsumowanie

Roztwory buforowe
Bufory
– mieszaniny maj
ą
ce zdolno
ść
przeciwdziałania zmianom pH.
Składaj
ą
si
ę
ze słabych kwasów lub słabych zasad i ich soli.
Bufor amonowy
: NH
4
OH (NH
3
·H
2
O) -słaba zasada
NH
4
Cl
- sól tej zasady i mocnego kwasu
NH
4
Cl
↔
NH
4
+
+ Cl
-
protonodawca reaguje z dodawana zasad
ą
:
protonodawca
NH
4
+
+ OH
-
↔
NH
4
OH
NH
3
+ H
2
O
↔
NH
4
+
+OH
-
protonobiorca reaguje z dodawanym kwasem:
protonobiorca
NH
3
+ H
+
↔
NH
4
+
pH roztworu nie ulega zmianom
Mieszanin
ą
buforowa jest ka
ż
dy układ zawieraj
ą
cy protonodawc
ę
i protonobiorc
ę
.

Wskaźniki kwasowo - zasadowe
Wska
ź
niki (indykatory) – słabo zdysocjowane kwasy lub zasady organiczne,
których jony wykazuj
ą
odmienne zabarwienie ni
ż
niezdysocjowane cz
ą
steczki.
Np. fenoloftaleina: niezdysocjowane cz
ą
steczki s
ą
bezbarwne, aniony R
-
s
ą
malinowe.
HR
↔
H
+
+ R
-
r. bezbarwny r. malinowy
- po dodaniu kwasu H
+
- reakcja przebiega w lewo – roztwór jest bezbarwny,
-po dodaniu zasady – reakcja przebiega w prawo – roztwór malinowy
Gdy w roztworze jest 50% cz
ą
steczek zdysocjowanych –pojawia si
ę
barwa
po
ś
rednia. Ka
ż
dy wska
ź
nik ma okre
ś
lony zakres pH, w którym nast
ę
puje zmiana
barwy.
]
[
]
[
]
[
HR
R
H
K
HR
−
+
⋅
=
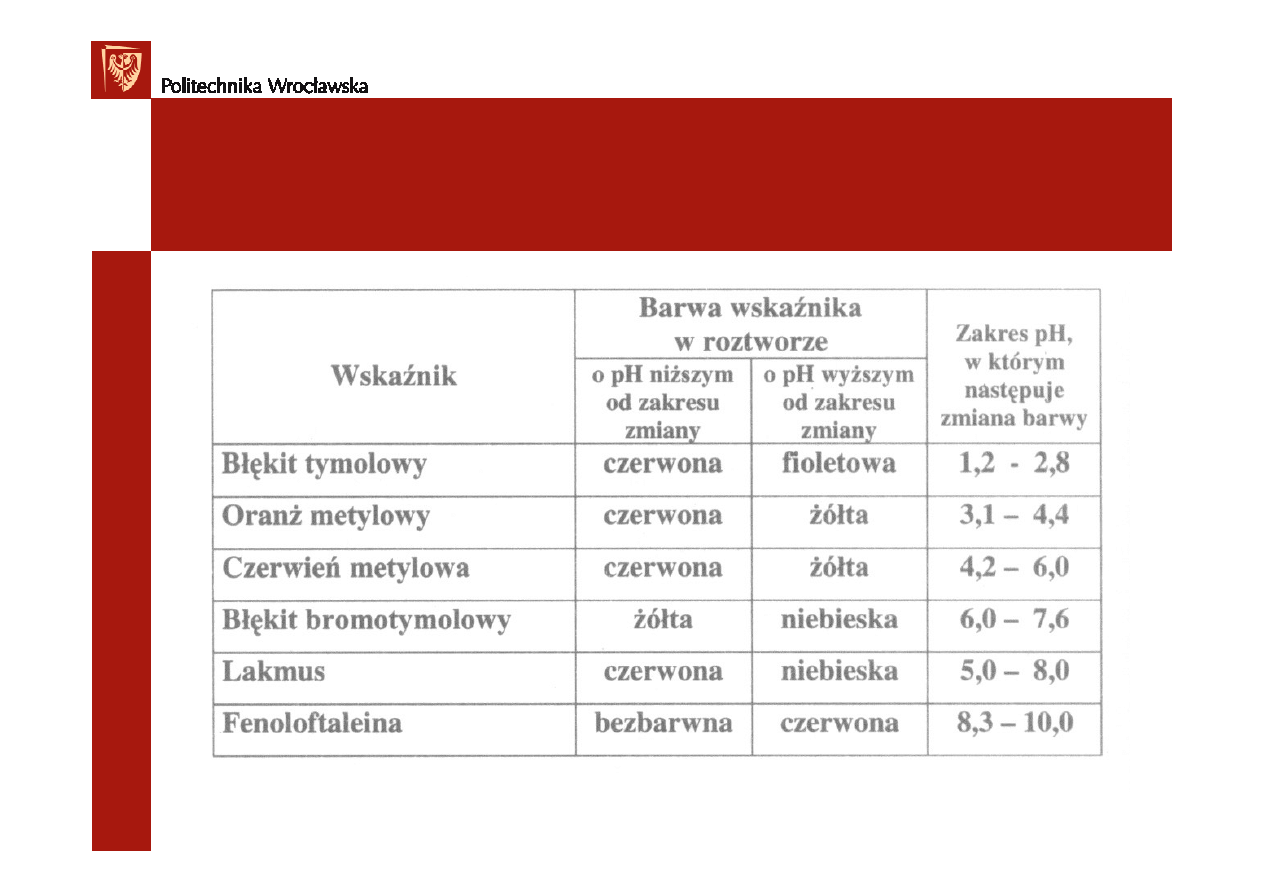
Wskaźniki kwasowo - zasadowe

Reakcje w roztworach wodnych
hydroliza
sól + woda
kwas + zasada
zoboj
ę
tnienie
Hydrolizie ulegaj
ą
tylko te sole, których jony maja zdolno
ść
przyjmowania lub oddawania protonów w
ś
rodowisku wodnym:
•sole słabych kwasów i mocnych zasad
•sole mocnych kwasów i słabych zasad
•sole słabych kwasów i słabych zasad
Sole mocnych kwasów i mocnych zasad nie hydrolizuj
ą
Reakcje jonowe – reakcje zachodz
ą
ce w wodnych roztworach elektrolitów
1.Reakcje miedzy jonami i cz
ą
steczkami (wody)
- hydroliza soli
2.Reakcje mi
ę
dzy jonami
- powstaje substancja słabo zdysocjowana
- zachodz
ą
reakcje zoboj
ę
tnienia
- powstaje substancja trudno rozpuszczalna
3.Reakcje mi
ę
dzy jonami i atomami
- wypieranie wodoru z kwasów

1.Hydroliza soli
• Hydroliza soli mocnych kwasów i słabych zasad, np. NH
4
Cl ( NH
4
OH i HCl)
NH
4
Cl + H
2
O = NH
4
OH + H
+
+ Cl
-
NH
4
+
+ Cl
-
+ H
2
O = NH
4
OH +H
+
+ Cl
-
NH
4
+
+H
2
O = NH
4
OH + H
+
Powstaje słaba zasada (w niewielkim stopniu zdysocjowana na jony), odczyn
roztworu jest kwa
ś
ny (pH<7)
•Hydroliza soli słabych kwasów i mocnych zasad, np. CH
3
COONa
CH
3
CONa + H
2
O = CH
3
COOH + Na
+
+ OH
-
CH
3
COO
-
+ Na
+
+ H
2
O = CH
3
COOH + Na
+
+ OH
-
CH
3
COO
-
+ H
2
O = CH
3
COOH + OH
-
Powstaje słaby kwas, odczyn otrzymanego roztworu jest zasadowy (pH > 7).
•Hydroliza soli słabych kwasów i słabych zasad, np. CH
3
COONH
4
CH
3
COONH
4
+ H
2
O = CH
3
COOH + NH
4
OH
Powstaje słaby kwas i słaba zasada. Odczyn mo
ż
e by
ć
lekko kwasowy lub lekko
zasadowy lub oboj
ę
tny, w zale
ż
no
ś
ci od tego, jaka jest moc utworzonych w
wyniku hydrolizy kwasu i zasady.

2.Reakcje między jonami
Zachodz
ą
wówczas, gdy w wyniku reakcji powstaje:
a) substancja słabo zdysocjowana
b) substancja trudno rozpuszczalna
a) NH
4
Cl + NaOH +NH
4
OH + NaCl
NH
4
+
+ Cl
-
+ Na
+
+OH
-
= NH
4
OH + Na
+
+ Cl
-
NH
4
+
+OH
-
= NH
4
OH
Reakcja zoboj
ę
tnienia
HCl + NaOH = NaCl + H
2
O
H
+
+ Cl
-
+ Na
+
+ OH
-
= H
2
O + Na
+
+ Cl
-
H
+
+ OH
-
= H
2
O
b) HCl + AgNO
3
= AgCl
↓
+HNO
3
H
+
+ Cl
-
+ Ag
+
+ NO
3
-
= AgCl
↓
+ H
+
+ NO
3
-
Ag
+
+ Cl
-
= AgCl
↓
3.Reakcje między jonami i atomami
Metale zwykle oddaj
ą
elektrony - wyst
ę
puj
ą
jako jony dodatnie.
Fe + O
2
→
FeO
2
- reakcje redox
Fe
0
→
Fe
2+
+2e -utlenianie 2O
0
+2e
→
2O
2-
- redukcja
Zn + Cu
2+
+ SO
4
2-
→
?
Zn + 2H
+
+ SO
4
2-
→
?
Cu + Zn
2+
+ 2Cl
-
→
?
Cu + 2H
+
+ 2Cl
-
→
?
Do
ś
wiadczenie:
M
s
↔
M
aq
n+
+ne
Na przebieg reakcji wpływa:
1. Energia sieci
2. Energia hydratacji

3.Reakcje między jonami i atomami
Aby okre
ś
li
ć
kierunek przebiegu tej reakcji nale
ż
y okre
ś
li
ć
potencjał na granicy
roztwór – elektroda. Potencjał ten wyznacza si
ę
wzgl
ę
dem
standardowego
półogniwa wodorowego.
Standardowy potencjał metalu E
0
–
to ró
ż
nica potencjałów mi
ę
dzy
półogniwem z rozpatrywanego metalu a standardowym ogniwem wodorowym
Metale uporz
ą
dkowane według wzrastaj
ą
cego potencjału standardowego
stanowi
ą
szereg napi
ę
ciowy metali.
W szeregu tym
potencjał standardowy wodoru wynosi 0
(E
0
= 0)
Metale o potencjale ujemnym s
ą
mniej szlachetne od wodoru i b
ę
d
ą
wypiera
ć
wodór z roztworu (b
ę
d
ą
si
ę
rozpuszcza
ć
w kwasach):
Me + nH
+
→
Me
n+
+ n/2 H
2
Metale szlachetne (o potencjale dodatnim) nie rozpuszczaj
ą
si
ę
w kwasach.
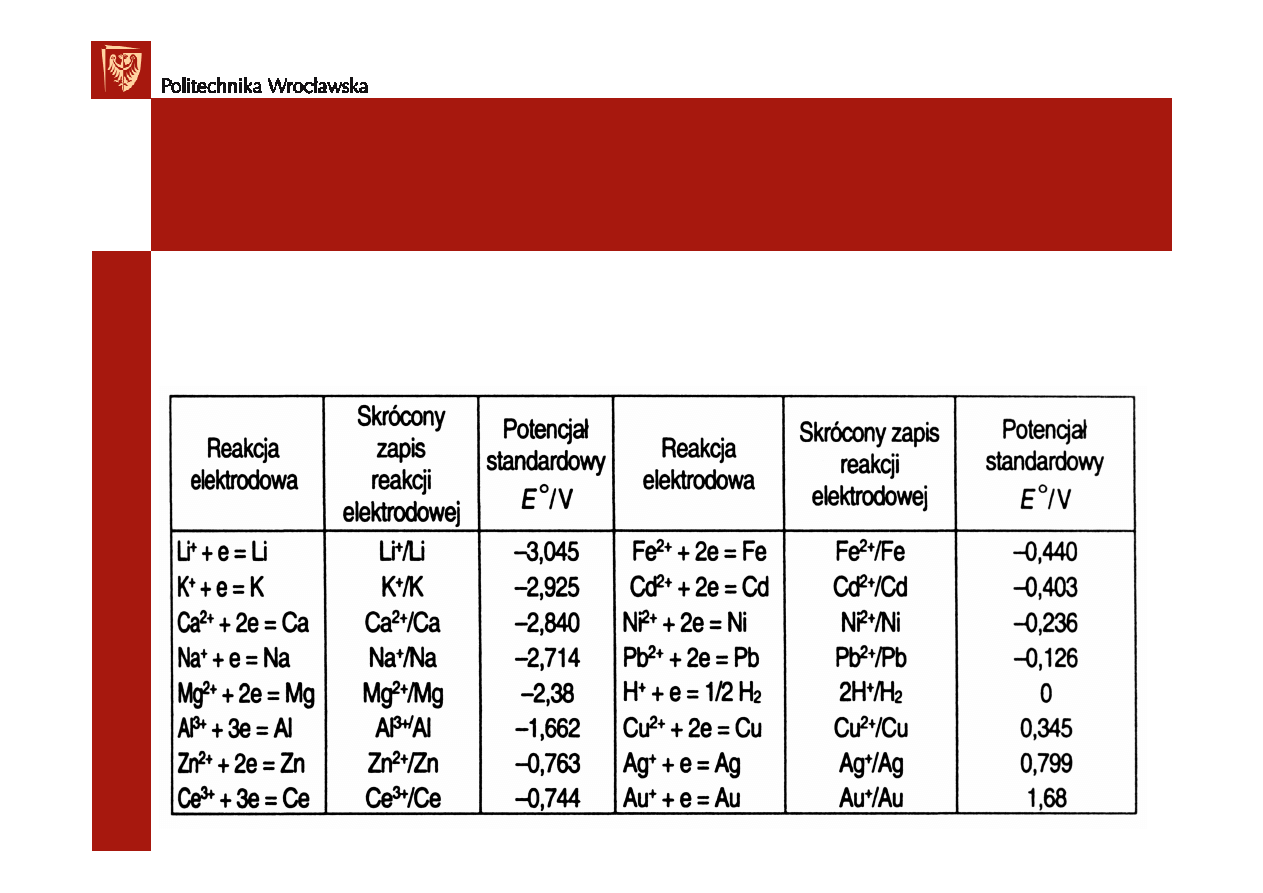
3.Reakcje między jonami i atomami
Je
ż
eli do roztworu jonów jednego metalu zanurzymy płytk
ę
z drugiego metalu, to
wymiana jonów zajdzie wtedy, gdy do roztworu jonów metalu bardziej
szlachetnego zanurzymy metal mniej szlachetny.
Wyszukiwarka
Podobne podstrony:
więcej podobnych podstron