
La maladie de Legg-Perthes-Calvé : challenge
étiologique, thérapeutique et pronostique
Legg-Calve-Perthes disease
M. Dutoit
Hôpital orthopédique de la Suisse romande, avenue Pierre-Decker 4, 1005 Lausanne, Suisse
Disponible sur internet le 30 novembre 2006
Résumé
La maladie de Legg-Perthes-Calvé (LPC) demeure, malgré les progrès réalisés, une affection difficile et déroutante à
traiter. Après un rappel des éléments essentiels de la définition et de l’étiologie, de la physiopathologie et des
manifestations cliniques, le rôle et la place des investigations complémentaires actuellement à disposition (radiogra-
phie, scintigraphie et surtout IRM) sont précisés. Ces examens complémentaires ainsi que leur évolution permettent
de mieux cerner le pronostic et, par conséquent, le traitement. Les facteurs importants dans la prise en charge et le
pronostic de la maladie de LPC sont : 1) âge du patient, bon pronostic dans la règle sans traitement avant l’âge de
cinq ans ; 2) pronostic réservé après l’âge de neuf ans, même après traitement chirurgical ; 3) étendue de la nécrose
épiphysaire, en particulier du pilier externe ; 4) excentration de la hanche quel que soit l’âge de l’enfant. Il n’y a
toujours pas de traitement causal de cette affection. Les traitements conservateurs et chirurgicaux visent à prévenir
l’installation de déformation ou d’« incongruence » articulaire, responsables de coxarthrose dès la quatrième
décennie. La place respective des traitements conservateurs et chirurgicaux est analysée ainsi que leurs indications et
leurs complications.
© 2006 Elsevier Masson SAS. Tous droits réservés.
Abstract
Treatment of Legg-Calvé-Perthes disease remains, in spite of realized progresses, difficult and disturbing. The
important factors for establishing diagnosis concerning definition, etiology, physiopathology and clinical manifesta-
tions are reminded. The role of present complementary investigations as well as their evolution are very important
to better establish the prognosis and the treatment. The most important factors for treating and establishing the
prognosis of LPC are: 1) age. The prognosis is good in almost every case before 5 years old, without any treatment;
2) the prognosis is not good after 9 years, also, very often, after surgical treatment; 3) area of the epiphyseal necrosis,
particularly of the lateral pillar; 4) extrusion of the hip at any age. Today, there is always no causal treatment of
Legg-Calvé-Perthes disease. Conservative and surgical treatment aims to prevent deformities of the femoral head
accompanied or not by articular incongruency, responsible for hip arthritis from the fourth decade. The place of
conservative and surgical treatment as well as their complications are described; it aims to guide the spontaneous
recovery with as little as possible, deformation of the femoral epiphysis.
© 2006 Elsevier Masson SAS. Tous droits réservés.
Mots clés : Ostéonécrose ; Hanche ; Croissance ; Enfants
Keywords: Osteonecrosis; Hip; Growth; Children
Adresse e-mail : Michel.Dutoit@chuv.ch (M. Dutoit).
Archives de pédiatrie 14 (2007) 109–115
0929-693X/$ - see front matter © 2006 Elsevier Masson SAS. Tous droits réservés.
doi:10.1016/S0929-693X(06)00523-9

Cela fera bientôt cent ans que Legg à Boston, Calvé en
France et Perthes en Allemagne ont décrit quasiment simul-
tanément la même affection, qu’ils ont pu, grâce à l’essor
débutant de la radiologie, distinguer de la tuberculose. Le
terme d’ostéochondrite primitive doit être abandonné car il
ne s’agit pas d’une affection de la tête fémorale osseuse et
cartilagineuse, mais plutôt d’une ostéonécrose primitive ; le
cartilage articulaire n’est jamais atteint d’emblée !
Si des progrès importants concernant l’étiologie, le dia-
gnostic et l’imagerie ont été réalisés au cours des dernières
décennies, les grands principes thérapeutiques ont peu évo-
lués et font encore l’objet de discussions allant de l’absten-
tion (traitement symptomatique) à la chirurgie. Il est dès lors
difficile de proposer une conduite thérapeutique univoque
qui, de plus, devra être adaptée à l’évolution de l’affection.
1. DÉFINITION ET ÉTIOLOGIE
La maladie de Legg-Perthes-Calvé (LPC) est une affection
ischémique de l’épiphyse fémorale proximale en croissance,
d’origine vasculaire, d’étiologie indéterminée, caractérisée
par une nécrose du noyau d’ossification de la tête fémorale.
La revascularisation osseuse survient toujours avec ou sans
traitement ; les déformations de la tête fémorale surviennent
essentiellement durant cette phase de revascularisation.
L’étiologie demeure obscure malgré toutes les hypothè-
ses émises et recherches effectuées à ce jour. Le rôle des
microtraumatismes répétés, d’une synovite aiguë transitoire
préalable n’est pas clairement établi. L’hyperpression articu-
laire ainsi générée peut-elle entraîner un ralentissement ou
un arrêt circulatoire suffisant pour entraîner une nécrose de
l’épiphyse fémorale proximale dont la vascularisation est
vulnérable ? (Long trajet intracapsulaire de l’artère nourri-
cière, branche de l’artère circonflexe fémorale médiale.)
L’hypercoagulabilité sanguine a été évoquée comme fac-
teur associé susceptible de favoriser les thromboses dans un
réseau vasculaire vulnérable. Les études sont contradictoi-
res et ne permettent pas de conclure : il est de plus difficile
d’admettre qu’une perturbation généralisée entraîne une
atteinte articulaire isolée de la hanche.
Des perturbations du retour veineux avec stase en amont
et nécrose secondaire n’ont pas, à ce jour, fait la preuve de
leur existence car les études artériographiques et scintigra-
phiques confirment l’origine artérielle vraisemblable de la
maladie de LPC.
Il n’y a pas de prédisposition génétique. D’autres facteurs
étiologiques ont été évoqués ; nous en retenons deux :
prématurité, tabagisme passif.
2. PHYSIOPATHOLOGIE
Cette nécrose, d’allure ischémique, est différente des
autres nécroses de la tête fémorale post-traumatique et
post-infectieuse par exemple, car elle est réversible. Elle
touche la hanche en croissance entre trois et neuf ans. Les
altérations métaphysaires parfois associées sont le reflet de
la perturbation du cartilage de croissance (îlots de cartilage
non ossifiés), voire le reflet des altérations de l’épiphyse
fémorale remaniée et déformée se projetant sur la radiogra-
phie en regard du col fémoral.
Pour que la maladie de LPC se manifeste, il faut non
seulement une occlusion vasculaire entraînant un premier
infarctus mais aussi un deuxième infarctus, tel que décrit par
Sanchis
, causé le plus souvent par une fracture sous-
chondrale, en zone fragilisée, qui majore l’atteinte vascu-
laire. De la même façon, il a également été parfois décrit
plusieurs épisodes d’atteinte vasculaire dans la genèse de la
maladie de LPC.
Il s’agit d’une affection qui passe par quatre stades
anatomopathologiques et radiologiques successifs, mais
évoluant en continuité :
• le stade 1 correspond à la nécrose initiale. La radiogra-
phie est souvent normale, il faut rechercher les signes
suivants :
C
augmentation relative de l’espace articulaire ;
C
arrêt de la croissance du noyau d’ossification de la
tête fémorale, qui apparaît plus dense et plus blanc.
La fracture sous-chondrale survient plus tardivement,
toujours dans le stade 1. Elle ne sera visible souvent que
sur les clichés en incidence de profil soulignant la néces-
sité de faire toujours deux incidences radiologiques.
Néanmoins, la radiologie conventionnelle est souvent
pratiquement normale pendant de nombreux mois, et
c’est la scintigraphie ou l’IRM qui permettent le diagnos-
tic précoce ;
• le stade 2, de fragmentation, représente la revasculari-
sation progressive de la zone nécrotique avec souvent
adaptation morphologique concomitante de l’os néo-
formé plus fragile et vulnérable à une hyperpression
localisée que l’os nécrotique, ce qui peut entraîner des
déformations épiphysaires importantes. L’aspect radio-
logique de l’épiphyse est caractérisé, à ce stade, par des
alternances de plages blanches et noires ; ces dernières
sont caractéristiques des premières phases de la revas-
cularisation qui permettront la réossification progres-
sive de la zone nécrotique. Ce processus s’étend sur de
nombreuses semaines, expliquant l’aspect inhomo-
gène, parfois inquiétant de l’épiphyse ;
• le stade 3, de réossification, aboutit au remplacement
progressif, après revascularisation, de l’os nécrotique
par de l’os vivant normal. Sur les radiographies, on
assiste au remplacement progressif de l’os blanc, né-
crotique par de l’os d’aspect normal ;
• le stade 4, de guérison, est caractérisé par une épiphyse
à structure osseuse normale, mais avec des séquelles
morphologiques touchant à la fois la forme et le vo-
lume de l’épiphyse. L’articulation coxofémorale est plus
ou moins congruente. Le col fémoral plus ou moins
épaissi, raccourci et déformé.
110
M. Dutoit / Archives de pédiatrie 14 (2007) 109–115

L’atteinte du cartilage n’est jamais primaire ; elle est
secondaire, mécanique, en rapport avec les déformations ou
la faillite du socle osseux nécrotique sous-jacent.
La durée totale d’évolution est variable selon l’âge au
diagnostic, l’importance et l’étendue de l’atteinte nécroti-
que. Dans les formes sévères, chez l’enfant âgé, cette affec-
tion peut durer jusqu’à trois ou quatre ans.
3. ÉPIDÉMIOLOGIE
La fréquence de la maladie de LPC est variable. En Eu-
rope, elle est en moyenne de 1/2000 enfants.
Elle touche le plus souvent les garçons (quatre garçons
pour une fille). Elle peut occasionnellement toucher de très
jeunes enfants avant trois ans. Sa fréquence est maximale
entre trois et sept ans. L’atteinte peut être bilatérale dans 8
à 24 % des cas ; une atteinte bilatérale peut faire évoquer une
dysplasie poly-épiphysaire.
Elle est plus rare au-delà de neuf ans avec alors un
pronostic bien plus réservé. Le retard d’âge osseux fré-
quemment associé à cette affection n’a, à ce jour, pas reçu
d’explication claire.
4. MANIFESTATIONS CLINIQUES
L’examen clinique révèle, en début d’évolution, une limi-
tation de la rotation interne de la hanche, à rechercher en
décubitus ventral. Si la durée d’évolution est plus longue, on
note une amyotrophie de la cuisse, de la fesse, voire une
inégalité de longueur. La rotation externe automatique (si-
gne de Drehmann) lors de la flexion active ou passive de la
hanche est alors fortement évocatrice d’une déformation de
la tête fémorale (ovalaire), soit en début d’évolution soit plus
tardivement en rapport avec un conflit lié à la perturbation
de la congruence articulaire par excentration de la hanche
par exemple (Hinge abduction).
L’abduction est fréquemment limitée au début de la mala-
die en rapport avec une rétraction antalgique des adduc-
teurs ; plus tardivement dans l’évolution, son installation
signe une excentration, facteur pronostique défavorable. Le
volant d’abduction doit donc être constamment surveillé
durant l’évolution.
Il n’y a pas d’état fébrile, pas d’altération de l’état général,
et un certain nombre de maladies de LPC sont des décou-
vertes fortuites lors d’investigations radiologiques pour des
malformations digestives ou urinaires par exemple.
5. INVESTIGATIONS COMPLÉMENTAIRES
La radiologie standard est souvent négative ou peu évo-
catrice en début d’évolution. Elle permet cependant plus
tardivement de définir le stade évolutif, l’étendue de l’at-
teinte, et par-là, de préciser le pronostic.
C’est la scintigraphie et l’IRM (Imagerie par résonnance
magnétique) qui représentent les deux méthodes de choix
pour le diagnostic précoce :
• la scintigraphie permet le diagnostic précoce ; elle permet
de préciser l’étendue de l’atteinte et de formuler un
pronostic. Ainsi Tsao, et al.
distinguent deux évolu-
tions basées sur la vitesse de la revascularisation de
l’épiphyse fémorale proximale et de son étendue ; une
revascularisation rapide est synonyme de bon pronostic
avec des déformations peu importantes et un risque
d’excentration faible. Il s’agirait d’une « recanalisation »
d’emblée des vaisseaux épiphysaires (groupe A), alors
qu’une revascularisation lente est la conséquence d’une
néovascularisation (groupe B). Cette analyse très précise
n’est probablement pas à disposition partout. La scinti-
graphie renseigne en revanche peu sur la morphologie ;
• l’IRM est aussi un moyen de diagnostic précoce mais un
peu plus tardif que la scintigraphie. Plus tardivement, elle
nous donne des renseignements morphologiques de
grande valeur pour préciser, par exemple, une éventuelle
indication chirurgicale. Elle nous renseigne également sur
le pronostic. De Sanctis, et al.
proposent des critères
pronostiques basés sur l’IRM, en fonction de l’étendue de
la nécrose inférieure ou supérieure à 50 %, de l’atteinte
du cartilage de croissance ainsi que de l’importance de
l’extrusion (trois stades : absent, moyen, sévère). Il faut y
ajouter l’« horizontalisation » relative du labrum acétabu-
laire qui, à notre avis, est également un facteur morpho-
logique pronostique important.
5.1. Quel examen face à une suspicion de maladie
de LPC ?
La radiographie du bassin de face ainsi qu’un fémur proxi-
mal de profil demeurent incontournables. La scintigraphie
osseuse est utile pour le diagnostic précoce, mais elle ren-
seigne peu sur la morphologie et n’est pas disponible par-
tout.
L’IRM est également utile pour le diagnostic précoce ; elle
apporte des renseignements morphologiques et pronosti-
ques importants au spécialiste. C’est certainement l’examen
de choix, mais il a un coût et n’est pas disponible partout.
Le CT-scan (Computed tomography) est utile pour préciser
la tactique chirurgicale.
6. CLASSIFICATION
Il existe toute une série de classifications basées sur la
radiologie conventionnelle.
Il s’agit donc le plus souvent de garçons présentant des
douleurs ou une boiterie après l’effort ou lors de la
pratique sportive. Les douleurs, comme fréquemment
chez l’enfant, sont volontiers localisées au niveau du ge-
nou ; elles sont inconstantes. La boiterie est d’intensité
variable allant de la boiterie à peine perceptible à l’impo-
tence fonctionnelle marquée. Ces symptômes disparais-
sent souvent au repos.
111
M. Dutoit / Archives de pédiatrie 14 (2007) 109–115

La classification proposée par Herring (
) est la plus
récente
. Elle est de plus en plus utilisée car sa reproduc-
tibilité est parmi les meilleures, tout comme sa fiabilité
pronostique. Elle est basée sur la division de l’épiphyse
fémorale proximale en trois piliers : le pilier médian qui est le
siège de la nécrose qui peut s’étendre au pilier latéral
externe dont l’atteinte est divisée en trois stades (pilier
intact groupe A, pilier atteint avec collapsus d’une moitié
groupe B, pilier totalement collabé groupe C). Toutes les
classifications nécessitent, avant de pouvoir être appliquées
de façon sûre et reproductible, un délai relativement impor-
tant pour formuler un pronostic. Il est donc impossible
d’affirmer d’emblée le pronostic d’une maladie de LPC.
La classification scintigraphique, moins utilisée, est proba-
blement une des plus fiables car basée sur la vascularisation ;
elle permet aussi de relever l’atteinte ou non du pilier
externe (facteur pronostique important pour Herring). Un
pilier externe visible sur la scintigraphie a un bon pronostic ;
un pilier externe non ou mal visible est un signe pronostique
péjoratif. La scintigraphie apprécie aussi dans le groupe A la
recanalisation rapide des structures vasculaires, signe de bon
pronostic. Le groupe B, de revascularisation vraie, est carac-
térisé par une évolution plus lente et un moins bon pronos-
tic. Un pilier externe visible sur la scintigraphie a un bon
pronostic ; un pilier externe non ou mal visible est un signe
pronostique péjoratif.
7. PRONOSTIC
Comme dit plus haut, les séquelles de LPC peuvent être
une découverte fortuite soulignant par là le retentissement
fonctionnel parfois peu marqué de cette affection. Les étu-
des longitudinales basées sur la classification de Herring
rapportent pour le groupe A 90 à 100 % de bons résultats,
pour le groupe B 70 à 75 % et pour le groupe C 30 % de bons
résultats. La guérison survient également plus rapidement
dans le groupe A que dans le groupe C.
Le pronostic est lié à l’âge. Un jeune enfant a un meilleur
pronostic qu’un enfant âgé de 9 ou 10 ans au moment du
diagnostic, car les possibilités de remodelage sont bien plus
grandes jusqu’à la fin plus lointaine de la croissance.
L’étendue de l’atteinte nécrotique joue également un rôle
essentiel dans le pronostic ; plus l’atteinte est étendue, plus
défavorable sera le pronostic car le risque de déformations
est alors important.
Un troisième élément pronostique doit encore être sou-
ligné, c’est celui de l’excentration de la tête fémorale. Si elle
est supérieure à 20 % (
), elle est synonyme de mauvais
pronostic. Cette excentration doit donc être traquée sans
répit lors des contrôles. Toute diminution de la mobilité,
toute exacerbation des phénomènes douloureux, toute limi-
tation de l’abduction doivent la faire rechercher et traiter
énergiquement car elle peut entraîner des déformations
importantes de la tête fémorale.
Finalement, le pronostic est lié à l’âge et à l’étendue de la
nécrose. Nous n’avons aucune prise sur ces éléments ; le
pronostic est lié aussi à la déformation de la tête fémorale et
à la congruence articulaire de la hanche. Les traitements,
décharge, chirurgie ont pour but d’éviter la déformation de
la tête fémorale ou de maintenir la congruence articulaire.
En effet, les patients présentant, en fin de croissance, le plus
d’altérations morphologiques seront candidats à l’arthro-
plastie totale de la hanche précocement, aux alentours de la
quatrième ou cinquième décennie. La classification radiolo-
gique proposée par Stulberg
permet, dans une certaine,
mesure de le prédire.
8. TRAITEMENT
Le traitement obéit à trois règles :
• maintenir la mobilité qui est essentielle non seulement à
la nutrition et à la survie du cartilage articulaire mais aussi
Fig. 1
.
Classification de Herring. L’épiphyse fémorale est divisée en trois
parties.
Le pilier latéral (zone grisée) peut être :
• intact : Herring A ;
• diminué de moitié : Herring B ;
• collabé : Herring C.
Fig. 2
.
Excentration selon Green = pourcentage de découverture de l’épi-
physe rapporté à la largeur du disque de croissance du côté sain.
112
M. Dutoit / Archives de pédiatrie 14 (2007) 109–115
à la prévention des déformations articulaires par mauvais
appui ;
• préserver la congruence articulaire et faire la chasse à
l’excentration fémorale ;
• maintenir la tête sphérique.
Une étude multicentrique américaine paraît démontrer
de façon certaine que le traitement a une influence sur les
résultats, mais seulement après l’âge de huit ans et pour les
stades B et C de Herring. Il s’agit d’enfants relativement âgés
et avec une atteinte importante d’emblée.
Vraisemblablement, la chirurgie ne change pas l’évolution
et le pronostic chez les jeunes patients.
Quant au nihilisme thérapeutique, simple traitement
symptomatique, il n’est plus du tout d’actualité. La sur-
veillance radioclinique régulière joue un rôle important dans
la prévention des altérations morphologiques, qui est essen-
tielle pour un bon pronostic fonctionnel à moyen et long
terme.
Il est certain que la chirurgie ne change pas l’évolution et
le pronostic, et ce, d’autant plus lorsqu’elle est réalisée à la
fin de la phase de revascularisation. En effet, les déformations
osseuses surviennent au début de cette phase alors que l’os
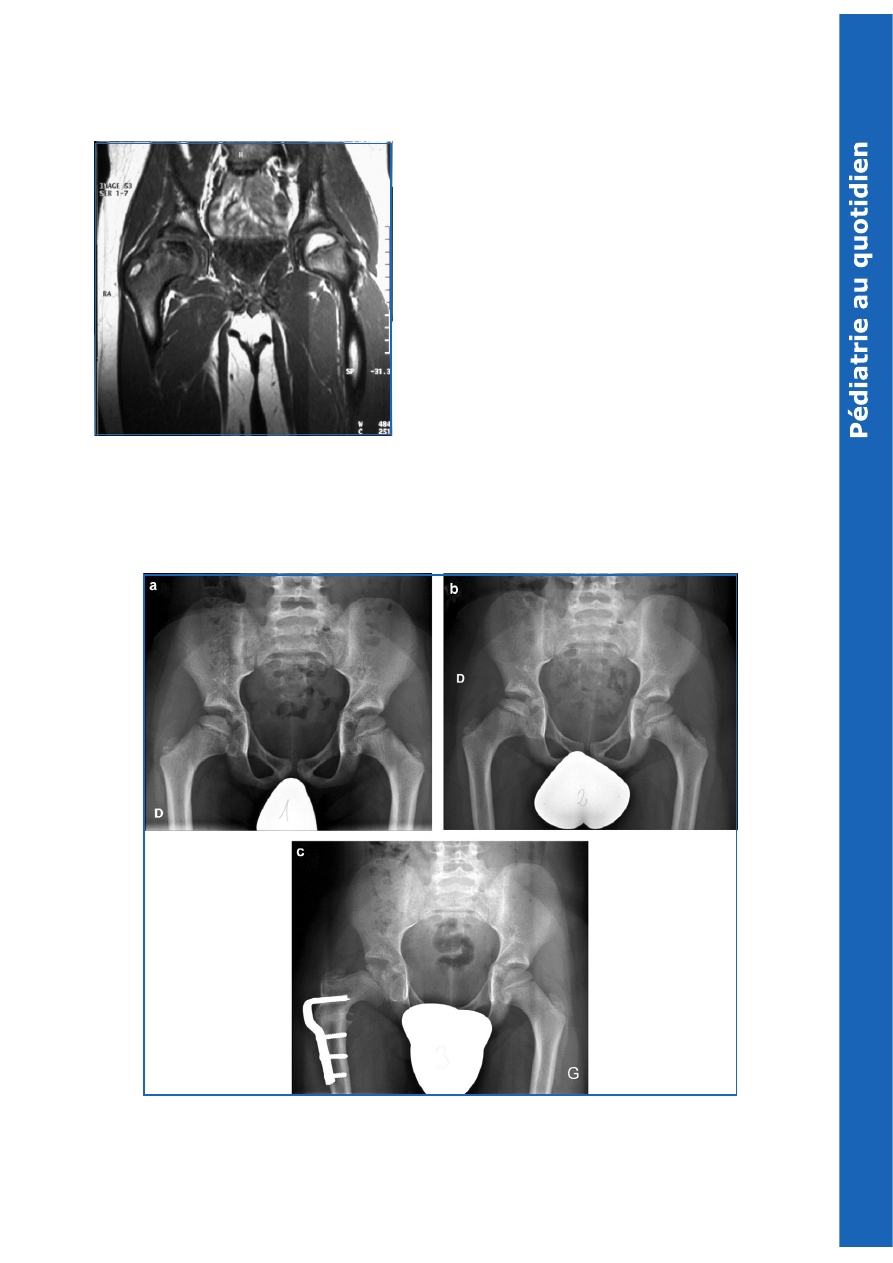
Fig. 3
.
Image IRM. « Horizontalisation » du labrum acétabulaire du côté
droit. Le labrum ne recouvre plus normalement la tête fémorale, il est
refoulé vers le haut.
Fig. 4
.
Exemple de traitement chirurgical par ostéotomie de varisation.
a : maladie de LPC droite ; b : six mois plus tard, amorce d’excentration ; c : contrôle après ostéotomie de varisation et extension du fémur droit. Amélioration
de la congruence articulaire.
113
M. Dutoit / Archives de pédiatrie 14 (2007) 109–115
est moins résistant. Tout appui pathologique, toute incon-
gruence articulaire peuvent entraîner des déformations sé-
vères de la tête fémorale, responsables plus tard d’arthrose
secondaire.
Le traitement qu’il soit orthopédique ou chirurgical reste
toujours fort controversé. Les indications sont fonction de :
• l’âge au diagnostic ;
• l’importance et la localisation de la nécrose.
8.1. Traitement orthopédique
L’abstention thérapeutique peut certainement être ad-
mise chez le sujet en dessous de cinq ans avec une atteinte
de type Herring A, éventuellement B. S’il existe une atteinte
plus sévère, un bilan d’imagerie plus complet doit être
réalisé (clichés dynamiques, IRM) et une éventuelle chirurgie
peut être indiquée afin de prévenir la survenue d’une défor-
mation fémorale et d’une incongruence articulaire.
La simple mise en traction, provisoire, pour les cas les
plus symptomatiques ainsi que pour ceux présentant une
limitation articulaire importante garde toute sa place dans
l’arsenal thérapeutique. Il faut souligner la nécessité de lutter
contre la rétraction des adducteurs par des mesures physio-
thérapeutiques adéquates.
Au-delà de cinq ans, une hanche qui reste centrée de type
Herring A peut être traitée par mobilisation, décharge (can-
nes) et surveillance régulière.
Les appareils de décharge trop longtemps prescrits non
seulement ne déchargent pas la hanche mais entraînent des
mauvais appuis à l’origine de déformations de la tête fémo-
rale. Ils doivent donc être abandonnés.
8.2. Traitement chirurgical
Il nous semble qu’une hanche excentrée ou en voie
d’excentration doit faire l’objet d’un traitement chirurgical
dans l’optique de prévenir ou de diminuer l’installation de
déformations de la tête fémorale. L’« horizontalisation » du
labrum objectivée sur l’IRM (
) est également un argu-
ment en faveur d’un tel traitement qui doit être fait suffisam-
ment tôt, dès que les premiers signes de revascularisation
surviennent. Il ne doit cependant pas se faire sur une hanche
raide ou peu mobile.
Les méthodes chirurgicales visent à améliorer la
congruence articulaire et à décharger les zones fragilisées de
la tête fémorale.
Ce sont :
• ostéotomie fémorale (
) ;
• ostéotomie pelvienne (
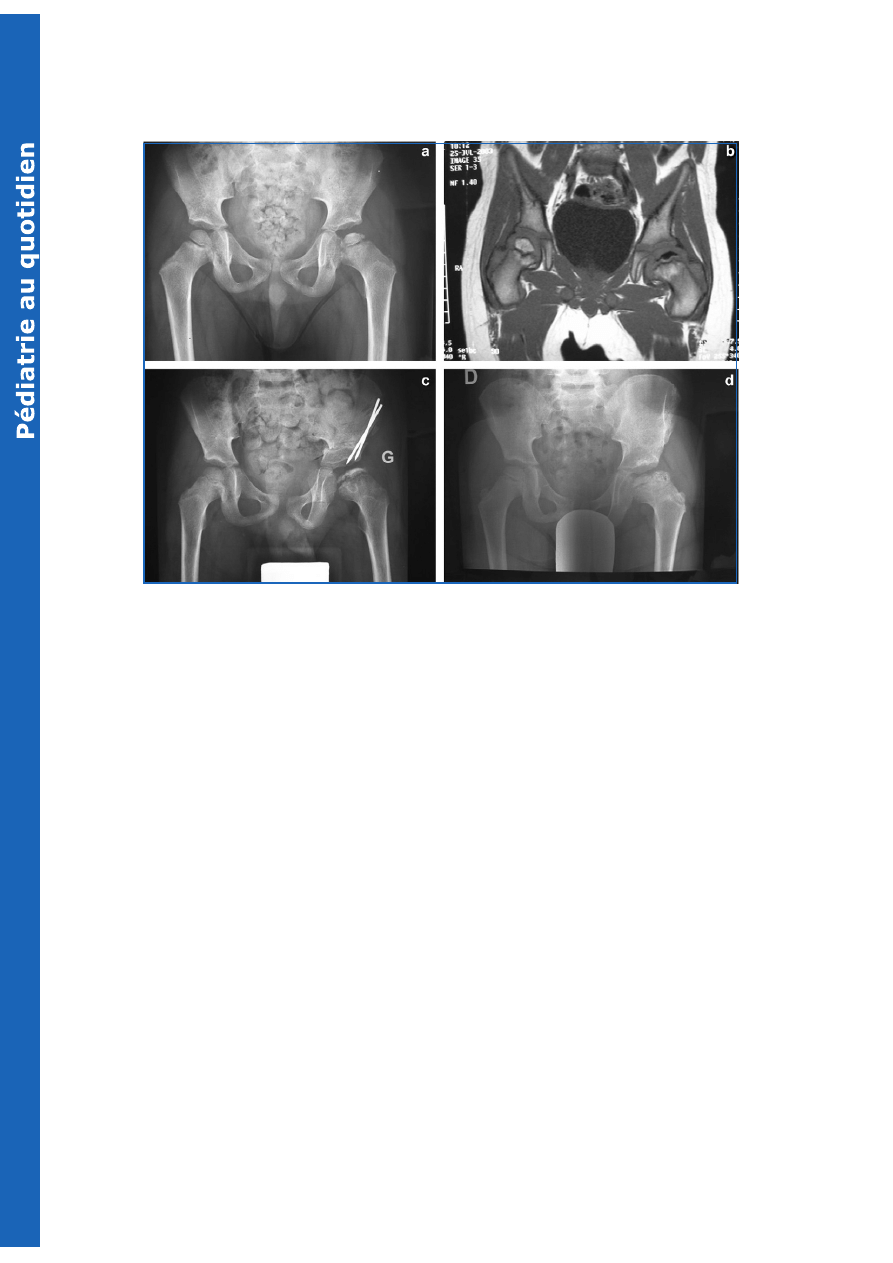
Fig. 5
.
Exemple de traitement chirurgical par ostéotomie de Salter.
a : maladie de LPC gauche chez un enfant de cinq ans, atteinte étendue, respect partiel du pilier externe, stade B de Herring ;
b : image IRM six mois plus tard ; atteinte paraissant intéresser tout le noyau épiphysaire qui apparaît dense, collabé et déformé. Le labrum est horizontal. La
maquette cartilagineuse de la tête fémorale est ovalaire ;
c : six semaines après ostéotomie de Salter faite en raison d’une atteinte très étendue. Apparition de signes de revascularisation dans le noyau épiphysaire ;
d : deux ans plus tard, revascularisation du noyau presque terminée, reconstruction encore en cours. Tête fémorale ovalaire, paraissant congruente.
114
M. Dutoit / Archives de pédiatrie 14 (2007) 109–115

Les ostéotomies fémorales sont indiquées en l’absence
de déformation du fémur proximal ; elles sont plutôt utili-
sées dans les formes avec atteinte localisée.
Les ostéotomies pelviennes sont plus volontiers utilisées
dans les formes étendues pour autant que la sphéricité de la
tête fémorale n’est pas trop perturbée. Il n’y a cependant pas
de consensus sur les indications et techniques chirurgicales
dans le cadre de la maladie de LPC.
9. COMPLICATIONS
Tout traitement a des complications.
Le traitement conservateur pur, isolé, par mise en dé-
charge à l’aide de cannes ou en fauteuil roulant est particu-
lièrement long difficile à respecter et à accepter socialement.
Il ne permet d’éviter ni collapsus de la tête fémorale, ni perte
de la congruence, ni même excentration. Les appareils de
décharge sont abandonnés car inefficaces et dangereux.
La chirurgie fémorale peut entraîner des raccourcis-
sements, une restriction de la mobilité, elle peut bien en-
tendu se compliquer d’une surinfection tout comme la chi-
rurgie acétabulaire. Il s’agit d’une chirurgie le plus souvent
« palliative », rarement « curative ». Les séquelles morpho-
logiques peuvent parfois être symptomatiques en fin d’ado-
lescence, et des traitements chirurgicaux complémentaires
portant sur l’acétabulum, la réorientation et l’allongement
du col fémoral peuvent alors être indiqués.
À moyen terme, en fonction des déformations et de la
congruence articulaire, les patients ayant présenté une mala-
die de LPC peuvent avoir des activités physiques normales
pendant quelques décennies. Leur tolérance à la pratique
sportive, aux activités professionnelles lourdes est parfois
restreinte. Néanmoins, la grande majorité subit une arthro-
plastie totale de hanche aux alentours de 55 à 60 ans.
10. CONCLUSION
La maladie de LPC reste donc un challenge diagnostique,
thérapeutique et pronostique. L’analyse de l’évolution clini-
que et radiologique demeure d’importance capitale. Les
facteurs pronostiques sont à souligner : âge, excentration,
diminution de la mobilité, déformation de la tête fémorale,
étendue de la nécrose et prise en charge thérapeutique.
Les classifications demeurent difficiles, voire impossibles
d’emblée ; le pronostic reste donc souvent peu précis, voire
inconnu pendant de nombreux mois. Néanmoins, il s’agit
d’une nécrose qui guérit seule, pouvant entraîner des défor-
mations et des incongruences articulaires et dont le traite-
ment ne fait que guider cette récupération spontanée.
RÉFÉRENCES
[1]
Sanchis M, Freeman MAR, Zahir A. Experimental stimulation of the
blood supply to the capital femoral epiphysis in the puppy. J Bone Joint
Surg Am 1973;55:335–42.
[2]
Tsao AK, Dias LS, Conway JJ, et al. The prognostic value and
significance of serial bone scintigraphy in Legg-Calvé-Perthes disease.
J Pediatr Orthop 1997;17:223–30.
[3]
De Sanctis N, Rega AN, Rondinella F. Pronostic evaluation of
Legg-Calvé-Perthes
disease
by
MRI.
J
Pediatr
Orthop
2000;20:455–70.
[4]
Herring JA, Nanstadt JB, Williams JD, et al. The lateral pillar
classification of Legg-Calvé-Perthes disease. J Pediatr Orthop
1992;12:143–50.
[5]
Stulberg SD, Cooperman DR, Wallensten R. The natural history of
Legg-Calvé-Perthes disease. J Bone Joint Surg Am 1968;63:1095–108.
Pour en savoir plus
Agus H, Kalenderer O, Eryanlmaz G, et al. Intraobserver and interobserver
reliability of Catterall, Herring, Salter-Thompson and Stulberg classifica-
tion systems in Perthes disease. J Pediatr Orthop B 2004;13:166–9.
Catterall A. The natural history of Perthes disease. J Bone Joint Surg Br
1971;53:37–53.
Dezateux C, Roposch A. The puzzles of Perthes’disease. J Bone Joint Surg
2005;87:1463–4.
Green NE, Beauchamp RD, Griffin PD. Epiphyseal extrusion as a pronostic
index in Legg Calve Perthes disease. J Bone Joint Am 1981;11:127–39.
Herring JA, Kim HT, Browne R. Legg-Calve-Perthes disease. Part II: Pro-
spective multicenter study of the effect of treatment on outcome. J
Bone Joint Surg Am 2004;86:2121–34.
Joseph B, Varghese G, Mulpuri K, et al. Natural evolution of Perthes disease:
a study of 610 children under 12 years of age at disease onset. J Pediatr
Orthop 2003;23:590–600.
Kamegaya M, Saisu T, Ochiai N, et al. A paired study of Perthes’disease
comparing conservative and surgical treatment. J Bone Joint Surg Br
2004;86:1176–81.
Kitakoji T, Hattori T, Kitoh H, et al. Which is a better method for
Perthes’disease: femoral varus or Salter osteotomy? Clin Orthop Relat
Res 2005;430:163–70.
115
M. Dutoit / Archives de pédiatrie 14 (2007) 109–115
Document Outline
- La maladie de Legg-Perthes-Calvé : challenge étiologique, thérapeutique et pronostique
- RÉFÉRENCES
- Pour en savoir plus
Wyszukiwarka
Podobne podstrony:
więcej podobnych podstron