
ROZPORZ
ĄDZENIE KOMISJI (WE) NR 1805/2006
z dnia 7 grudnia 2006 r.
zmieniaj
ące załącznik I do rozporządzenia Rady (EWG) nr 2377/90 ustanawiającego wspólnotową
procedur
ę określania najwyższego dopuszczalnego poziomu pozostałości produktów leczniczych
weterynaryjnych w
środkach spożywczych pochodzenia zwierzęcego w odniesieniu do
tiamfenikolu, fenwaleratu i meloksykamu
(Tekst maj
ący znaczenie dla EOG)
KOMISJA WSPÓLNOT EUROPEJSKICH,
uwzgl
ędniając Traktat ustanawiający Wspólnotę Europejską,
uwzgl
ędniając rozporządzenie Rady (EWG) nr 2377/90 z dnia
26 czerwca 1990 r. ustanawiaj
ące wspólnotową procedurę
okre
ślania maksymalnego limitu pozostałości produktów leczni-
czych weterynaryjnych w
środkach spożywczych pochodzenia
zwierz
ęcego (
1
), w szczególno
ści jego art. 2,
uwzgl
ędniając opinie Europejskiej Agencji Leków wydane przez
Komitet ds. Weterynaryjnych Produktów Leczniczych,
a tak
że mając na uwadze, co następuje:
(1)
Wszystkie substancje czynne farmakologicznie stosowane
we Wspólnocie w produktach leczniczych weterynaryj-
nych
przeznaczonych
do
podawania
zwierz
ętom,
od których lub z których pozyskuje si
ę żywność,
powinny by
ć oceniane zgodnie z rozporządzeniem
(EWG) nr 2377/90.
(2)
Tiamfenikol jest uj
ęty w załączniku I do rozporządzenia
(EWG) nr 2377/90 w odniesieniu do mi
ęśni, tłuszczu,
w
ątroby, nerek i mleka bydła, jak również w odniesieniu
do mi
ęśni, skóry, tłuszczu, wątroby i nerek kurcząt,
z wyj
ątkiem zwierząt, których jaja są przeznaczone do
spo
życia przez ludzi. Tiamfenikol jest również ujęty
w za
łączniku III do tego rozporządzenia w odniesieniu
do mi
ęśni, skóry, tłuszczu, wątroby i nerek trzody
chlewnej. Po zbadaniu informacji dostarczonych przez
wnioskodawc
ę w celu określenia ostatecznego najwyż-
szego poziomu pozosta
łości tiamfenikolu w odniesieniu
do trzody chlewnej uznaje si
ę za właściwe dokonanie
zmiany wpisu dotycz
ącego tiamfenikolu w załączniku I
do rozporz
ądzenia (EWG) nr 2377/90 w odniesieniu do
mi
ęśni, tłuszczu, wątroby i mleka wszystkich zwierząt,
od których lub z których pozyskuje si
ę żywność,
z wyj
ątkiem zwierząt, których jaja są przeznaczone do
spo
życia przez ludzi. Najwyższy dopuszczalny poziom
pozosta
łości w odniesieniu do tłuszczu, wątroby
i nerek nie powinien mie
ć zastosowania do ryb.
(3)
Fenwalerat zosta
ł ujęty w załączniku III do rozporzą-
dzenia (EWG) nr 2377/90 w odniesieniu do mi
ęśni,
t
łuszczu, wątroby, nerek i mleka bydła. Tymczasowe
najwy
ższe dopuszczalne poziomy pozostałości utraciły
wa
żność z dniem 1 lipca 2006 r. Po zbadaniu informacji
dostarczonych przez wnioskodawc
ę w celu określenia
ostatecznego najwy
ższego dopuszczalnego poziomu
pozosta
łości fenwaleratu w odniesieniu do bydła uznaje
si
ę za właściwe uwzględnienie fenwaleratu w załączniku I
do rozporz
ądzenia (EWG) nr 2377/90 w odniesieniu do
mi
ęśni, tłuszczu, wątroby, nerek i mleka bydła.
(4)
Meloksykam jest uwzgl
ędniony w załączniku I do rozpo-
rz
ądzenia (EWG) nr 2377/90 w odniesieniu do mięśni,
w
ątroby i nerek bydła, trzody chlewnej i koniowatych
oraz w odniesieniu do mleka pochodz
ącego od bydła.
Po zbadaniu informacji dostarczonych przez wniosko-
dawc
ę w celu określenia ostatecznego najwyższego
poziomu pozosta
łości meloksykamu w odniesieniu do
królików i mleka pochodz
ącego od kóz uznaje się za
w
łaściwe dokonanie zmiany wpisu w tym załączniku,
dotycz
ącego meloksykamu w odniesieniu do mięśni,
w
ątroby i nerek królików i kóz oraz w odniesieniu do
mleka pochodz
ącego od kóz.
(5)
Nale
ży zatem odpowiednio zmienić rozporządzenie
(EWG) nr 2377/90.
(6)
Nale
ży przewidzieć odpowiedni okres poprzedzający
stosowanie niniejszego rozporz
ądzenia, aby umożliwić
pa
ństwom członkowskim dostosowanie pozwoleń na
wprowadzenie do obrotu omawianych weterynaryjnych
produktów leczniczych wydanych zgodnie z dyrektyw
ą
2001/82/WE Parlamentu Europejskiego i Rady z dnia
6 listopada 2001 r. w sprawie wspólnotowego kodeksu
odnosz
ącego się do weterynaryjnych produktów leczni-
czych (
2
), co mo
że okazać się konieczne w świetle niniej-
szego rozporz
ądzenia.
(7)
Środki przewidziane w niniejszym rozporządzeniu są
zgodne z opini
ą Stałego Komitetu ds. Weterynaryjnych
Produktów Leczniczych,
PRZYJMUJE NINIEJSZE ROZPORZ
ĄDZENIE:
Artykuł 1
W za
łączniku I do rozporządzenia (EWG) nr 2377/90 wpro-
wadza si
ę zmiany zgodnie z załącznikiem do niniejszego rozpo-
rz
ądzenia.
PL
L 343/66
Dziennik Urz
ędowy Unii Europejskiej
8.12.2006
(
1
) Dz.U. L 224 z 18.8.1990, str. 1. Rozporz
ądzenie ostatnio zmie-
nione rozporz
ądzeniem Komisji (WE) nr 1729/2006 (Dz.U. L 325
z 24.11.2006, str. 6).
(
2
) Dz.U. L 311 z 28.11.2001, str. 1. Dyrektywa zmieniona dyrektyw
ą
2004/28/WE (Dz.U. L 136 z 30.4.2004, str. 58).

Artykuł 2
Niniejsze rozporz
ądzenie wchodzi w życie trzeciego dnia po jego opublikowaniu w Dzienniku Urzędowym
Unii Europejskiej.
Rozporz
ądzenie stosuje się od dnia 8 lutego 2007 r.
Niniejsze rozporz
ądzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich
pa
ństwach członkowskich.
Sporz
ądzono w Brukseli, dnia 7 grudnia 2006 r.
W imieniu Komisji
Günter VERHEUGEN
Wiceprzewodniczący
PL
8.12.2006
Dziennik Urz
ędowy Unii Europejskiej
L 343/67
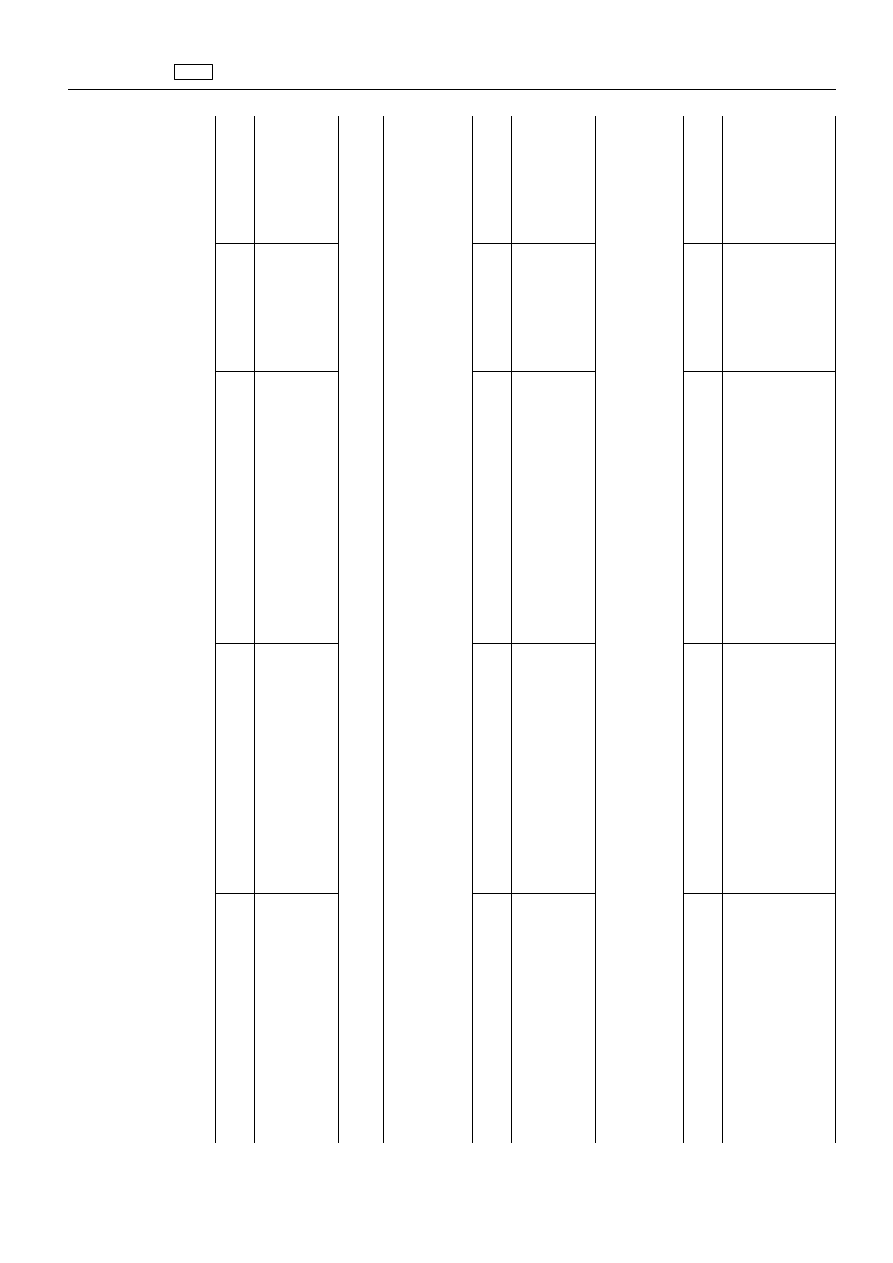
ZA
ŁĄ
CZNIK
Do
za
łą
cznika
I
do
rozporz
ądzenia
(EWG)
nr
2377/90
(Wykaz
substancji
farmakologicznie
czynnych,
dla
których
zosta
ły
ustalone
najwy
ższe
dopuszczalne
poziomy
pozosta
ło
ści)
dodaje
się
nast
ępuj
ąc
ą
substancj
ę:
1.
Środki
przeciwzaka
źne
1.2.
Antybiotyki
1.2.5.
Florfenikol
i
substancje
pochodne
Substancja
farmakologiczn
ie
czynna
Pozosta
ło
ść
znacznikowa
Gatunki
zwierz
ąt
Najwy
ższy
dopuszczalny
poziom
pozosta
ło
ści
Tkanki
docelowe
„Tiamfenikol
Tiamfenikol
Wszystkie
gatunki
zwierz
ąt,
od
których
lub
z
których
pozyskuje
sięż
ywno
ść
(
1
)
50
μg/kg
Mi
ęś
nie
(
2
)
50
μg/kg
Tł
uszcz
(
3
)
50
μg/kg
W
ątroba
50
μg/kg
Nerka
50
μg/kg
Mleko
(
1
)
Nie
ma
zastosowania
w
odniesieniu
do
zwierz
ąt,
których
jaja
przeznaczone
są
do
spo
życia
przez
ludzi,
najwy
ższe
dopuszczaln
e
poziomy
pozosta
ło
ści
nie
maj
ą
zastosowania
w
odniesieniu
do
tł
uszczu,
w
ątroby
i
nerek
ryb.
(
2
)
W
przypadku
ryb
odnosi
si
ę
do
»mi
ęś
ni
i
skóry,
w
naturalnych
proporcjach«.
(
3
)
W
przypadku
trzody
chlewnej
i
drobiu
ten
najwy
ższy
dopuszczalny
poziom
pozosta
ło
ści
odnosi
si
ę
do
»skóry
i
tł
uszczu,
w
naturalnych
proporcjach«
”.
2.
Środki
przeciwpaso
żytnicze
2.2.
Środki
przeciw
ektopaso
żytom
2.2.3.
Pyretroidy
Substancja
farmakologiczn
ie
czynna
Pozosta
ło
ść
znacznikowa
Gatunki
zwierz
ąt
Najwy
ższy
dopuszczalny
poziom
pozosta
ło
ści
Tkanki
docelowe
„Fenwalerat
Fenwalerat
(suma
izomerów
RR,
SS,
RS
i
SR)
Byd
ło2
5
μg/kg
Mi
ęś
nie
250
μg/kg
Tł
uszcz
25
μg/kg
W
ątroba
25
μg/kg
Nerka
40
μg/kg
Mleko
”
4.
Środki
przeciwzapalne
4.1.
Środki
przeciwzapalne
bez
zawarto
ści
sterydów
4.1.4.
Pochodne
oksykamu
Substancja
farmakologiczn
ie
czynna
Pozosta
ło
ść
znacznikowa
Gatunki
zwierz
ąt
Najwy
ższy
dopuszczalny
poziom
pozosta
ło
ści
Tkanki
docelowe
„Meloksykam
Meloksykam
Trzoda
chle
wna,
koniowate,
króliki
20
μg/kg
Mi
ęś
nie
65
μg/kg
W
ątroba
65
μg/kg
Nerka
Byd
ło,
kozy
20
μg/kg
Mi
ęś
nie
65
μg/kg
W
ątroba
65
μg/kg
Nerka
15
μg/kg
Mleko
”
PL
L 343/68
Dziennik Urz
ędowy Unii Europejskiej
8.12.2006
Wyszukiwarka
Podobne podstrony:
więcej podobnych podstron