
Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
1/
VIII
VII. ZWIĄZKI KOMPLEKSOWE (KOORDYNACYJNE)
1. Pojęcia podstawowe
Zmieszajmy roztwory FeCl
2
(1 mol) i KCN (6 moli) - powstaje roztwór barwy
żółtej, który nie wykazuje reakcji na kation Fe
2+
.
D l a c z e g o?
Fe
2+
+ 6CN
-
= [Fe(CN)
6
]
4-
Jest to bardzo trwały jon, zwany kompleksowym, o strukturze oktaedrycznej.
Ten jon kompleksowy może utworzyć sól K
4
Fe(CN)
6
, którą można wydzielić z
roztworu.
jon kompleksowy
związek kompleksowy
(koordynacyjny)
[Fe(CN)
6
]
4-
K
4
[Fe(CN)
6
]
atom centralny ligand
Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
2/
VIII
Atom centralny - atomy metali (np. d-elektronowych) lub niemetali (np. bor,
krzem)
Liczba koordynacyjna - liczba ligandów przyłączonych do atomu centralnego
→
→
→
→
od
2 do 12
Ligandy
Cząsteczki: NH
3
, H
2
O, CO
Aniony: F
-
, Cl
-
, Br
-
, I
-
, NO
3
-
, SO
4
2-
, CN
-
Przeważnie ligand koordynuje wokół atomu centralnego za pomocą jednego atomu.
W niektórych przypadkach ligand koordynuje za pomocą dwóch lub więcej
atomów
→
→
→
→
ligandy chelatowe (lub kleszczowe)
Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
3/
VIII
Przykłady ligandów chelatowych dwukleszczowych:
a) Etylenodiamina (en)
H
2
N - CH
2
- CH
2
- NH
2
b) Dimetyloglioksym (dmg) H
3
C - C = N - OH
H
3
C - C = N - OH
Przykład ligandu sześciokleszczowego:
Anion kwasu etylenodiaminotetraoctowego (edta)
OOC - CH
2
CH
2
- COO
4-
N - CH
2
- CH
2
- N
OOC - CH
2
CH
2
- COO
Geometria jonów kompleksowych a liczba koordyncji jonu centralnego:
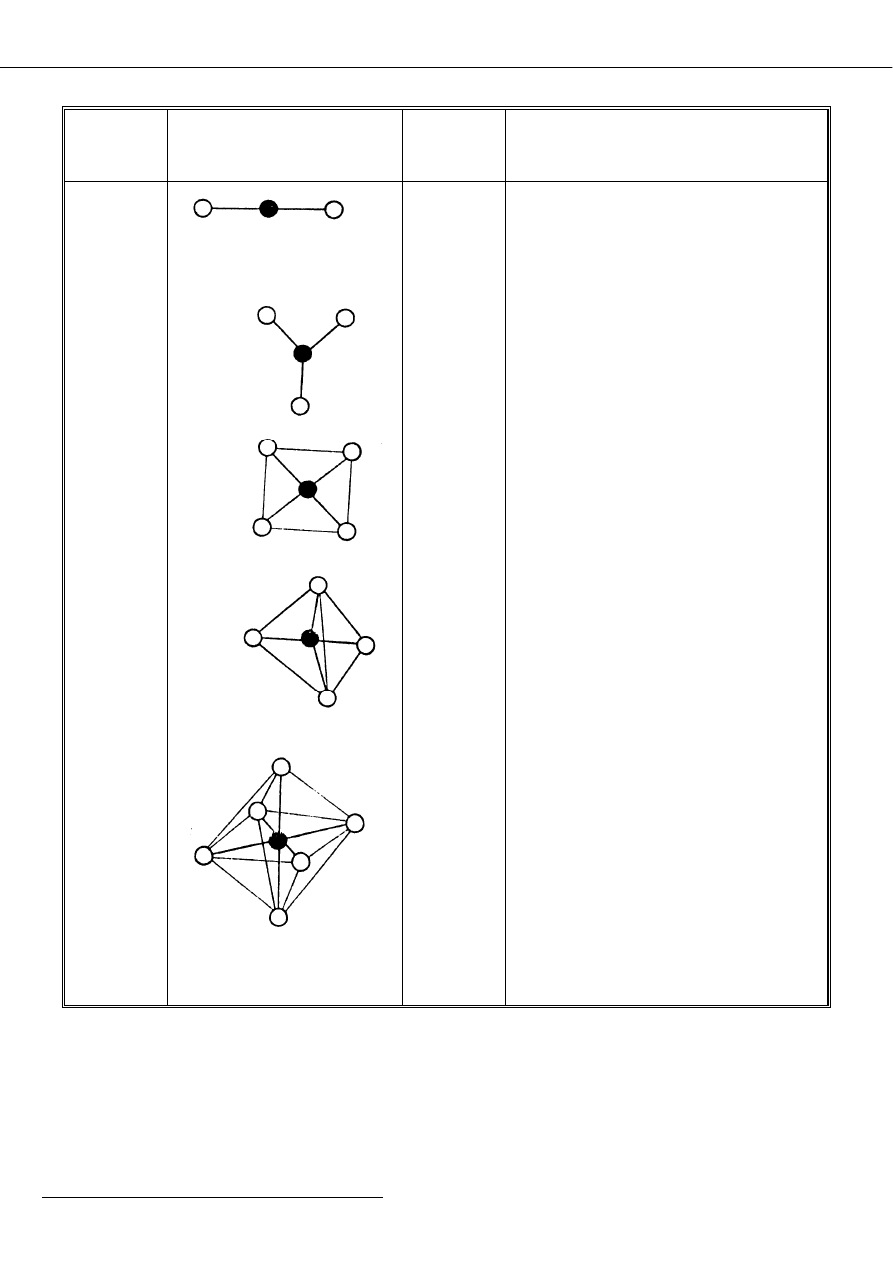
Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
4/
VIII
Liczba
koord.
Geometria
Hybry-
dyzacja
Przykłady
2
3
4
6
sp
sp
2
dsp
2
sp
3
d
2
sp
3
[Ag(NH
3
)
2
]
+
, [Au(CN)
2
]
-
[HgI
3
]
-
, [SnCl
3
]
-
[Ni(CN)
4
]
2-
[BF
4
]
-
, CrO
4
2-
,
Ni(CO)
4
[Fe(CN)
6
]
4-
, PtCl
6
2-
Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
5/
VIII
jednordzeniowe
Kompleksy
wielordzeniowe
Co(CN)
6
3-
1 - rdzeniowy
[(NH
3
)
5
Cr(OH)Cr(NH
3
)
5
]
5+
2 - rdzeniowy
Co
4
(CO)
12
4 - rdzeniowy
Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
6/
VIII
2. Nomenklatura związków kompleksowych
Zasady przyjętej nomenklatury
1) Pełna nazwa - najpierw nazwa liganda a potem nazwa jonu centralnego
Wzór - odwrotnie: tetrakarbonylniklu
→
→
→
→
Ni(CO)
4
2) Stopień utlenienia centralnego atomu
→
→
→
→
w nawiasie okrągłym rzymska cyfra
[Cu(NH
3
)
4
]
2+
- jon tetraaminamiedzi(II)
3) Gdy kompleks jest ujemny to do nazwy atomu centralnegododaje się końcówkę -
an
[Fe(CN)
6
]
4-
- jon heksacyjanożelazianowy(II)
4) Ligandy wymienia się w kolejności alfabetycznej [Co(NH
3
)
4
Cl
2
]
+
- jon
tetraaminadichlorokobaltu(III)
5) Ligandy anionowe mają końcówkę – o np. Cl
-
- chloro, OH
-
- hydrokso
Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
7/
VIII
Nazwy niektórych ligandów nieorganicznych:
O
2-
OH
-
S
2-
I
-
Br
-
Cl
-
F
-
−−−−
2
3
CO
CN
-
−−−−
2
4
2
O
C
SCN
-
−−−−
2
2
O
okso
hydrokso
tio
jodo
bromo
chloro
fluoro
węglano
cyjano
szczawiano
tiocyjaniano
perokso
H
-
−−−−
3
NO
ONO
-
−−−−
2
NO
−−−−
2
4
SO
−−−−
2
3
2
O
S
H
2
O
NH
3
CO
NO
hydrydo
lub
hydro
azotano
nitrito-O
nitrito-N
siarczano
tiosiarczano
akwa
amina
karbonyl
nitrozyl

Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
8/
VIII
6) Do oznaczania liczby ligandów - przedrostki greckie (mono-, di-, tri-, tetra-,
penta-, heksa-)
PtCl
6
2-
- anion heksachloroplatynianowy(IV),
- przedrostek mono- najczęściej się opuszcza,
- bardziej skomplikowane ligandy ujmuje się w nawias poprzedzany określeniem
bis-, tris-, tetrakis.
7) Jeżeli w kompleksie pojawia się grupa mostkowa to poprzedza się ją literą
grecką -
µµµµ
NH
2
(NH
3
)
4
Co
Co(NH
3
)
4
- jon
µµµµ
-amido-
µµµµ
-hydrokso-
OH
-bis[tetraamina-kobaltu(III)]
4-

Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
9/
VIII
3. Izomeria związków kompleksowych
Izomeria to zjawisko występowania substancji o takim samym składzie chemicznym
ale różniących się strukturą cząsteczki
Wyróżniamy izomerię :
- strukturalną,
- stereoizometryczną.
Izomeria strukturalna
1
0
Izomeria jonowa
[Co(NH
3
)
5
Br]SO
4
- siarczan pentaaminabromokobaltu(III) - fioletowy
[Co(NH
3
)
5
(SO
4
)]Br - bromek pentaaminasiarczanokobaltu(III) – czerwony
To są dwa zupełnie różne związki kompleksowe
.

Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
10/
VIII
Jak te związki reagują z BaCl
2
i AgNO
3
?
1.
[Co(NH
3
)
5
Br]SO
4
= [Co(NH
3
)
5
Br]
2+
+ SO
4
2-
SO
4
2-
Ba
2+
= BaSO
4
↓↓↓↓
(biały osad)
2.
[Co(NH
3
)
5
SO
4
]Br = [Co(NH
3
)
5
SO
4
]
+
+ Br
-
Br
-
Ag
+
= AgBr
↓↓↓↓
(żółty osad)
Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
11/
VIII
2
0
Izomeria hydratacyjna
[Cr(H
2
O)
6
]Cl
3
fioletowy
[Cr(H
2
O)
5
Cl]Cl
2
⋅⋅⋅⋅
H
2
O
niebieski
[Cr(H
2
O)
4
Cl
2
]Cl
⋅⋅⋅⋅
2H
2
O
zielony
Jak te izomery reagują z AgNO
3
?
1. [Cr(H
2
O)
6
]Cl
3
= [Cr(H
2
O)
6
]
3+
+ 3Cl
-
3Cl
-
+ 3Ag
+
= 3AgCl Na 1 mol kompleksu zużywa się 3 mole AgNO
3
2. [Cr(H
2
O)
5
Cl]Cl
2
= [Cr(H
2
O)
5
Cl]
2+
+ 2Cl
-
2Cl
-
+ 2Ag
+
= 2AgCl
Na 1 mol kompleksu zużywa się 2 mole AgNO
3
3. [Cr(H
2
O)
4
Cl
2
]Cl = [Cr(H
2
O)
4
Cl
2
]
+
+ Cl
-
Cl
-
+ Ag
+
= AgCl Na 1 mol kompleksu zużywa się 1 mol
AgNO
3

Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
12/
VIII
3
0
Izomeria koordynacyjna
Przykładem są dwa związki kompleksowe:
[Cr(NH
3
)
6
][Co(CN)
6
]
- heksacyjanokobaltan(III) heksaaminachromu(III)
[Co(NH
3
)
6
][Cr(CN)
6
] - heksacyjanochromian(III) heksaaminakobaltu(III)
4
0
Izomeria wiązaniowa
np. izomery z ligandem NO
2
-
→
→
→
→
wiąże się on z atomem centralnym za pośrednictwem atomu azotu lub tlenu
[Co(NH
3
)
5
NO
2
]
2+
jon pentaamina(nitrito-N)kobaltu(III)
[Co(NH
3
)
5
ONO]
2+
jon pentaamina(nitrito-O)kobaltu(III)

Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
13/
VIII
5. Stereoizomeria
- różne rozmieszczenie jonów wokół
jonu centralnego
izomeria
izomeria
geometryczna
optyczna
}
2 odmiany odznaczające
się zdolnością skręcania
płaszczyzny polaryzacji
światła
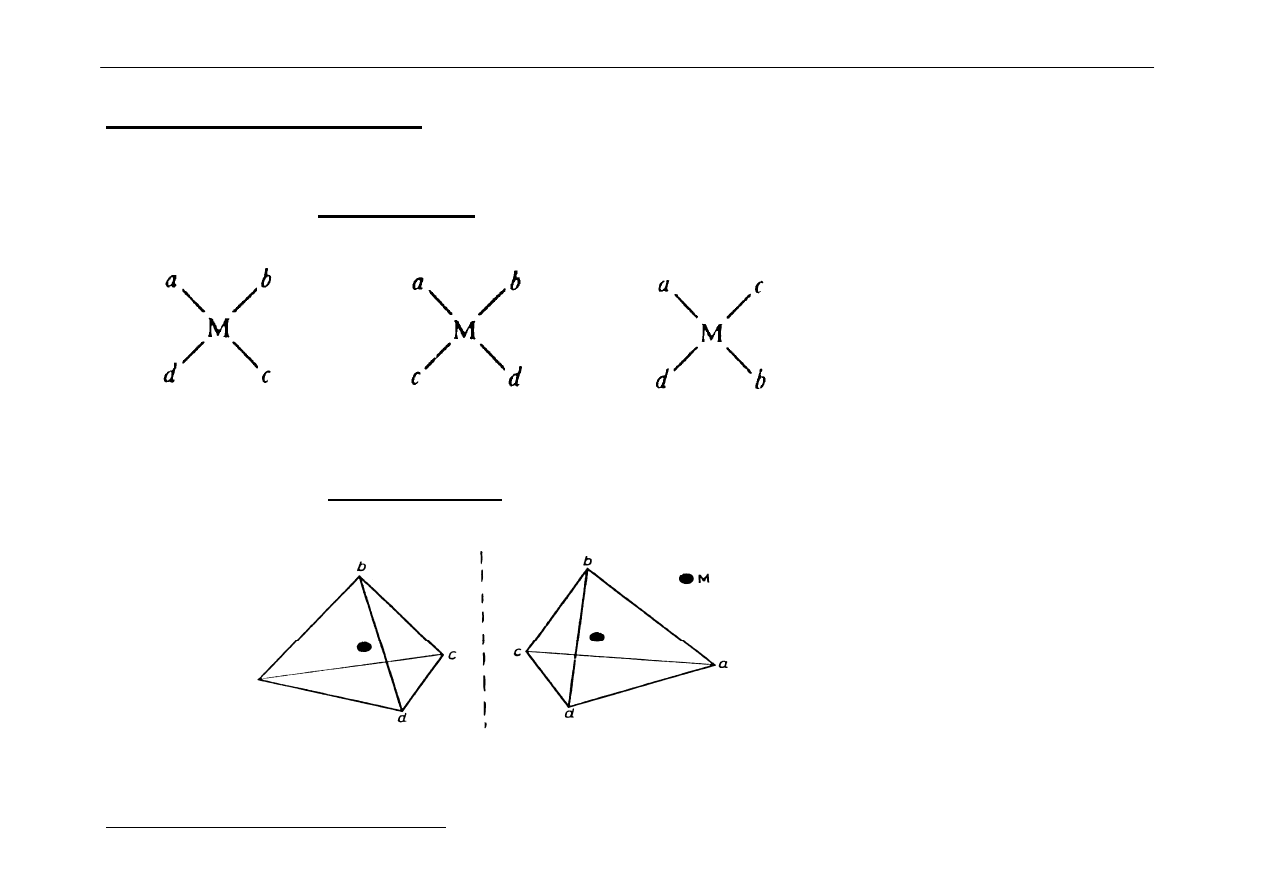
Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
14/
VIII
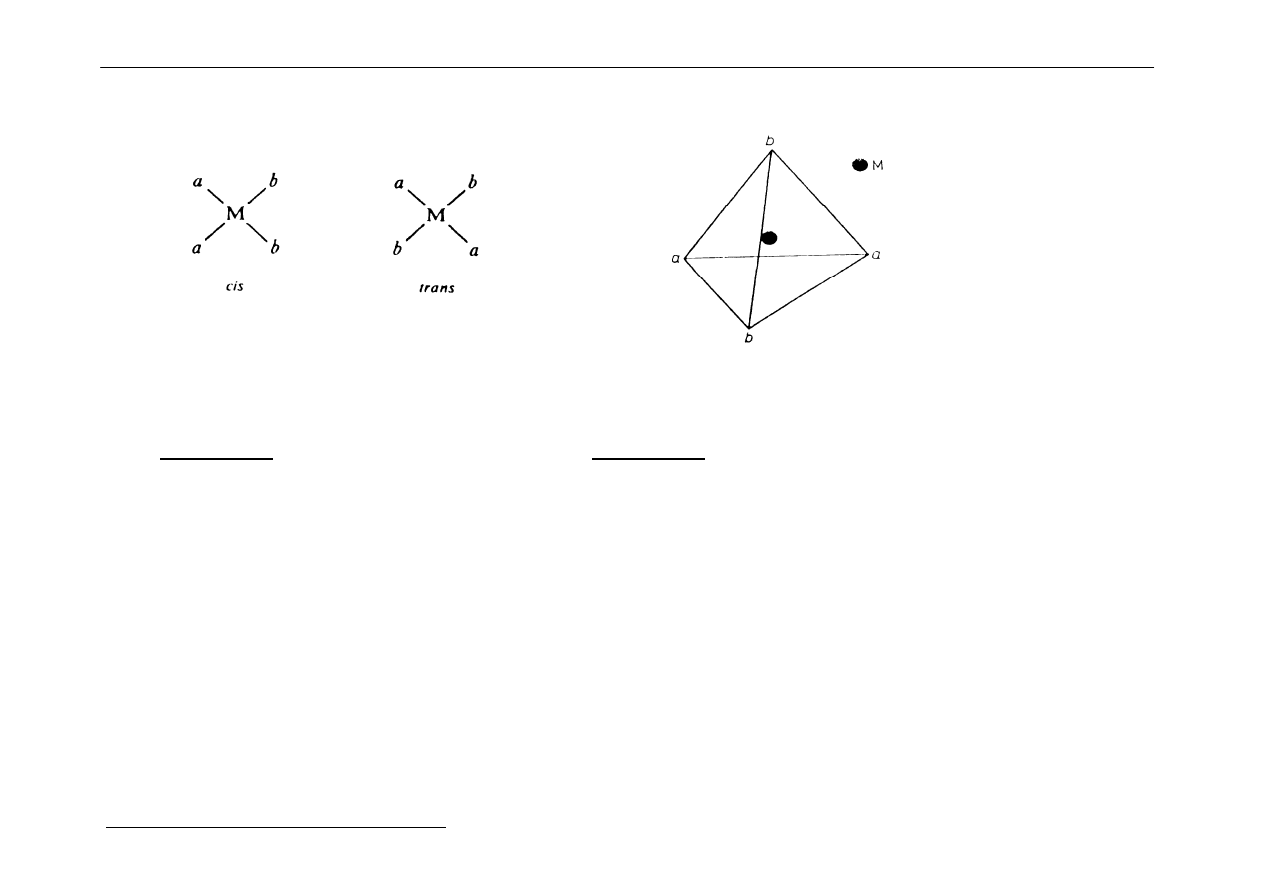
A. Liczba koordynacji 4
1
o
Izomeria geometryczna i optyczna w kompleksach typu Mabcd
Płaski kompleks kwadratowy - są tutaj 3 izomery geometryczne:
Z kolei kompleks tetraedryczny przejawia izomerię optyczną:
a
Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
15/
VIII
2
o
Kompleks typu Ma
2
b
2
ligandy obok
ligandy na
siebie
przeciw siebie
Kwadrat - izomery cis- i trans
Tetraedr - brak izomerii
Przykład rozpoznawania struktury :
Pt(NH
3
)
2
Cl
2
→
→
→
→
ma 2 izomery - struktura płaska
Zn(NH
3
)
2
Cl
2
→
→
→
→
tylko jeden izomer - struktura tetraedryczna
Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
16/
VIII
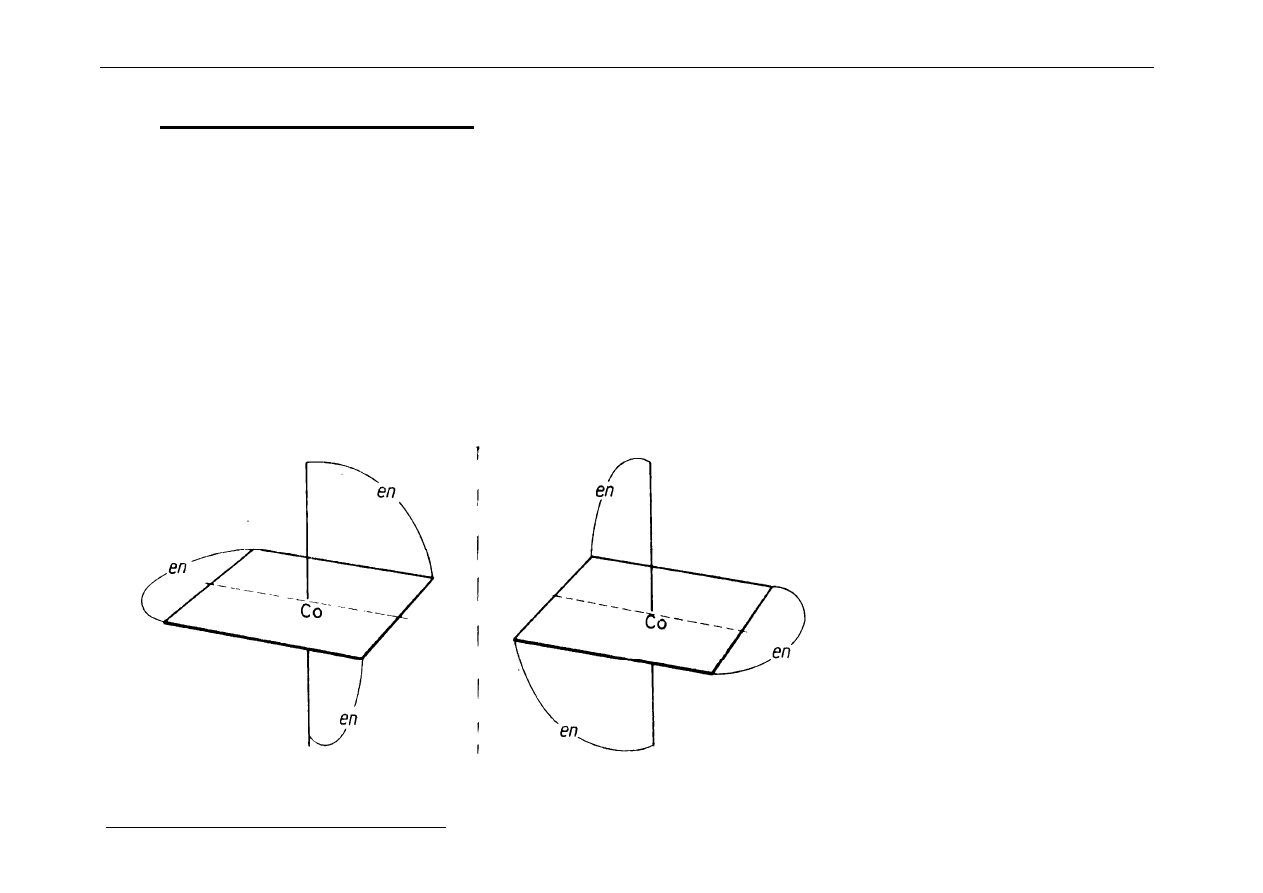
B. Liczba koordynacji 6
[Co(NH
3
)
4
Cl
2
]
+
→
→
→
→
dwa izomery: cis (fioletowy) trans (zielony)
Inny kompleks o l. k. 6:
[Co(H
2
N - CH
2
- CH
2
- NH
2
)
3
]
3+
kompleks chelatowy
tris(etylenodiamina)kobaltu(III)
→
→
→
→
dwa izomery optyczne
Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
17/
VIII
4. Równowagi w roztworach wodnych związków kompleksowych
Mieszamy dwa roztwory: CdCl
2
i KCN.
Jakie jony kompleksowe powstają?
Cd
2+
+
CN
-
⇔
⇔
⇔
⇔
[Cd(CN)]
+
(1)
[Cd(CN)]
+
+
CN
-
⇔
⇔
⇔
⇔
[Cd(CN)
2
]
(2)
[Cd(CN)
2
]
+
CN
-
⇔
⇔
⇔
⇔
[Cd(CN)
3
]
-
(3)
[Cd(CN)
3
]
-
+
CN
-
⇔
⇔
⇔
⇔
[Cd(CN)
4
]
2-
(4)
Stosując prawo działania mas piszemy wyrażenia na stałe równowagi:
Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
18/
VIII
K
Cd CN
Cd
CN
K
Cd CN
Cd CN
CN
K
Cd CN
Cd CN
CN
K
Cd CN
Cd CN
CN
1
2
2
2
3
3
2
4
4
2
3
====
====
====
====
++++
++++
++++
−−−−
−−−−
−−−−
−−−−
−−−−
−−−−
{[
(
)] }
{
}{
}
{[
(
) ]}
{[
(
)] }{
}
{[
(
) ] }
{[
(
) ]}{
}
{[
(
) ]
}
{[
(
) ] }{
}
_
K
1
, K
2
, K
3
i K
4
- stopniowe stałe trwałości
Wartości
logK
1
,
logK
2
,
logK
3
,
logK
4
wynoszą:
5,48 5,12 4,63 3,55

Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
19/
VIII
Rozpatrzmy teraz równowagę:
Cd
2+
+ 4CN
-
⇔
⇔
⇔
⇔
[Cd(CN)
4
]
2-
Stałą równowagi określa równanie:
4
4
2-
2+
- 4
=
{[Cd(CN ) ] }
{Cd }{CN }
ββββ
Jest to tzw. skumulowana stała trwałości, która jest równa:
ββββ
4
= K
1
⋅⋅⋅⋅
K
2
⋅⋅⋅⋅
K
3
⋅⋅⋅⋅
K
4
W podobny sposób
ββββ
3
= K
1
⋅⋅⋅⋅
K
2
⋅⋅⋅⋅
K
3
ββββ
2
= K
1
⋅⋅⋅⋅
K
2
ββββ
1
= K
1

Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
20/
VIII
W naszym przypadku :
log
ββββ
1
= 5,48
log
ββββ
2
=10,60
log
ββββ
3
= 15,23
log
ββββ
4
= 18,78
Definicje:
M
n
n
M
1
M
0
c
}
ML
{
x
c
}
ML
{
x
c
}
M
{
x
====
====
====
αααα
αααα
αααα
Suma ułamków molowych poszczególnych form jonowych:
1
x
n
====
ΣΣΣΣ
αααα
Ogólne stężenie analityczne metalu:
}.
ML
...{
}
ML
{
}
ML
{
}
M
{
c
n
2
M
++++
++++
++++
====
Można wykazać, że:
Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
21/
VIII
}
{L
....
+
}
{L
+
{L}
+
1
}
{L
=
x
}
{L
....
+
}
{L
+
{L}
+
1
1
=
x
k
n
2
2
1
n
n
n
k
n
2
2
1
o
ββββ
ββββ
ββββ
ββββ
ββββ
ββββ
ββββ
αααα
αααα
gdzie {L} - stężenie wolnego, niezwiązanego liganda
{M} - stężenie wolnego, niezwiązanego jonu metalu
Ogólne (analityczne) stężenie liganda (c
L
) :
c
L
= {L} + {ML} + 2{ML
2
} + .... k{ML
K
}
Jeżeli ligand protonuje (np. CN
-
, NH
3
):
c
L
= {LH} + {L} + {ML} + 2{ML
2
} + .... k{ML
K
}
Można więc obliczyć udział poszczególnych form jonowych w zależności od stężenia wolnego
liganda.
Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
22/
VIII
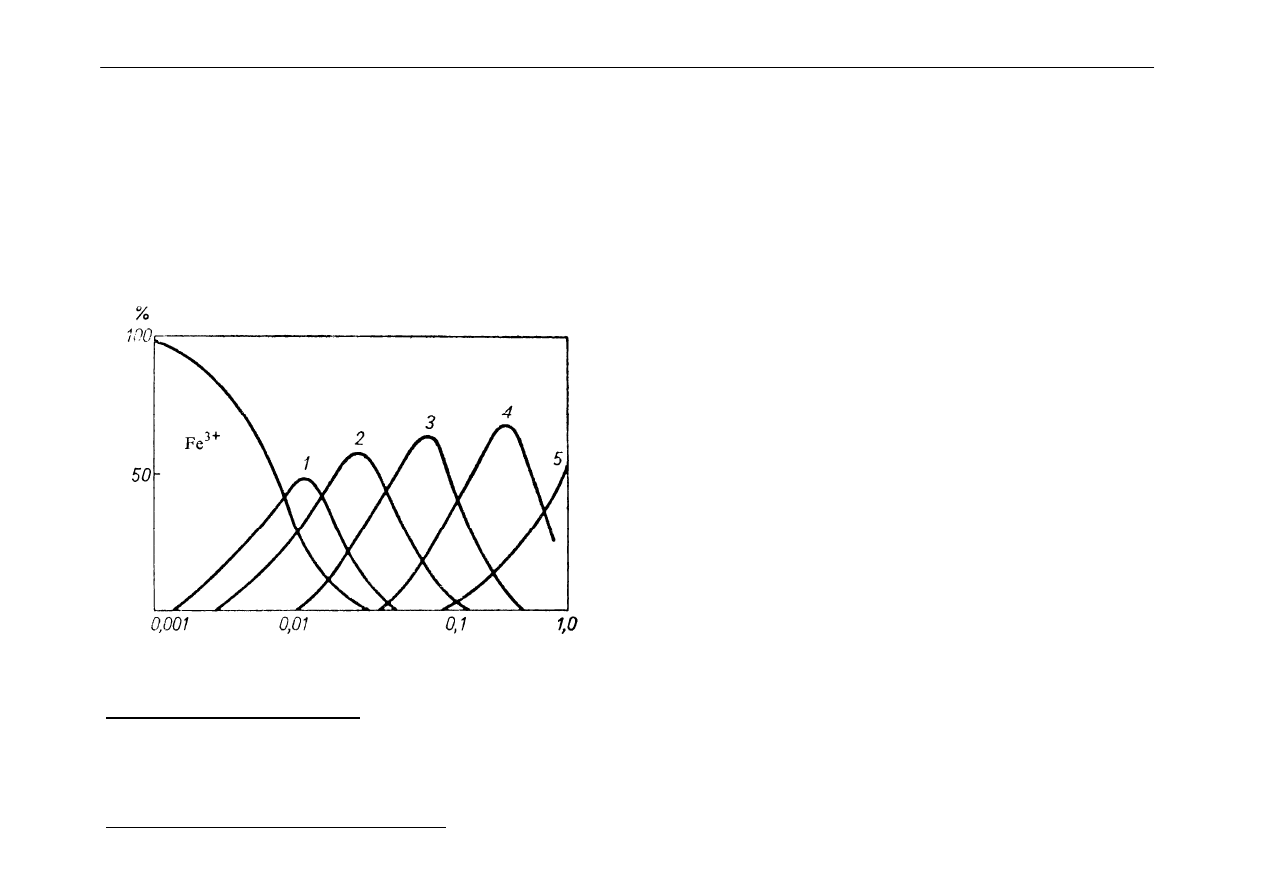
Rozpatrzmy jony kompleksowe Fe
3+
z SCN
-
I = 0 : log
ββββ
1
log
ββββ
2
log
ββββ
3
log
ββββ
4
log
ββββ
5
log
ββββ
6
3,1
5,2
6,2
6,2
6,1
6,0
Zależność x
αααα
n
= f({L}) można przedstawić graficznie:
Diagram kompleksów następczych
n
3
n
)
SCN
(
Fe
−−−−
w układzie stężenie
liganda-procent metalu w postaci poszczególnych kompleksów
−−−−
−−−−
++++
++++
−−−−
−−−−
−−−−
−−−−
−−−−
2
5
4
3
2
2
]
)
SCN
(
Fe
[
5
,
]
)
SCN
(
Fe
[
4
]
)
SCN
(
Fe
[
3
,
]
)
SCN
(
Fe
[
2
,
)]
SCN
(
Fe
[
1
[SCN
-
], mol/dm
3
Kompleksy chelatowe charakteryzują się znacznie większą trwałością niż kompleksy z
ligandami prostymi.
Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
23/
VIII
Przykład:
1)
[Ni(H
2
O)
6
]
2+
+ 6NH
3
⇔
⇔
⇔
⇔
[Ni(NH
3
)
6
]
2+
+ 6H
2
O
2)
[Ni(H
2
O)
6
]
2+
+ 3en
⇔
⇔
⇔
⇔
[Ni(en)
3
]
2+
+ 6H
2
O
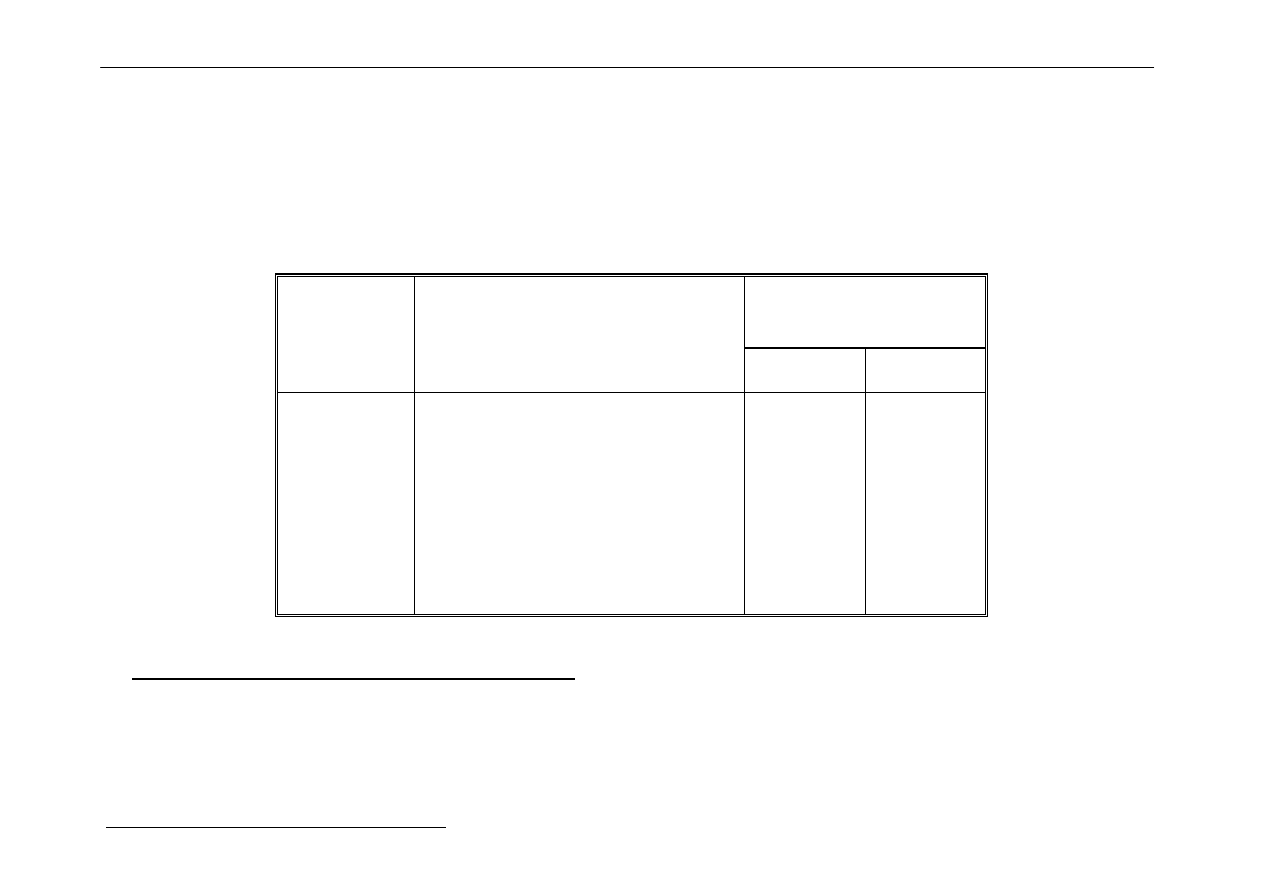
kation
Liczba koordynacyjna (n)
log
ββββ
n
NH
3
en
Ni
2+
Co
2+
Co
3+
Zn
2+
Cu
2+
6
6
6
4 (tetraedr)
4 (kwadrat)
9
5
34
9
13
19
14
49
11
20
Efekt ten zwany jest efektem chelatacji.

Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
24/
VIII
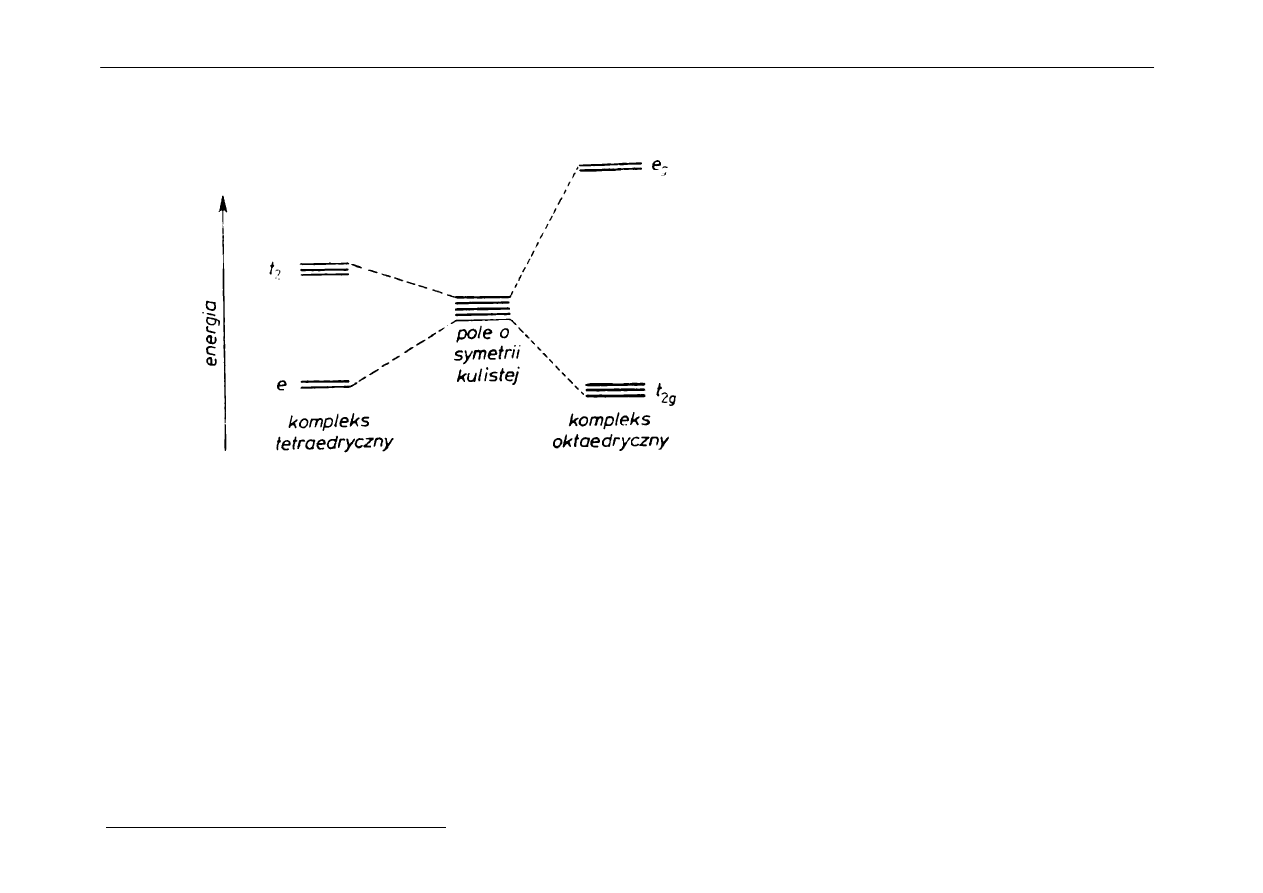
5. Teoria pola krystalicznego
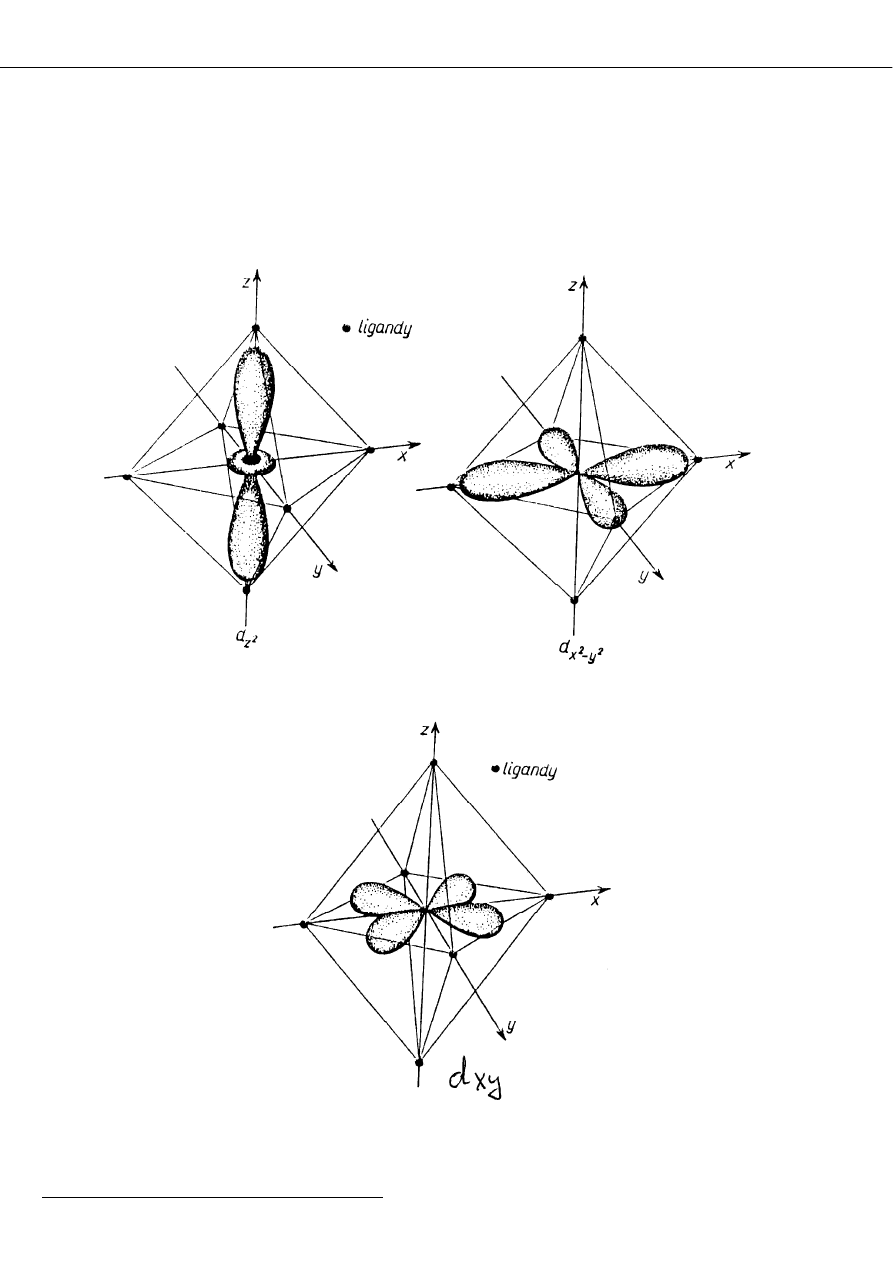
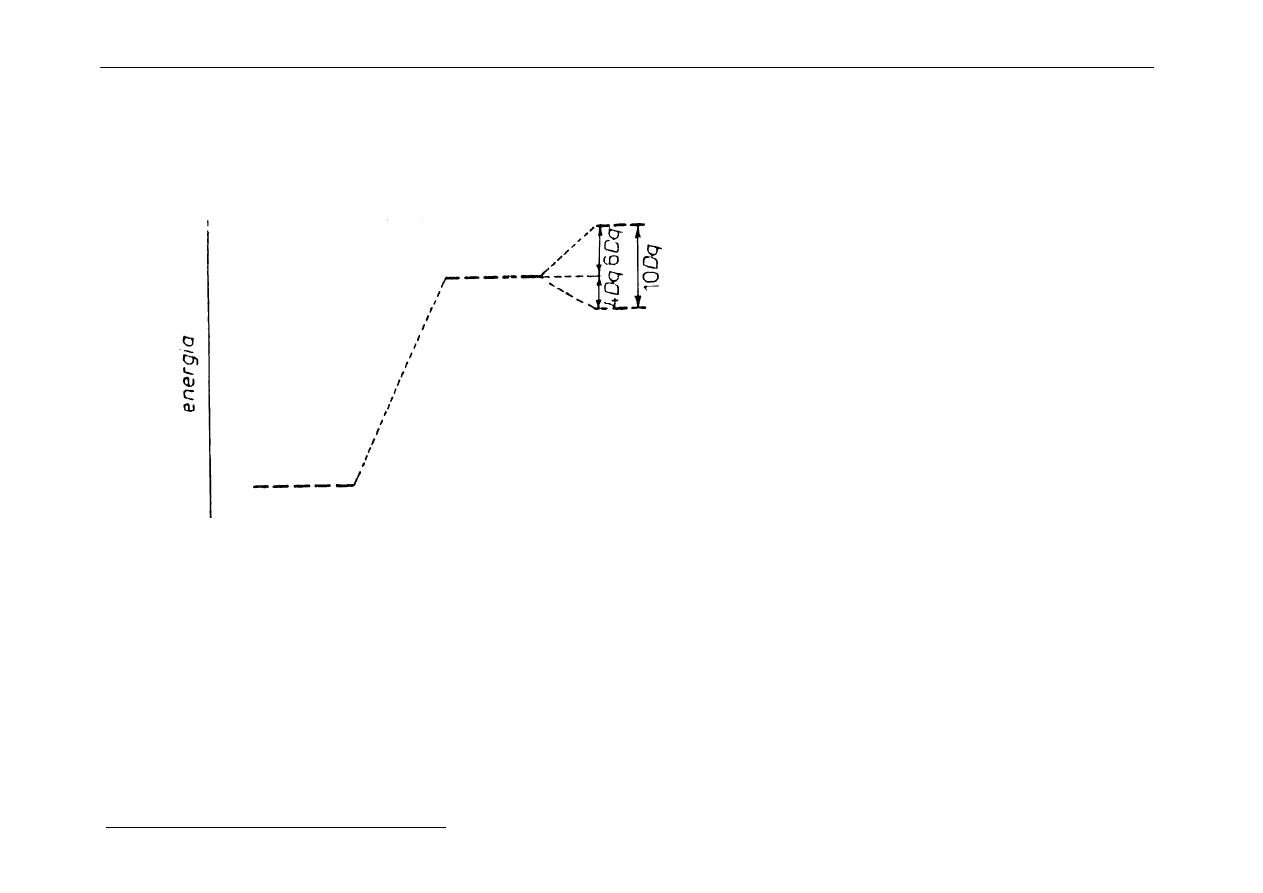
a)
Kompleksy oktaedryczne
Wiązanie pomiędzy centralnym kationem metalu
a ligandami jest wiązaniem jonowym.
W kompleksie oktedrycznym 6 ujemnie naładowanych jonów
(lub 6 cząsteczek polarnych)
zbliża się do kationu centralnego oddziaływując coraz silniej na elektrony
znajdujące się na orbitalach atomu centralnego.
Najsilniejsze oddziaływanie ma miejsce z elektronami znajdującymi się
wzdłuż osi x, y i z, a więc d
z2
i d
x2 - y2
-
ich energia ulega podwyższeniu ( symbol e
g
)
Elektrony na orbitalach d
xy
, d
yz
i d
xz
doznają słabszego oddziaływania -
ich poziom energetyczny leży poniżej poziomu orbitali d
z2
i d
x2 - y2
(symbol t
2g
)
Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
1/
VIII
Orientacja orbitali typu d atomu centralnego w stosunku do ligandów
w kompleksie oktaedrycznym.
Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
1/
VIII
Tak samo d
yz
i d
xz
Symbol g oznacza środek symetrii
jon d
n
jon d
n
jon d
n
swobodny
w polu elektr.
w polu elektr.
o symetrii
o symetrii
kulistej
oktaedru

Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
2/
VIII
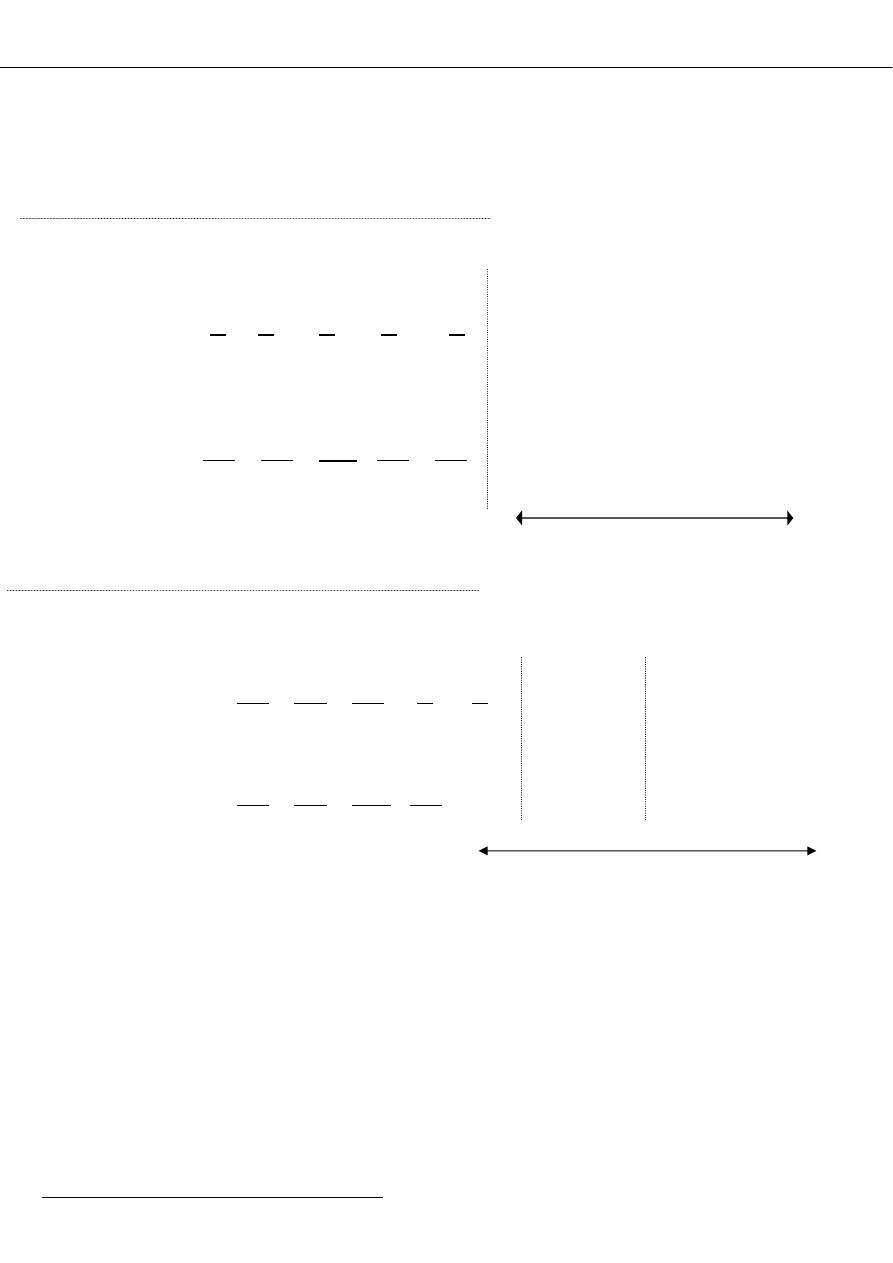
Jon centralny
Struktura
elektronowa
Zysk energetyczny
energia stabilizacji
Konfiguracja
elektronowa
Ti
3+
V
3+
Cr
3+
d
1
d
2
d
3
4 Dq
2 x 4 = 8 Dq
3 x 4 = 12 Dq
(t
2g
)
1
(t
2g
)
2
(t
2g
)
3
Ni
2+
Cu
2+
Zn
2+
d
8
d
9
d
10
6 x 4 - 2 x 6 = 12 Dq
6 x 4 - 3 x 6 = 6 Dq
6 x 4 - 4 x 6 = 0 Dq
(t
2g
)
6
(e
g
)
2
(t
2g
)
6
(e
g
)
3
(t
2g
)
6
(e
g
)
4
Jaka jest konfiguracja elektronowa dla struktur d
4
- d
7
?
Przykład : d
5
→
→
→
→
Fe
3+
Konfiguracja zależy od wartości 10 Dq - silne i słabe pola ligandów
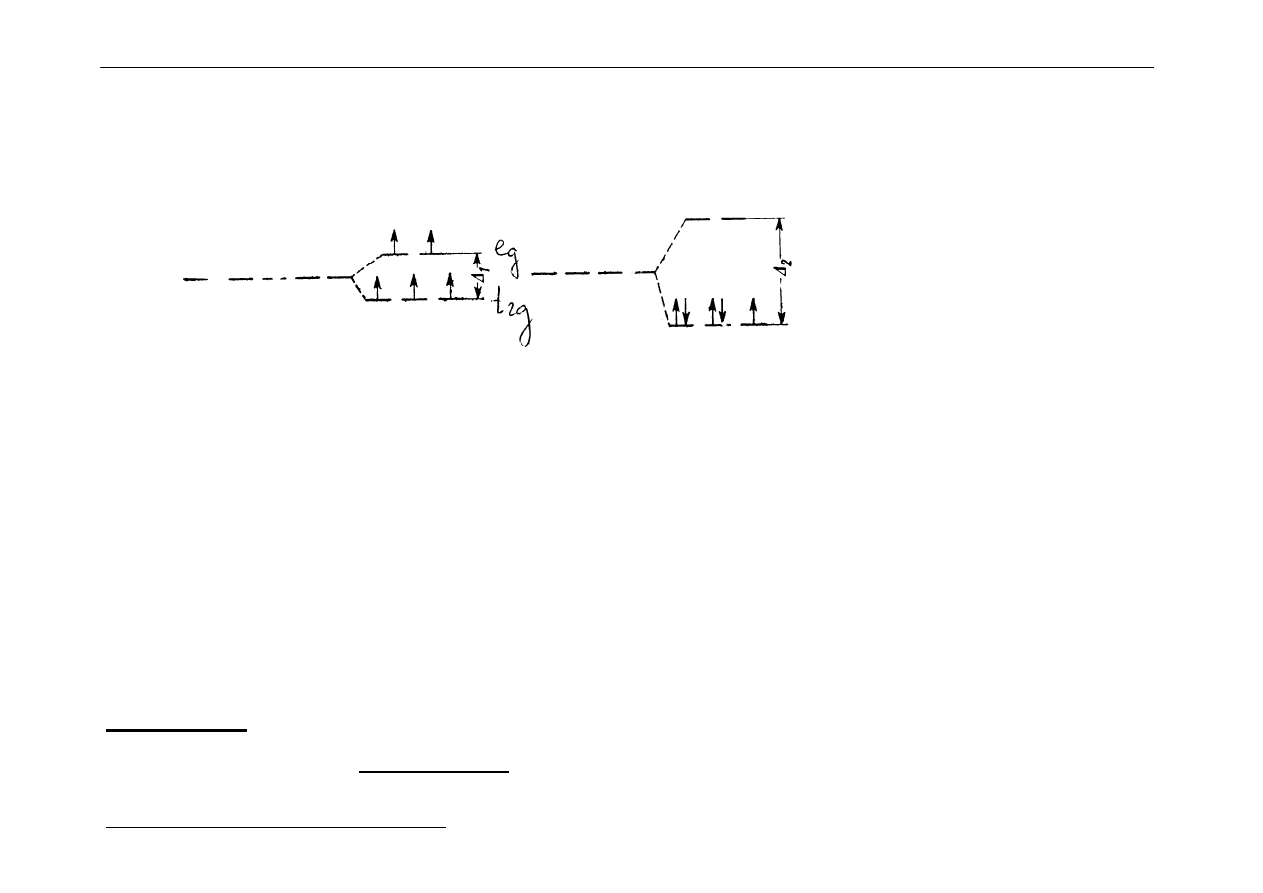
Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
3/
VIII
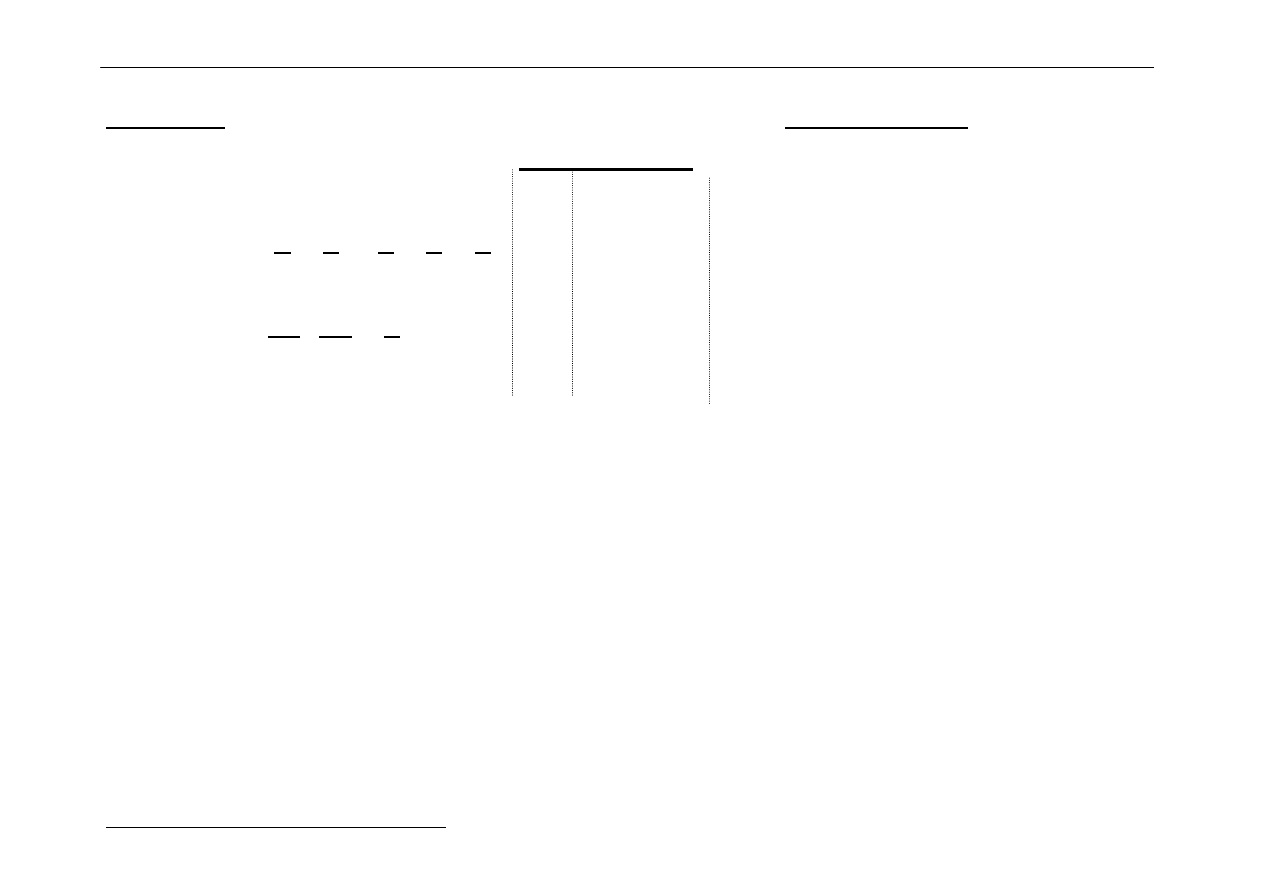
[FeF
6
]
3-
[Fe(CN)
6
]
3-
[FeF
6
]
3-
kompleks wysokospinowy (t
2g
)
3
(e
g
)
2
[Fe(CN)
6
]
3-
kompleks niskospinowy (t
2g
)
5
Szereg spektrochemiczny: szereg wzrastających wartości 10Dq:
I
-
< Br
-
< Cl
-
< F
-
< OH
-
< C
2
O
4
2-
< H
2
O
≈≈≈≈
O
2-
< NH
3
< en < <NO
2
-
<< CN
-
Najsilniejsze działanie rozszczepiające wywołują jony cyjankowe i dlatego kompleksy
cyjankowe są z reguły niskospinowe.
Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
4/
VIII
Najsłabsze rozszczepienie obserwujemy w przypadku jonów halo-genkowych.
Kompleksy halogenkowe są z reguły wysokospinowe.
[FeF
6
]
3-
↑↑↑↑
↑↑↑↑
↑↑↑↑
↑↑↑↑
↑↑↑↑
••••••••
••••••••
••••••••
••••••••
••••••••
••••••••
(sp
3
d
2
)
3d
4s
4p
4d
[Fe(CN)
6
]
3-
↑↑↑↑↓↓↓↓
↑↑↑↑↓↓↓↓
↑↑↑↑
••••••••
••••••••
••••••••
••••••••
••••••••
••••••••
(d
2
sp
3
)
Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
5/
VIII
b) Kompleksy tetraedryczne
Ułożenie 5 różnych orbitali d w stosunku do ligandów:
W kompleksie tetraedrycznym żaden z orbitali d nie jest skierowany wprost na ligandy.
Elektrony znajdujące się na orbitalach d
xy
, d
xz
i d
yz
(czyli na orbitalach t
2g
) są
odpychane przez ligandy silniej niż elektrony d
z2
i d
x2 - y2
(czyli na orbitalach e
g
).
Jest więc tutaj odwrotna kolejność niż w kompleksie oktaedrycznym.
Ponadto :
10 Dq
tetra
= 4/9 (10 Dq
okta
)
Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
6/
VIII
Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
1/
VIII
c) Hybrydyzacja w kompleksach tetraedrycznych i kwadratowych
Kompleksy tetraedryczne
→
→
→
→
sp
3
Przykłady : [MnCl
4
]
2-
, Ni(CO)
4
[MnCl
4
]
2-
Mn
2+
: 3d
5
↑↑↑↑
↑↑↑↑
↑↑↑↑
↑↑↑↑
↑↑↑↑
Cl
-
Cl
-
Cl
-
Cl
-
••••
••••
••••
••••
••••
••••
••••
••••
3d
4s 4p
Ni(CO)
4
Ni : 3d
10
↑↑↑↑↓↓↓↓
↑↑↑↑↓↓↓↓
↑↑↑↑↓↓↓↓
↑↑↑↑↓↓↓↓
↑↑↑↑↓↓↓↓
CO CO CO CO
••••
••••
••••
••••
••••
••••
••••
••••
sp
3
Kompleksy kwadratowe
→
→
→
→
dsp
2
Przykłady : [Ni(CN)
4
]
2-
Ni
2+
(3d
8
)
↑↑↑↑↓↓↓↓
↑↑↑↑↓↓↓↓
↑↑↑↑↓↓↓↓
↑↑↑↑
↑↑↑↑
3d
4s
4p
[Ni(CN)
4
]
2-
↑↑↑↑↓↓↓↓
↑↑↑↑↓↓↓↓
↑↑↑↑↓↓↓↓
↑↑↑↑↓↓↓↓
CN
-
••••
••••
CN
-
••••
••••
CN
-
CN
-
••••
••••
••••
••••
dsp
2
Jon Ni
2+
paramagnetyczny (dwa niesparowane elektrony)
Jon [Ni(CN)
4
]
2-
diamagnetyczny (brak niesparowanych elektronów)

Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
1/
VIII
d) Widma absorbcyjne kompleksów metali przejściowych -kompleksy te są barwne
Widma absorpcyjne w zakresie :
- światła widzialnego
- nadfioletu
dostarczają informacji na temat struktury elektronowej atomu centralnego i pośrednio o
symetrii całego kompleksu. Zajmuje się tym – SPEKTROSKOPIA ZWIĄZKÓW
KOORDYNACYJNYCH
e) Właściwości magnetyczne związków kompleksowych
Kompleksy nisko- i wysokospinowe - pomiar - momentów magnetycznych (
µµµµ
)
µµµµ
= n(n + 2)
µµµµ
B
n - liczba niesparowanych elektronów
µµµµ
B
- magneton Bohra
Jeżeli n = 0 to
µµµµ
= 0: substancja diamagnetyczna
Badania magnetyczne związków chemicznych, np. związków kompleksowych –
MAGNETOCHEMIA
Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
2/
VIII
6. Karbonylki metali przejściowych
Związki koordynacyjne metali grup przejściowych z tlenkiem węgla to k a r b o n y l k i
M(CO)
m
- jednordzeniowe
M
n
(CO)
m
- wielordzeniowe
Grupa ukł.
okres.
KARBONYLKI
5
V(CO)
6
6
Cr(CO)
6
Mo(CO)
6
W(CO)
6
7
Mn
2
(CO)
10
Tc
2
(CO)
10
Re
2
(CO)
10
8 - 10
Fe(CO)
5
Fe
2
(CO)
9
Fe
3
(CO)
12
Co
2
(CO)
8
Co
4
(CO)
12
Co
6
(CO)
16
Ni(CO)
4
Ru(CO)
5
Ru
3
(CO)
12
Rh
2
(CO)
8
Rh
4
(CO)
12
Rh
6
(CO)
16
Os(CO)
5
Os
3
(CO)
12
Ir
2
(CO)
8
Ir
4
(CO)
12
Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
3/
VIII
Reguła - "18" - liczba elektronów walencyjnych atomu centralnego i liczba elektronów
dostarczonych przez CO wynosi 18 (liczba elektronów atomu helowca - położonego najbliżej
w układzie okresowym).
Przykłady:
Cr(CO)
6
Ni(CO)
4
3d
5
4s
1
→
→
→
→
6
3d
8
4s
2
→
→
→
→
10
6 x 2 el.cz.CO
→
→
→
→
12
4 x 2 el.cz.CO
→
→
→
→
8
= 18
= 18
Uwaga: cząsteczka CO dysponuje wolną parą elektronową przy atomie węgla (donor 2
elektronów)
Wyjątek : V(CO)
6
- 17 elektronów
Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
4/
VIII
Można przewidzieć istnienie jonów kompleksowych takich jak :
[Mn(CO)
6
]
+
→
→
→
→
Cr(CO)
6
[Co(CO)
4
]
-
→
→
→
→
Ni(CO)
4
W prostych karbonylkach każde wiązanie jest liniowe
W karbonylkach wielordzeniowych obok liniowo związanych cząsteczek CO występują też
cząsteczki CO tworzące mostek pomiędzy dwoma atomami metalu.
O
Tutaj: hybrydyzacja atomu
C
węgla typu sp
2
(z 1 atomem tlenu i 2 atomami
metalu)
M
M
Ponadto często tworzą się także wiązania kowalencyjne pomiędzy atomami metalu.
Tutaj również zostaje zachowana reguła „18” gazu szlachetnego w stosunku do każdego
atomu metalu.
Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
5/
VIII
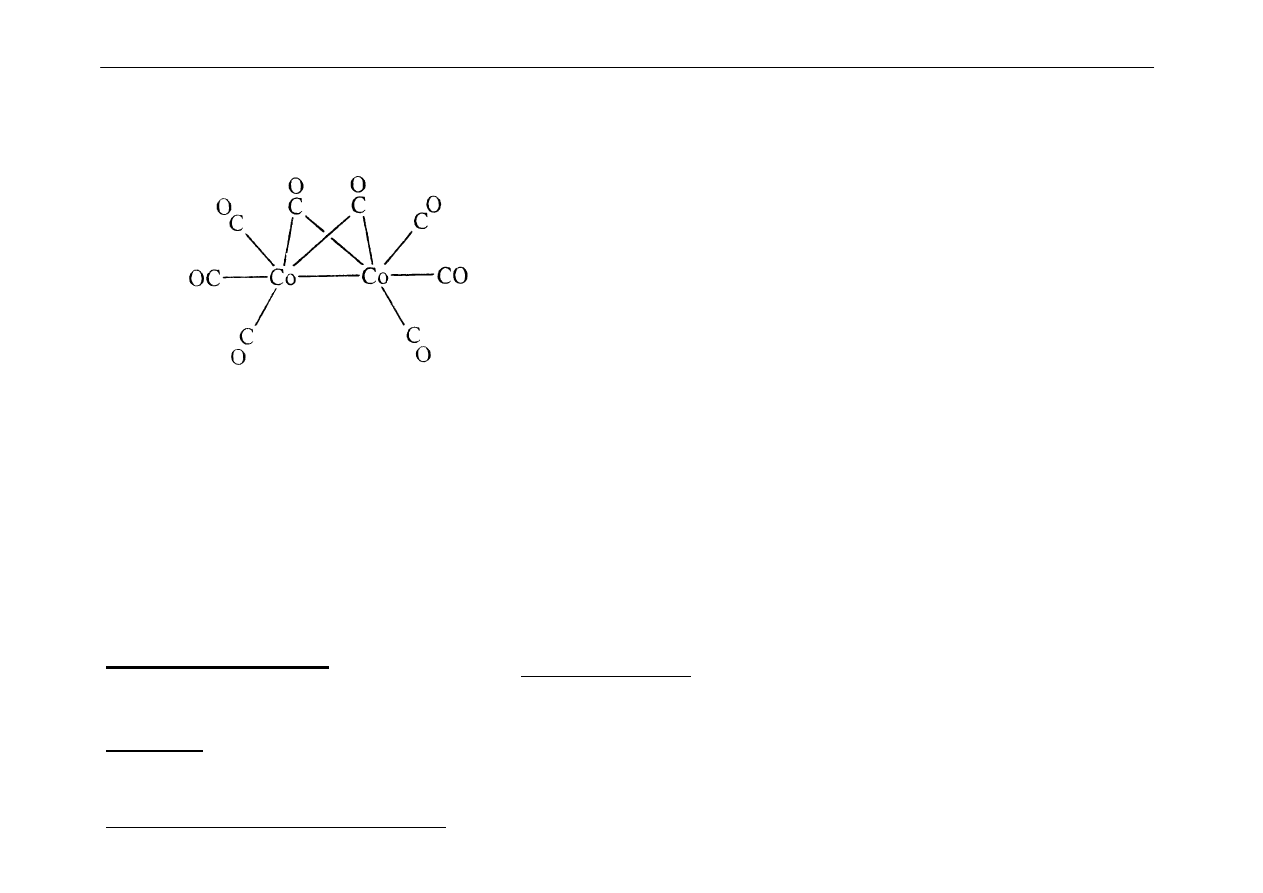
Co
2
(CO)
8
Oktakarbonyl-
dikobaltu
3 x cząsteczka CO
3 x 2
→
→
→
→
6
2 x cząsteczka CO (mostek)
2 x 1
→
→
→
→
2
wiązanie z sąsiednim atomem kobaltu
1
→
→
→
→
1
atom kobaltu (3d
7
4s
2
)
9 x 1
→
→
→
→
9
Razem 18
Klastery metaliczne - związki pierwiastków
d- elektronowych zawierające wiązanie metal-metal
Klastery od CLUSTERS - grona, roje - zawierają kilka atomów metalu ze sobą związanych.
Oprócz karbonylków do tej grupy zaliczają się też halogenki, np.:
Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
6/
VIII
Hg
2
Cl
2
Mo
6
Cl
12
[Re
2
Cl
8
]
2-
Klastery i klatraty - to dwa różne pojęcia !
Karbonylki wielordzeniowe otrzymuje się przez:
ogrzewanie
karbonylków
naświetlanie (nadfiolet)
prostych
7. Kompleksy cyjankowe i nitrozylowe
Jony CN
-
i NO
+
są izoelektronowe z cząsteczką CO
→
→
→
→
wykazują podobne właściwości jako
ligandy w związkach koordynacyjnych
Kompleksy cyjankowe - przykłady :
}

Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
7/
VIII
Au(CN)
2
-
[Co(CN)
5
]
3-
Zn(CN)
3
-
[Co(CN)
6
]
3-
Zn(CN)
4
2-
[Mo(CN)
7
]
4-
[W(CN)
8
]
2-
Kompleksy zawierające, jako jedyne ligandy, ligandy nitrozylowe są nieliczne.
Znane są np. kompleksy:
Mn(CO)(NO)
3
Fe(CO)
2
(NO)
2
Co(CN)
3
NO
Mn(CO)(NO)
3
tj. karbonyltrinitrozylmangan:
liczba elektr. walencyjnych Mn:
(d
5
s
2
) = 7
liczba elektronów CO:
1 x 2 = 2
liczba elektronów NO:
3 x 3 = 9
Razem
18 el.
Uwaga: NO jest donorem 3 elektronów.
Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
8/
VIII
8. Kompleksy metali przejściowych z węglowodorami
Chemia metaloorganiczna - atom metalu połączony jest z rodnikiem lub cząsteczką
organiczną za pośrednictwem atomu węgla. Zwyczajowo - nie zalicza się do związków
metaloorganicznych kompleksów karbonylkowych i cyjankowych.
Przykład:
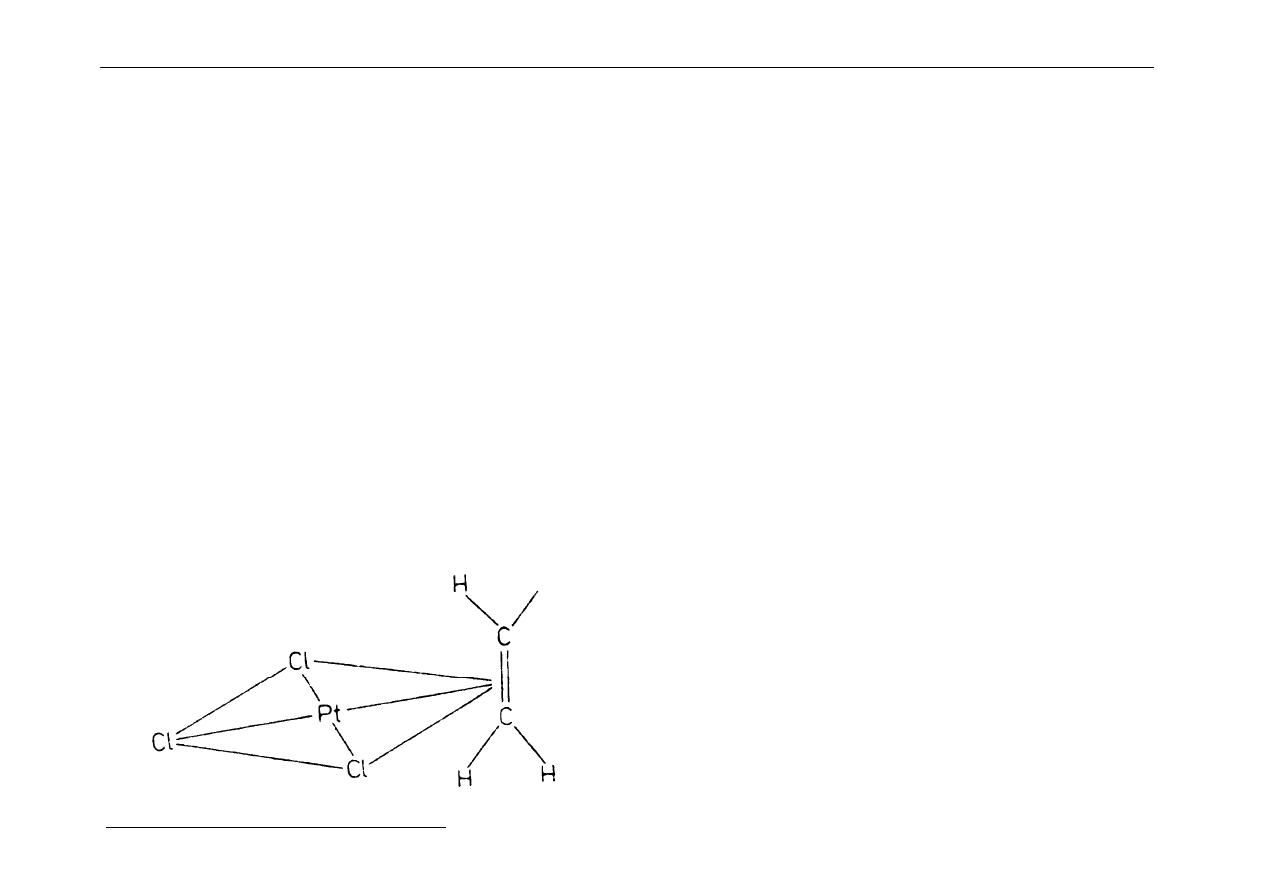
K[Pt(C
2
H
4
)Cl
3
] tj. trichloro(etylen)platynian(II) potasu:
[PtCl
4
]
2-
+ C
2
H
4
= [Pt(C
2
H
4
)Cl
3
]
-
+ Cl
-
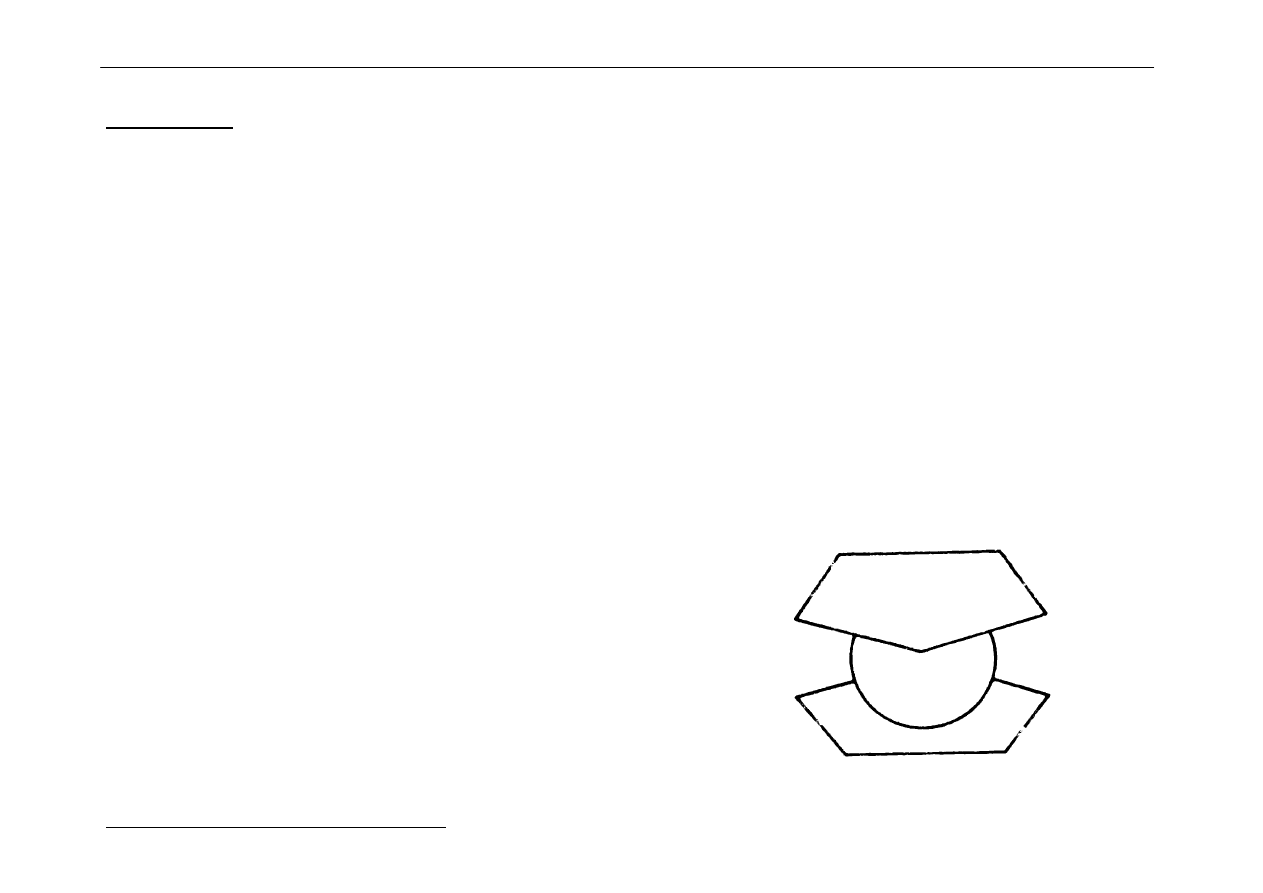
Budowa:
Cząsteczka C
2
H
4
⊥
⊥⊥
⊥
do płaszczyzny
PtCl
3
H
Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
9/
VIII
Kompleksy:
ALKENOWE
- 1 podwójne wiązanie
DIENOWE
- 2 podwójne wiązania
POLIENOWE
- 3 lub więcej podwójnych wiązań
Ligandami mogą też być węglowodory aromatyczne
Pierwszy kompleks z tej grupy to FERROCEN :
Fe + 2C
5
H
6
→
→
→
→
Fe(C
5
H
5
)
2
+ H
2
↓↓↓↓
↓↓↓↓
cyklopentadien bis(cyklopentadieno)żelazo
−−−−
5
5
H
C
Fe
2
+
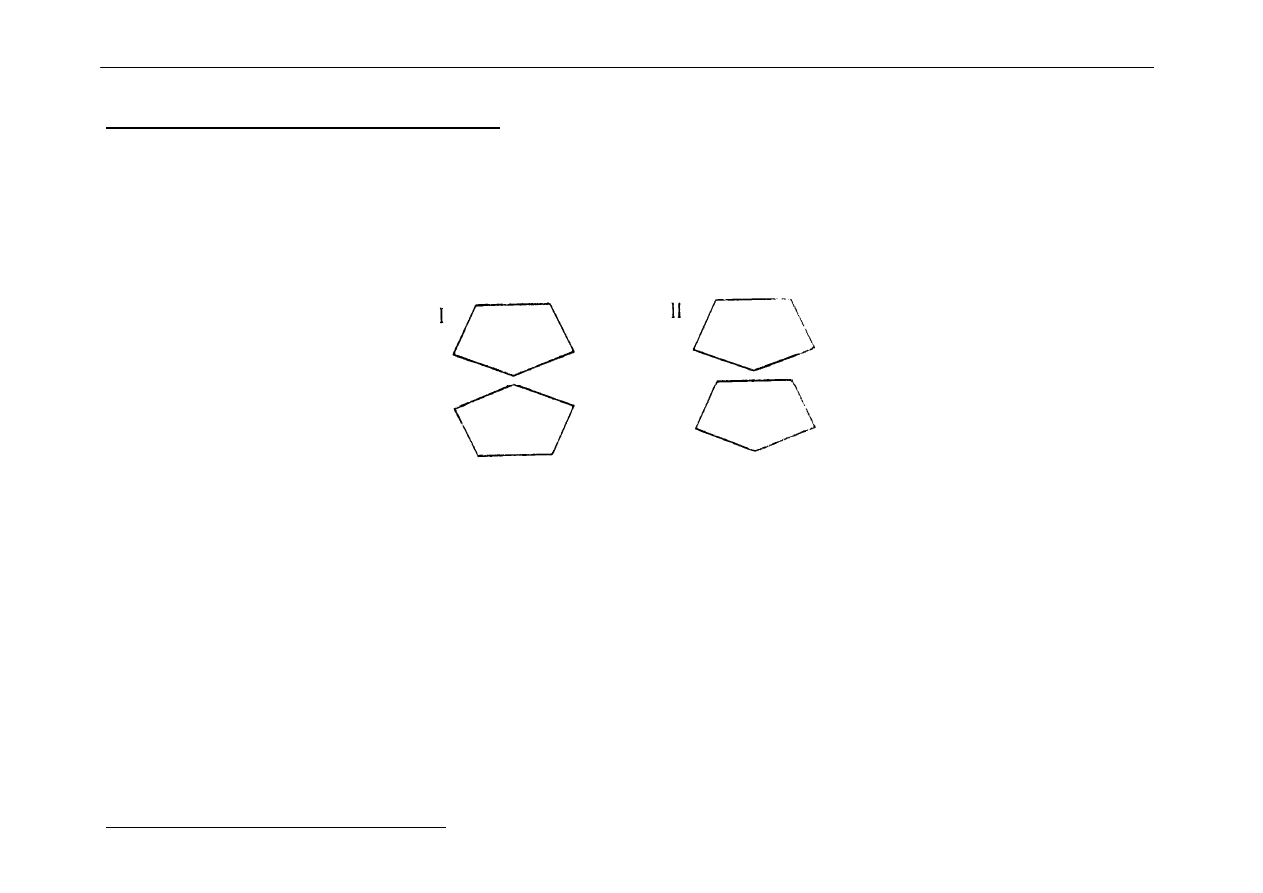
Struktura FERROCENU :
−−−−
5
5
H
C
→
→
→
→
anion cyklopentadienylowy
Jest to tzw. kompleks sandwiczowy
sandwich = kanapka
Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
10/
VIII
Inne związki typu sandwiczowego :
V(cp)
2
, Cr(cp)
2
, Mn(cp)
2
, Co(cp)
2
, Ni(cp)
2
cp = cyklopentadien
Związki te są izomorficzne i posiadają bardzo zbliżone temperatury topnienia
Dwie orientacje pierścieni :
9. Komórki elementarne związków kompleksowych
Kryształy o sieci jonowej
→
→
→
→
węzły są obsadzone przez proste kationy Na
+
, K
+
, Ca
2+
i proste aniony Cl
-
, F
-
, O
2-
, S
2-
→
→
→
→
np. komórki sieciowe typu NaCl i CaF
2
Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
11/
VIII
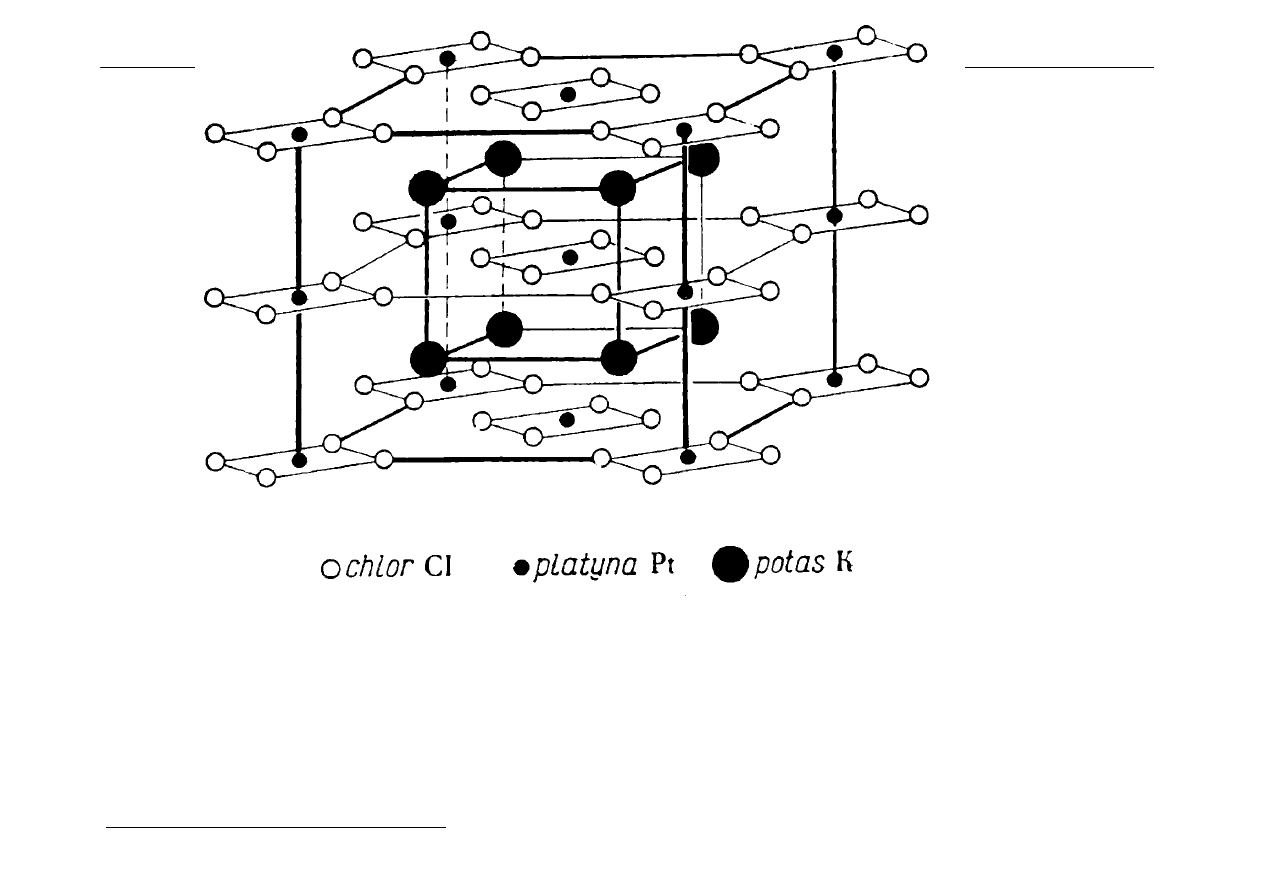
W związkach kompleksowych węzły są obsadzone przez grupy atomów :
K
2
PtCl
6
→
→
→
→
2K
+
i PtCl
6
2-
K
2
PtCl
4
→
→
→
→
2K
+
i PtCl
4
2-
Sieć K
2
PtCl
6
Jest to sieć CaF
2
(fluorytu)
Ca
2+
→
→
→
→
sieć regularna płasko centrowana
F
-
→
→
→
→
środki 8 sześcianów (wewnątrz sześcianu komórki)
Patrz : sieć K
2
PtCl
6
Sieć K
2
PtCl
4
Sieć K
2
PtCl
4
Sieć K
2
PtCl
4
:
Władysław Walkowiak Chemia Nieorganiczna II – CHC1041 w- PWr.
Związki Kompleksowe (Koordynacyjne) - VIII
12/
VIII
Wyszukiwarka
Podobne podstrony:
więcej podobnych podstron