
Budowa ciał stałych
sieć krystaliczna
układy krystalograficzne
sieć realna – defekty
wiązania w ciałach stałych
Ciała stałe
to substancje o regularnej, przestrzennej budowie
krystalicznej, czyli regularnym uporządkowaniu w
przestrzeni elementów tworzących ciało (atomów, jonów,
cząsteczek)
w zależności od stopnia uporządkowania struktury
wewnętrznej wyróżniamy ciała
krystaliczne (kryształ) gdy elementy uporządkowane są w sposób
okresowy tzw. uporządkowanie dalekiego zasięgu, anizotropia
polikryształy – uporządkowanie wewnątrz obszarów (ziaren)
amorficzne (bezpostaciowe) – uporządkowanie bliskiego zasięgu
ciekłe kryształy – ciecze anizotropowe, charakteryzują się
uporządkowanym ułożeniem cząsteczek
Struktura kryształów
Sieć Bravais’go – podstawowe pojęcie w opisie dowolnego
krystalicznego ciała stałego – określa charakter okresowego
uporządkowania w przestrzeni powtarzających się
elementów strukturalnych kryształu
sieć Bravais’go jest dyskretnym, nieskończonym zbiorem punktów
przestrzeni uporządkowanych w ten sposób, że przy obserwacji
układu z dowolnego należącego doń punktu wzajemne rozmieszenie
punktów układu i jego orientacja są zawsze takie same
z geometrycznego punktu widzenia uporządkowanie, okresowo
powtarzające się rozmieszczenie cząstek w krysztale, można opisać
za pomocą
operacji równoległego przemieszczania
czyli
translacji
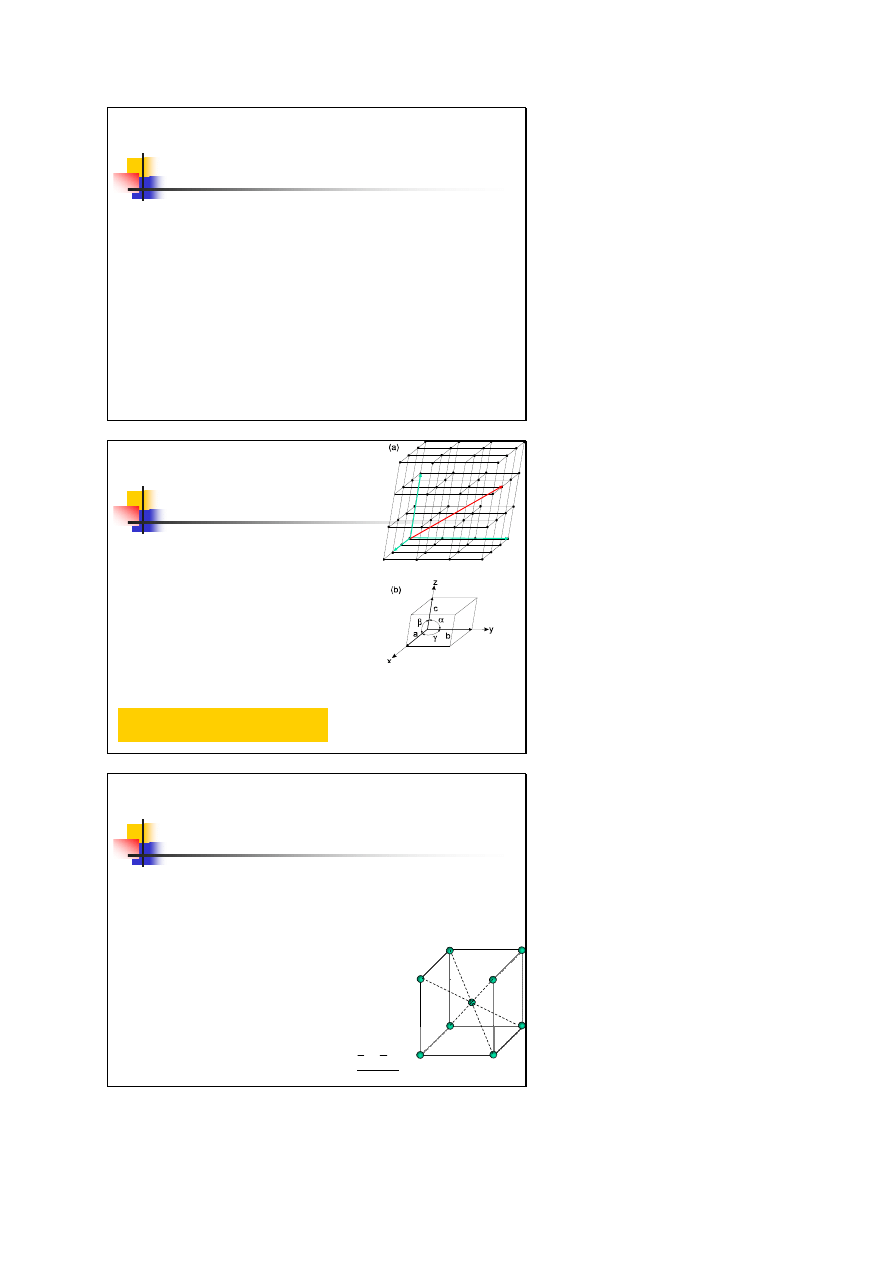
Sieć krystaliczna
sieć krystaliczna określa charakter okresowego
uporządkowania w przestrzeni powtarzających się
elementów strukturalnych kryształu
baza sieci to najmniejszy powtarzający się element
strukturalny:
pojedynczy atom
grupy atomów
jon
molekuła
sieć translacyjna to sieć przestrzenna utworzona
przez punkty bazy – węzły sieci
Sieć Bravais’go
Trójwymiarowa sieć translacyjna Bravais’go jest
zbiorem wszystkich tych punktów przestrzeni,
których wektory wodzące mają postać:
c
p
b
n
a
m
R
r
r
r
r
+
+
=
gdzie m, n, p dowolne liczby całkowite
dowolna trójka wektorów nie leżących w
jednej płaszczyźnie, wektory te generują
sieć (sieć jest rozpięta na tych wektorach)
c
b
a
r
r
r ,
,
długości tych wektorów tzn. liczby
a, b i c nazywamy stałymi sieci
Równoległościan zbudowany
na elementarnych wektorach
translacji nazywamy komórką
elementarną
c
b
a
R
r
r
r
r
2
3
2
+
+
=
Właściwości sieci krystalicznej
komórka prosta – węzły tylko w narożach (jeden
węzeł na komórkę)
komórki złożone – sieci centrowane
komórka elementarna – odzwierciedla symetrię sieci
stałe sieci i kąty to tzw. parametry sieci
liczba atomów w komórce elementarnej
liczba koordynacyjna – liczba punktów
sieci leżących najbliżej danego węzła
współczynnik upakowania – stosunek
objętości wszystkich atomów do
objętości całego kryształu
a=b=c,
α=β=γ=90°
3
3
2
3
4
a
a
k
⎟
⎠
⎞
⎜
⎝
⎛
=
π
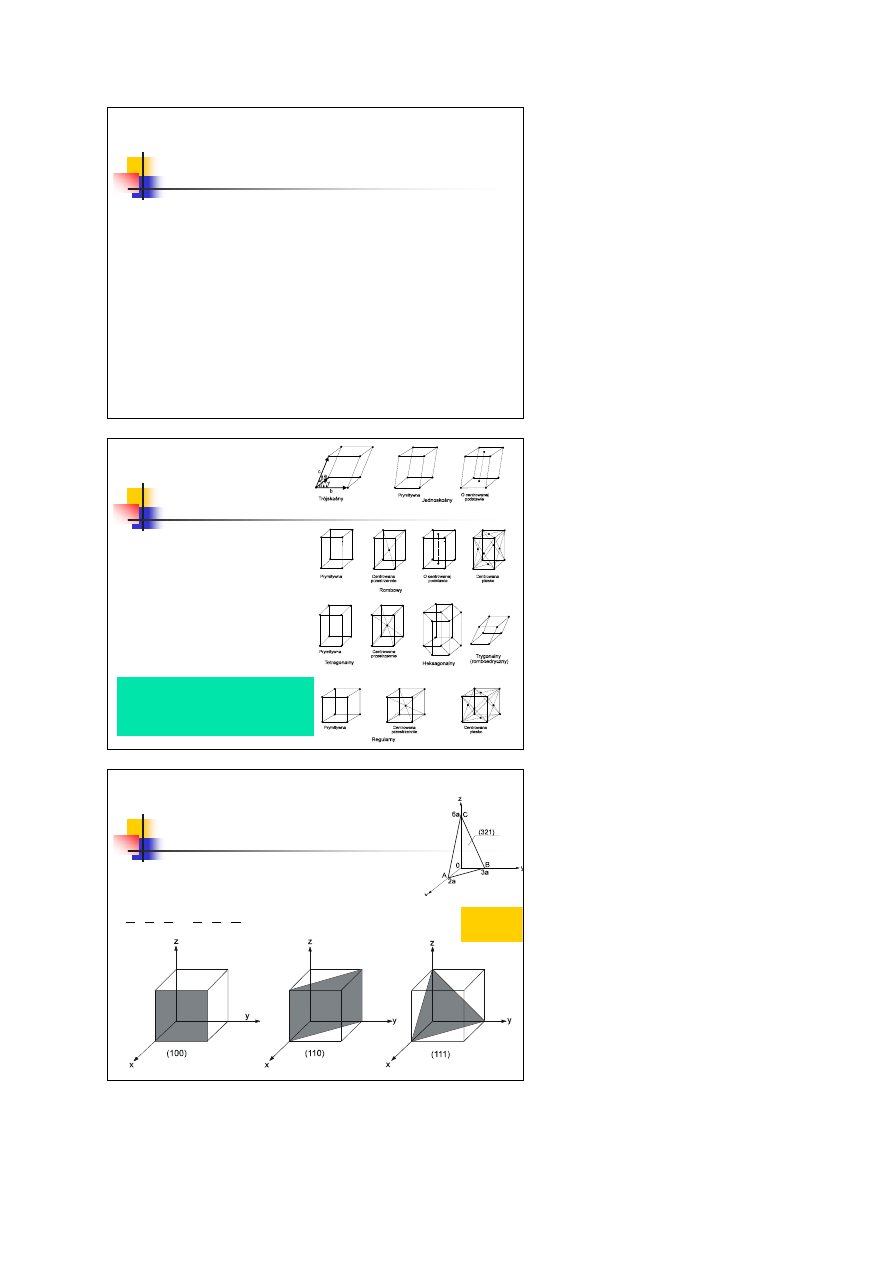
Elementy symetrii
C
n
- obroty o całkowitą wielokrotność kąta 2
π/n
(2, 3, 4 lub 6 krotne)
i - inwersje – przekształcenia z jednym punktem
stałym np. środek symetrii
obroty inwersyjne
σ
n
=i C
n
odbicie zwierciadlane
ρ= σ
2
=i C
2
translacje
Symetrię sieci Bravais’ego określa zbiór wszystkich
izometrii przekształcających daną sieć w siebie
Do grupy symetrii należą:
α β γ
≠ ≠
≠ ≠
a b c
α β
γ
= =
≠
≠ ≠
90
90
o
o
a b c
α β γ
= = =
≠ ≠
90
o
a b c
α β γ
= = ≠
= =
90
o
a b c
α β γ
= = =
= ≠
90
o
a b c
α β γ
= = =
= =
90
o
a b c
krystalograficzne
układy
W zależności od stopnia symetrii, sieci
Bravais’go dzieli się na siedem
układów krystalograficznych:
regularny,
tetragonalny,
rombowy,
jednoskośny,
trójskośny,
heksagonalny i trygonalny
Wśród nich wyróżnia się 14 typów
sieci krystalograficznych o różnym
centrowaniu: przestrzennym,
powierzchniowym i w podstawach.
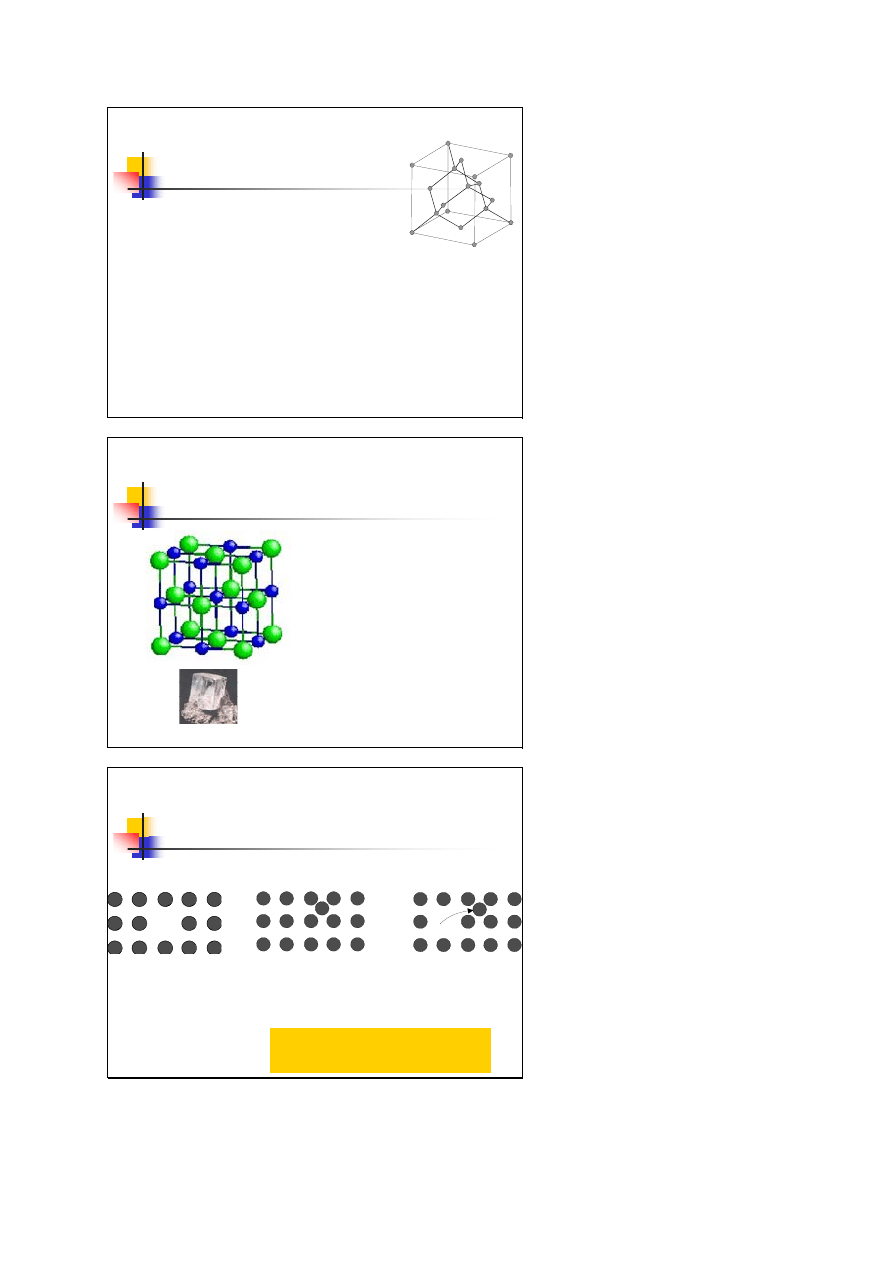
Wskaźniki płaszczyzn
odwrotności punktów przecięcia płaszczyzny z osiami
sprowadzamy do wspólnego mianownika
D
l
D
k
D
h
C
B
A
,
,
,
,
⇒
1
1
1
i liczniki zapisujemy w postaci (hkl)
wskaźniki
Millera
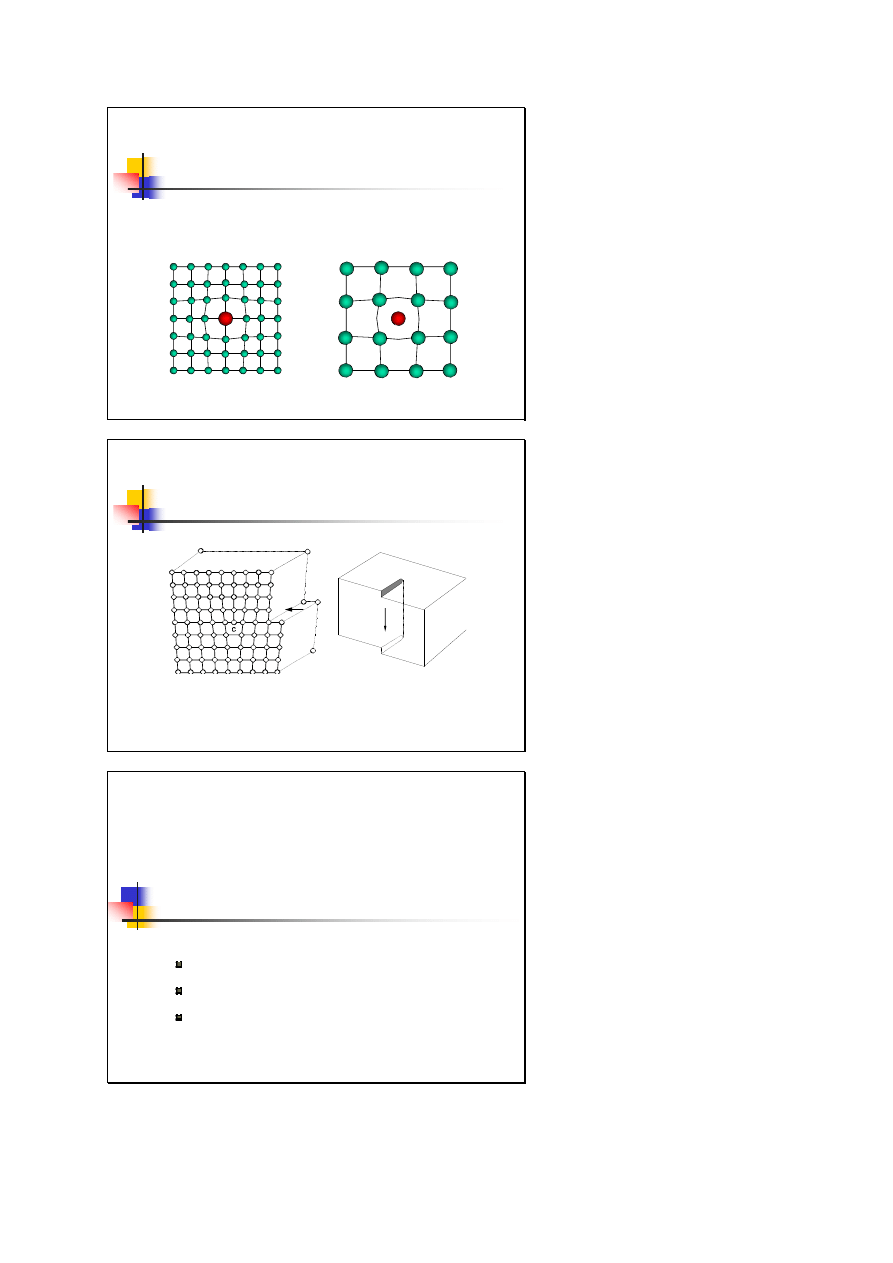
Typowe struktury krystaliczne
struktura diamentu
płasko centrowana sieć regularna
z dwupunktową bazą (dwa atomy
węgla przesunięte wzdłuż głównej
przekątnej o ¼ długości),
liczba koordynacyjna 4
pierwiastki C (diament),
Si (krzem), Ge (german)
C
Typowe struktury krystaliczne
struktura chlorku sodu
Chlorek sodu (NaCl) – struktura
jonowa – sieć regularna,
centrowana powierzchniowo, z
bazą dwupunktową z jonu Na i
jonu Cl przesuniętego o ½
głównej przekątnej (dwie
podsieci: sodu i chloru)
liczba koordynacyjna 6
inne związki: LiF, KCl, PbS
Na
+
Cl
-
Defekty sieci krystalicznej
defekt Schottky’ego,
atomy opuszczając swe
położenie przesuwają się
w kierunku powierzchni –
wyparowanie zewnętrzne
atomy międzywęzłowe
defekty punktowe – luki (wakanse) – nieobsadzone węzły sieci
defekty Frenkla, wakanse
stowarzyszone z atomami
międzywęzłowymi
defekty te nie mają ustalonych położeń,
mogą przesuwać się wewnątrz kryształu,
zwykle dyfundują w głąb próbki
Domieszki (defekty punktowe)
Domieszki stanowią najważniejszy i najbardziej rozpowszechniony
rodzaj defektów sieci - wywierają istotny wpływ na chemiczne,
optyczne, magnetyczne i mechaniczne właściwości ciał stałych
podstawienie
wtrącenie
Defekty liniowe (dyslokacje )
krawędziowe, pojawienie się
dodatkowej półpłaszczyzny
sieciowej, wektor przesunięcia b
charakteryzuje stopień poślizgu
śrubowe, przesunięcie atomów
wzdłuż osi dyslokacji
dyslokacje, a właściwości
mechaniczne kryształów
b
r
b
r
Struktura pasmowa
wiązania atomów w krysztale
drgania sieci krystalicznej
struktura pasmowa kryształów
Charakter wiązań
B
r
n
−
A
r
m
−
+
A
r
B
r
m
n
( )
n
m
r
B
r
A
r
U
+
−
=
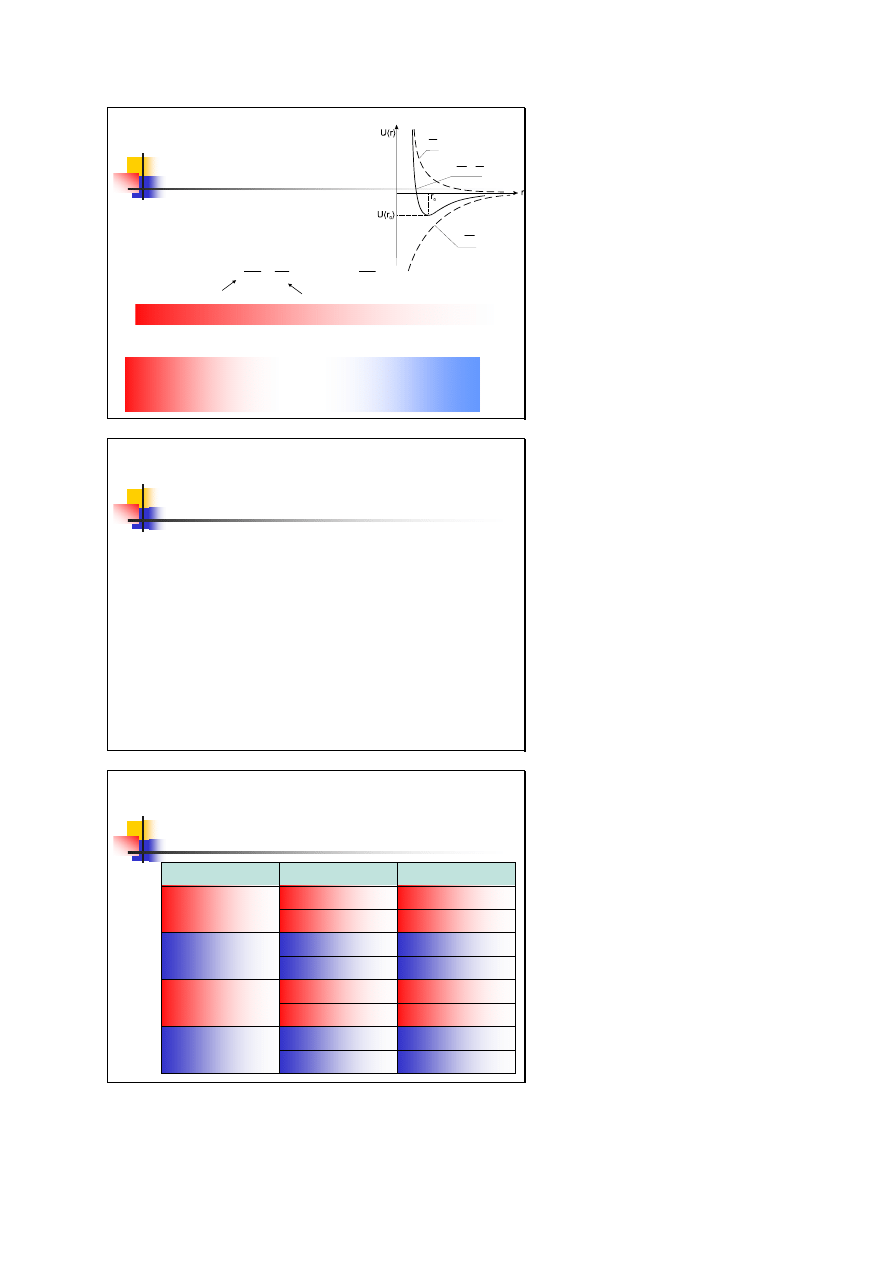
Niezależnie od natury sił międzyatomowych,
przebieg energii potencjalnej w funkcji odległości
między atomami ma podobną postać:
siły przyciągania
siły odpychania
Siły przyciągania są bardziej dalekozasięgowe więc n>m
W stanie równowagi trwałej dla r=r
o
energia osiąga minimum
dr
dU
F
−
=
Siły odpychania
wynikają z nakładania
się jąder atomowych
Siły przyciągania mają
charakter sił
elektromagnetycznych
Rodzaje wiązań
wiązania jonowe
elektrostatyczne przyciąganie się ładunków
wiązania kowalencyjne
nakładanie się powłok elektronowych
wiązania metaliczne
oddziaływanie chmury elektronów z jądrami
wiązania molekularne
wiązania między cząsteczkowe siłami van der Walsa
Energia wiązania atomów
Typ wiązania
Przykłady
Energia kJ/mol
jonowe
LiF
1014
NaCl
765
kowalencyjne
Ge
374
Si
448
metaliczne
Cu
338
Fe
393
molekularne
Ne
1,9
Kr
3,2
Wiązanie jonowe
występuje w kryształach utworzonych z silnie
elektrododatnich atomów metali i silnie
elektroujemnych atomów chlorowców (NaCl, CsCl, KJ)
wzajemne oddziaływanie jonów Na
+
i Cl
-
energia oddziaływania wynosi
gdzie
α
M
– stała Madelunga uwzględniająca
oddziaływanie kulombowskie jonu z dalszymi
sąsiadami
kryształy jonowe są twarde, o wysokiej temperaturze
topnienia, złe przewodniki ciepła i pradu
( )
n
o
M
r
B
r
e
r
U
+
πε
α
−
=
4
2
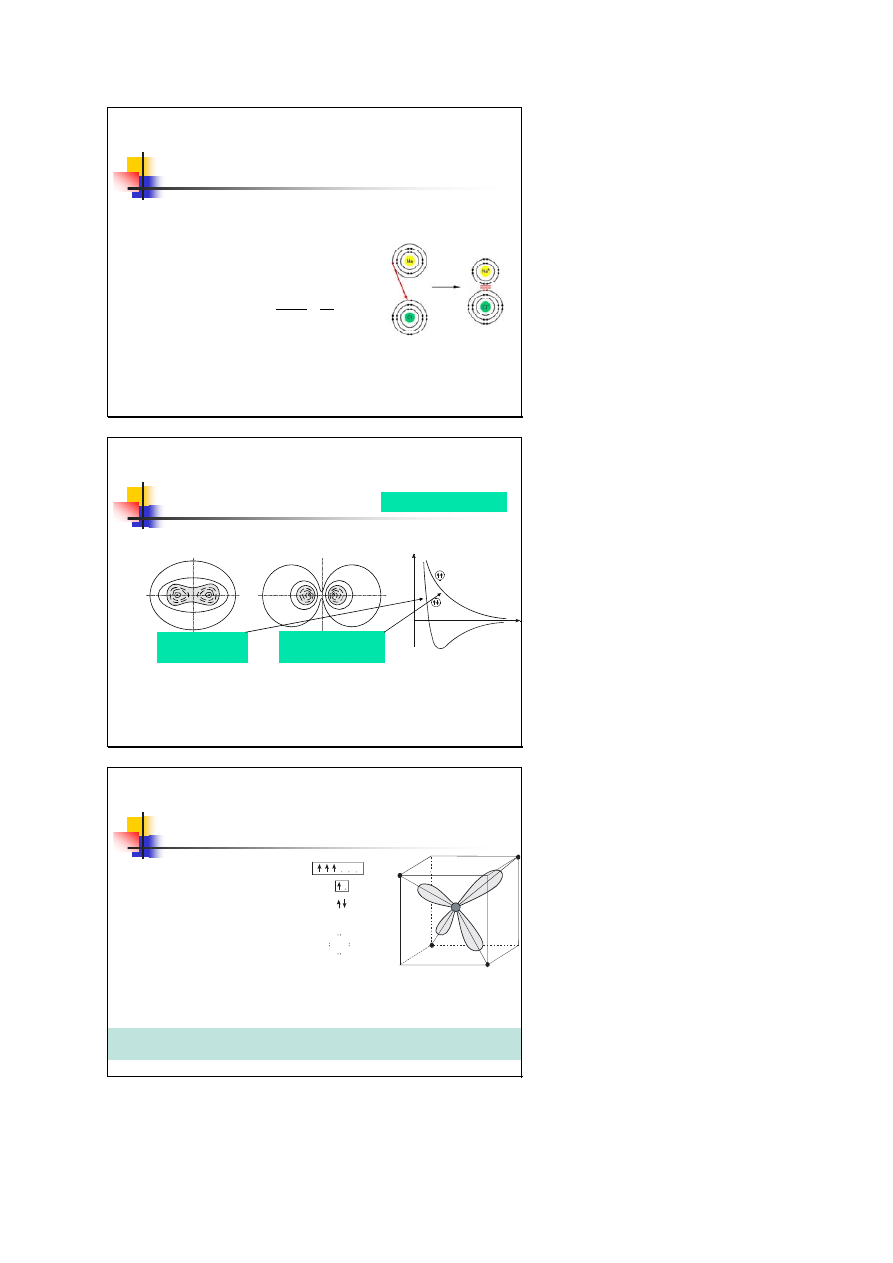
Wiązanie kowalencyjne
(atomowe)
występuje w atomach leżących blisko siebie w układzie
okresowym, o tej samej lub zbliżonej elektroujemności
U(r)
r
orbital wiążący
siły przyciągania
orbital antywiążący
siły odpychania
Oddziaływanie uwarunkowane wymianą elektronów między atomami
ma kwantowy charakter i nosi nazwę oddziaływania wymiennego
W przypadku jodowodoru HI po utworzeniu wspólnej pary elektronowej
wodór ma dublet charakterystyczny dla He, a jod oktet taki jak ksenon
H· + ·Ï: = H:Ï:
..
..
wodór H
2
, azot N
2
Kryształy kowalencyjne - CH
4
C
C
H
H
H
H
H
H
H
(a) (b)
(c)
2p
2s
1s
hybrydyzacja orbitali 2s i 2p
powstaje orbital sp
3
Wiązanie kowalencyjne jest wiązaniem silnym, ma charakter wysoce kierunkowy.
Kryształy są twarde i słabo odkształcalne. Typowe wiązanie dla półprzewodników
orbital atomowy
cząsteczki CH
4
Na skutek oddziaływań między
atomami w krysztale zmienia
się konfiguracja elektronów

Wiązanie metaliczne
występuje dla atomów o małej liczbie elektronów
walencyjnych
przy zbliżaniu atomów następuje przekrywanie funkcji
falowych tych elektronów tak, że gęstość
prawdopodobieństwa ich znalezienia jest stała
delokalizacja elektronów i łatwość ich
przemieszczania pod wpływem pola elektrycznego
wiązanie ma charakter kolektywny i objętościowy
dodatnio naładowane jądra oddziaływują z chmurą
oderwanych elektronów swobodnych
wiązanie metaliczne nie jest skierowane, więc metale
są plastyczne. Koncentracja elektronów 10
23
cm
-3
miedź, żelazo
Wiązanie molekularne
Wiązania molekularne mają charakter wiązań
elektrostatycznych (siły van der Walsa) i dzielimy na:
oddziaływanie trwałych lub
indukowanych momentów dipolowych cząsteczek
oddziaływania te są krótkiego zasięgu i łatwo niszczone
na skutek ruchów termicznych – istotne w procesach
biologicznych
kryształy molekularne są podatne na odkształcenia, topią
się w niskich temperaturach, źle przewodzą ciepło i prąd
argon, krypton,
naftalen
Drgania sieci
krystalicznej
atomy sieci krystalicznej wykonują drgania wokół swoich
położeń równowagi
drgania te występują nawet w T=0K
amplituda drgań (10
-11
m) jest dużo mniejsza od odległości
międzysieciowych, tak że można je traktować jako drgania
harmoniczne
rozszerzalność cieplna i przewodnictwo cieplne związane są z
drganiami atomów
drgania cieplne są przyczyną występowania oporu elektrycznego
drgania rozchodzą się w krysztale w postaci fal sprężystych
zwanych sieciowymi
ze względu na ograniczoność sieci krystalicznej energia tych
drgań jest skwantowana w postaci porcji zwanych fononami
Wyszukiwarka
Podobne podstrony:
więcej podobnych podstron