
Copyright by Oficyna Wydawnicza „Tutor”
dr inż. Zdzisław Głowacki
ARKUSZ ZAWIERA INFORMACJE PRAWNIE CHRONIONE
DO MOMENTU ROZPOCZĘCIA EGZAMINU!
TUTOR
CH-RM 201404
II Ogólnopolska Próbna Matura
„CHEMIA Z TUTOREM”
dla uczniów klas maturalnych
POZIOM ROZSZERZONY
Czas pracy: 150 minut
Instrukcja dla zdającego
1. Sprawdź, czy arkusz egzaminacyjny zawiera 16 stron (zadania 1–25).
Ewentualny brak zgłoś przewodniczącemu zespołu nadzorującego egzamin.
2. Rozwiązania i odpowiedzi zapisz w miejscu na to przeznaczonym przy
każdym zadaniu.
3. W rozwiązaniach zadań rachunkowych przedstaw tok rozumowania
prowadzący do ostatecznego wyniku. Pamiętaj o jednostkach.
4. Pisz czytelnie. Używaj długopisu/pióra tylko z czarnym tuszem/atramentem.
5. Nie używaj korektora, a błędne zapisy wyraźnie przekreśl.
6. Pamiętaj, że zapisy w polu oznaczonym jako brudnopis nie podlegają
ocenie.
7. Możesz korzystać z karty wybranych tablic chemicznych dopuszczonej przez
CKE jako pomoc egzaminacyjna, linijki oraz prostego kalkulatora.
8. Uwaga! Jeżeli w treści zadania nie podano inaczej, to wartości mas
atomowych z układu okresowego pierwiastków zaokrąglaj w obliczeniach
do liczb całkowitych, tylko w przypadku atomu chloru przyjmij wartość
35,5 u.
9. Na arkuszu wpisz swój numer PESEL.
Życzymy powodzenia!
3 kwietnia 2014 r.
Za rozwiązanie
wszystkich zadań można
otrzymać łącznie
60 punktów
Wypełnia zdający przed rozpoczęciem pracy
PESEL ZDAJĄCEGO
KOD ZDAJĄCEGO
dr inż. Zdzisław Głowacki © Oficyna Wydawnicza „Tutor” – 2014 r.
www.szkolna.pl
strona 2
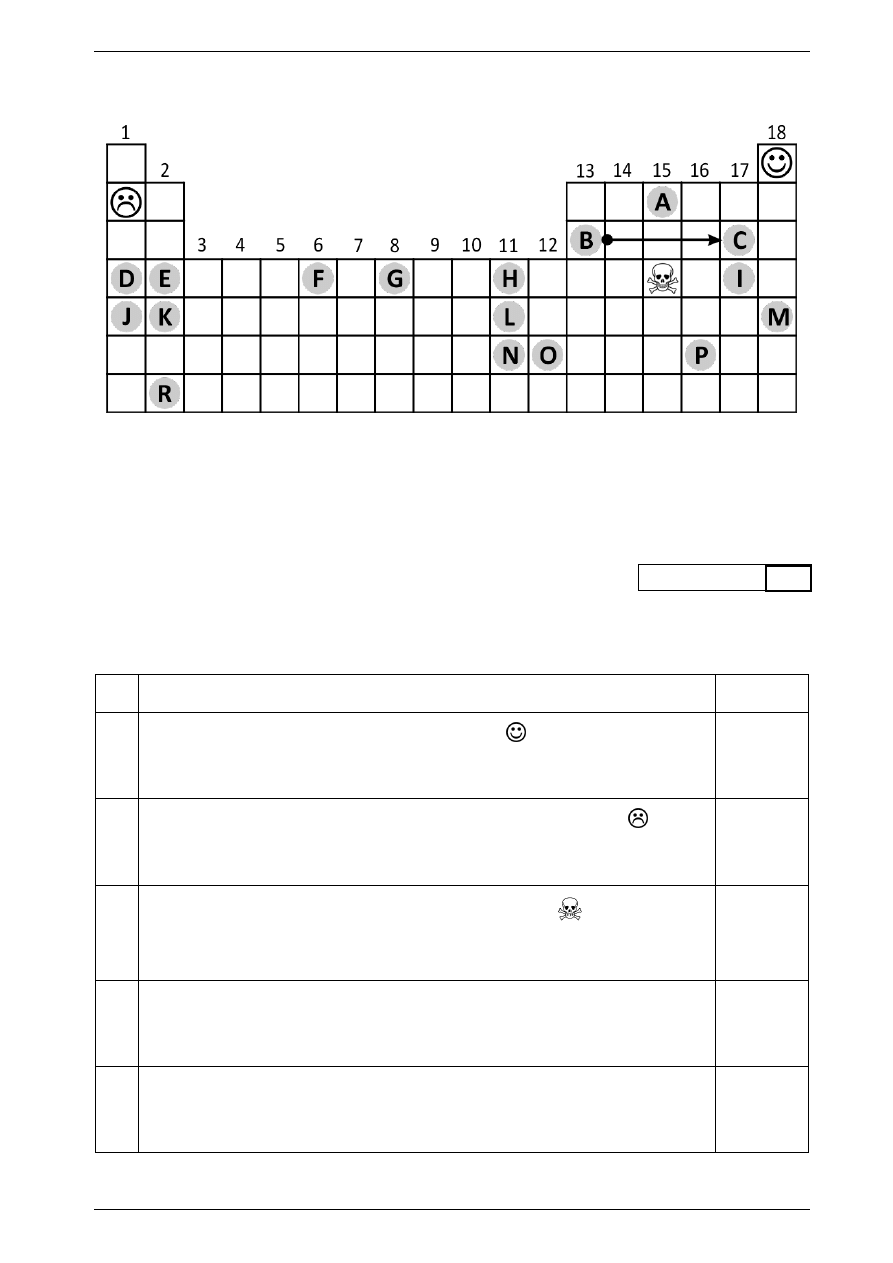
Rysunek do zadań 1. – 3.
Rysunek przedstawia zarys układu okresowego pierwiastków. Kolejne kolumny i ich numery odpowiadają
grupom pierwiastków. Na podstawie tego rysunku oraz informacji zawartych w Karcie wybranych tablic
chemicznych wykonaj zadania 1.
3.
Zadanie 1.
(2 pkt)
przyznane punkty
Uzupełnij tabelę, wpisując do ostatniej kolumny P, jeżeli stwierdzenie jest prawdziwe, F – jeżeli jest
fałszywe albo inną informację, o której podanie jesteś proszony w poleceniu.
Stwierdzenie
P/F/inne
A.
Pierwiastek znajdujący się w miejscu oznaczonym
wykryto po raz pierwszy
w 1868 roku w zewnętrznej części atmosfery Słońca.
B.
Sole pierwiastka znajdującego się w miejscu oznaczonym symbolem
znalazły
zastosowanie jako lek w psychiatrii oraz w profilaktyce stanów maniakalno-
-depresyjnych.
C.
Tlenek pierwiastka znajdującego się w miejscu oznaczonym
jest silną trucizną
znaną pod nazwą arszenik. Wpisz do kolumny obok wzór sumaryczny tego tlenku
(jego masa molowa wynosi 198 g).
D.
Metale znajdujące się w miejscach oznaczonych literami B i N z powodu pasywacji
nie reagują z kwasem azotowym(V).
E.
Wpisz litery oznaczające pierwiastki, które zostały odkryte przez Marię Skłodowską-
-Curie.
dr inż. Zdzisław Głowacki © Oficyna Wydawnicza „Tutor” – 2014 r.
www.tutor.edu.pl
strona 3
Zadanie 2.
(1 pkt)
przyznane punkty
Podkreśl, w podanym niżej tekście, właściwe określenia prawidłowo uzupełniające treść.
W szeregu pierwiastków znajdujących się na rysunku, w miejscu od litery B do litery C włącznie, liczba
elektronów walencyjnych tych pierwiastków maleje/rośnie/nie ulega zmianie, promienie atomowe
maleją/rosną/nie ulegają zmianie, energia jonizacji maleje/rośnie/nie ulega zmianie, elektroujemność
maleje/rośnie/nie ulega zmianie, właściwości kwasowe tlenków tych pierwiastków maleją/rosną/
nie ulegają zmianie, natomiast przynależność do okresu maleje/rośnie/nie ulega zmianie.
Zadanie 3.
(2 pkt)
przyznane punkty
Uzupełnij tabelę, wpisując do kolumny odpowiedzi na zamieszczone wcześniej pytania i polecenia.
Pytanie/polecenie
Odpowiedź
A.
Zapisz pełną konfigurację elektronową dla elektronów walencyjnych
pierwiastka znajdującego się w miejscu oznaczonym literą G.
B.
Jakimi literami oznaczono w czwartym okresie układu pierwiastek/pier-
wiastki, u którego/których występuje promocja elektronowa?
C.
Uszereguj pierwiastki oznaczone literami D, E, J i K zgodnie z ich
wzrastającą aktywnością chemiczną. Wpisz obok kolejno ich symbole
chemiczne.
D.
Wpisz litery, w miejscu których w czwartym okresie znajdują się atomy
pierwiastków posiadających więcej niż jeden niesparowany elektron
walencyjny w stanie podstawowym.
E.
Izotop pierwiastka oznaczonego literą R o liczbie masowej 226 ulega
rozpadowi alfa. Podaj nazwę grupy pierwiastków, do której należy
cięższy produkt rozpadu tego izotopu.
BRUDNOPIS (Zapisy w brudnopisie nie podlegają ocenie!)
dr inż. Zdzisław Głowacki © Oficyna Wydawnicza „Tutor” – 2014 r.
www.szkolna.pl
strona 4
Informacja do zadań 4. i 5.
Kobalt-60 – promieniotwórczy izotop kobaltu sztucznie otrzymywany przez
aktywację neutronową naturalnego kobaltu zawierającego niemal wyłącznie
izotop Co-59.
Kobalt-60 ulega rozpadowi beta minus, podczas tego rozpadu uwolnione
zostają dwa kwanty gamma o energii 1,17 i 1,33 MeV.
Jest wykorzystywany, jako źródło promieniowania gamma, między innymi do
napromieniowywania komórek nowotworowych. Jednemu rozpadowi towa-
rzyszy emisja dwóch kwantów gamma, a czas połowicznego rozpadu wynoszący 5,3 roku umożliwia
uzyskanie dużego natężenia promieniowania z małej próbki przy możliwości pracy urządzenia przez długi
okres. Urządzenie do napromieniowywania zmian nowotworowych z użyciem radioaktywnego kobaltu
nazywa się bombą kobaltową.
Zadanie 4.
(1 pkt)
przyznane punkty
Technik uruchamiający bombę kobaltową przeczytał w instrukcji, że urządzenie będzie funkcjonowało
prawidłowo, dopóki zawartość promieniotwórczego izotopu nie spadnie poniżej 25% zawartości
początkowej. Oblicz, ile lat może prawidłowo funkcjonować to urządzenie.
Obliczenia:
Odpowiedź: ...................................................................................................................................................
Zadanie 5.
(2 pkt)
przyznane punkty
a) Podaj nazwę pierwiastka, którego ilość będzie się zwiększała w bombie kobaltowej w trakcie jej pracy.
Odpowiedź: ......................................................................................................................................................
b) Do urządzenia służącego do miejscowego napromieniowywania tkanek nowotworowych wstawiono
ampułkę o masie 3,2 g zawierającą 200 mg promieniotwórczego izotopu o
2
60
.
Jaka będzie masa tej ampułki po upływie 5,3 roku? Masę podaj w miligramach.
Obliczenia:
Odpowiedź: ...................................................................................................................................................
dr inż. Zdzisław Głowacki © Oficyna Wydawnicza „Tutor” – 2014 r.
www.tutor.edu.pl
strona 5
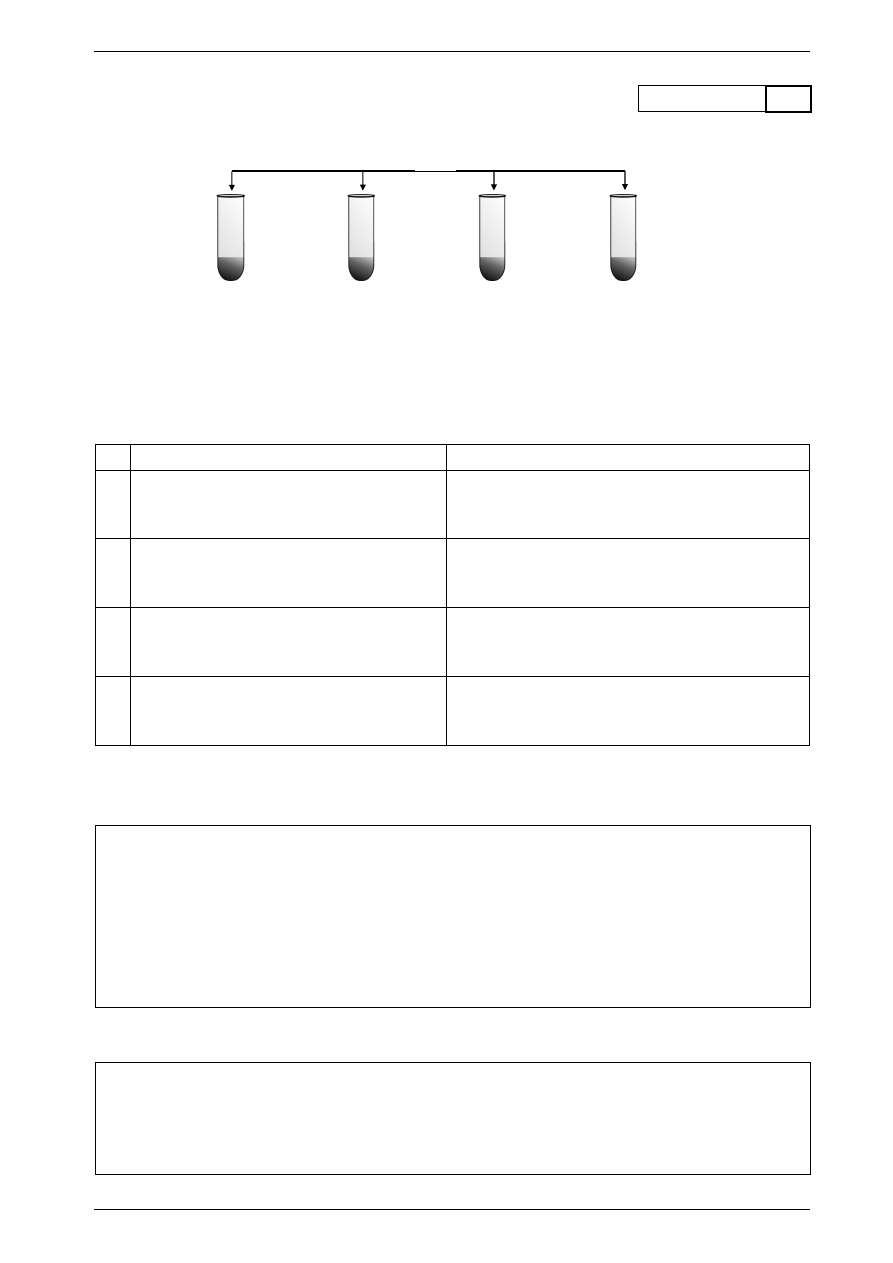
Zadanie 6.
(6 pkt)
przyznane punkty
Przeprowadzono doświadczenie zilustrowane poniższym schematem.
I.
II.
III.
IV.
W każdej probówce zaobserwowano objawy reakcji chemicznych i wydzielanie się gazu.
a) Spośród podanych stałych substancji wybierz cztery, które mogły być substratami w opisanych
reakcjach i wpisz ich nazwy odpowiednio do tabeli.
Ca(OH)
2
, K
2
S, Na
2
CO
3
, KI, KMnO
4
, Zn, SiO
2
, NaCl
Obserwacje
Substrat
I.
wydziela się żółtozielony gaz o drażniącym
zapachu
II.
wydzielający się bezbarwny gaz ma bardzo
nieprzyjemny zapach, zabarwia na czerwono
zwilżony papierek wskaźnikowy
III. wydzielający się gaz powoduje zmętnienie
wody wapiennej
IV. wydzielający się gaz nie powoduje
zmętnienia wody wapiennej, jest lżejszy
od powietrza i zapala się wybuchowo
b) Zapisz jonowo równanie reakcji chemicznej zachodzącej w probówce nr I oraz przedstaw równania
bilansu elektronowo-jonowego.
c) Zapisz cząsteczkowo równanie reakcji chemicznej zachodzącej w probówce nr III.
HCl
dr inż. Zdzisław Głowacki © Oficyna Wydawnicza „Tutor” – 2014 r.
www.szkolna.pl
strona 6
Zadanie 7.
(4 pkt)
przyznane punkty
W tabeli podano wartości temperatur topnienia i temperatur wrzenia dla kilku substancji chemicznych
mierzone pod ciśnieniem 1013 hPa.
Lp. Gaz Ciecz Wzór substancji
Temp. topnienia [
C]
Temp. wrzenia [
C]
1.
CH
4
182,5
161,5
2.
CH
3
Br
93,7
3,6
3.
CH
3
OH
98,0
64,6
4.
H
2
O
0
100
5.
H
2
S
85,7
60,2
6.
glukoza (cukier)
150
410
a) Zaznacz krzyżykiem „X” odpowiednio w tabeli substancje, które w temperaturze pokojowej (20
C)
i pod ciśnieniem 1013 hPa są gazami, oraz te, które są cieczami.
b) Metan wrze w temperaturze
161,5
C, natomiast bromometan w temperaturze 3,6
C. Napisz, co jest
powodem wysokiej temperatury wrzenia bromometanu.
.....................................................................................................................................................................
c) Bardzo dużą różnicę w temperaturach wrzenia można odnotować, porównując temperatury wrzenia
wody i siarkowodoru. Napisz, co odpowiada w tym przypadku za tak znaczną różnicę.
.....................................................................................................................................................................
Zadanie 8.
(2 pkt)
przyznane punkty
W jakim stosunku masowym należy zmieszać z sobą azotan(V) potasu i azotan(V) amonu w celu
otrzymania mieszanki nawozowej o 20% zawartości azotu? Przedstaw obliczenia i podaj odpowiedź
w formacie 1 : X, gdzie X jest liczbą obliczoną z dokładnością do części setnych.
Odpowiedź: ...................................................................................................................................................
dr inż. Zdzisław Głowacki © Oficyna Wydawnicza „Tutor” – 2014 r.
www.tutor.edu.pl
strona 7
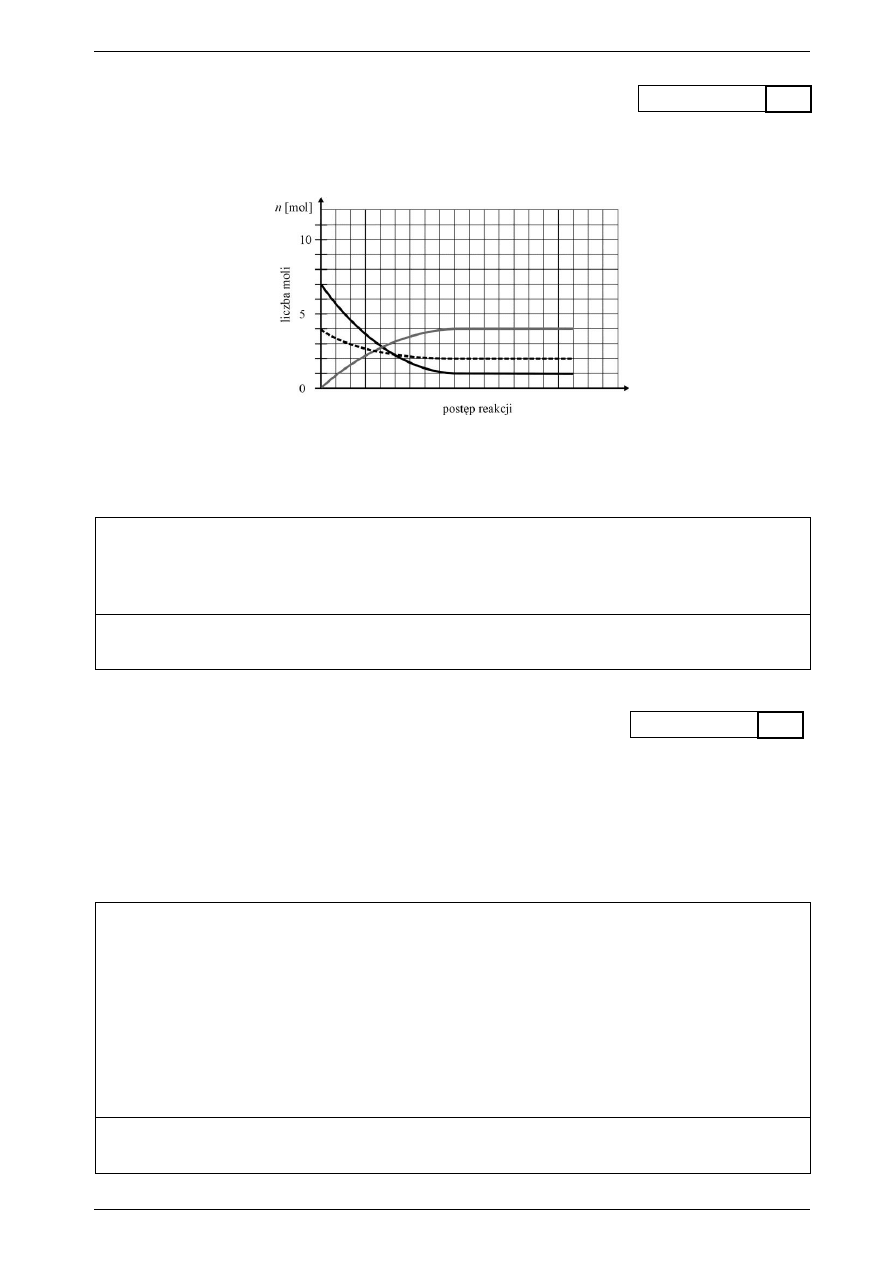
Zadanie 9.
(2 pkt)
przyznane punkty
W reaktorze ciśnieniowym o objętości 1 dm
3
przeprowadzono reakcję syntezy amoniaku. Do reakcji użyto
7 moli wodoru i 4 mole azotu. Przebieg reakcji przedstawiono na wykresie.
a) Opisz odpowiednio na wykresie, które krzywe odpowiadają substratom w tej reakcji.
b) Oblicz stałą równowagi tej reakcji.
Obliczenia:
Odpowiedź: ...................................................................................................................................................
Zadanie 10.
(3 pkt)
przyznane punkty
Przeprowadzono reakcję estryfikacji pewnego kwasu monokarboksylowego alkoholem metylowym. Po
pewnym czasie stwierdzono, że w stanie równowagi w mieszaninie są następujące liczby moli reagentów:
[kwasu] = 0,9 [alkoholu] = 0,4 [estru] = 0,6 [wody] = 0,6
O ile się zmieniła liczba moli estru w stanie równowagi, jeżeli przeprowadzając ponownie tę reakcję,
wprowadzono do układu o 0,5 mola więcej alkoholu?
Obliczenia:
Odpowiedź: ...................................................................................................................................................
dr inż. Zdzisław Głowacki © Oficyna Wydawnicza „Tutor” – 2014 r.
www.szkolna.pl
strona 8
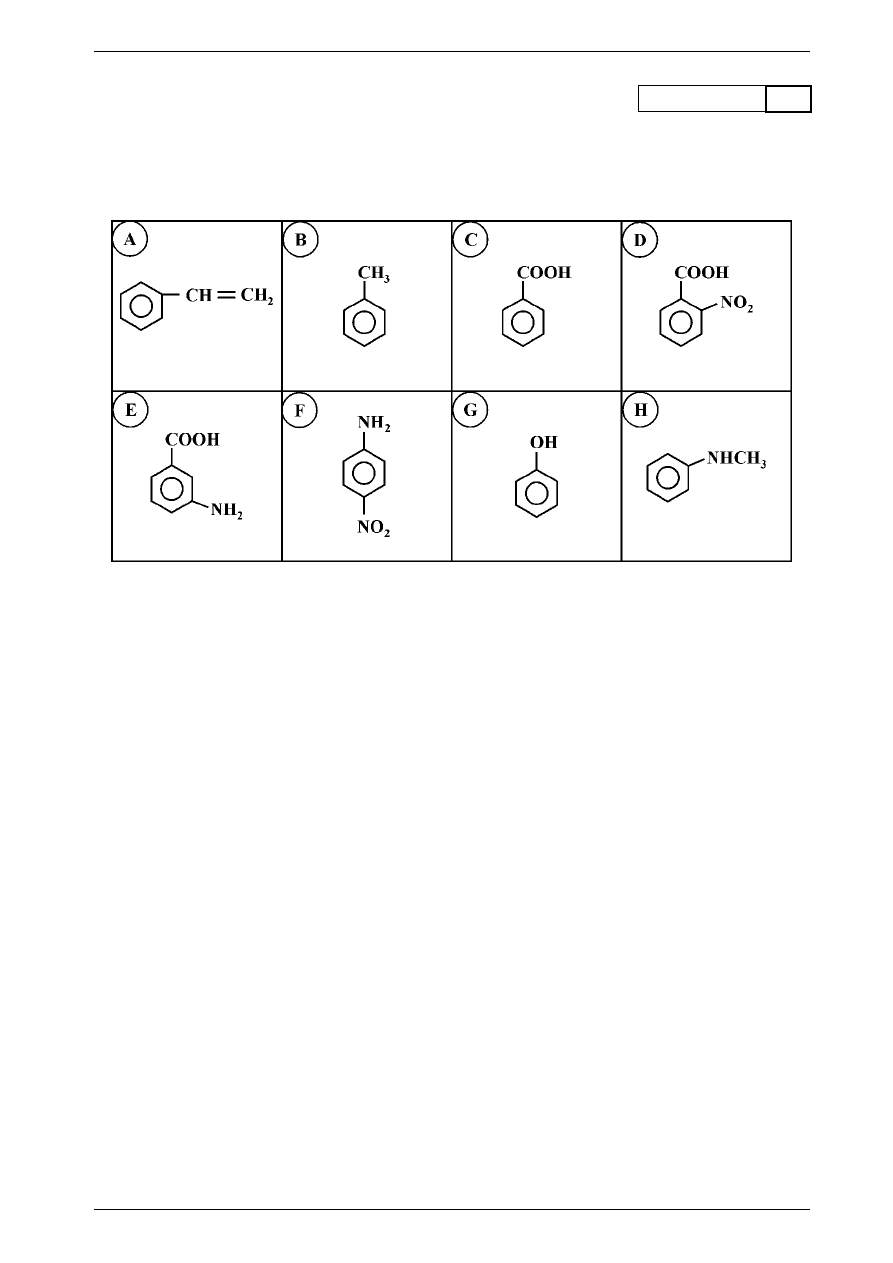
Zadanie 11.
(7 pkt)
przyznane punkty
W tabeli przedstawiono wzory ośmiu związków aromatycznych oznaczonych literami alfabetu od A do H.
Odpowiedz na pytania oraz wykonaj polecenia dotyczące tych związków chemicznych, znajdujące się pod
tym zestawieniem.
a) Podaj nazwy dwóch związków z tego zestawienia posiadających najsilniejsze właściwości kwasowe.
Są to: ...........................................................................................................................................................
b) Podaj oznaczenia literowe dwóch związków z tego zestawienia posiadających najsilniejsze właściwości
zasadowe.
Są to: ...........................................................................................................................................................
c) Który z tych związków wytworzy barwne związki kompleksowe w reakcji z Fe l
3
?
Podaj oznaczenie literowe i nazwę tego związku. ....................................................................................
d) Przeprowadzono reakcję jednego z tych związków z roztworem bromu w l
4
. W wyniku tej reakcji
roztwór bromu uległ odbarwieniu.
Był to związek oznaczony literą .................................................................................................................
dr inż. Zdzisław Głowacki © Oficyna Wydawnicza „Tutor” – 2014 r.
www.tutor.edu.pl
strona 9
e) Oblicz pH roztworu wodnego związku oznaczonego literą G o stężeniu 0,01 mol/dm
3
, jeżeli stała
dysocjacji (K
a
) tego związku wynosi 10
10
.
Obliczenia:
Odpowiedź: ...................................................................................................................................................
f) W myśl teorii Brönsteda
Lowry’ego każdy kwas posiada sprzężoną z nim zasadę i odwrotnie każda
zasada posiada sprzężony z nią kwas. Uzupełnij, rysując odpowiednie wzory strukturalne, sprzężone
pary kwas
zasada.
SPRZĘŻONA PARA
SPRZĘŻONA PARA
kwas
zasada
kwas
zasada
BRUDNOPIS (Zapisy w brudnopisie nie podlegają ocenie!)
dr inż. Zdzisław Głowacki © Oficyna Wydawnicza „Tutor” – 2014 r.
www.szkolna.pl
strona 10
Informacja do zadań 12., 13. i 14.
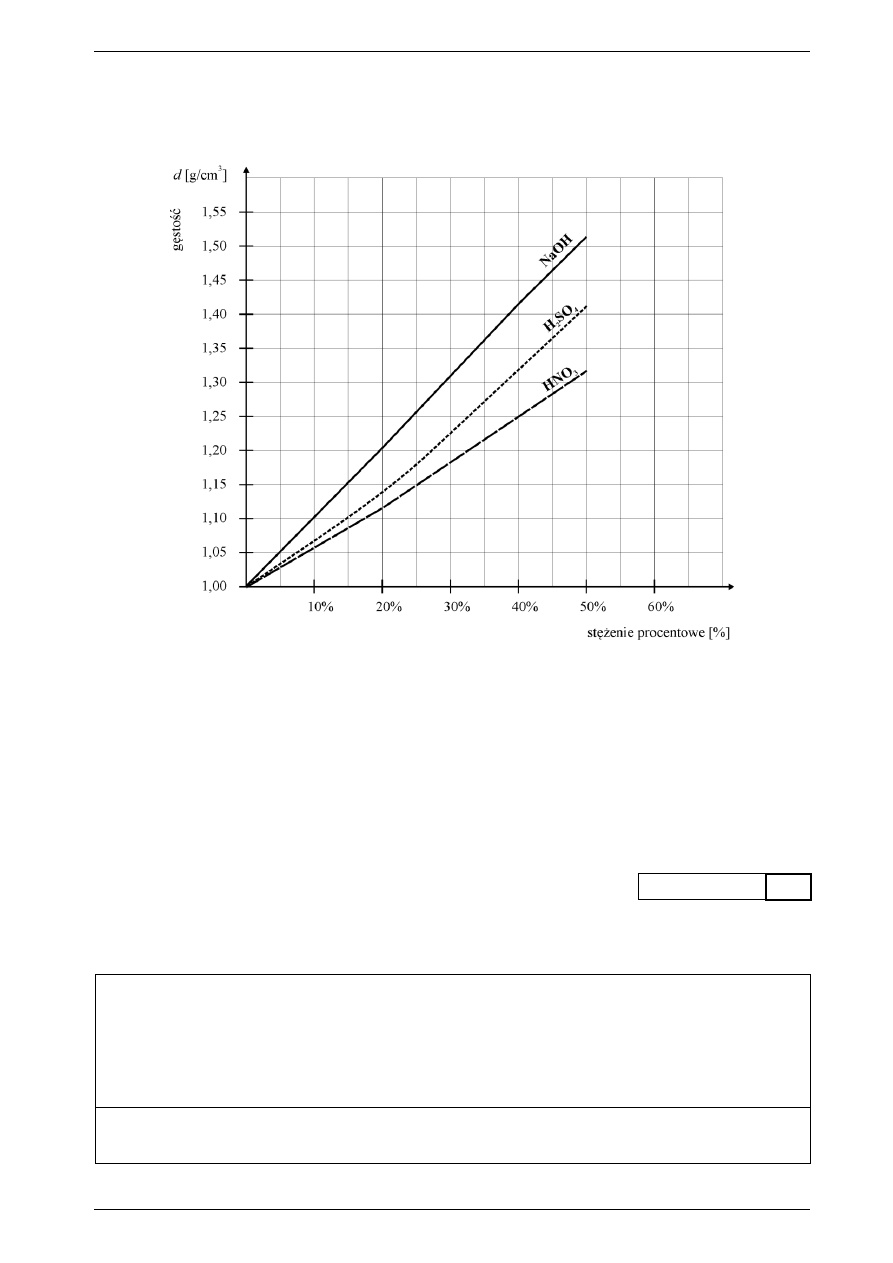
Wykres zmian gęstości roztworów w zależności od ich stężenia procentowego.
Na zajęciach kółka chemicznego uczniowie wykonali niżej opisane czynności. Korzystając z „Wykresu
zmian gęstości roztworów”, wykonaj obliczenia do zadań 12., 13. i 14. oraz odpowiedz na postawione
pytania.
Na obu szalkach wagi postawiono po jednej zlewce o pojemności 100 cm
3
. Do piewszej zlewki wlano
20 cm
3
20% roztworu NaOH. Zrównoważenie wagi nastąpiło, kiedy do drugiej zlewki dodano 19,2 cm
3
roztworu kwasu azotowego(V). Następnie przygotowano roztwór końcowy poprzez zmieszanie w kolbie
o pojemności 200 cm
3
obu roztworów zdjętych z szalek wagi.
Zadanie 12.
(1 pkt)
przyznane punkty
Wyznacz stężenie procentowe dodanego roztworu kwasu azotowego(V), który posłużył do zrówno-
ważenia wagi.
Obliczenia:
Odpowiedź: ...................................................................................................................................................
dr inż. Zdzisław Głowacki © Oficyna Wydawnicza „Tutor” – 2014 r.
www.tutor.edu.pl
strona 11
Zadanie 13.
(1 pkt)
przyznane punkty
Jaki był odczyn roztworu końcowego? Odpowiedź uzasadnij obliczeniami.
Obliczenia:
Odpowiedź: ...................................................................................................................................................
Zadanie 14.
(2 pkt)
przyznane punkty
Oblicz, jakie było stężenie molowe jonów azotanowych(V) w końcowym roztworze.
Wynik podaj z dokładnością do 0,1 mol/dm
3
.
Obliczenia:
Odpowiedź: ...................................................................................................................................................
BRUDNOPIS (Zapisy w brudnopisie nie podlegają ocenie!)
dr inż. Zdzisław Głowacki © Oficyna Wydawnicza „Tutor” – 2014 r.
www.szkolna.pl
strona 12
Informacje do zadań 15. i 16. zawiera tabela.
Półogniwo
Reakcja elektrodowa
E
[V]
1.
SO
4
2
, SO
3
2
SO
4
2
+ H
2
O + 2e
SO
3
2
+ 2 OH
0,94
2.
Cr
2
O
7
2
, Cr
3+
Cr
2
O
7
2
+ 14 H
+
+ 6e
2 Cr
3+
+ 7 H
2
O
+ 1,36
3.
MnO
4
, Mn
2+
MnO
4
+ 8 H
+
+ 5e
Mn
2+
+ 4 H
2
O
+ 1,51
Zadanie 15.
(2 pkt)
przyznane punkty
Zaprojektuj ogniwo zbudowane z dwóch półogniw wybranych z tabeli, którego wartość siły elektro-
motorycznej (SEM) będzie najwyższa. Zapisz, zgodnie z konwencją sztokholmską, schemat tego ogniwa
i podaj wartość SEM.
Schemat ogniwa
Wartość SEM tego ogniwa wynosi: ..............................................................................................................
Zadanie 16.
(1 pkt)
przyznane punkty
Zapisz sumaryczne równanie reakcji chemicznej zachodzącej podczas pracy tego ogniwa.
...........................................................................................................................................................................
...........................................................................................................................................................................
BRUDNOPIS (Zapisy w brudnopisie nie podlegają ocenie!)

dr inż. Zdzisław Głowacki © Oficyna Wydawnicza „Tutor” – 2014 r.
www.tutor.edu.pl
strona 13
Zadanie 17.
(3 pkt)
przyznane punkty
W trakcie elektrolizy 300 cm
3
wodnego roztworu Na
2
SO
4
o gęstości 1,2 g/cm
3
zawierającego 0,5 mola tej
soli, na elektrodach platynowych wydzieliło się 6 ,2 dm
3
mieszaniny gazów (w przeliczeniu na warunki
normalne). Oblicz, jakie jest stężenie procentowe Na
2
SO
4
w roztworze po zakończeniu elektrolizy. Wynik
podaj z dokładnością do dziesiątych części procentu.
Obliczenia:
Odpowiedź: ...................................................................................................................................................
Zadanie 18.
(2 pkt)
przyznane punkty
Standardowe entalpie spalania siarki w tlenie i w ozonie wynoszą odpowiednio:
297 kJ/mol i
392 kJ/mol.
W obu przypadkach produktem spalania jest tlenek siarki(IV).
a) Podaj, ile wynoszą entalpie tworzenia tlenu cząsteczkowego i ozonu.
b) Oblicz, ile energii cieplnej wydzieli się w trakcie spalania 1 kg siarki w powietrzu w warunkach
standardowych. Wynik podaj z dokładnością do 1 kJ.
Obliczenia:
Odpowiedzi:
a) ...................................................................................................................................................................
b) ...................................................................................................................................................................

dr inż. Zdzisław Głowacki © Oficyna Wydawnicza „Tutor” – 2014 r.
www.szkolna.pl
strona 14
Zadanie 19.
(6 pkt)
przyznane punkty
W czterech pojemnikach znajdują się:
2-metylopropan-2-ol
,
butanal
,
butano-2,3-diol
i
butanon
.
Opisz tok postępowania (możesz go zilustrować schematem, rysunkiem) oraz zaproponuj charakterys-
tyczne reakcje chemiczne, które pozwolą i dokonać identyfikacji tych związków.
Zapisz pełne równanie jednej z wybranych reakcji chemicznych, które zamierzasz przeprowadzić.
Tok postępowania i charakterystyczne reakcje chemiczne
Równanie wybranej reakcji chemicznej:
.......................................................................................................................................................................
.......................................................................................................................................................................
Zadanie 20.
(2 pkt)
przyznane punkty
Narysuj wzór półstrukturalny i podaj wzór sumaryczny oraz rzędowość alkoholu o nazwie:
cis-5-etylo-4-metylohept-3-en-2-ol.
Przeprowadzono addycję bromowodoru do tego alkoholu. Podaj nazwę głównego produktu tej reakcji.
Wzór półstrukturalny:
Wzór sumaryczny i rzędowość: .....................................................................................................................
Nazwa produktu: ...........................................................................................................................................
dr inż. Zdzisław Głowacki © Oficyna Wydawnicza „Tutor” – 2014 r.
www.tutor.edu.pl
strona 15
Zadanie 21.
(2 pkt)
przyznane punkty
Przeprowadzono reakcję polikondensacji wykorzystując jako substraty kwas 3-chloropentanodiowy oraz
propano-1,2-diol. Narysuj, za pomocą wzorów półstrukturalnych, fragment otrzymanego polimeru
zbudowany z jednej cząsteczki kwasu oraz dwóch cząsteczek alkoholu. Na rysunku zaznacz i nazwij
wiązania chemiczne łączące substraty w tym łańcuchu.
Zadanie 22.
(2 pkt)
przyznane punkty
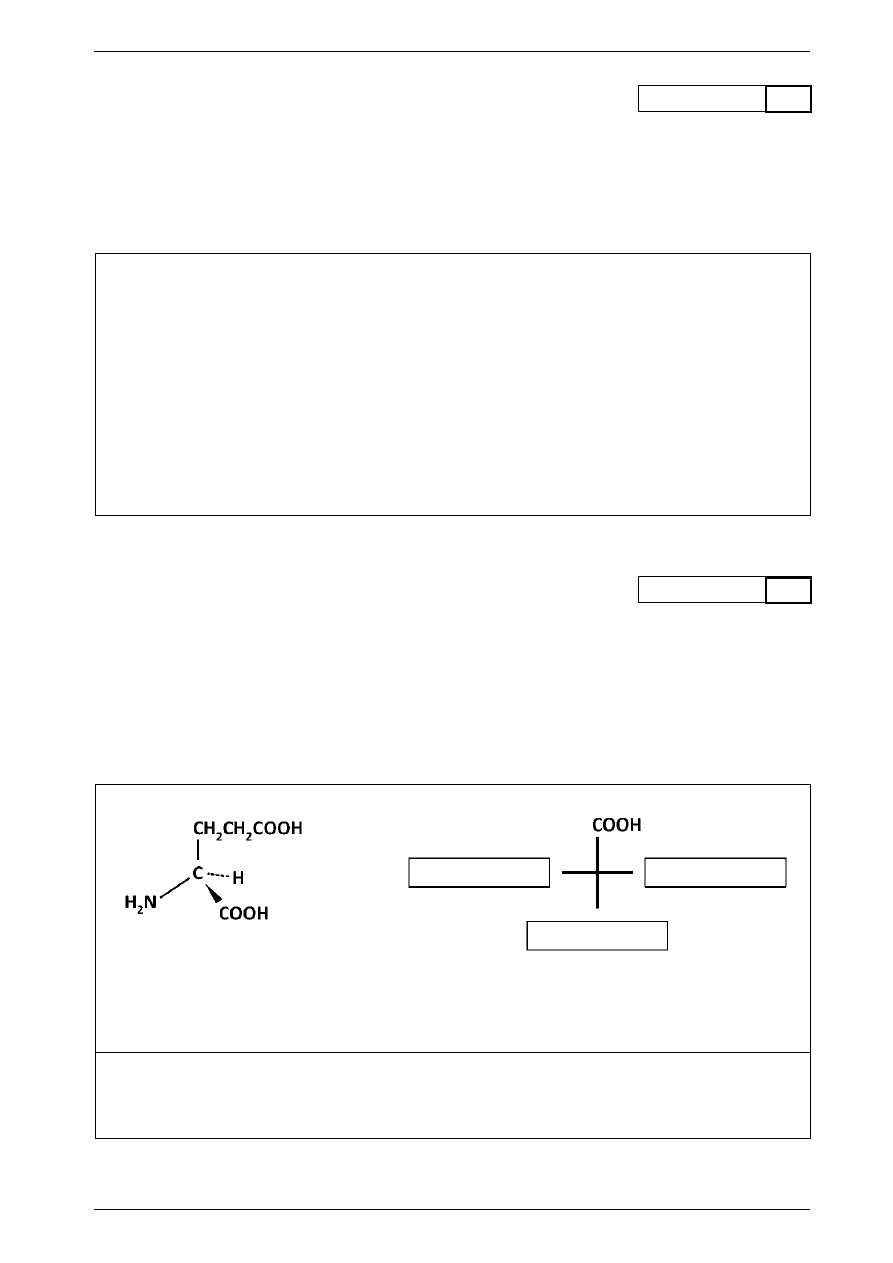
Wzór poniżej przedstawia przestrzenne rozmieszczenie grup i atomów przy asymetrycznym atomie węgla
w cząsteczce kwasu glutaminowego.
a) Podaj nazwę systematyczną kwasu glutaminowego.
b) Uzupełnij wzór rzutowy Fischera cząsteczki tego kwasu i określ, do którego szeregu konfiguracyjnego
(D czy L) należy ten aminokwas.
szereg konfiguracyjny
………..
Nazwa systematyczna: ..................................................................................................................................
dr inż. Zdzisław Głowacki © Oficyna Wydawnicza „Tutor” – 2014 r.
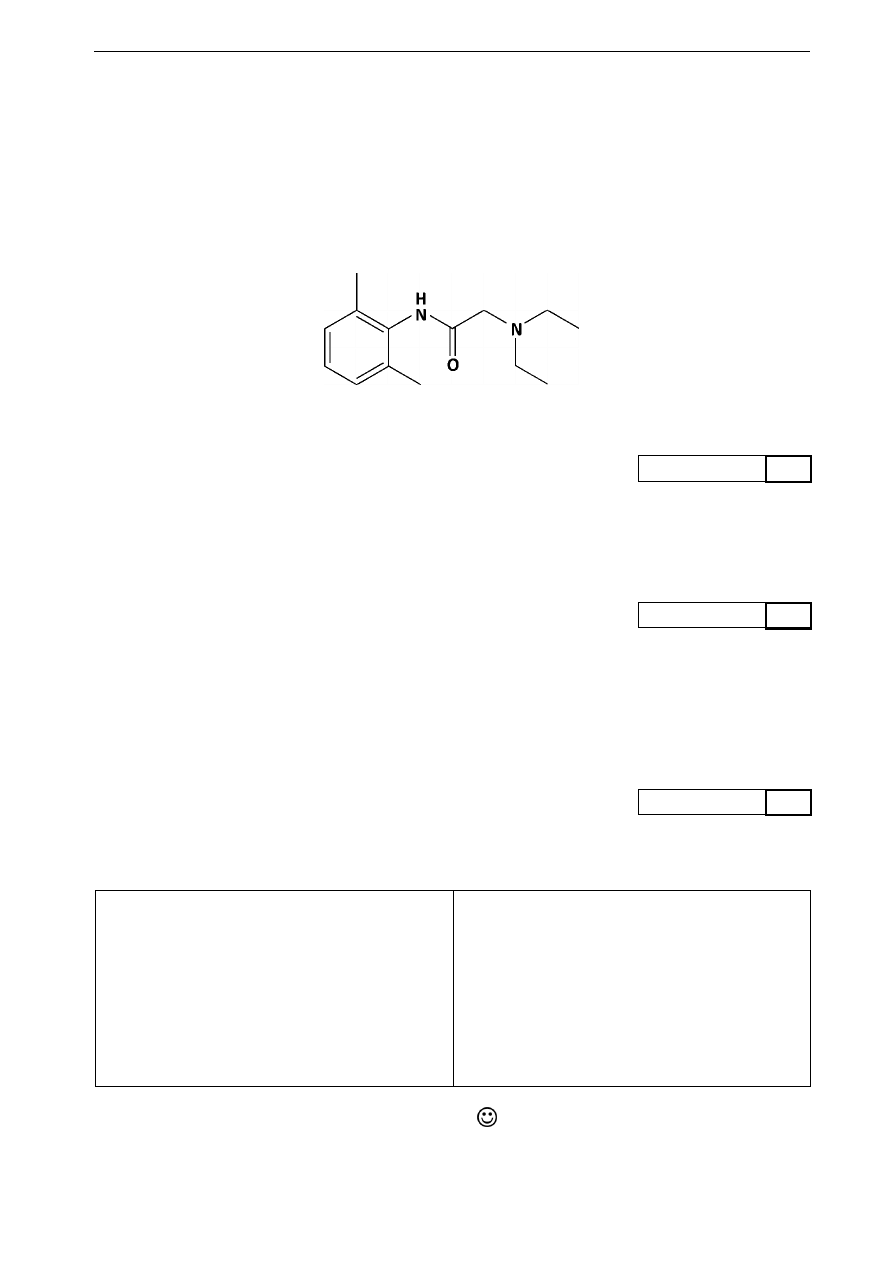
Informacja do zadań 23., 24. i 25.
Lidokaina – jest związkiem organicznym o masie molowej 234,38 g. Jej uproszczony wzór strukturalny
oraz nazwa systematyczna są podane niżej. Lidokaina jest stosowana jako środek miejscowo znieczulający.
Przeważnie podawana jest przezskórnie w formie aerozolu lub żelu. W stomatologii najczęściej używana
w postaci dwuprocentowego roztworu chlorowodorku lidokainy w ampułkach. Efekt zastosowania
lidokainy w aerozolu jest odczuwalny po upływie minuty i trwa przez 5–6 min. Metabolizowana jest
w wątrobie i wydalana w 90% w formie nieaktywnych metabolitów.
2-(dietylamino)-N-(2,6-dimetylofenylo)acetamid
Zadanie 23.
(1 pkt)
przyznane punkty
Podaj wzór sumaryczny lidokainy.
..........................................................................................................................................................................
Zadanie 24.
(1 pkt)
przyznane punkty
Jaki będzie odczyn wodnego roztworu lidokainy? Odpowiedź uzasadnij.
..........................................................................................................................................................................
..........................................................................................................................................................................
Zadanie 25.
(2 pkt)
przyznane punkty
Przeprowadzono enzymatyczną hydrolizę wiązania peptydowego w lidokainie. Zapisz wzór półstrukturalny
otrzymanego aromatycznego produktu tej hydrolizy oraz podaj jego systematyczną nazwę.
wzór półstrukturalny
Nazwa systematyczna:
................................................................................
................................................................................
................................................................................
................................................................................
To już koniec zmagań . Dziękujemy.
dr inż. Zdzisław Głowacki – Oficyna Wydawnicza „Tutor”
e-mail: tutor@tutor.torun.pl
Wyszukiwarka
Podobne podstrony:
więcej podobnych podstron