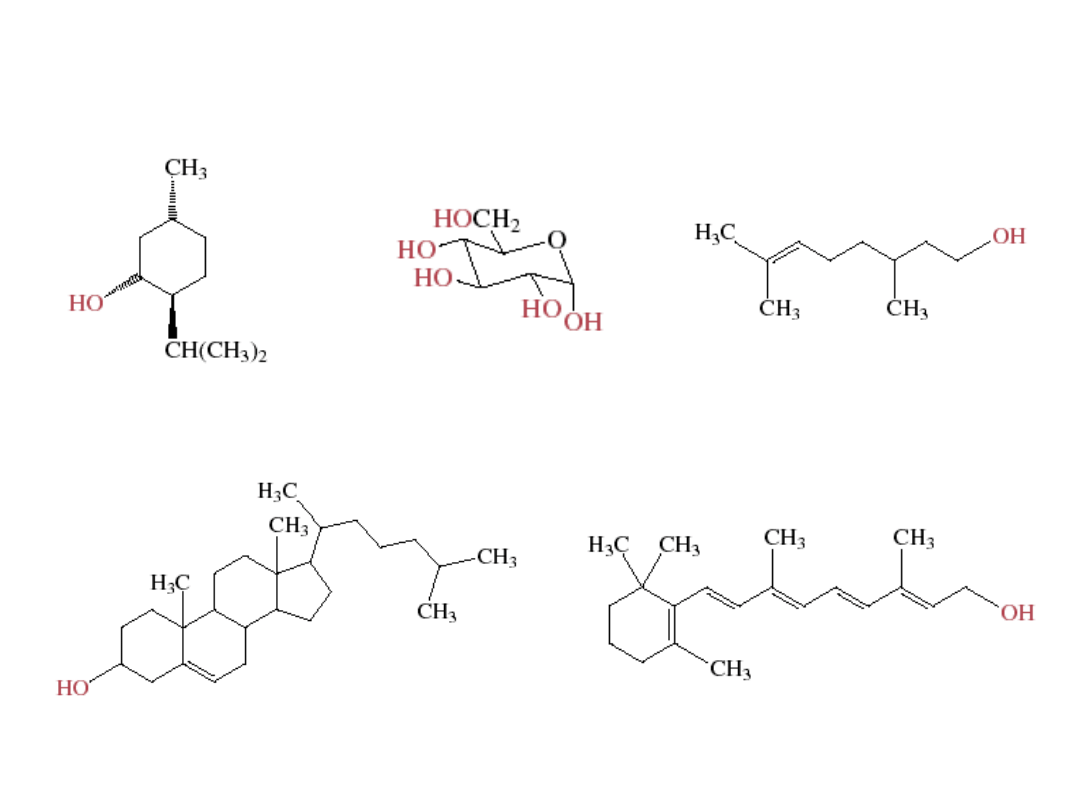
Alkohole
R
OH
mentol
glukoza
citronellol
cholesterol
retinol (witamina A)
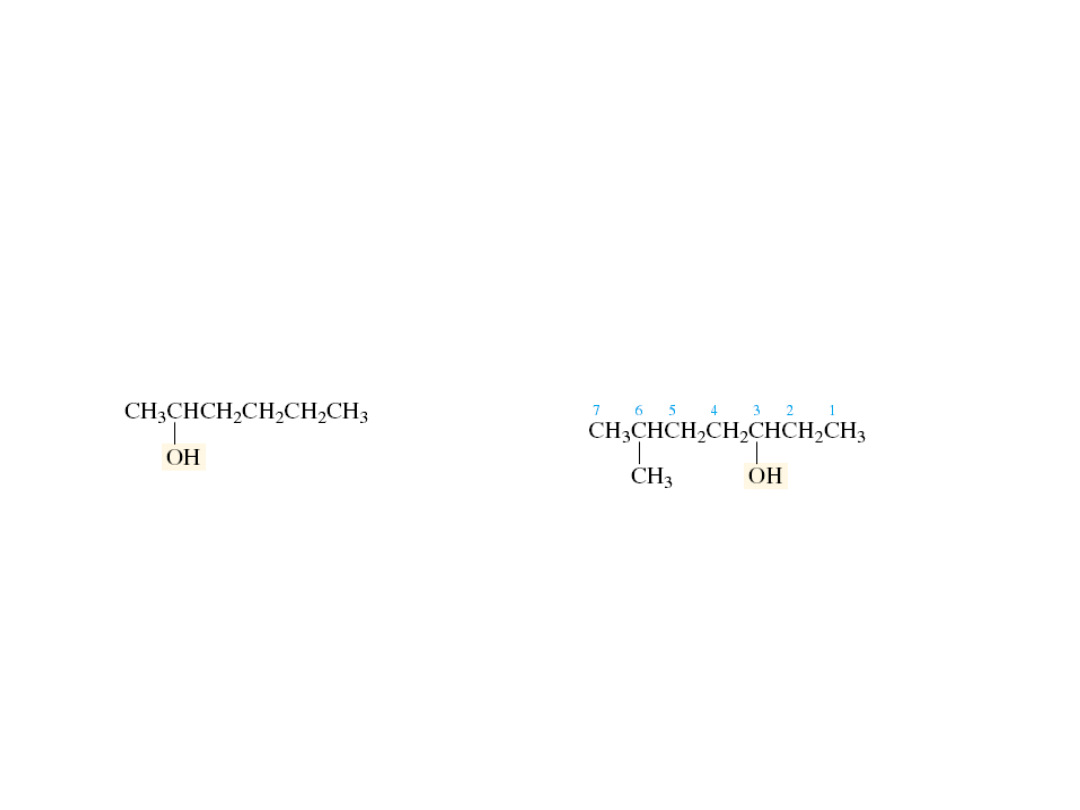
Nomenklatura
• System nazw potocznych: oparty jest na nazwach rodników, połączonych z grupą
OH
;
np. alkohol etylowy, izopropylowy, t-butylowy itd..
• System IUPAC: nazwy tworzy się poprzez dodanie końcówki –
ol
do nazwy
macierzystego węglowodoru, za który uważa się węglowodór o najdłuższym prostym
łańcuchu węglowym, obejmującym również atom węgla połączony z grupą
OH
.
Numerację wybiera się tak, aby atom węgla z grupą
OH
posiadał możliwie najmniejszy
numer.
alkohol 1-metylopentylowy
2-heksanol
6-metylo-3-heptanol
• Numerujemy podstawniki zgodnie z ich położeniem w łańcuchu i zapisujemy nazwę,
wypisując podstawniki w porządku alfabetycznym.
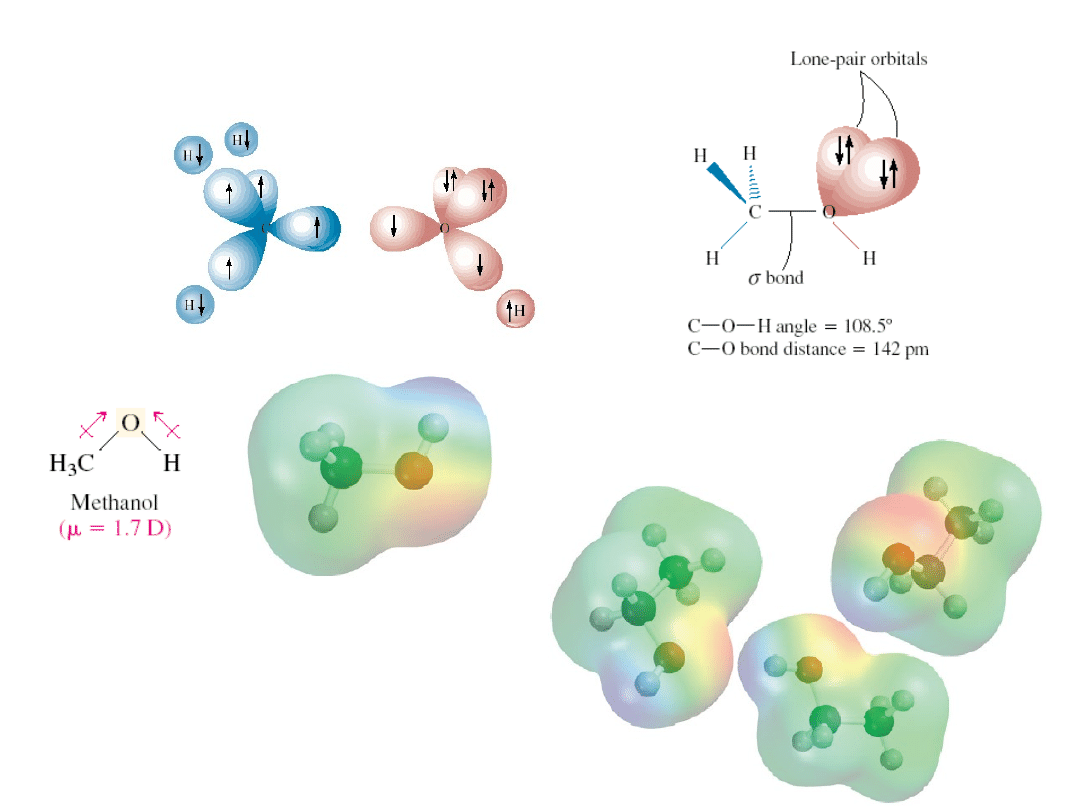
Budowa i właściwości fizyczne
wiązanie wodorowe
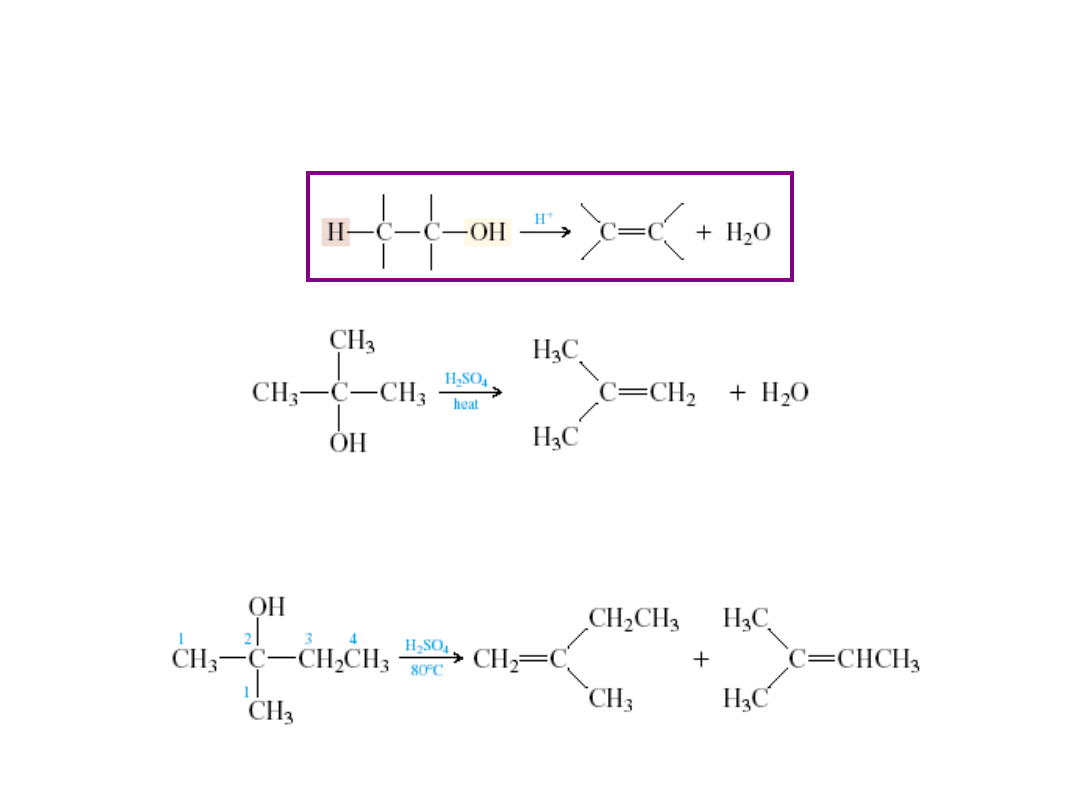
Reakcje alkoholi
Reakcje dehydratacji alkoholi do alkenów
2-metylo-2-propanol
2-metylo-2-propen (82%)
2-metylo-2-butanol
2-metylo-1-buten
(10%)
2-metylo-2-buten
(90%)
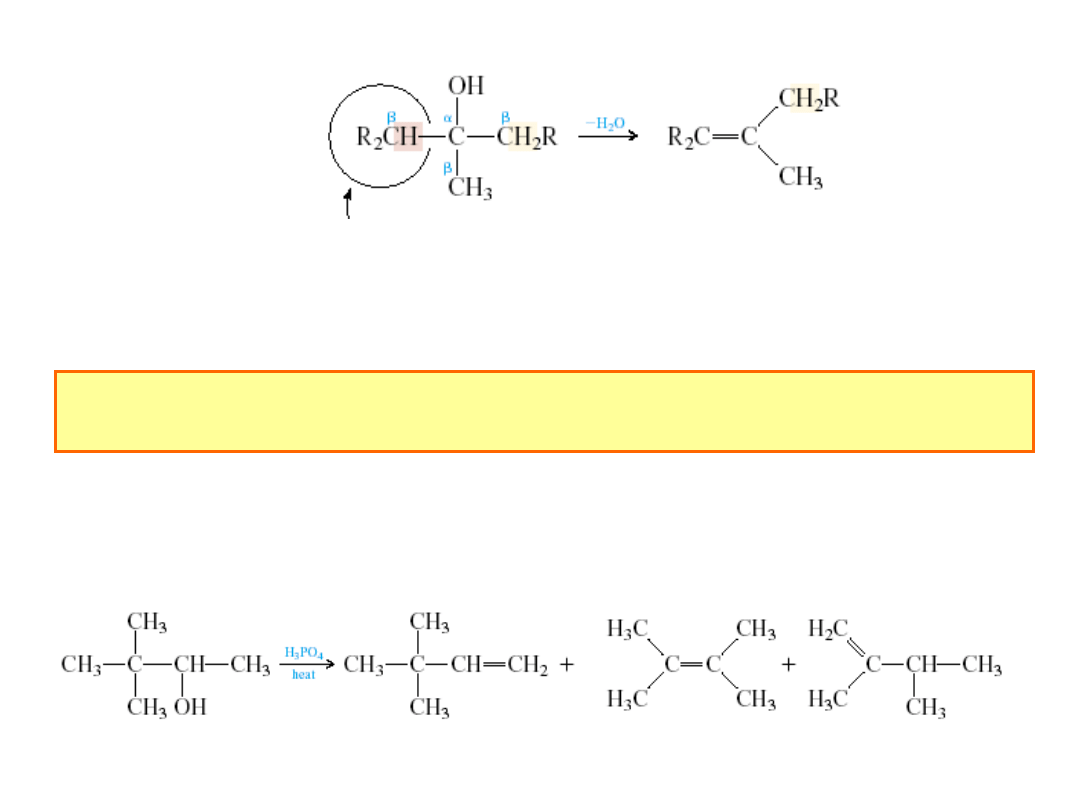
Reguła Zajcewa
Reguła Zajcewa
:
W eliminacji H
2
O z alkoholi głównym produktem reakcji
jest alken bardziej rozgałęziony
Eliminacja
β
następuje
przy tym atomie węgla
który posiada najmniej
atomów wodoru
Reakcja przegrupowania
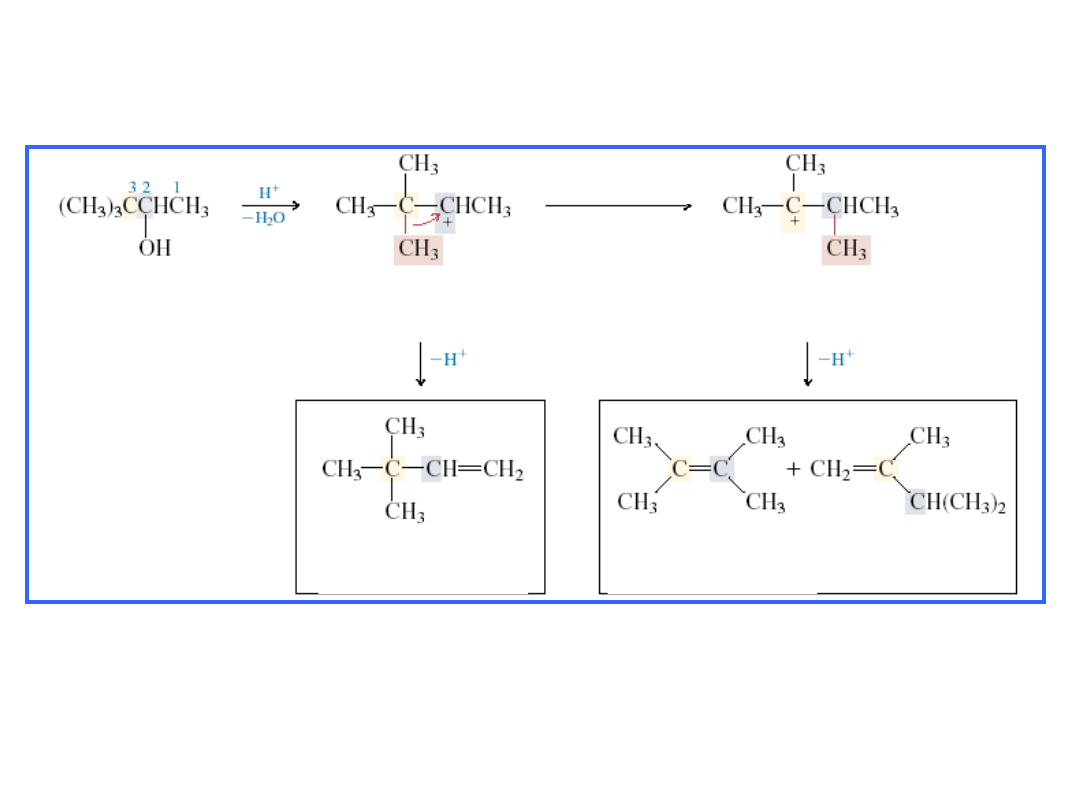
3,3-dimetylo-2-butanol
kation 1,2,2-trimetylopropylowy
(II-rz. karbokation)
kation 1,1,2-trimetylopropylowy
(III-rz. karbokation)
przesunięcie grupy
metylowej z C-3 do C-2
3,3-dimetylo-1-buten
(3%)
2,3-dimetylo-2-buten
(64%)
2,3-dimetylo-1-buten
(33%)
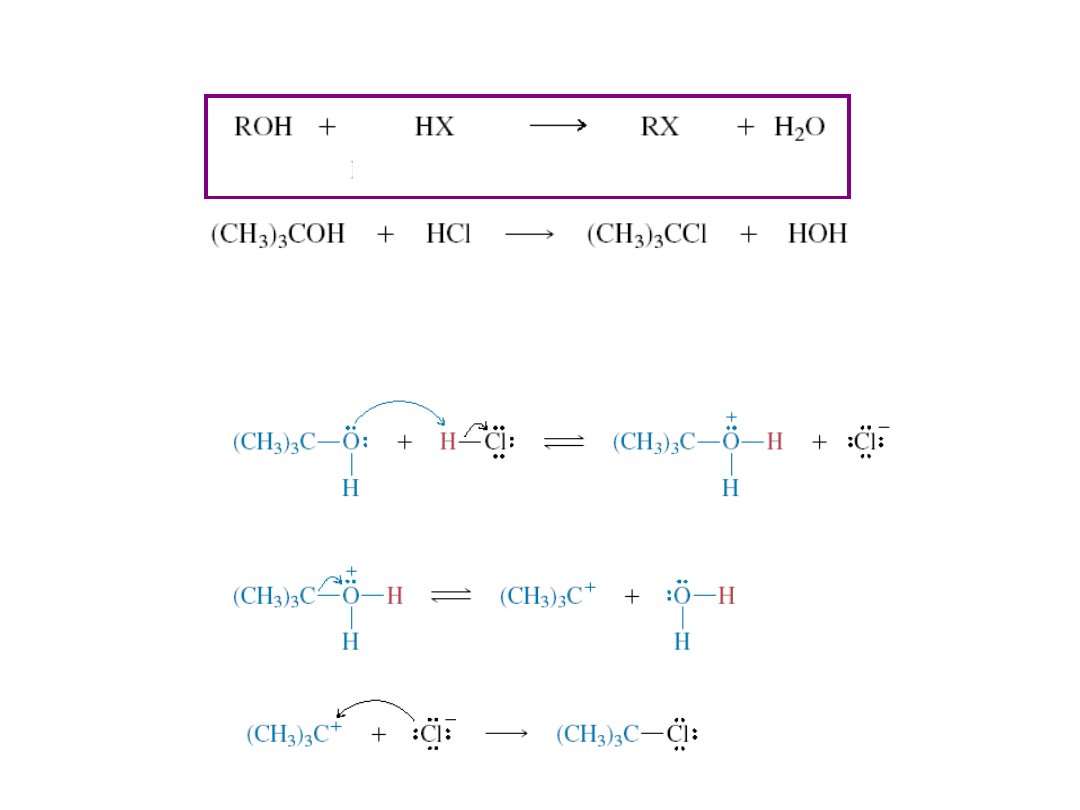
Reakcja alkoholi z chlorowodorkami
• S
N
1
Mechanizm
alkohol
halogenowodór
halogenek alkilu
woda
alkohol
t-butylowy
chlorowodór
chlorek
t-butylu
woda
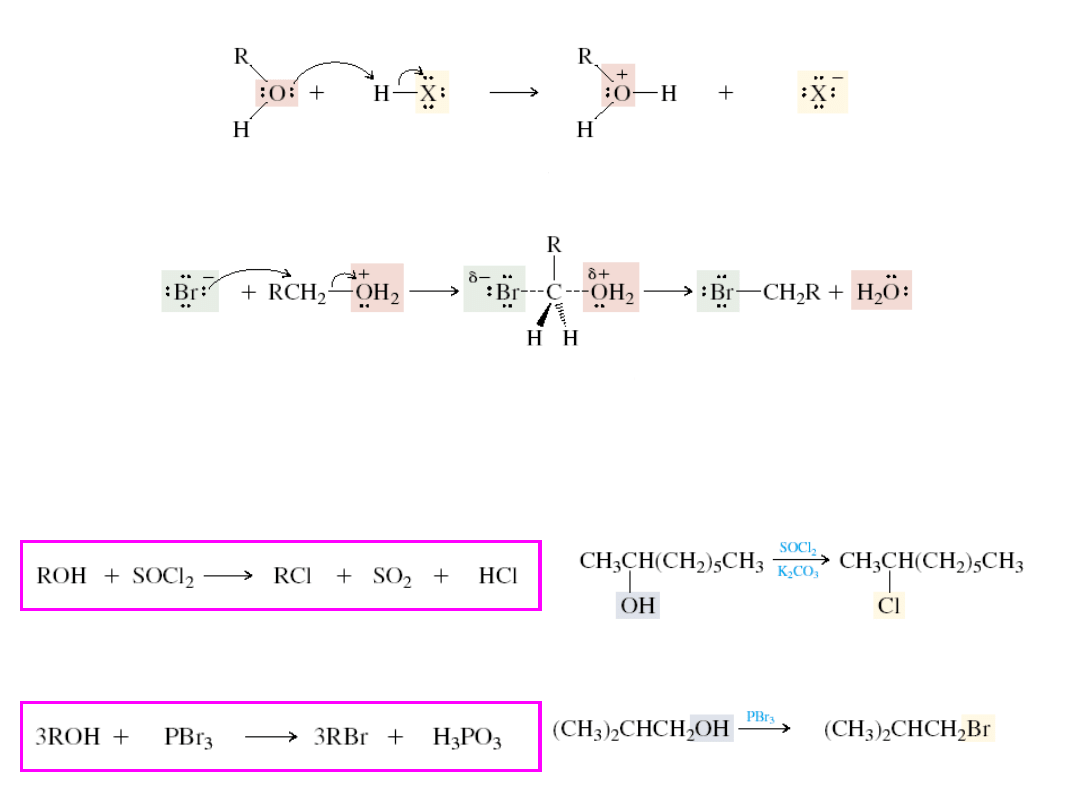
• S
N
2
Inne metody przekształcania alkoholi do chlorków alkilowych
alkohol
(zasada)
halogenowodór
(kwas)
jon oksoniowy
(sprzężony kwas)
jon halogenku
(sprzężona zasada)
jon
bromkowy
I-rz. jon
oksoniowy
stan przejściowy
w reakcji S
N
2
I-rz. bromek
alkilu
woda
2-oktanol
2-chlorooktan (81%)
alkohol izobutylowy
bromek izobutylu (55-60%)
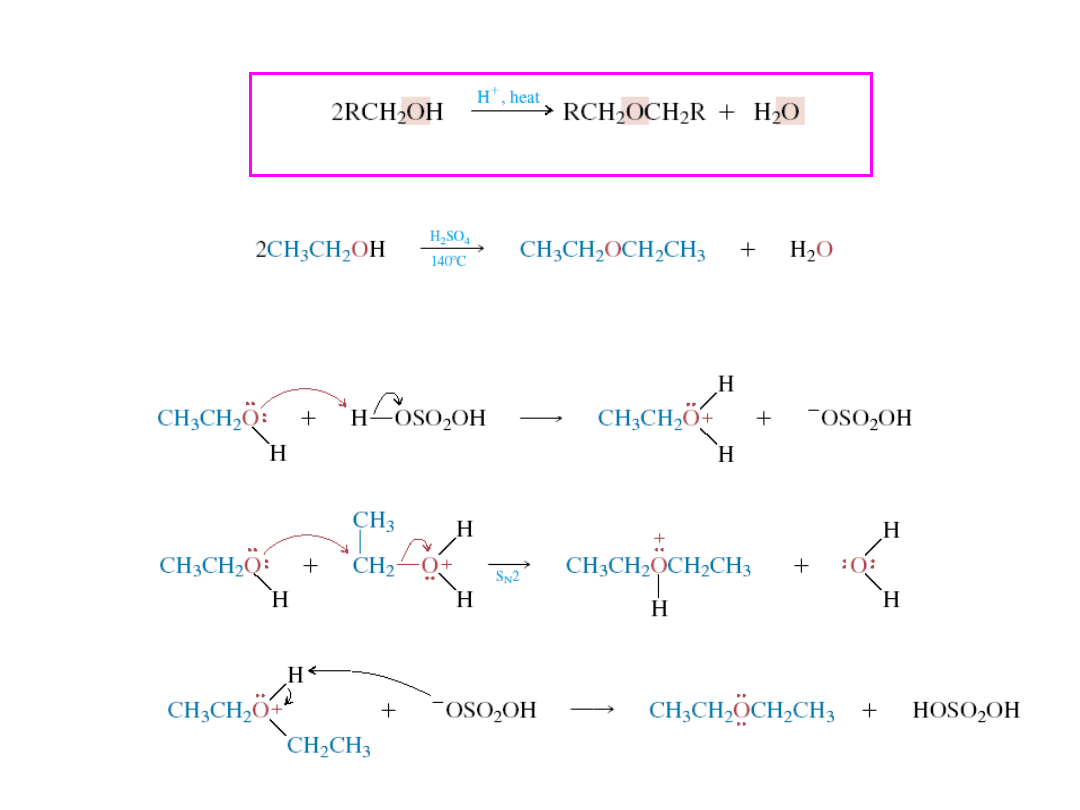
Przekształcanie alkoholi do eterów
Mechanizm
alkohol I_rzędowy
eter dialkilowy
woda
etanol
eter dietylowy
woda
szybko
wolno
szybko
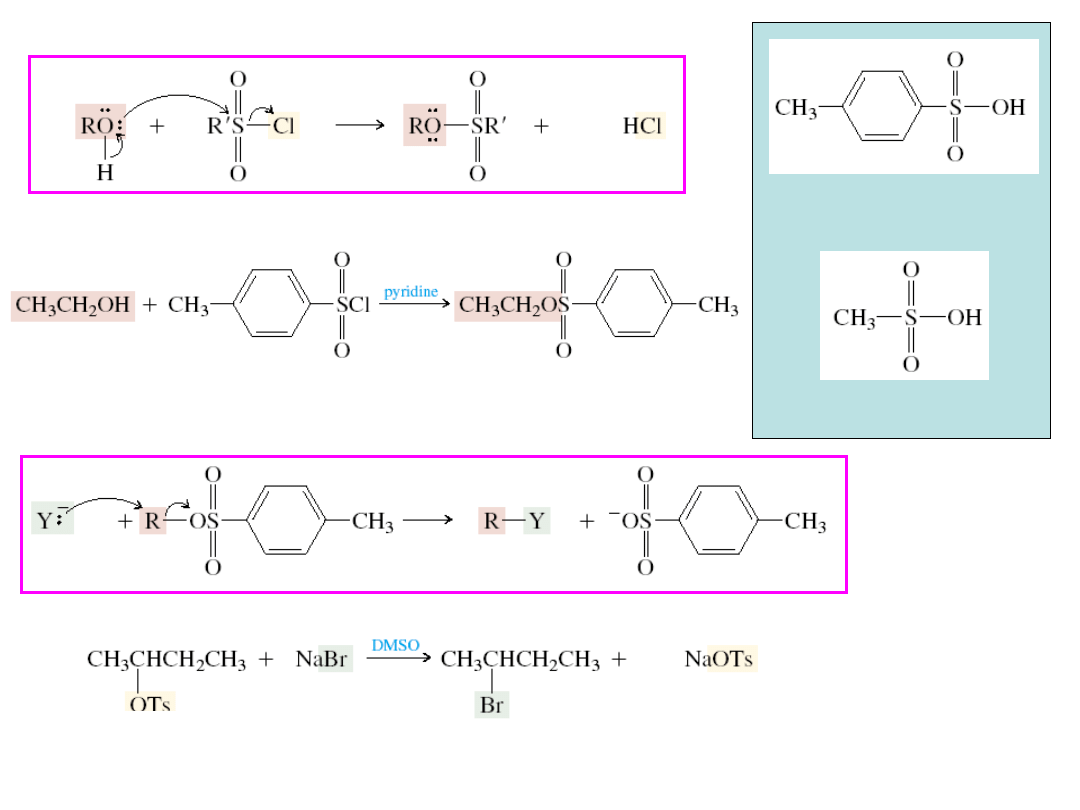
Przekształcanie alkoholi w tosylany
kwas metanosulfonowy
kwas
p-toluenosulfonowy
etanol
chlorek p-toluenosulfonowy
p-toluenosulfonian
etylu
p-toluenosulfonian
sec-butylu
bromek
sodu
bromek sec-butylu
(82%)
p-toluenosulfonian
sodu
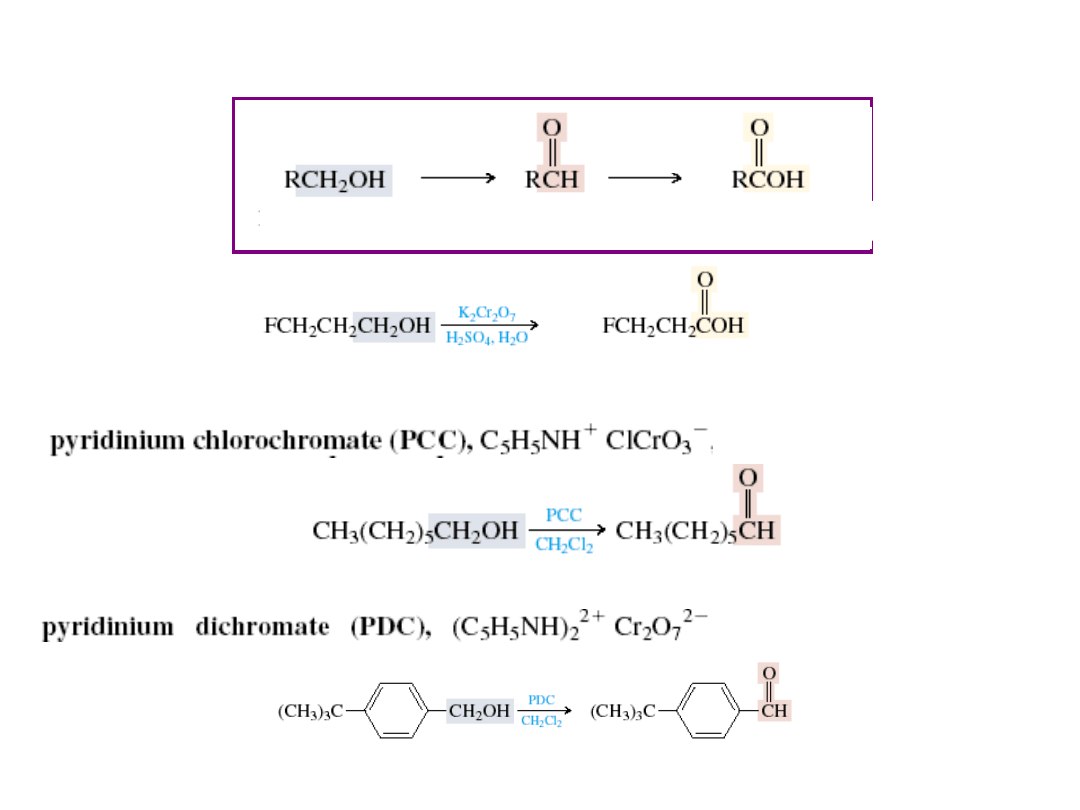
Utlenienie alkoholi
I-rz. alkohol
aldehyd
kwas karboksylowy
utlenianie
utlenianie
3-fluoro-1-propanol
kwas 3-fluoropropionowy (74%)
(chlorochromian pirydyny)
(dichromian pirydyny)
alkohol p-t-butylobenzylowy
aldehyd p-t-butylobenzylowy (94%)
alkohol 1-heptanol
heptanal (78%)
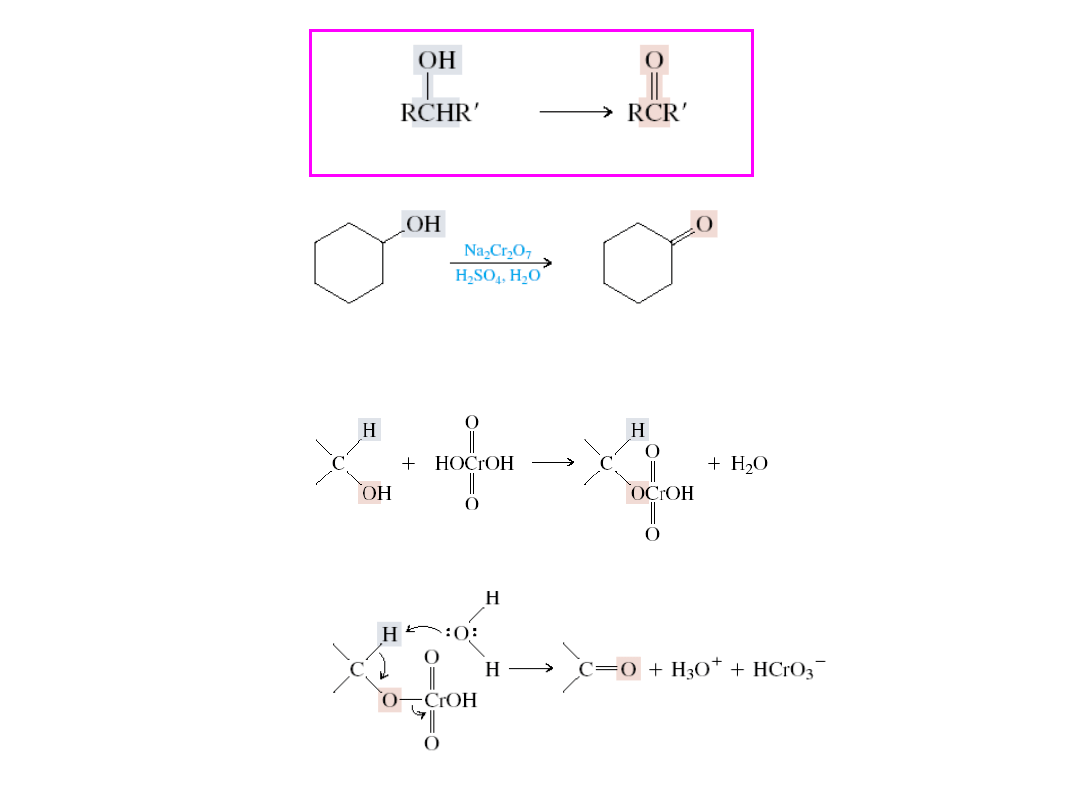
Mechanizm
II-rz. alkohol
keton
utlenianie
cykloheksanol
cykloheksanon
(85%)
alkohol
kwas chromowy
chromian
alkilu
aldehyd
lub keton
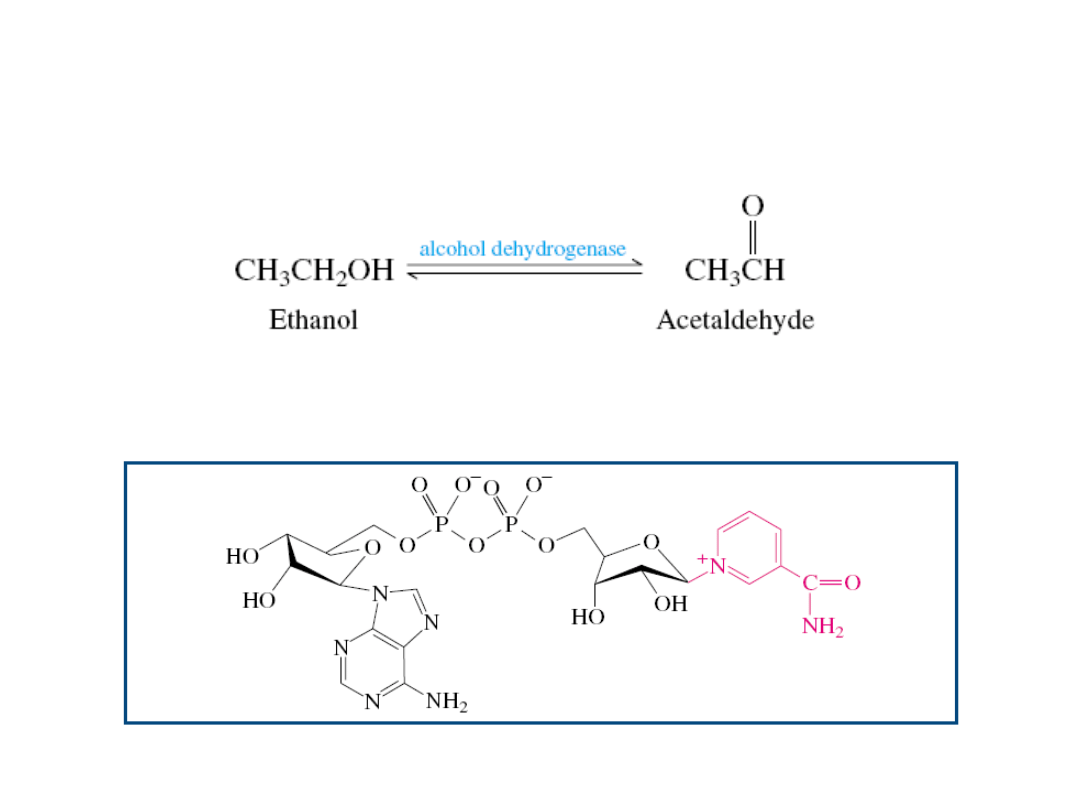
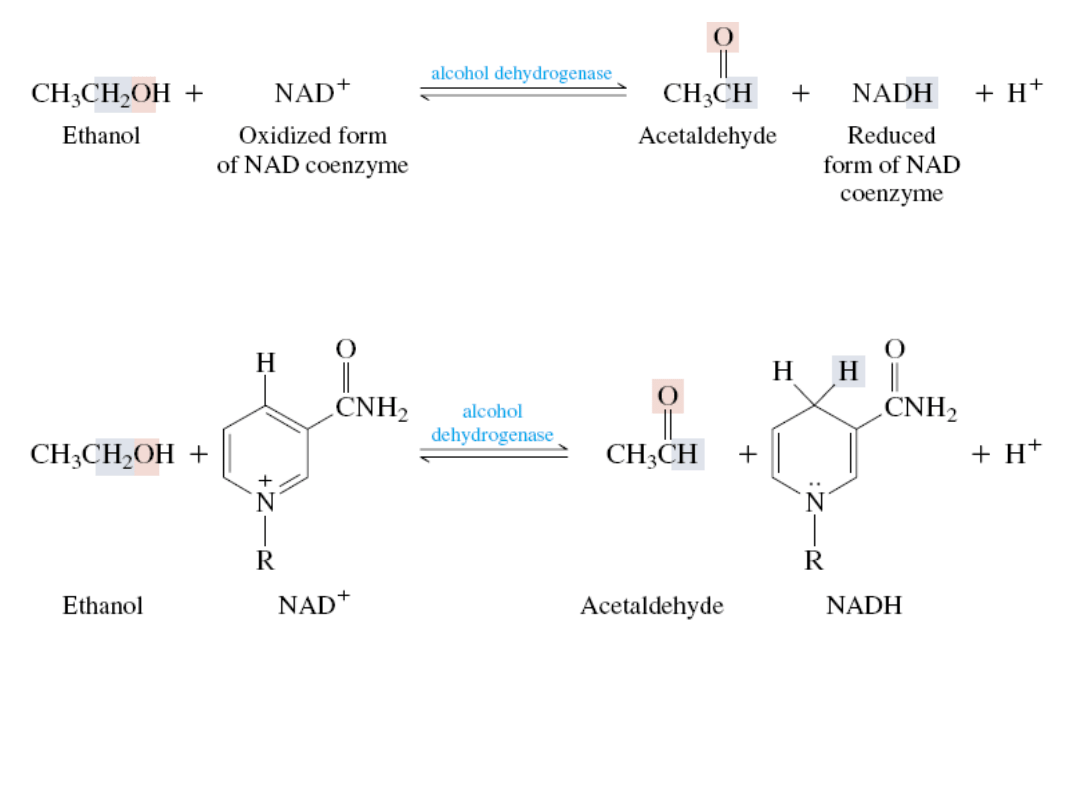
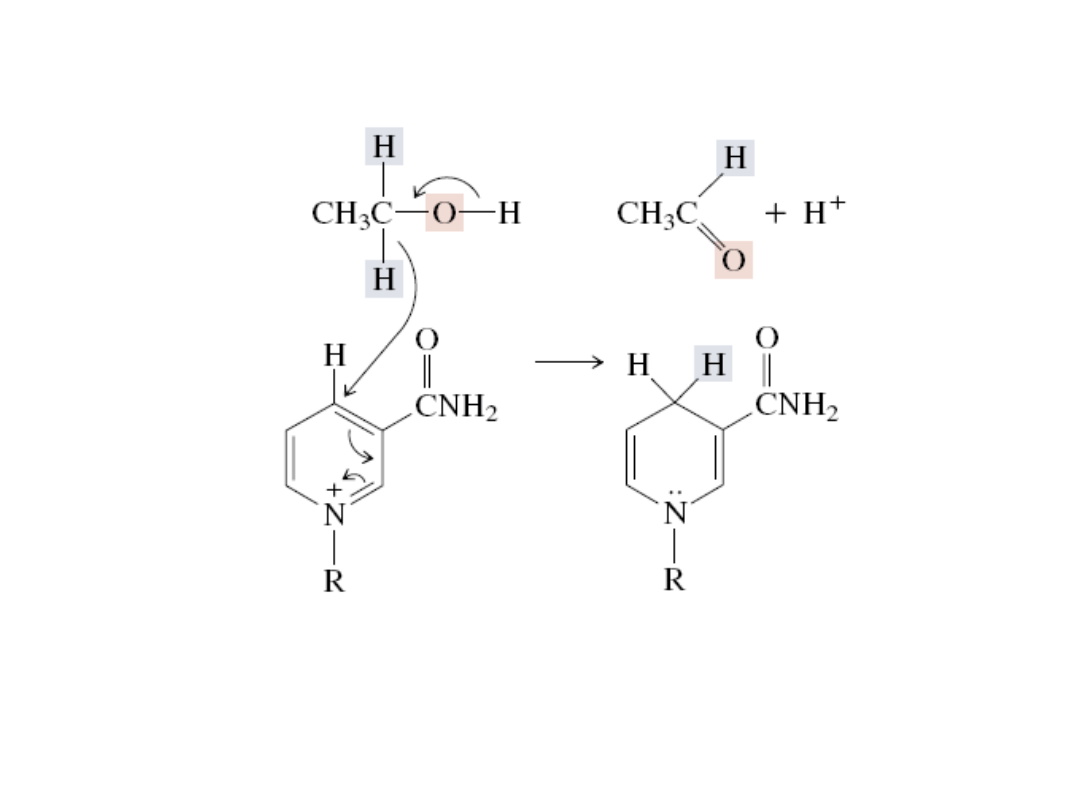
Biologiczne utlenianie alkoholu
Etery i epoksydy
Nomenklatura
C-O-C
Etery
są związkami posiadającymi dwie grupy organiczne przyłączone do
jednego atomu tlenu.
Epoksydy
są cyklicznymi, trójczłonowymi eterami,
nazywanymi również niekiedy oksiranami
•
Nazwy eterów są zwykle tworzone przez podanie słowa eter, po którym wymienia się
w porządku alfabetycznym nazwy alkilowych lub arylowych grup przyłączanych do atomu
tlenu.
eter etylowo-metylowy
eter dietylowy
eter chloropopylowo-etylowy
•
Dla eterów posiadających bardziej złożoną budowę, może być konieczne podanie dla
grup –OR nazwy grupy alkoksylowej. Zgodnie z IUPAC, mniejsze grupy alkoksylowe
traktowane są jako podstawniki.
OCH
3
2-metoksypentan
OH
OCH
3
trans-2-metoksycykloheksanol
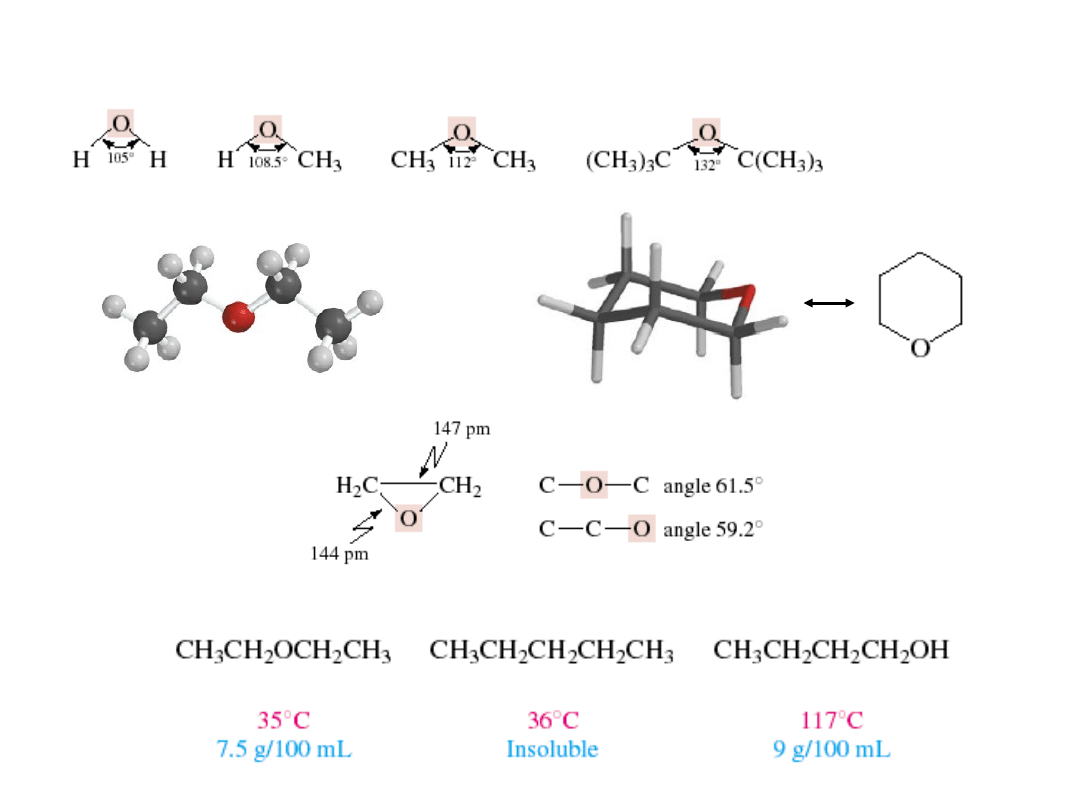
Struktura, wiązania i właściwości fizyczne eterów
142-153 ppm
T. wrz.
Rozp. w wodzie
tetrahydropyran
eter dietylowy
pentan
1-butanol
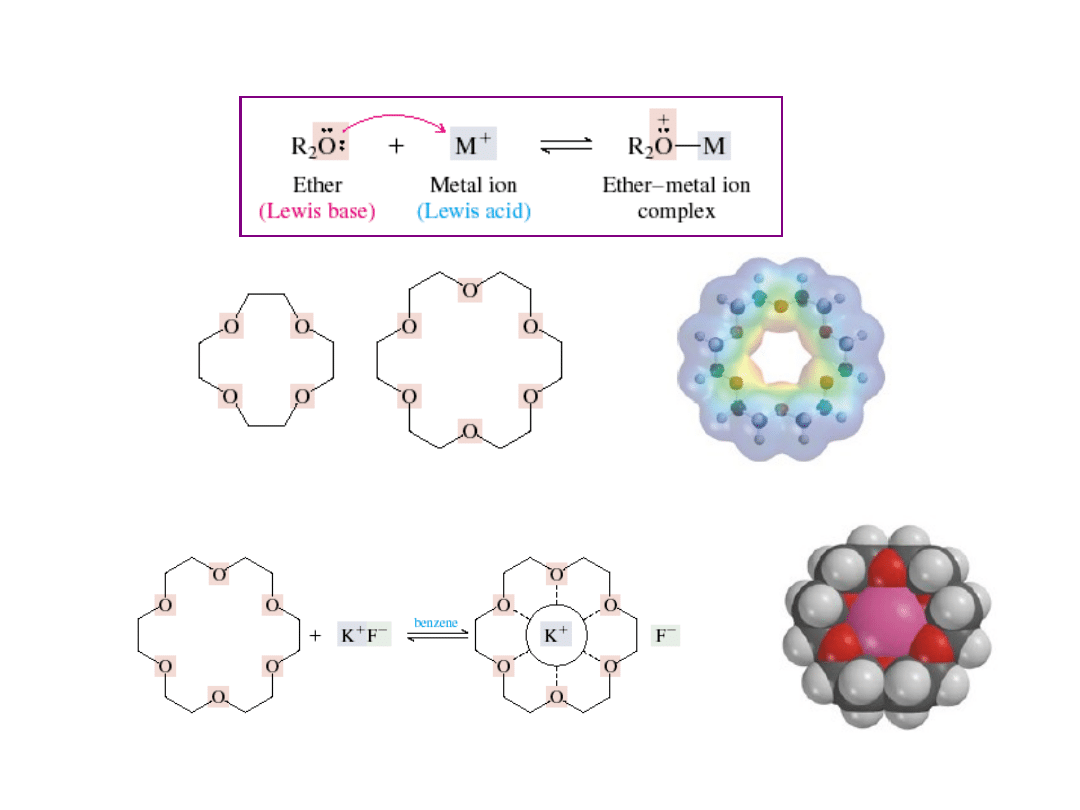
Etery koronowe
12-korona-4 18-korona-6
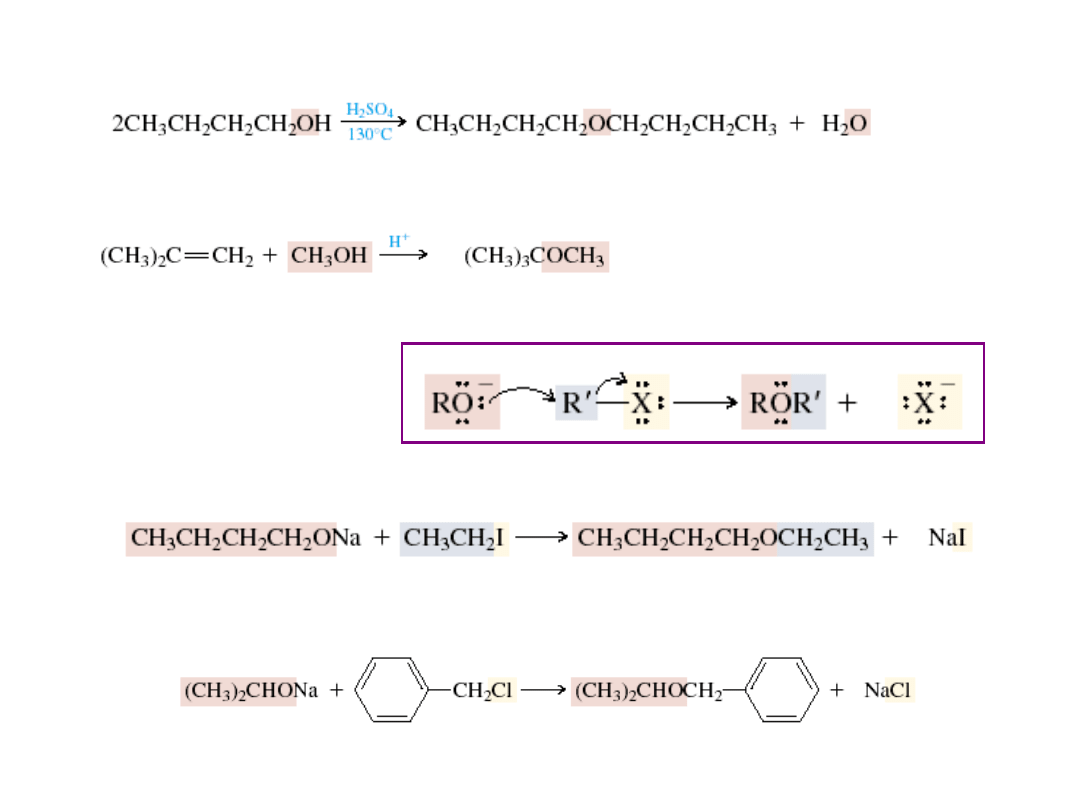
Synteza eterów
dodaje się do benzyny ,
podnosząc liczbę oktanową
Synteza Williamsona
jon alkoksylowy chlorek alkilu eter jon halogenkowy
butanolan sodu jodek etylu eter butylowo-etylowy jodek sodu
izopropanolan sodu chlorek benzylu eter izopropylowo-benzylowy chlorek sodu
1-butanol
eter dibutylowy
(60%)
woda
2-metylopropen
metanol
eter t-butylometylowy
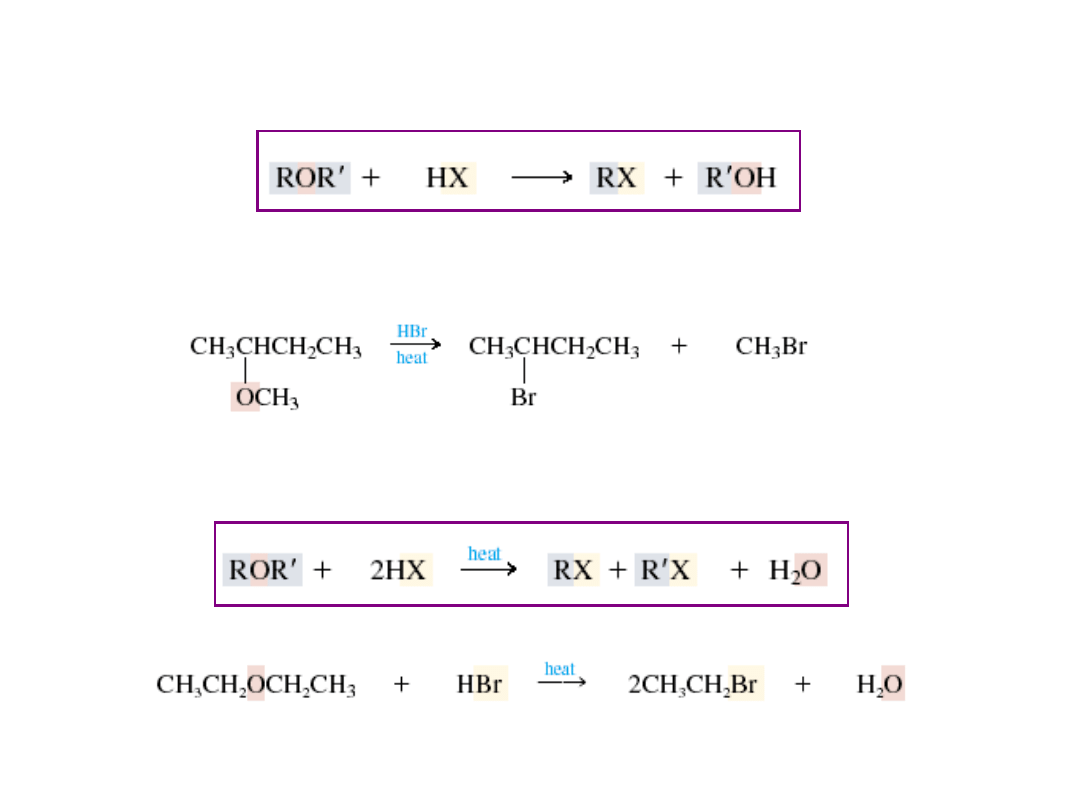
Reakcje eterów
Katalizowane kwasami rozszczepianie eterów
eter halogenowodór chlorek alkilu alkohol
sec-butylo-metylo eter 2-bromobutan (86%) bromometan
eter dietylowy bromowodór bromek etylu woda
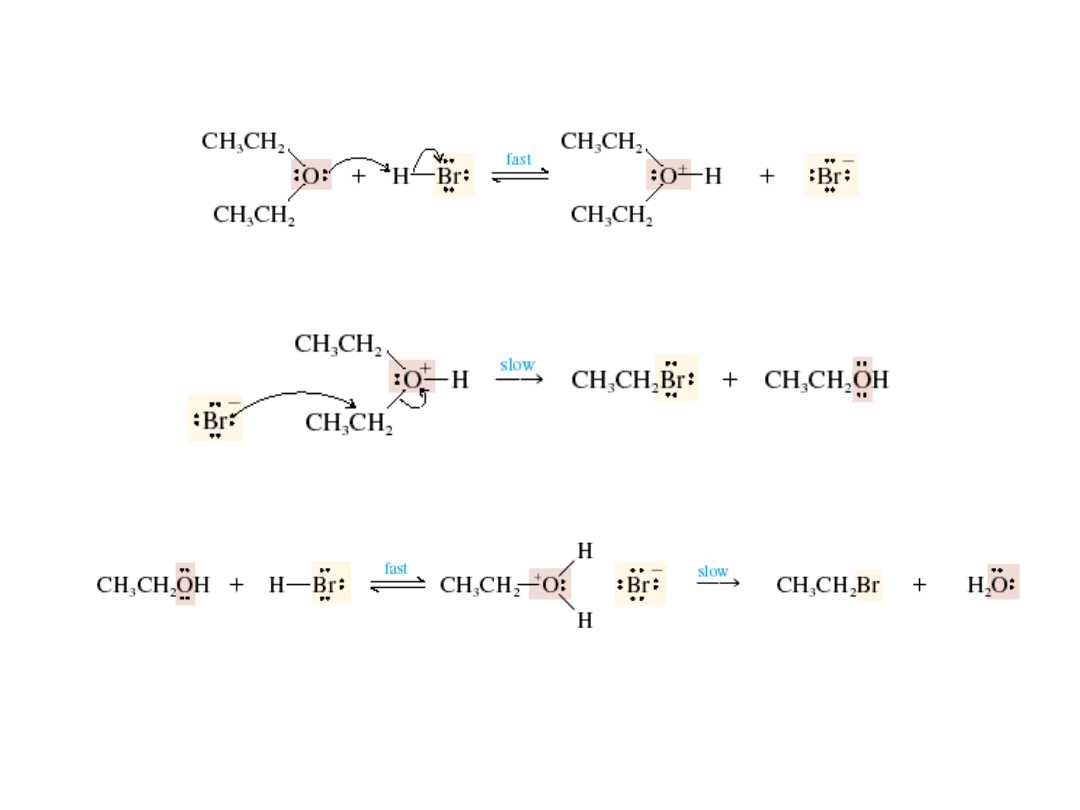
Mechanizm
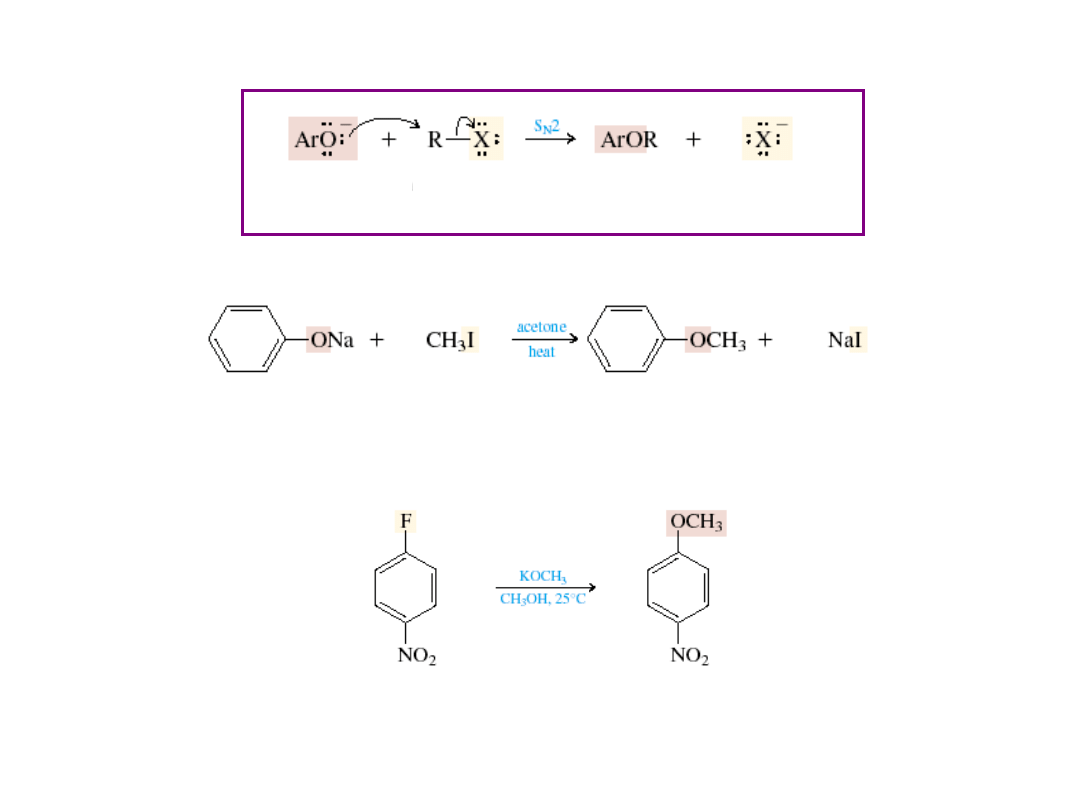
Synteza eterów arylowych
fenolan sodu
halogenek
alkilu
eter
alkilo-arylowy
anion
halogenkowy
fenolan sodu
jodometan
anizol
(95%)
jodek sodu
p-fluoronitrobenzen
p-nitroanizol
(93%)
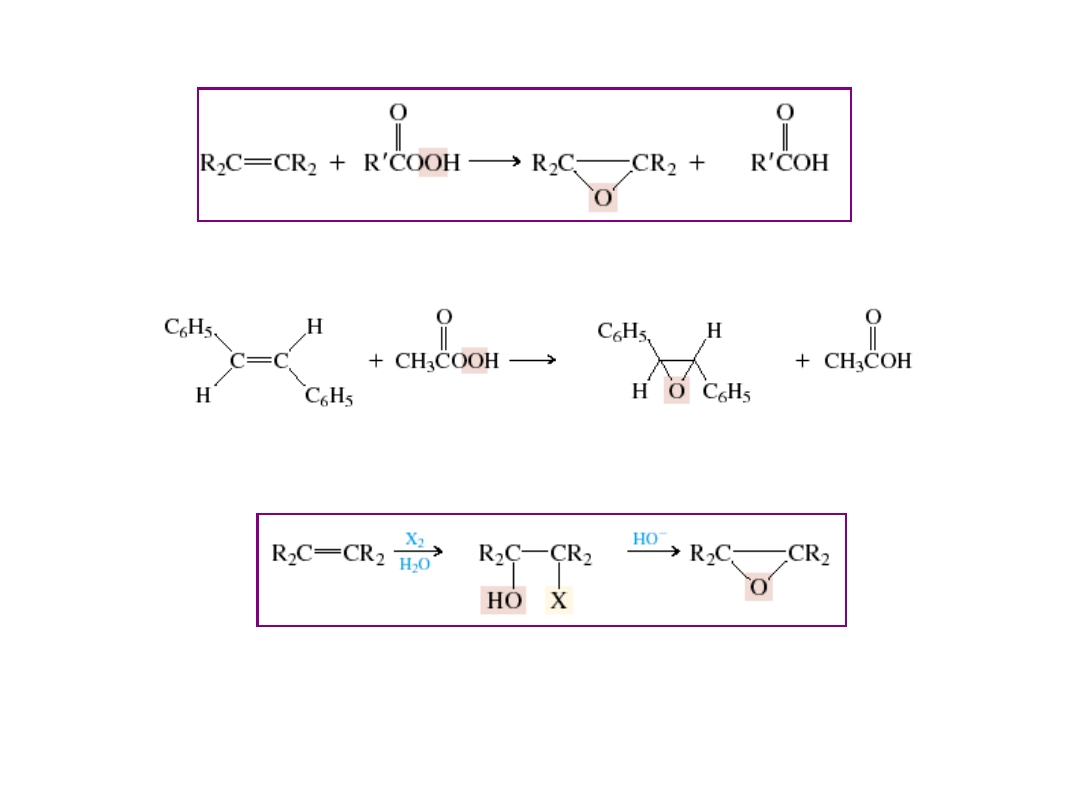
Synteza epoksydów
alken nadkwas epoksyd kwas karboksylowy
E-1,2-difenyloeten nadtlenokwas trans-2,3-difenyloepoksyd kwas octowy
kwasu ostowego
alken wicynalna halohydryna epoksyd

Wyszukiwarka
Podobne podstrony:
więcej podobnych podstron