Postępy Biochemii 59 (4) 2013
379
Angelika Chachaj
Andrzej Szuba
Klinika Chorób Wewnętrznych, 4 Wojskowy
Szpital Kliniczny z Polikliniką i Uniwersytet
Medyczny, Wrocław
Klinika Chorób Wewnętrznych, 4 Wojskowy
Szpital Kliniczny z Polikliniką, ul. Weigla 5, 50-
981 Wrocław; tel./faks: (71) 76 60 599, e-mail:
szubaa@yahoo.com
Artykuł otrzymano 30 września 2013 r.
Artykuł zaakceptowano 11 października
2013 r.
Słowa kluczowe: naczynia limfatyczne, lim-
fangiogeneza, PROX1, VEGFR-3, VEGF-C,
wrodzona niewydolność naczyń limfatycz-
nych
Wykaz skrótów: BEC (ang. blood endothelial
cells) — komórki śródbłonka naczyń krwiono-
śnych; ECM (ang. extracellular matrix) — ma-
cierz pozakomórkowa; LEC (ang. lymphatic en-
dothelial cell) — komórki śródbłonka naczynia
limfatycznego; LYVE-1 (ang. lymphatic vessel
endothelial hyaluronan receptor-1) — receptor
hialuronianu-1; PROX1 (ang. prospero-related
homeobox transcription factor 1) — czynnik trans-
krypcyjny typu homeobox związany z Prospe-
ro-1; SMC (ang. smooth muscle cells) — komórki
mięśni gładkich; VEGF-A, -C, -D (ang. vascular
endothelial growth factor - A, -C, -D) — śródbłon-
kowy czynnik wzrostu — A, -C, -D; VEGFR-3
(ang. vascular endothelial growth factor receptor-3)
— receptor czynnika wzrostu śródbłonka na-
czyń typu 3
Śródbłonek naczyń limfatycznych
STRESZCZENIE
W
porównaniu do wiedzy o budowie i funkcji śródbłonka naczyń krwionośnych, która
była intensywnie rozwijana przez kilka ostatnich dziesięcioleci, postęp w poznawaniu
komórek śródbłonka limfatycznego (LEC, ang.
blood endothelial cells) był przez długie lata
niemożliwy z powodu braku swoistych metod, które pozwoliłyby na uwidocznienie naczyń
limfatycznych w tkankach. Dopiero kilka ostatnich lat przyniosło w tym względzie istotny
postęp. Identyfikacja specyficznych znaczników LEC oraz rozwój nowych doświadczalnych
modeli zwierzęcych umożliwiły identyfikację wielu antygenów i czynników wzrostu tych
komórek oraz izolowanie czystych populacji LEC. Badania wskazują na heterogenność i
plastyczność LEC oraz na aktywny ich udział w utrzymywaniu homeostazy przestrzeni po-
zakomórkowej, w transporcie lipidów, odpowiedzi immunologicznej oraz w patofizjologii
ostrych i przewlekłych chorób zapalnych, reakcji odrzucania przeszczepów i chorób nowo-
tworowych. Artykuł przedstawia aktualną wiedzę dotyczącą znaczenia oraz regulacji LEC,
zarówno w zdrowiu, jak i w chorobie.
WPROWADZENIE — POSTĘP W POZNAWANIU BUDOWY
MOLEKULARNEJ ŚRÓDBŁONKA LIMFATYCZNEGO
Chociaż pierwsze wzmianki o istnieniu układu limfatycznego sięgają aż do
czasów starożytnej Grecji, a anatomiczna budowa układu limfatycznego została
opisana w całości pod koniec XIX wieku [1], to jednak dopiero kilka ostatnich lat
przyniosło istotny postęp w rozumieniu molekularnej struktury i funkcji komórek
śródbłonka limfatycznego. W porównaniu do wiedzy o budowie i funkcji śród-
błonka naczyń krwionośnych (BEC, ang. blood endothelial cells), która była inten-
sywnie rozwijana przez kilka ostatnich dziesięcioleci, postęp w poznawaniu LEC
był przez długie lata niemożliwy z powodu braku swoistych metod, które po-
zwoliłyby na uwidocznienie naczyń limfatycznych w tkankach. Naczynia chłonne
są trudne do wizualizowania, ponieważ są one często nieregularne i zapadnięte.
Najczęściej nie można ich w sposób pewny odróżnić od naczyń krwionośnych [2].
Dopiero w ostatnim dziesięcioleciu odkryto szereg znaczników LEC, dzię-
ki którym możliwe jest badanie naczyń chłonnych i odróżnienie ich od naczyń
krwionośnych. Spośród znanych obecnie kilkunastu znaczników LEC, w bada-
niach immunohistochemicznych najczęściej wykorzystuje się obecność na LEC
podoplaniny, receptora hyaluronianu LYVE-1 (ang. lymphatic vessel endothelial
hyaluronan receptor-1), czynnika transkrypcyjnego typu homeobox związanego
z Prospero-1 (PROX1, ang. prospero-related homeobox transcription factor 1) oraz
receptora czynnika wzrostu śródbłonka naczyń typu 3 (VEGFR-3, ang. vascular
endothelial growth factor receptor-3) [3]. Dotychczas nie znaleziono znacznika LEC
w pełni swoistego dla nich. Wszystkie poznane dotąd znaczniki LEC mogą znaj-
dować się także w innych komórkach [4]. Dlatego w badaniach stosuje się kom-
binację znaczników, najczęściej LYVE-1/podoplanina lub LYVE-1/PROX1 [3].
Znaczniki LEC nie tylko pozwoliły na ich odróżnienie od BEC w trakcie obser-
wacji preparatów immunohistochemicznych, ale umożliwiły również intensywny
rozwój technik izolowania czystych populacji LEC, co dało podstawę do ich mole-
kularnego scharakteryzowania. LEC zostały po raz pierwszy wyizolowane w 1984
roku przez dwa zespoły badaczy, Johnstona i Walkera, z przewodu limfatycznego
krezki krowy oraz przez Bowmana i wsp., od pacjentki z masywnym szyjnośród-
piersiowym torbielowatym naczyniakiem limfatycznym. Rok później LEC zostały
wyizolowane z przewodu piersiowego psa i człowieka. W 1994 roku Leak i Jones
po raz pierwszy zademonstrowali proces limfangiogenezy in vitro [1].
Dzięki znacznikom LEC izolowanie tych komórek stało się dużo prostsze. Są
one obecnie separowane za pomocą cytometrii przepływowej, przy zastosowaniu
sortowania komórek w polu elektrycznym albo magnetycznym, zarówno z du-
żych naczyń limfatycznych, takich jak np. piersiowy przewód limfatyczny, jak i

380
www.postepybiochemii.pl
z naczyń chłonnych włosowatych, pochodzących właściwie
z każdej tkanki ludzkiej lub zwierzęcej. Wyizolowane w ten
sposób LEC mogą być następnie unieśmiertelniane [5] i ba-
dane metodą in vitro oraz z użyciem ciałek embrionalnych.
Badania metodą in vitro umożliwiają ocenę skutków
działania poszczególnych stymulatorów bądź inhibitorów
limfangiogenezy. Badania te pozwalają zatem jedynie na
odrębną ocenę poszczególnych etapów limfangiogenezy
(np. proliferacji, adhezji albo migracji LEC) [5].
W ostatnich latach możliwe jest również badanie popula-
cji LEC za pomocą tzw. ciałek embrionalnych, zawierających
komórki macierzyste, które zanurza się w sztucznej macierzy
pozakomórkowej lub wszczepia do organizmu myszy. Jest to
metoda pośrednia pomiędzy badaniami metodą in vitro i in
vivo. Umożliwia ona ocenę kolejnych etapów procesu limfan-
giogenezy w czasie jednego badania. Komórki macierzyste
pod wpływem odpowiednich czynników wzrostu dzielą się,
różnicują w stronę fenotypu LEC, a w końcu tworzą prymi-
tywny splot naczyń chłonnych. Ciałka embrionalne mogą
zawierać komórki macierzyste od normalnych, ale też od
zmutowanych myszy, co umożliwia np. porównanie procesu
nowotworzenia naczyń chłonnych w czasie prawidłowego
rozwoju osobniczego i w stanach patologicznych [5].
W badaniach LEC metodą in vivo do niedawna używa-
no prawie wyłącznie transgenicznych myszy. Badania z
ich użyciem umożliwiły poznanie funkcji biologicznych
wielu białek i genów biorących udział w procesie limfan-
giogenezy, jak również testowanie nowych leków pro- i
antylimfangiogennych [5,6]. Z uwagi na to, że manipulacje
genetyczne u myszy są czasochłonne i kosztowne, od kilku
lat w badaniach LEC stosuje się także modele małych zwie-
rząt – danio pręgowanego (Danio reiro, ang. zebrafish) i ki-
janki żaby (Xenopus laevis i Xenopus tropicalis). Zarodki tych
zwierząt można otrzymać w dużych ilościach i w krótkim
czasie, co umożliwia manipulacje genetyczne zakrojone
na większą skalę niż z użyciem transgenicznych myszy.
Ponadto, zarodki danio i kijanki żab są przezroczyste, co
pozwala bezpośrednio obserwować proces limfangiogene-
zy. Od 2005 roku, kiedy po raz pierwszy scharakteryzowa-
no u tych małych zwierząt układ limfatyczny, zdążyły już
posłużyć w wielu badaniach do poznania mechanizmów
molekularnych regulujących funkcję LEC [6].
PROCES LIMFANGIOGENEZY W CZASIE ROZWOJU
PŁODOWEGO I W STANACH PATOLOGICZNYCH
Limfangiogeneza u człowieka rozpoczyna się w 6–7 ty-
godniu płodowym, i jest to 3–4 tygodnie po rozpoczęciu
embrionalnej angiogenezy. W tym czasie wybrane subpo-
pulacje komórek śródbłonka żylnego, wykazujące syntezę
VEGFR-3, położone w bocznych częściach przednich, pier-
wotnych żył głównych, zaczynają tracić właściwości komó-
rek śródbłonka żylnego, różnicując się w stronę fenotypu
LEC. Pierwszym wskaźnikiem tej nowej tożsamości LEC
jest synteza na nich LYVE-1 [7]. Te pierwsze LEC, wyka-
zujące produkcję LYVE-1, zaczynają się intensywnie dzielić
i tworzą pierwotne struktury morfologiczne naczyń chłon-
nych, tzw. pierwotne woreczki limfatyczne (ang. primary
lymph sacs), u człowieka w liczbie 6 [8,9].
Obwodowe naczynia chłonne wyrastają z pierwotnych wo-
reczków limfatycznych poprzez pączkowanie, a następnie wy-
dłużanie i rozgałęzianie, w wyniku czego powstaje pierwotny
splot naczyń limfatycznych, przenikający tkanki i narządy.
Najważniejszymi stymulatorami tworzenia naczyń chłonnych
są śródbłonkowy czynnik wzrostu-C (VEGF-C , ang. vascular
endothelial growth factor-C) oraz śródbłonkowy czynnik wzro-
stu-D (VEGF-D, ang. vascular endothelial growth factor-D). Pod-
czas rozwoju płodowego są one wydzielane przez mezenchy-
malne komórki otaczające pierwotne żyły główne, ale także
przez komórki naczyń krwionośnych, w tym komórki mię-
śni gładkich (SMC, ang. smooth muscle cells) oraz BEC [10,11].
VEGF-C i -D są ligandami receptora VEGFR-3, znajdującego
się na LEC. Poprzez działanie na ten receptor indukują wzrost
naczyń chłonnych, zarówno podczas rozwoju płodowego, jak
i w życiu pozapłodowym. Nowo utworzone naczynia chłonne
przechodzą następnie proces przemodelowania i dojrzewania.
Obejmują one przekształcenie prymitywnego splotu limfa-
tycznego w hierarchiczną sieć naczyń chłonnych [8,12] .
Uformowany już układ chłonny jest strukturą, która
reaguje na zmiany otoczenia. U dorosłych, wiele stanów
patologicznych przebiega z nowotworzeniem naczyń
chłonnych. Tzw. patologiczna limfangiogeneza zachodzi
w przypadku ran, chorób autoimmunologicznych, po ra-
dioterapii oraz w chorobie nowotworowej. Najważniejszy-
mi czynnikami limfangiogennymi są w niej VEGF-C oraz
śródbłonkowy czynnik wzrostu-A (VEGF-A, ang. vascular
endothelial growth factor-A), wydzielane przez komórki za-
palne, ewentualnie przez komórki nowotworowe.
HETEROGENNOŚĆ I PLASTYCZNOŚĆ LEC
Badania ostatnich lat wskazują na heterogenność i pla-
styczność LEC. Cechy te charakteryzują również BEC [13].
Rozważając zjawisko heterogenności, w uproszczeniu moż-
na przyjąć, że w organizmie człowieka nie ma dwóch iden-
tycznych komórek LEC, biorąc jednocześnie pod uwagę ich
status anatomiczny, morfologiczny, metaboliczny, funkcjo-
nalny i immunologiczny [13]. LEC wykazują fenotypową
zmienność, szczególnie zależną od ich lokalizacji i stanu
funkcjonalnego. Przykładem może być porównanie LEC po-
chodzących z naczyń chłonnych włosowatych i zbiorczych
pod względem morfologii (omówione w kolejnym podroz-
dziale), ale także obecności na nich receptora LYVE-1 i po-
doplaniny. LEC z naczyń włosowatych wykazują syntezę
obydwu znaczników, natomiast LEC z naczyń zbiorczych
tylko podoplaniny. LEC pochodzące z węzłów chłonnych,
śledziony, grasicy, migdałków podniebiennych czy też z bio-
drowego naczynia chłonnego, znacznie różnią się od siebie
pod względem produkcji różnych antygenów [13]. Porówna-
no np. transkryptom LEC pochodzących z jelita z transkryp-
tomem LEC pochodzących ze skóry. Wykazano, że komórki
te różniły się ekspresją ponad dwustu genów [14]. Podobnie,
profile antygenów obecnych na LEC z okresu płodowego,
z tkanki zmienionej zapalanie albo z guza nowotworowego
także są inne w tych różnych funkcjonalnie stanach LEC [4].
Heterogenność LEC dotyczy również ich pochodzenia.
Chociaż pierwotne LEC, budujące pierwotne woreczki limfa-
tyczne, mają pochodzenie żylne, to jednak LEC mogą rozwijać

Postępy Biochemii 59 (4) 2013
381
się również bezpośrednio z komórek prekursorowych pocho-
dzących ze szpiku kostnego. Nie wiadomo jeszcze czy takie
prekursory budują naczynia chłonne w czasie rozwoju pło-
dowego u ludzi. Wykazano jednak, że mogą być one źródłem
LEC w czasie patologicznej limfangiogenezy. Szpikowymi
prekursorami LEC wydają się być głównie monocyty CD11b+.
Komórki te wykazują syntezę antygenowo swoistą zarówno
dla monocytów (CD68, CD11b), jak i dla LEC (LYVE-1, podo-
planina, VEGFR-3, i PROX1). Pod wpływem stymulacji zapal-
nej komórki te są zdolne do przekształcenia się w LEC [15,16].
Zjawisko plastyczności LEC odnosi się natomiast do ich
potencjalnie zmiennej tożsamości. Wykazano, że BEC i LEC
pochodzące ze skóry wykazują podobną ekspresję ponad 95%
genów. O różnicowaniu się w kierunku fenotypu LEC spośród
BEC pierwotnej żyły głównej decyduje gen czynnika trans-
krypcyjnego PROX1. Stwierdzono, że ekspresja tego genu w
BEC zapoczątkowuje przeprogramowanie BEC w stronę feno-
typu LEC poprzez aktywację genów specyficznych dla LEC i
wyciszenie genów specyficznych dla BEC. W odwrotnej sytu-
acji, gdy w wykształconej już komórce LEC dojdzie do inak-
tywacji genu Prox1, następstwem jest utrata fenotypu LEC, co
wykazano zarówno w warunkach in vitro, jak i in vivo [13].
BUDOWA ANATOMICZNA I HISTOLOGICZNA
UKŁADU CHŁONNEGO. ZNACZENIE LEC W
HOMEOSTAZIE PRZESTRZENI POZAKOMÓRKOWEJ
Układ chłonny wraz z układem krwionośnym tworzą
wspólnie układ krążenia. Płyn oraz makrocząsteczki, któ-
re opuszczają naczynia krwionośne włosowate, są trans-
portowane z przestrzeni śródmiąższowej przez naczynia
limfatyczne włosowate i wracają z powrotem do krwio-
biegu poprzez sieć większych, tzw. zbiorczych naczyń
chłonnych. Tym samym, układ chłonny uzupełnia funkcję
układu krwionośnego poprzez regulację ilości płynu śród-
tkankowego oraz transport z przestrzeni śródmiąższowej
białek, produktów rozpadu komórek, produktów prze-
miany materii, komórek odpornościowych i sodu. Usuwa
również bakterie, inne mikroorganizmy inwazyjne oraz
cząsteczki, np. pyłu i kurzu, które wnikają do organizmu
przez skórę, układ oddechowy i przewód pokarmowy.
Dzięki temu układ chłonny przeciwdziała obrzękowi tka-
nek oraz utrzymuje właściwe środowisko zewnętrzne dla
komórek ustroju [8].
Chociaż układ chłonny i krwionośny komplementarnie
utrzymują homeostazę organizmu, to strukturalnie i funk-
cjonalnie są odrębnymi jednostkami. Podczas gdy układ ser-
cowo-naczyniowy tworzy układ zamknięty, w którym krew
pompowana jest przez serce, układ limfatyczny stanowi sys-
tem otwarty, jednokierunkowy, niskociśnieniowy, wolno-
przepływowy, nie posiadający centralnej siły napędowej [8].
System naczyń limfatycznych obwodowo zaczyna się śle-
po zakończonymi naczyniami włosowatymi o średnicy 30–80
μm, które następnie przechodzą w naczynia zbiorcze, a te —
w dwa przewody chłonne (przewód piersiowy i prawy prze-
wód limfatyczny), uchodzące do układu żylnego. Podczas gdy
głównym zadaniem mikronaczyń limfatycznych jest wychwyt
płynu śródmiąższowego oraz elementów morfotycznych z
tkanki śródmiąższowej, większe naczynia chłonne zapewniają
transport chłonki z powrotem do krwiobiegu.
Naczynia limfatyczne są obecne w większości tkanek or-
ganizmu, z wyjątkiem mózgu, siatkówki, szpiku kostnego
oraz tkanek pozbawionych unaczynienia, takich jak naskórek,
włosy, paznokcie, chrząstki i rogówki [8,17]. Aplazja układu
chłonnego jest wadą letalną, a jego dysfunkcja (wrodzona albo
nabyta) skutkuje rozwinięciem obrzęku limfatycznego [17].
Chłonne naczynia włosowate są cienkościenne, o
średnicy większej niż krwionośne naczynia włosowate.
Zbudowane są z pojedynczej warstwy nachodzących na
siebie dachówkowato LEC, które mają kształt liści dębu i są
ze sobą połączone przez wyspecjalizowane, krótkie i niecią-
głe połączenia (ang. button-like junctions), zbudowane m.in.
z VE-kadheryny [18]. W przeciwieństwie do krwionośnych
naczyń włosowatych, chłonne naczynia włosowate nie po-
siadają błony podstawnej oraz są pozbawione pericytów i
SMC [18,19]. Od zewnątrz LEC są umocowane w otaczają-
cej macierzy zewnątrzkomórkowej (ECM, ang. extracellular
matrix) za pomocą elastycznych włókien kotwiczących, tzw.
filamentów, zbudowanych z fibrylliny i emiliny-1. Włókna
te łączą LEC z włóknistymi elementami ECM, tj. kolagenem,
fibronektyną, tenascyną C, witronektyną, lamininą [20]. Fi-
lamenty stanowią nie tylko stabilizację delikatnych chłon-
nych naczyń włosowatych, ale również zapewniają regu-
lację stopnia przepuszczalności ściany tych naczyń. W wa-
runkach fizjologicznych chłonne naczynia włosowate mają
światło zapadnięte, jednak, gdy następuje wzrost ciśnienia
śródmiąższowego, filamenty odciągają od siebie LEC, co
skutkuje powstawaniem szczelin pomiędzy tymi komór-
kami. W ten sposób zwiększa się przepuszczalność ściany
i poszerza się światło tych naczyń, co zapewnia zwiększo-
ny drenaż otaczającej tkanki oraz ułatwione przechodzenie
makromolekuł oraz komórek do światła naczyń chłonnych
[17,20].
O dużym znaczeniu filamentów dla prawidłowego
funkcjonowania układu chłonnego świadczą wyniki ba-
dania, w którym u myszy analizowano konsekwencje
związane z brakiem genu emiliny-1. Histologicznie, na-
czynia chłonne tych myszy charakteryzowały się hipo-
plastycznością, zmniejszoną ilością filamentów i niepra-
widłowymi połączeniami międzykomórkowymi, a kli-
nicznie anomalie te prowadziły do wystąpienia obrzęku
limfatycznego [21].
Większe naczynia chłonne budową przypominają żyły.
Są zbudowane z warstwy LEC połączonych między sobą w
sposób ciągły (ang. zipper-like junctions) i otoczonych błoną
podstawną oraz warstwą SMC. Skurcze zbudowanych z
tych komórek mięśni gładkich wzdłuż naczyń chłonnych,
oprócz ruchów klatki piersiowej oraz pracy mięśni szkie-
letowych, stanowią siłę napędową przepływu chłonki [18].
Wykazano, że naczynia przejściowe, znajdujące się pomię-
dzy naczyniami włosowatymi i zbiorczymi, posiadają nie-
ciągłą warstwę SMC. Większe naczynia chłonne, podob-
nie jak naczynia żylne, posiadają zastawki, zapewniające
jednokierunkowy transport. Zastawki te zbudowane są
z rdzenia przymocowanego do ściany naczynia oraz po-
krywających go LEC [17,20]. Na rycinie 1 przedstawiono
schemat budowy naczyń chłonnych włosowatych i zbior-
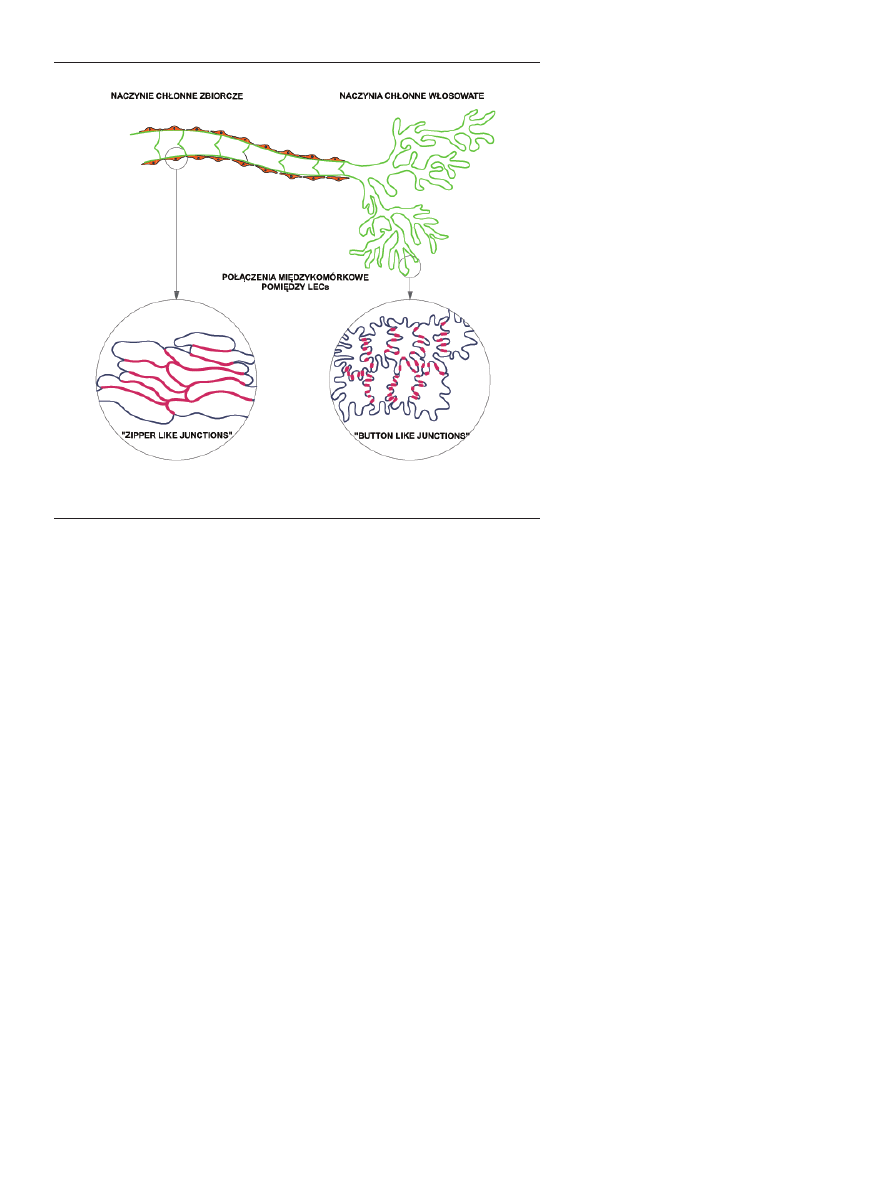
382
www.postepybiochemii.pl
czych oraz specyficznych dla nich połączeń międzykomór-
kowych pomiędzy LEC.
ZNACZENIE LEC W ODPOWIEDZI
IMMUNOLOGICZNEJ I W STANACH ZAPALNYCH
Układ chłonny pod względem czynnościowym można
postrzegać jako część układu odpornościowego, na który,
oprócz naczyń limfatycznych, składają się węzły chłonne,
migdałki, grasica, śledziona, wątroba, kępki Peyera i szpik
kostny. Dzięki skierowaniu antygenów, leukocytów, ma-
krofagów i komórek dendrytycznych z tkanek do węzłów
chłonnych, układ limfatyczny odgrywa istotną rolę w ini-
cjowaniu odpowiedzi immunologicznej organizmu oraz
podtrzymywaniu tolerancji wobec własnych antygenów
[8,17].
W ostatnich latach wykazano, że LEC odgrywają również
istotną, aktywną rolę w patofizjologii chorób zapalnych, za-
równo ostrych, jak i przewlekłych. W ostrych stanach zapal-
nych, takich jak np. rany, ostre infekcje, dochodzi raczej do
poszerzenia istniejących naczyń limfatycznych, niż do ich
nowotworzenia [22]. Przewlekłe zakażenia dróg oddecho-
wych, reumatoidalne zapalenie stawów, choroba Leśniow-
skiego-Crohna, wrzodziejące zapalenie jelita grubego, łusz-
czyca skóry i zapalenia skóry po naświetlaniu promienio-
waniem UVB są przykładami przewlekłych stanów zapal-
nych, w których, oprócz tworzenia naczyń krwionośnych,
dochodzi również do wzmożonej limfangiogenezy [23].
Aktywny udział LEC w procesach zapalnych wynika
przede wszystkim z wydzielania przez nie szeregu cytokin,
takich jak CCL21, CXCL12 i CCL27. Cytokiny te są ligan-
dami dla receptorów, odpowiednio CCR7, CXCR4, CCR10,
znajdujących się na dojrzałych komórkach dendrytycznych i
niektórych limfocytach T i B. Połączenie cy-
tokin z tymi receptorami działa na zasadzie
„pokazania paszportu” przez komórki od-
pornościowe i ułatwia przechodzenie tych
komórek do światła naczynia chłonnego, a
następnie do węzłów chłonnych [23,24].
Ponadto, LEC wykazują syntezę szeregu
cząsteczek adhezyjnych, m.in. mannozowe-
go receptora 1 (MR-1, ang. mannose recep-
tor 1), CLEVER-1 (ang. common lymphatic
endothelial and vascular receptor-1), ICAM-
1 (ang. intercellular adhesion molecule-1),
VCAM-1 (ang. vascular adhesion molecu-
le-1). Cząsteczki te pośredniczą w procesie
przylegania leukocytów do LEC i ułatwiają
tym samym ich przechodzenie z tkanek do
światła naczyń chłonnych [23,24].
Ustalenie biologicznej roli limfangioge-
nezy w stanach zapalnych wymaga dal-
szych badań [25]. Z jednej strony, nowo-
tworzone naczynia limfatyczne w obrębie
tkanki zmienionej zapalnie zmniejszają jej
obrzęk, kierują antygeny i komórki odpor-
nościowe do węzłów chłonnych, wzmac-
niając tym odpowiedź immunologiczną,
a po ustaniu stanu zapalnego pomagają
oczyścić tkankę z rozpadłych komórek, cy-
tokin, nadmiaru płynu i komórek odpornościowych [26].
Z drugiej jednak strony, nie można wykluczyć, że zwięk-
szony drenaż limfatyczny miejsca zapalenia zwiększa ry-
zyko przeniesienia drobnoustrojów i cytokin zapalnych
po całym organizmie. Ponadto, wiadomo, że w przypadku
transplantacji narządów, np. nerek albo rogówki, nasilona
limfangiogeneza po przeszczepie, zwiększając migrację ko-
mórek odpornościowych do węzłów chłonnych, zwiększa
niepożądaną reakcję immunologiczną „gospodarz przeciw-
ko przeszczepowi” (ang. host versus graft reaction). Próby za-
stosowania leków hamujących limfangiogenezę wydają się
poprawiać ogólną przeżywalność przeszczepów. Wymaga
to jednak dalszych badań [27].
ZNACZENIE LEC W GOSPODARCE LIPIDOWEJ
Naczynia chłonne są również odpowiedzialne za wchła-
nianie tłuszczy oraz witamin rozpuszczalnych w tłuszczach
(A,D,E,K) z jelit, a z drugiej strony, uczestniczą w trans-
porcie zwrotnym cholesterolu (RCT, ang. rewers cholesterol
transport) [8,17,28]. Już w 1627 roku Gaspard Asselli we
Włoszech opisał biały płyn, który płynie „mlecznymi ży-
łami” (ang. milky veins) z jelit u psów po ich nakarmieniu
[1]. Chociaż transport lipidów z jelit był jedną z pierwszych
funkcji, jakie przypisano układowi chłonnemu, dotychczas
przeprowadzono niewiele badań dotyczących molekular-
nego poznania tego procesu [29].
Wykazano niedawno, że prawie wszystkie tłuszcze z jelit
dostają się do krwi przez układ chłonny, początkowo przez
wyspecjalizowane naczynia chłonne, zwane naczyniami
mleczowymi (ang. lacteals), znajdującymi się w kosmkach
jelitowych. Komórki jelita, enterocyty, wydzielają do blasz-
Rycina 1. Schemat budowy naczyń chłonnych włosowatych i zbiorczych oraz specyficznych dla nich
połączeń międzykomórkowych pomiędzy LEC.

Postępy Biochemii 59 (4) 2013
383
ki właściwej błony śluzowej jelita (lamina propria) chylo-
mikrony, będące lipoproteinami o średnicy 100-2000 nm,
bogatymi w trójglicerydy. W lamina propria chylomikrony
mają styczność z naczyniami chłonnymi. Dostają się do ich
światła, a następnie są nimi transportowane do układu żyl-
nego [30].
Nadal nie ma pewności, w jaki sposób chylomikrony do-
stają się przez warstwę LEC do światła naczyń chłonnych.
Do niedawna wśród naukowców panowała zgoda, że pro-
ces ten odbywa się poprzez transport bierny, przez otwory
międzykomórkowe pomiędzy LEC. Badania ostatnich lat
wskazują jednak na aktywny udział LEC w tym transpor-
cie. W kilku badaniach udowodniono, że chylomikrony
przechodzą przez warstwę LEC głównie poprzez transport
wewnątrzkomórkowy. Poznanie dokładnej, molekular-
nej charakterystyki tego procesu wymaga jednak dalszych
prac [29]. Zaburzenia transportu chylomikronów do układu
chłonnego mogą leżeć u podstawy patogenezy zespołu nie-
dożywienia i niedoboru witamin [30].
Naczynia chłonne biorą również udział w RCT. Polega
on na przekazywaniu lipoprotein o dużej gęstości (HDL,
ang. high density lipoproteins) z tkanek obwodowych do wą-
troby, najpierw drogą naczyń chłonnych, a potem naczynia-
mi krwionośnymi. W wątrobie HDL są metabolizowane do
cholesterolu i soli żółciowych, wydalanych z kałem. Proces
RCT zapewnienia homeostazę przestrzeni pozakomórko-
wej i stanowi ochronę przed miażdżycą naczyń [28,31].
Do niedawna uważano, że cholesterol z przestrzeni po-
zakomórkowej przechodzi do światła naczyń chłonnych
pasywnie, poprzez przestrzenie międzykomórkowe po-
między LEC. Wykazano, że komórki LEC działają w tym
transporcie aktywnie. HDL z przestrzeni pozakomórkowej
dostają się do światła naczyń chłonnych głównie drogą
przezkomórkową, po związaniu z receptorem SR-BI (ang.
scavenger receptor class B type I), obecnym na powierzchni
LEC. Transport zwrotny cholesterolu jest zatem procesem
kontrolowanym przez LEC [31].
ZNACZENIE LEC W METABOLIZMIE HIALURONIANU
I KONTROLI CIŚNIENIA TĘTNICZEGO
Hialuronian, inaczej kwas hialuronowy (HA, ang. hy-
aluronic acid), to glikozaminoglikan, który jest podstawo-
wym składnikiem ECM wszystkich tkanek. Pomimo prostej
struktury chemicznej, HA bierze udział w wielu ważnych
procesach w organizmie człowieka, przede wszystkim w
utrzymywaniu właściwego środowiska pozakomórkowe-
go, w tym, wiązaniu wody i sodu w tej przestrzeni. Wyka-
zano, że właściwości HA zależą od długości jego łańcucha.
Długi łańcuch HA sprawia, że działa on przeciwzapalnie,
natomiast krótsze jego formy są prozapalne. Produkty roz-
kładu HA, wytwarzane w odpowiedzi na stan zapalny w
tkance, mogą aktywować LEC i podwyższać w nich poziom
syntezy cząsteczek adhezyjnych (np. ICAM-1, VCAM-1), co
zwiększa rekrutację leukocytów i ewentualnych komórek
nowotworowych do odprowadzających naczyń limfatycz-
nych [32].
W organizmie człowieka zachodzi duży obrót HA, około
jedna trzecia całości HA jest wymieniana w ciągu jednego
dnia. W stanach zapalnych obrót HA dodatkowo wzrasta.
Szczególnie dużo HA znajduje się w skórze. Uważa się, że
zawiera ona ponad 50% całkowitej ilości HA znajdującej
się w organizmie człowieka. W tkankach HA jest metabo-
lizowany przez fibroblasty i makrofagi, ale również jest
on usuwany przez naczynia chłonne, które kierują go do
metabolizujących go węzłów chłonnych. Na komórkach
śródbłonka w obrębie zatok rdzeniowych w węzłach chłon-
nych znajduje się receptor HARE (ang. hyaluronan receptor
for endocytosis), zwany również stabiliną-2. Jest on głównym
receptorem dla glikozaminoglikanów, zapoczątkowuje ich
metabolizm i występuje nie tylko w węzłach chłonnych, ale
również w wątrobie i śledzionie. W narządach tych również
odbywa się metabolizm HA, jednakże o mniejszym ilościo-
wo znaczeniu niż w tkankach i węzłach chłonnych. LYVE-1
jest także receptorem dla HA, jednakże jego rola w metabo-
lizmie HA jest obecnie kwestionowana [32].
Dotychczas nie określono dokładnie jak duża część HA
jest w organizmie człowieka wychwytywana przez układ
chłonny i metabolizowana w węzłach chłonnych. Ostat-
nie badania wskazują jednak, że znaczenie LEC jest w tym
względzie mniejsze niż początkowo zakładano, a najwięk-
szy udział w obrocie HA wydają się mieć miejscowe makro-
fagi i fibroblasty [32].
Naczynia limfatyczne w skórze mogą mieć także znacze-
nie w regulacji ciśnienia tętniczego. W badaniach na sodow-
rażliwych szczurach (DSS, ang. Dahl’s salt sensitive rats) wy-
kazano, że glikozaminoglikany w skórze wiążą nieaktywny
osmotycznie sód. W sytuacji dużego nagromadzenia sodu
w skórze zostaje uruchomiona kaskada zdarzeń z udziałem
makrofagów, które wydzielają VEGF-C i stymulują limfan-
giogenezę. Nowo powstałe naczynia limfatyczne są uważa-
ne za mechanizm buforowy, który pozwala na zwiększony
drenaż tkanek bogatych w sód i chroni przed wystąpieniem
sodowrażliwego nadciśnienia tętniczego. Dotychczas nie
wiadomo jednak czy taki mechanizm obronny działa u czło-
wieka. Potrzebne są w tym względzie dalsze badania [33].
ZNACZENIE LEC W PATOFIZJOLOGII
CHOROBY NOWOTWOROWEJ
Znaczenie LEC w chorobach nowotworowych jest obec-
nie najbardziej intensywnie badanym obszarem dotyczącym
naczyń chłonnych. Coraz więcej badań wskazuje na silną
korelację pomiędzy nasileniem procesu limfangiogenezy w
obrębie guza a przerzutami komórek nowotworowych do
węzłów chłonnych, do odległych narządów i krótszym cza-
sem przeżycia chorych [3,8,34]. Przez długie lata układ chłon-
ny był traktowany jako bierny uczestnik procesu nowotwo-
rowego. Obecnie wiadomo już, że naczynia limfatyczne to
nie tylko proste kanały, do których komórki nowotworowe
wchodzą biernie, razem z płynem śródmiąższowym, a po-
tem są przekazywane wraz z chłonką do węzłów chłonnych.
Badania wykazują, że LEC aktywnie przyczyniają się do roz-
przestrzeniania się choroby nowotworowej [34,35].

384
www.postepybiochemii.pl
LEC, aktywowane przez cytokiny i czynniki wzrostu wy-
dzielane przez komórki nowotworowe, produkują chemoki-
ny, które ułatwiają komórkom nowotworowym wejście do
światła naczyń chłonnych, a następnie do węzłów chłonnych.
Komórki nowotworowe są wówczas traktowane jak komór-
ki odpornościowe. Przykładem są produkowane przez LEC
cytokiny CCL21 i CXCL12, które mogą łączyć się z komór-
kami nowotworowymi wykazującymi syntezę swoistych dla
nich receptorów, odpowiednio CCR7 (np. komórki czerniaka,
raka piersi, raka żołądka, niedrobnokomórkowego raka płuc)
i CXCR4 (np. komórki czerniaka i raka piersi). Te chemokiny
i ich receptory odgrywają kluczową rolę w ułatwianiu prze-
rzutów komórkom nowotworowym [34-37]. Co więcej, cyto-
kiny wydzielane przez guz nowotworowy mogą wpływać
na zwiększenie przepuszczalności naczyń chłonnych oraz na
zwiększenie syntezy cząsteczek adhezyjnych na powierzch-
ni LEC, takich jak np. MR1 i CLEVER-1. Zmiany te również
mogą odgrywać rolę w zwiększaniu ryzyka przerzutów no-
wotworowych przez układ limfatyczny [38].
ZESPOŁY GENETYCZNE W WYNIKU
MUTACJI GENÓW ANTYGENÓW LEC
Mutacje wykryte w genach antygenów LEC pozwoliły zi-
dentyfikować genetyczną przyczynę wielu wrodzonych ze-
społów niewydolności naczyń limfatycznych. Mutacje genu
czynnika transkrypcyjnego SOX18 (region determinujący
płeć Y, SRY-box 18, indukujący bezpośrednio gen Prox1,
który jest głównym czynnikiem warunkującym fenotyp
LEC) zostały niedawno zidentyfikowane jako przyczyna
rzadkiego zespołu brak owłosienia — obrzęk — poszerzenie
naczyń chłonnych (ang. hypotrichosis-lymphedema-teleangiec-
tasia). W zależności od rodzaju mutacji zespół ten dziedzi-
czy się w sposób dominujący lub recesywny. Objawy wy-
stępują już u dzieci pod postacią utraty włosów na głowie,
braku rzęs i brwi, obrzęków limfatycznych, obejmujących
kończyny dolne i powieki, oraz teleangiektazji, występują-
cych głównie na dłoniach, nogach i podeszwach stóp [39].
Heterozygotyczne mutacje punktowe zmiany sensu w ge-
nie kodującym VEGFR-3 stwierdzono u kilku rodzin z choro-
bą Milroya. Jest to rzadka choroba, dziedziczona autosomalnie
dominująco. Jej istotą jest hipoplazja naczyń chłonnych skóry.
Klinicznie charakteryzuje się wystąpieniem obrzęku limfatycz-
nego, dotyczącego najczęściej jednej kończyny dolnej. Defekt
może również dotyczyć naczyń chłonnych jelit z objawami
biegunki tłuszczowej, występującej na skutek upośledzonego
transportu chylomikronów [40].
Mutacje w genie FOXC2 (czynnik transkrypcyjny z domeną
forkhead, ang. forkhead box protein C2, będący głównym regu-
latorem limfangiogenezy na etapie przebudowy i dojrzewania
nowo utworzonych naczyń) są przyczyną zespołu, nazwane-
go obrzękiem limfatycznym z podwójnym rzędem rzęs (ang.
lymphedema-distichiasis syndrome). Jest to choroba dziedziczo-
na autosomalnie dominująco, cechująca się występowaniem
obrzęku limfatycznego kończyn dolnych i podwójnym rzę-
dem rzęs (klinicznie — od kliku dodatkowych rzęs do całego
dodatkowego rzędu rzęs). Innymi objawami mogą być: meta-
plazja gruczołów Meiboma, żylaki, opadanie powiek, rozsz-
czep podniebienia i wrodzone wady serca [41].
Mutacje typu zmiany sensu (ang. missense mutation) w
genie integryny α9β1, warunkującej wykształcenie prawidło-
wych zastawek w zbiorczych naczyniach chłonnych, są zwią-
zane z wystąpieniem wrodzonego chylothorax u płodu [42].
Mutacje w genie CCBE1 (domeny EGF łączące kolagen i
wapń, ang. collagen and calcium-binding EGF domain-containing
protein 1, warunkujące pączkowanie i migrację nowych LEC
z pierwotnej żyły głównej) mogą powodować jedną z postaci
obrzęku limfatycznego dziedzicznego w sposób autosomalny
recesywny — zespół Hennekama (ang. lymphedema-lymphan-
giectasia-mental retardation syndrome). W zespole tym pacjenci
mają obrzęki limfatyczne kończyn, limfangiektazje w obrębie
jelit oraz różnego stopnia niesprawność intelektualną [43].
PIŚMIENNICTWO
1. Loukas M, Bellary SS, Kuklinski M, Ferrauiola J, Yadav A, Shoja MM,
Shaffer K, Tubbs RS (2011) The lymphatic system: a historical perspec-
tive. Clin Anat 24: 807-816
2. Choi I, Lee S, Hong YK (2012) The new era of the lymphatic system:
no longer secondary to the blood vascular system. Cold Spring Harb
Perspect Med 2: a006445
3. Van der Auwera I, Cao Y, Tille JC, Pepper MS, Jackson DG, Fox SB,
Harris AL, Dirix LY, Vermeulen PB (2006) First international consen-
sus on the methodology of lymphangiogenesis quantification in solid
human tumours. Br J Cancer 95: 1611-1625
4. Baluk P, McDonald DM (2008) Markers for microscopic imaging of
lymphangiogenesis and angiogenesis. Ann N Y Acad Sci 1131: 1-12
5. Bruyere F, Noel A (2010) Lymphangiogenesis: in vitro and in vivo mo-
dels. FASEB J 24: 8-21
6. Shin WS, Rockson SG (2008) Animal models for the molecular and me-
chanistic study of lymphatic biology and disease. Ann N Y Acad Sci
1131: 50-74
7. Banerji S, Ni J, Wang SX, Clasper S, Su J, Tammi R, Jones M, Jackson
DG (1999) LYVE-1, a new homologue of the CD44 glycoprotein, is a
lymph-specific receptor for hyaluronan. J Cell Biol 144: 789-801
8. Alitalo K, Tammela T, Petrova TV (2005) Lymphangiogenesis in deve-
lopment and human disease. Nature 438: 946-953
9. Wigle JT, Oliver G (1999) Prox1 function is required for the develop-
ment of the murine lymphatic system. Cell 98: 769-778
10. Karpanen T, Alitalo K (2008) Molecular biology and pathology of lym-
phangiogenesis. Annu Rev Pathol 3: 367-397
11. Achen MG, Jeltsch M, Kukk E, Makinen T, Vitali A, Wilks AF, Alitalo
K, Stacker SA (1998) Vascular endothelial growth factor D (VEGF-D)
is a ligand for the tyrosine kinases VEGF receptor 2 (Flk1) and VEGF
receptor 3 (Flt4). Proc Natl Acad Sci USA 95: 548-553
12. Sabin F (1902) On the origin of the lymphatics system from the veins
and the development of the lymph hearts and thorarcic duct in the pig.
Am J Anat 1: 367-391
13. Lee S, Choi I, Hong YK (2010) Heterogeneity and plasticity of lympha-
tic endothelial cells. Semin Thromb Hemost 36: 352-361
14. Norrmen C, Vandevelde W, Ny A, Saharinen P, Gentile M, Haraldsen
G, Puolakkainen P, Lukanidin E, Dewerchin M, Alitalo K, Petrova TV
(2010) Liprin (beta)1 is highly expressed in lymphatic vasculature and
is important for lymphatic vessel integrity. Blood 115: 906-909
15. Ran S, Montgomery KE (2012) Macrophage-Mediated Lymphangioge-
nesis: The Emerging Role of Macrophages as Lymphatic Endothelial
Progenitors. Cancers (Basel) 4: 618-657
16. Religa P, Cao R, Bjorndahl M, Zhou Z, Zhu Z, Cao Y (2005) Presence
of bone marrow-derived circulating progenitor endothelial cells in the
newly formed lymphatic vessels. Blood 106: 4184-4190
17. Albrecht I, Christofori G (2011) Molecular mechanisms of lymphan-
giogenesis in development and cancer. Int J Dev Biol 55: 483-494
Postępy Biochemii 59 (4) 2013
385
Lymphatic endothelium
Angelika Chachaj, Andrzej Szuba
Department of Internal Medicine, 4th Military Hospital in Wroclaw, 5 Weigla St., 50-981 Wroclaw, Poland
e-mail: szubaa@yahoo.com
Key words: lymphatic vessels, lymphangiogenesis, PROX1, VEGFR-3, VEGF-C, congenital lymphatic insufficiency
ABSTRACT
Compared to the knowledge about the structure and function of endothelial cells of blood vessels, which was heavily developed over the
past few decades, advance in the knowledge of lymphatic endothelial cells (LECs) for many years has been impossible, because of the lack
of specific methods that allow histological visualization of lymphatic vessels in the tissues. The last years have brought significant progress
in this field. Identification of specific markers of LECs and the development of new experimental animal models have allowed to recognize a
number of antigens and growth factors of LECs and to isolate pure LECs populations. Studies indicate heterogeneity and plasticity of LECs
and their active participation in the extracellular homeostasis, lipid transport, immune response and in the pathophysiology of acute and
chronic inflammatory diseases, graft rejection and cancer. The article presents the current knowledge on the importance and regulation of
LECs, both in health and disease.
18. Baluk P, Fuxe J, Hashizume H, Romano T, Lashnits E, Butz S, Vestwe-
ber D, Corada M, Molendini C, Dejana E, McDonald DM (2007) Func-
tionally specialized junctions between endothelial cells of lymphatic
vessels. J Exp Med 204: 2349-2362
19. Schulte-Merker S, Sabine A, Petrova TV (2011) Lymphatic vascular
morphogenesis in development, physiology, and disease. J Cell Biol
193: 607-618
20. Chen J, Alexander JS, Orr AW (2012) Integrins and their extracellular
matrix ligands in lymphangiogenesis and lymph node metastasis. Int J
Cell Biol 2012: 853703
21. Danussi C, Spessotto P, Petrucco A, Wassermann B, Sabatelli P, Mon-
tesi M, Doliana R, Bressan GM, Colombatti A (2008) Emilin1 deficiency
causes structural and functional defects of lymphatic vasculature. Mol
Cell Biol 28: 4026-4039
22. Huggenberger R, Siddiqui SS, Brander D, Ullmann S, Zimmermann
K, Antsiferova M, Werner S, Alitalo K, Detmar M (2011) An important
role of lymphatic vessel activation in limiting acute inflammation. Blo-
od 117: 4667-4678
23. Kim H, Kataru RP, Koh GY (2012) Regulation and implications of in-
flammatory lymphangiogenesis. Trends Immunol 33: 350-356
24. Maby-El Hajjami H, Petrova TV (2008) Developmental and patholo-
gical lymphangiogenesis: from models to human disease. Histochem
Cell Biol 130: 1063-1078
25. Jurisic G, Detmar M (2009) Lymphatic endothelium in health and dise-
ase. Cell Tissue Res 335: 97-108
26. Baluk P, Tammela T, Ator E, Lyubynska N, Achen MG, Hicklin DJ,
Jeltsch M, Petrova TV, Pytowski B, Stacker SA, Yla-Herttuala S, Jack-
son DG, Alitalo K, McDonald DM (2005) Pathogenesis of persistent
lymphatic vessel hyperplasia in chronic airway inflammation. J Clin
Invest 115: 247-257
27. Dietrich T, Bock F, Yuen D, Hos D, Bachmann BO, Zahn G, Wiegand S,
Chen L, Cursiefen C (2010) Cutting edge: lymphatic vessels, not blood
vessels, primarily mediate immune rejections after transplantation. J
Immunol 184: 535-539
28. Chachaj A, Drozdz K, Szuba A (2008) [Reverse cholesterol transport
processes and their role in artherosclerosis regression]. Postepy Bio-
chem 54: 301-307
29. Dixon JB (2010) Mechanisms of chylomicron uptake into lacteals. Ann
N Y Acad Sci 1207 Suppl 1: E52-57
30. Nordskog BK, Phan CT, Nutting DF, Tso P (2001) An examination of
the factors affecting intestinal lymphatic transport of dietary lipids.
Adv Drug Deliv Rev 50: 21-44
31. Lim HY, Thiam CH, Yeo KP, Bisoendial R, Hii CS, McGrath KC, Tan
KW, Heather A, Alexander JS, Angeli V (2013) Lymphatic vessels are
essential for the removal of cholesterol from peripheral tissues by SR-
-BI-mediated transport of HDL. Cell Metab 17: 671-684
32. Jackson DG (2009) Immunological functions of hyaluronan and its re-
ceptors in the lymphatics. Immunol Rev 230: 216-231
33. Machnik A, Dahlmann A, Kopp C, Goss J, Wagner H, van Rooijen N,
Eckardt KU, Muller DN, Park JK, Luft FC, Kerjaschki D, Titze J (2010)
Mononuclear phagocyte system depletion blocks interstitial tonici-
ty-responsive enhancer binding protein/vascular endothelial growth
factor C expression and induces salt-sensitive hypertension in rats.
Hypertension 55: 755-761
34. McAllaster JD, Cohen MS (2011) Role of the lymphatics in cancer me-
tastasis and chemotherapy applications. Adv Drug Deliv Rev 63: 867-
875
35. Li T, Yang J, Zhou Q, He Y (2012) Molecular regulation of lymphangio-
genesis in development and tumor microenvironment. Cancer Micro-
environ 5: 249-260
36. Shields JD, Kourtis IC, Tomei AA, Roberts JM, Swartz MA (2010) In-
duction of lymphoidlike stroma and immune escape by tumors that
express the chemokine CCL21. Science 328: 749-752
37. Pepper MS, Tille JC, Nisato R, Skobe M (2003) Lymphangiogenesis
and tumor metastasis. Cell Tissue Res 314: 167-177
38. Irjala H, Alanen K, Grenman R, Heikkila P, Joensuu H, Jalkanen S
(2003) Mannose receptor (MR) and common lymphatic endothelial
and vascular endothelial receptor (CLEVER)-1 direct the binding of
cancer cells to the lymph vessel endothelium. Cancer Res 63: 4671-4676
39. Irrthum A, Devriendt K, Chitayat D, Matthijs G, Glade C, Steijlen PM,
Fryns JP, Van Steensel MA, Vikkula M (2003) Mutations in the tran-
scription factor gene SOX18 underlie recessive and dominant forms of
hypotrichosis-lymphedema-telangiectasia. Am J Hum Genet 72: 1470-
1478
40. Irrthum A, Karkkainen MJ, Devriendt K, Alitalo K, Vikkula M (2000)
Congenital hereditary lymphedema caused by a mutation that inacti-
vates VEGFR3 tyrosine kinase. Am J Hum Genet 67: 295-301
41. Dagenais SL, Hartsough RL, Erickson RP, Witte MH, Butler MG,
Glover TW (2004) Foxc2 is expressed in developing lymphatic vessels
and other tissues associated with lymphedema-distichiasis syndrome.
Gene Expr Patterns 4: 611-619
42. Ma GC, Liu CS, Chang SP, Yeh KT, Ke YY, Chen TH, Wang BB, Kuo
SJ, Shih JC, Chen M (2008) A recurrent ITGA9 missense mutation in
human fetuses with severe chylothorax: possible correlation with poor
response to fetal therapy. Prenat Diagn 28: 1057-1063
43. Alders M, Hogan BM, Gjini E, Salehi F, Al-Gazali L, Hennekam EA,
Holmberg EE, Mannens MM, Mulder MF, Offerhaus GJ, Prescott TE,
Schroor EJ, Verheij JB, Witte M, Zwijnenburg PJ, Vikkula M, Schul-
te-Merker S, Hennekam RC (2009) Mutations in CCBE1 cause general-
ized lymph vessel dysplasia in humans. Nat Genet 41: 1272-1274
Wyszukiwarka
Podobne podstrony:
więcej podobnych podstron