
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
MINISTERSTWO EDUKACJI
NARODOWEJ
Jolanta Łagan
Stosowanie podstawowych zasad toksykologii
311[02].Z3.01
Poradnik dla ucznia
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy
Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
1
Recenzenci:
mgr Urszula Ciosk-Rawluk
dr Robert Rochel
Opracowanie redakcyjne:
mgr Jolanta Łagan
Konsultacja:
mgr inż. Gabriela Poloczek
Poradnik stanowi obudowę dydaktyczn
ą
programu jednostki modułowej 311[02].Z3.01,
„Stosowanie podstawowych zasad toksykologii”, zawartego w modułowym programie
nauczania dla zawodu technik analityk.
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy, Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
2
SPIS TREŚCI
1.
Wprowadzenie
3
2.
Wymagania wstępne
5
3.
Cele kształcenia
6
4.
Materiał nauczania
7
4.1. Substancje chemiczne w ujęciu toksykologicznym
7
4.1.1. Materiał nauczania
7
4.1.2. Pytania sprawdzające
13
4.1.3. Ćwiczenia
14
4.1.4. Sprawdzian postępów
15
4.2. Zatrucia substancjami szkodliwymi
16
4.2.1. Materiał nauczania
16
4.2.2. Pytania sprawdzające
17
4.2.3. Ćwiczenia
18
4.2.4. Sprawdzian postępów
20
4.3. Elementy toksykometrii
21
4.3.1. Materiał nauczania
21
4.3.2. Pytania sprawdzające
25
4.3.3. Ćwiczenia
25
4.3.4. Sprawdzian postępów
26
4.4. Sposoby neutralizacji i likwidacji substancji szkodliwych
27
4.4.1. Materiał nauczania
27
4.4.2. Pytania sprawdzające
30
4.4.3. Ćwiczenia
30
4.4.4. Sprawdzian postępów
32
5. Sprawdzian osiągnięć
33
6. Literatura
38

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
3
1. WPROWADZENIE
Otrzymujesz do ręki Poradnik Stosowanie podstawowych zasad toksykologii, który
zawiera:
−
wymagania wstępne – wykaz umiejętności, jakie powinieneś mieć już ukształtowane,
−
cele kształcenia – wykaz umiejętności, jakie ukształtujesz podczas pracy z poradnikiem,
−
materiał nauczania zawierający wiadomości teoretyczne, umożliwiający samodzielne
przygotowanie się do wykonywanych ćwiczeń i zaliczenia sprawdzianu,
−
pytania sprawdzające wiedzę potrzebną do wykonania ćwiczenia,
−
ć
wiczenia, które pomogą ci zweryfikować wiadomości teoretyczne oraz ukształtować
umiejętności praktyczne,
−
sprawdzian postępów,
−
sprawdzian osiągnięć – zestaw pytań sprawdzających Twoje opanowanie wiedzy
i umiejętności z zakresu całej jednostki modułowej,
−
literaturę.
W materiale nauczania zostały omówione:
−
substancje chemiczne będące toksynami,
−
zatrucia powodowane substancjami szkodliwymi,
−
wybrane zagadnienia z zakresu toksykometrii,
−
sposoby neutralizacji i likwidacji substancji szkodliwych.
Przed przystąpieniem do wykonywania ćwiczeń zapoznaj się z pytaniami
sprawdzającymi, które pozwolą Ci ocenić stan Twojej wiedzy potrzebnej do wykonania
ć
wiczeń.
Kolejnym etapem poznania zagadnień z zakresu toksykologii będzie wykonanie ćwiczeń.
Po ich wykonaniu sprawdź poziom swoich postępów, odpowiadając na pytania zawarte
w sprawdzianie postępów. Poznane przez Ciebie wiadomości i umiejętności zostaną
zweryfikowane sprawdzianem osiągnięć, który zawiera:
−
instrukcję, w której omówiono tok postępowania podczas prowadzenia sprawdzianu,
−
zestaw pytań testowych,
−
przykładową kartę odpowiedzi, w której, w odpowiednich miejscach wpisz odpowiedzi
na pytania.
Jednostka modułowa Stosowanie podstawowych zasad toksykologii, której treść teraz
poznasz jest jednym z modułów koniecznych do zdobycia wiedzy z zakresu podstawowych
badań toksykologicznych – schemat 1.
Bezpieczeństwo i higiena pracy
W czasie pobytu w pracowni zobowiązany jesteś przestrzegać przepisów bezpieczeństwa
i higieny pracy oraz instrukcji przeciwpożarowych wynikających z rodzaju wykonywanych
ć
wiczeń. Przepisy te poznasz w trakcie nauki.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
4
Schemat układu jednostek modułowych
311[02].Z3
Podstawowe badania toksykologiczne
311[02].Z3.02
Badanie toksyn w środowisku
naturalnym i przemysłowym
311[02].Z3.01
Stosowanie podstawowych zasad
toksykologii
311[02].Z3.03
Badanie substancji toksycznych
w żywności i w środkach
codziennego użytku
311[02].Z3.04
Określanie wpływu leków
i substancji toksycznych
na organizm

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
5
2. WYMAGANIA WSTĘPNE
Przystępując do realizacji programu jednostki modułowej powinieneś umieć:
−
przestrzegać przepisów bezpieczeństwa i higieny pracy, ochrony przeciwpożarowej oraz
ochrony środowiska,
−
przestrzegać zasad dobrej techniki laboratoryjnej,
−
przestrzegać zasad bezpieczeństwa podczas badania analitycznego,
−
posługiwać się nomenklaturą związków nieorganicznych i organicznych,
−
określać właściwości fizyko – chemiczne substancji,
−
stosować stechiometrię do obliczeń chemicznych,
−
stosować obowiązujące jednostki układu SI,
−
sporządzać wykresy i interpretować wyniki,
−
sporządzać roztwory o określonym stężeniu,
−
przygotowywać próbki materiału do analizy,
−
przygotowywać sprzęt laboratoryjny, aparaturę, odczynniki,
−
korzystać z norm, przepisów, procedur i dostępnych instrukcji,
−
określać funkcje poszczególnych układów u człowieka.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
6
3. CELE KSZTAŁCENIA
W wyniku realizacji programu jednostki modułowej powinieneś umieć:
−
zdefiniować podstawowe pojęcia stosowane w toksykologii,
−
zdefiniować substancje toksyczne oraz określić ich właściwości i pochodzenie,
−
scharakteryzować mechanizm działania trucizn na organizmy żywe,
−
scharakteryzować czynniki wpływające na toksyczność substancji,
−
scharakteryzować drogi przenikania trucizn do organizmu,
−
pogrupować substancje toksyczne ze względu na ich pochodzenie i skutki działania,
−
zaprojektować sposoby neutralizacji i likwidacji trucizn oraz środków szkodliwych,
−
skorzystać ze źródeł informacji, norm i rozporządzeń dotyczących trucizn i substancji
niebezpiecznych,
−
wykonać obliczenia chemiczne niezbędne do przeprowadzenia analitycznych badań
substancji toksycznych.
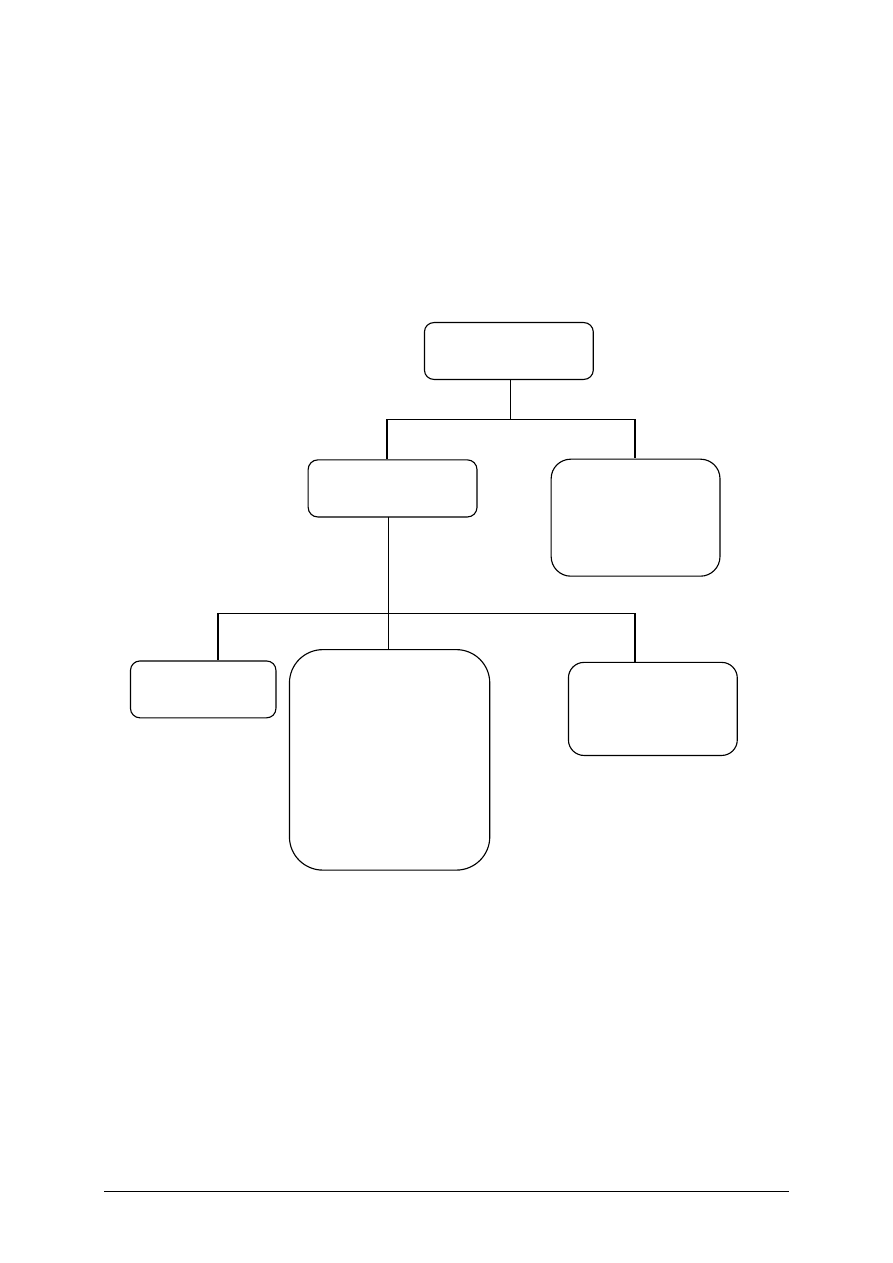
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
7
4. MATERIAŁ NAUCZANIA
4.1. Substancje chemiczne w ujęciu toksykologicznym
4.1.1. Materiał nauczania
Toksykologia jest nauką o truciznach. Ma charakter interdyscyplinarny. Rozwija się
w dwóch podstawowych kierunkach: teoretycznym i praktycznym.
Rys. 1. Podział toksykologii [opr. własne]
Substancje chemiczne to pierwiastki i ich związki występujące w przyrodzie lub
uzyskiwane w procesie produkcyjnym. Substancje niebezpieczne, to substancje stwarzające
zagrożenie dla człowieka lub dla środowiska.
Zadaniem
toksykologii jest rozpoznanie charakteru substancji chemicznej stanowiącej
niebezpieczeństwo dla zdrowia, środowiska naturalnego i środowiska pracy.
Możemy zakwalifikować je do co najmniej jednej z następujących kategorii:
−
bardzo toksyczne,
−
toksyczne,
−
szkodliwe,
−
ż
rące,
−
drażniące,
TOKSYKOLOGIA
Szczegółowa:
–
metali
i rozpuszczalników,
–
ś
rodków ochrony
roślin,
–
tworzyw sztucznych,
–
ś
rodków
gospodarstwa
domowego,
–
związków
promieniotwórczych.
Teoretyczna
Stosowana:
–
kliniczna,
–
sądowo-
lekarska,
–
doświadczalna.
Ogólna
Doświadczalna:
–
ś
rodowiskowa,
–
przemysłowa,
–
ż
ywności.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
8
−
uczulające,
−
rakotwórcze,
−
mutagenne,
−
działające szkodliwie na rozrodczość,
−
niebezpieczne dla środowiska.
Substancje chemiczne występują w postaci gazów, par, cieczy lub ciał stałych.
W grupie substancji szkodliwych wyróżniamy: metale, gazy, rozpuszczalniki organiczne,
pestycydy,
wielopierścieniowe
węglowodory
aromatyczne
(WWA),
nitrozoaminy,
polichlorowane bifenyle (PCB).
Metale i kationy metali
Substancje te wprowadzone do środowiska podlegają biologicznej kumulacji, a następnie
spożywane są przez człowieka w różnych produktach roślinnych i zwierzęcych. Występujące
w organizmie błony biologiczne pozwalają na ochronę organizmu przed dużym stężeniem.
Nadmierne ilości metali ciężkich: chromu, kobaltu, arsenu, niklu, kadmu, rtęci i ich kationów
oraz pierwiastków promieniotwórczych, kumulują się w narządach, skórze i tkankach. Grupy
funkcyjne substancji białkowych z jonami metali, tworzą połączenia metaloorganiczne, które
wykazują działanie toksyczne. Przykłady kumulacji metali w organizmie przedstawia
poniższa tabela.
Tabela 1.
Tkanki i narządy ssaków akumulujące pierwiastki śladowe [2, s. 220]
Pierwiastek
Tkanki, narządy
As
wątroba, nerki, skóra, włosy, paznokcie
B
mózg
Ba
skóra, płuca, kości, zęby
Be
kości, zęby, wątroba
Bi
nerki, płuca
Cd
kora nerkowa, wątroba, kości
Co
wątroba, nerki
Cr
nerki, rdzeń pacierzowy, kości, mięśnie
Cu
wątroba, nerki, serce, mózg, jądra
F
kości, zęby
Fc
erytrocyty, wątroba, śledziona, szpik kostny
Hg
nerki, tarczyca, przysadka mózgowa
I
tarczyca, ślinianki, mięsnie gałki ocznej
Mn
trzustka, wątroba, nerki
Mo
wątroba, nerki, zęby, kości
Ni
gruczoły limfatyczne, żeby, kości
Pb
kości, aorta, nerki, wątroba, mózg
Rb
wątroba, mięśnie
Se
mięśnie
Si
płuca, skóra
Sb
nerki, włosy
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
9
Sn
jądra
Sr
kości, aorta, jądra, gruczoł krokowy
Ti
płuca, skóra
V
płuca, kości, tkanka tłuszczowa
W
nerki, wątroba, gruczoły limfatyczne
Zn
nerki, wątroba, gruczoł krokowy, włosy, paznokcie
Gazy
Szkodliwe gazy rozprzestrzeniają się niekontrolowanie. Stanowią duże zagrożenie dla
zdrowia człowieka. Mogą być surowcami w procesach technologicznych i produktami
ubocznymi. Wywołują różne, w zależności od właściwości fizykochemicznych i czasu
działania na organizm, skutki.
Ze względu na toksyczność, dzielimy gazy na:
−
gazy duszące fizycznie: azot, argon, hel, wodór,
−
gazy trujace: tlenek węgla, siarkowodór,
−
gazy drażniące: amoniak, tlenki azotu, tlenek siarki(IV), ozon.
Rozpuszczalniki organiczne
Stosowane są do rozpuszczania substancji i w syntezie chemicznej. Znalazły
zastosowanie do gaszenia pożarów, dezynfekcji, jako materiał pędny, środki chroniące przed
zimnem. Są to różnorodne związki, pod względem chemicznym: węglowodory alifatyczne,
ketony, alkohole, glikole, etery, estry, węglowodory chlorowane oraz disiarczek węgla.
Działają toksycznie na skórę, mogą ulegać kumulacji w tkance tłuszczowej. Ich zdolność
rozpuszczania może ułatwić wchłanianie innych związków.
Pestycydy
Służą do zwalczania, zapobiegania rozwojowi organizmów roślinnych i zwierzęcych
niszczących produkty rolne i do regulacji wzrostu roślin. Niszczą dokuczliwe owady
pojawiające się w gospodarstwie domowym i rolnictwie.
Wyodrębniamy następujące grupy:
Tabela 2.
Podział pestycydów [opr. własne]
Grupa
Rodzaj
Przeznaczenie
zoocydy
insektycydy
rodentycydy
akarycydy,
nematocydy
moluskocydy
limacydy
owicydy
aficydy
−
owadobójcze
−
gryzoniobójcze
−
roztoczobójcze
−
nicieniobójcze
−
zwalczania mięczaków
−
do zwalczania ślimaków
−
ś
rodki
zabójcze
dla
jaj
owadów i roztoczy
−
ś
rodki przeciw mszycom
herbicydy
defolianty
desykanty
defloranty
−
ś
rodki do usuwania zbędnych
liści
−
ś
rodki do wysuszania listowia
przed mechanicznym zbiorem
−
ś
rodki do usuwania
nadmiernej ilości kwiatów
fungicydy
−
−
grzybobójcze
fumiganty
−
−
ś
rodki do gazowania
atraktanty
−
−
ś
rodki zwabiające
repelenty
−
−
odstraszające
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
10
Pestycydy mają zróżnicowaną budowę chemiczną, posiadają zróżnicowane właściwości
fizykochemiczne i charakteryzują się różną trwałością. Stosowanie pestycydów doprowadza
do wielu skutków ubocznych: skażenia ekosystemów, pozostałości w żywieniu, kumulują się
w ogniwach łańcucha pokarmowego. Wchodzą w interakcje z lekami i metalami ciężkimi.
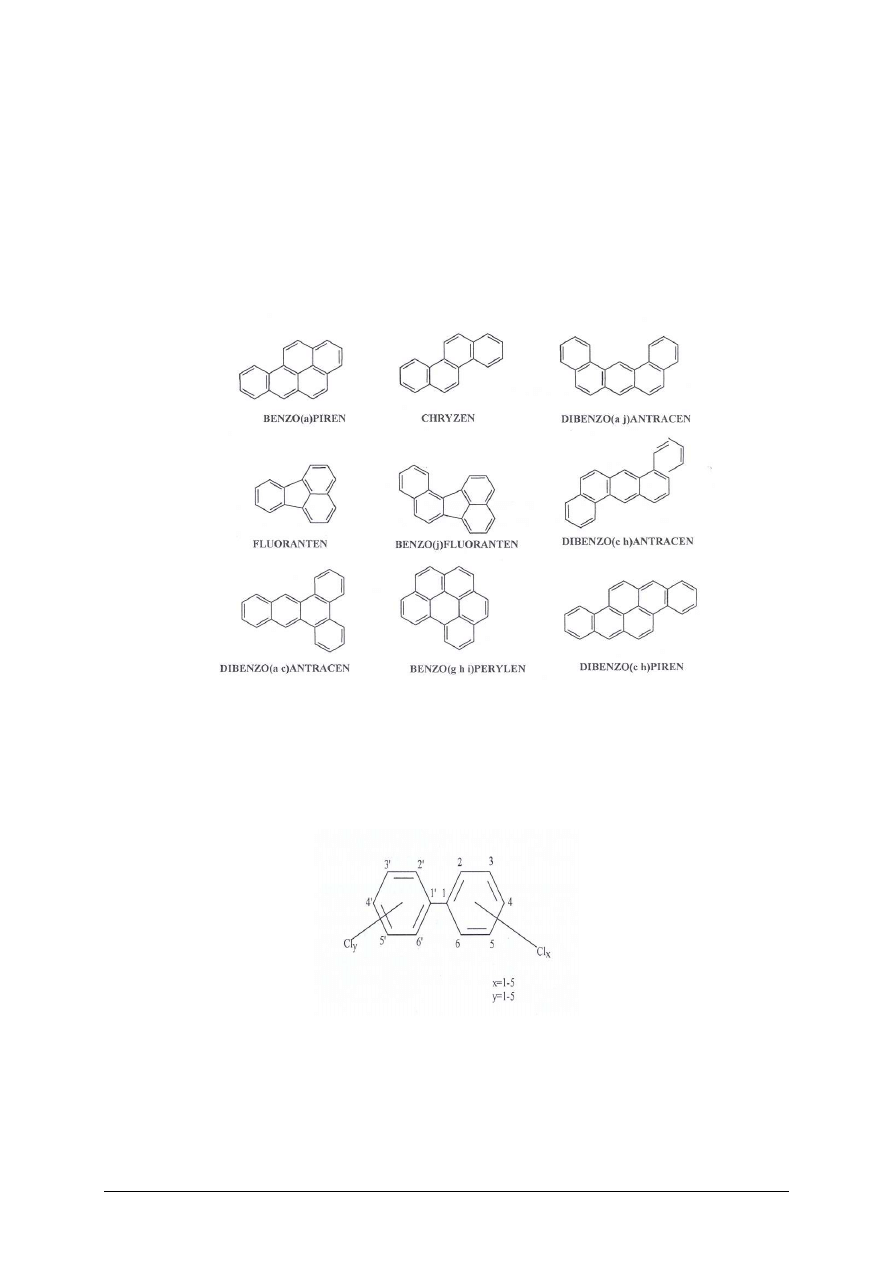
Wielopierścieniowe węglowodory aromatyczne (WWA)
Stanowią grupę kilkudziesięciu związków zawierających w cząsteczce od 2 do 13
skondensowanych pierścieni benzenowych. Powstają podczas niepełnego spalania związków
organicznych oraz pod wpływem mikroorganizmów glebowych.
Przedstawicielami WWA są:
Rys. 2.
Przykłady WWA [2, s. 267]
Wielopierścieniowe węglowodory aromatyczne do organizmu przedostają się przez układ
oddechowy, pokarmowy i skórę przy bezpośrednim kontakcie ze skórą. Wykazują działanie
mutagenne i rakotwórcze.
Polichlorowane bifenyle (PCB)
Są to związki o różnej zawartości chloru i wzorze ogólnym:
Rys. 3. Ogólny wzór polichlorowanych bifenyli [2, s. 272]
Do organizmu dostają się przez płuca, skórę, przewód pokarmowy. Kumulują się
w tkance tłuszczowej, mózgu i wątrobie. Mają tendencję przechodzenia przez łożysko kobiety
ciężarnej i z mlekiem matki mogą dostawać się do organizmu dziecka. Bifenyle z mniejszą
ilością atomów chloru w cząsteczce szybciej ulegają reakcjom w ustroju niż bifenyle
o większej liczbie atomów chloru.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
11
Istnieje również podział na toksykologię kliniczną, która zajmuje się wpływem leków
i trucizn na organizmy ludzkie.
Toksyny chemiczne dzielimy na:
a)
neurotoksyny: metale i związki metali, np.: ołowiu, talu, telluru, rtęci i manganu,
b)
nefrotoksyny:
−
metale ciężkie: rtęć, kadm, ołów, chrom,
−
chlorowcopochodne
węglowodorów:
tetrachlorek
węgla,
chloroform,
heksachlorobutadien, bromobenzen,
−
hepatoksyny: metale, związki organiczne, leki, pary lotnych chlorowanych
węglowodorów.
Długotrwałe narażenie substancjami chemicznymi może spowodować niekontrolowany
wzrost komórek prowadzący do zmian nowotworowych.
Substancje rakotwórcze i mutagenne ujmuje się w trzech kategoriach.
Tabela 3. Podział substancji niebezpiecznych [opr. wlasne]
Substancje niebezpieczne (Rozporządzenia Ministra Zdrowia z dnia 02.09.2003r)
Rakotwórcze
Mutagenne
Kategoria1 – substancje o udowodnionym działaniu
rakotwórczym dla człowieka
Kategoria 2 – substancje, które rozpatruje się jako
rakotwórcze dla człowieka
Kategoria 3 – substancje o możliwym działaniu
rakotwórczym na człowieka
Kategoria1 – substancje o udowodnionym działaniu
mutagennym dla człowieka
Kategoria 2 – substancje, które rozpatruje się jako
mutagenne dla człowieka
Kategoria 3 – substancje o możliwym działaniu
mutagennym dla człowieka
Substancje
chemiczne
sklasyfikowano
biorąc
pod
uwagę
ich
właściwości
fizykochemiczne:
−
o właściwościach wybuchowych (E); powodujące zagrożenie wybuchem wskutek
uderzenia, tarcia lub oddziaływania ognia,
−
o właściwościach utleniających (O); w kontakcie z materiałami palnymi mogą
spowodować pożar,
−
skrajnie łatwo palne (F); ciecze o temperaturze zapłonu poniżej 0
°
C i temperaturze
wrzenia
≤
35
°
C oraz gazy palne w warunkach normalnych (0
°
C, 1013 hPa),
−
wysoce łatwo palne (F); mogące rozgrzać się i zapalić w kontakcie z powietrzem
w temperaturze otoczenia bez dopływu energii,
−
łatwo palne; ciecze o temperaturze zapłonu w zakresie od 21 do 100
°
C,
−
bardzo toksyczne (T +); toksyczne (T) i szkodliwe (Xn) w przypadku spożycia,
w przypadku kontaktu ze skórą, w razie narażenia drogą oddechową,
−
o właściwościach żrących (C); wywołujące oparzenia,
−
o właściwościach drażniących (Xi); powodujące zapalenia skóry lub błon śluzowych,
działające drażniąco na oczy, na układ oddechowy,
−
powodujące uczulenia (Xn); poprzez drogę oddechową w przypadku kontaktu ze skórą,
−
rakotwórcze (T); mogące być przyczyną powstawania nowotworu(ów),
−
mutagenne (T lub Xn); mogące powodować dziedziczne uszkodzenia genetyczne,
−
teratogenne (T); mogące działać szkodliwie na płód,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
12
−
działające szkodliwie na rozrodczość (T); mogące upośledzić płodność,
−
niebezpieczne dla środowiska naturalnego (N); działające toksycznie na organizmy
wodne, rośliny, na zwierzęta, na organizmy żyjące w glebie, mogące wywołać długo
utrzymujące się szkodliwe zmiany w środowisku, stwarzające zagrożenia dla warstwy
ozonowej.
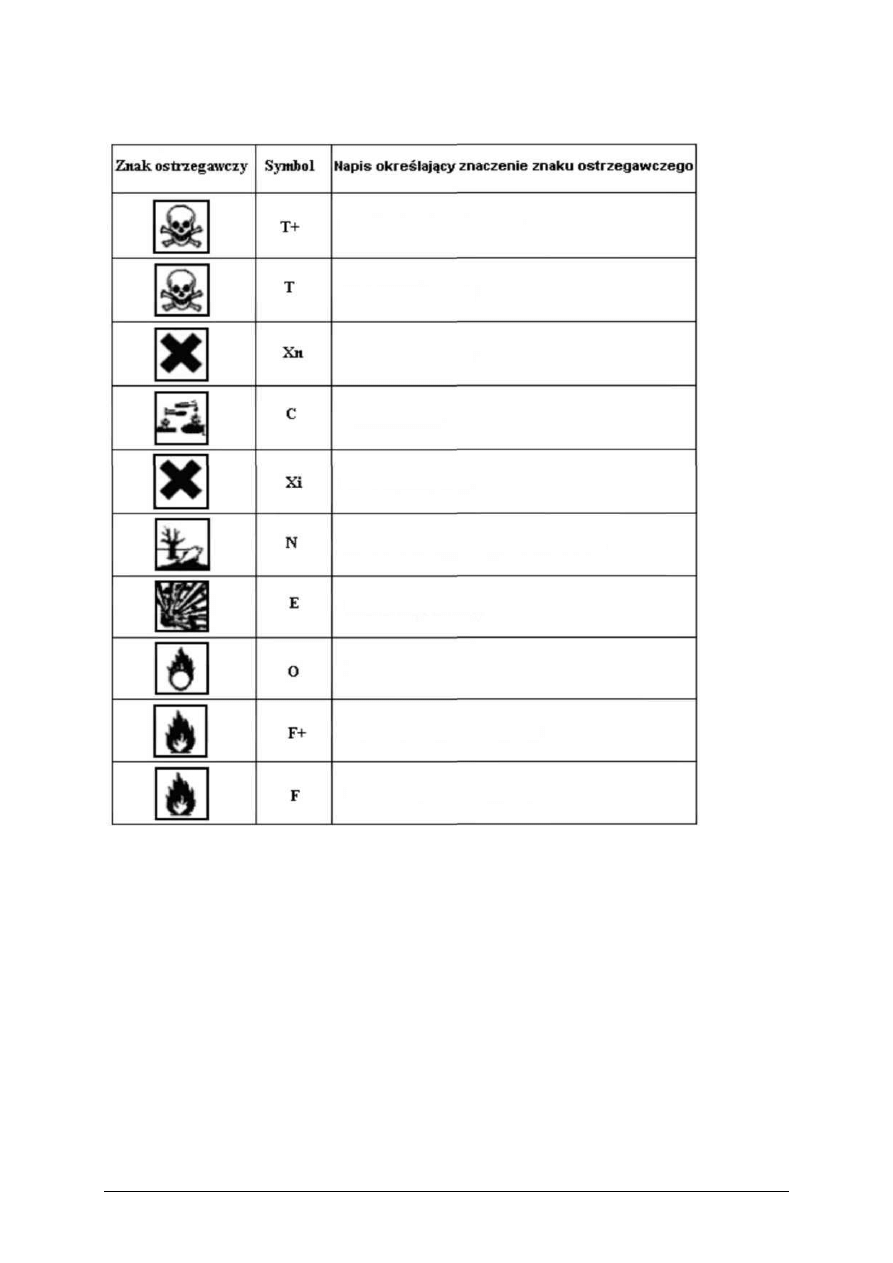
W chemii stosuje się odpowiednie oznakowania graficzne (piktogramy), które
przedstawia tabela 4.
Organizm człowieka w wielu sytuacjach narażony jest na działanie dwóch lub większej
ilości substancji chemicznych. Toksyczne oddziaływanie na organizm może być:
−
niezależne, gdy substancje charakteryzują się różnymi mechanizmami działania
i w związku z tym wywołują różne efekty. Łączny efekt działania pozostaje taki sam jak
w przypadku narażenia na każdą z tych substancji osobno (1+ 2 = 1 +2),
−
sumujące się (addytywne), gdy substancje wykazują taki sam mechanizm działania,
a wielkość efektu jest ilościowo równa sumie efektów powodowanych przez każdą
substancję oddzielnie (1 + 2 = 2),
−
synergistyczne, gdy następuje nasilenie działania toksycznego jednej substancji przez
inną substancję (1+ 2 = 4),
−
wzmożone (potencjalizacja), gdy substancja chemiczna nie wywołuje sama efektu
szkodliwego, lecz wzmaga szkodliwe działania innej substancji (0 + 1 = 2),
−
antagonistyczne, gdy następuje osłabienie lub zniesienie toksycznego działania
określonej substancji przez inną substancję (1+ 1 = 0).
Formą przedstawienia wiadomości o substancjach są Karty Charakterystyk. Każda
zawiera informacje ujęte w punkty:
1.
Identyfikacja substancji/preparatu. Identyfikacja producenta, importera lub dystrybutora.
2.
Skład i informacja o składnikach.
3.
Identyfikacje zagrożeń.
4.
Pierwsza pomoc.
5.
Postępowanie w przypadku pożaru.
6.
Postępowanie w przypadku niezamierzonego uwolnienia do środowiska.
7.
Postępowanie z substancją/preparatem i jej/jego magazynowanie.
8.
Kontrola narażenia i środki ochrony indywidualnej.
9.
Właściwości fizykochemiczne.
10.
Stabilność i reaktywność.
11.
Informacje toksykologiczne.
12.
Informacje ekologiczne.
13.
Postępowanie z odpadami.
14.
Informacje o transporcie.
15.
Informacje dotyczące przepisów prawnych.
16.
Inne informacje.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
13
Tabela 4. Znaki graficzne substancji niebezpiecznych [1, s. 53]
4.1.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1.
W jakim stanie skupienia występują substancje szkodliwe?
2.
Co rozumiesz pod pojęciem toksyna?
3.
Jakie grupy związków chemicznych należą do toksyn?
4.
Z jakich grup związków chemicznych są substancje będące toksynami?
5.
Jakie zastosowane mają pestycydy?
6.
Jakie znasz grupy pestycydów?
7.
Jakie kryteria stosujemy do klasyfikacji substancji rakotwórczych i mutagennych?
8.
Jaką klasyfikację stosujemy dla substancji chemicznych biorąc za kryterium podziału ich
niebezpieczne właściwości?
9.
Jakie może być oddziaływanie toksykologiczne dwóch substancji szkodliwych?
10.
Jakie informacje o substancji chemicznej można odczytać z jej Karty Charakterystyki?
Produkt bardzo toksyczny
Produkt toksyczny
Produkt szkodliwy
Produkt żrący
Produkt drażniący
Produkt niebezpieczny dla środowiska
Produkt wybuchowy
Produkt utleniający
Produkt skrajnie łatwopalny
Produkt wysoce łatwopalny

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
14
4.1.3. Ćwiczenia
Ćwiczenie 1
Z podanej grupy kart nazw, wzorów, toksyn, grup substancji i związków chemicznych
wybierz neurotoksyny, nefrotoksyny i hematoksyny.
Nazwy związków i substancji chemicznych: metanol, bromobenzen, tellur,
tetrachlorometan, kadm.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
wybrać z kolekcji kart nazwy, wzory substancji chemicznych, grupy związków
chemicznych i rodzaje toksyn,
2)
przyporządkować nazwie substancji chemicznej wzór (symbol),
3)
zaliczyć związek chemiczny do grupy,
4)
zaszeregować daną substancję chemiczną do toksyny,
5)
uzupełnić tabelę,
6)
dokonać oceny poprawności wykonanego ćwiczenia.
Grupa związku
chemicznego
Nazwa chemiczna
związku
Wzór (symbol
chemiczny)
Toksyna chemiczna
Wyposażenie stanowiska pracy:
−
szablony,
−
kalendarz chemiczny,
−
układ okresowy pierwiastków,
−
Karty Charakterystyk substancji niebezpiecznych,
−
tabela do uzupełnienia.
Ćwiczenie 2
Wykonaj pomiar stężenia jonów fluorkowych w wodzie wodociągowej metodą
potencjometryczną za pomocą elektrody jonoselektywnej.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
zorganizować stanowisko pracy zgodnie z wymaganiami bezpieczeństwa i higieny pracy,
2)
sporządzić roztwór buforowy,
−
odważyć 4,6 g octanu amonu, 58 g chlorku sodu, 174 g cytrynianu sodu, do zlewki
napełnionej około 500 cm
3
wody destylowanej przenieść odważone ilości substancji
i rozpuścić,
−
doprowadzić roztwór do pH 5,9–6,0 za pomocą lodowatego kwasu octowego,
−
przenieść otrzymany roztwór do kolby miarowej o objętości 1 dm
3
,
−
uzupełnić kolbę wodą destylowaną do objętości 1 dm
3
,
3)
sporządzić podstawowy roztwór wzorcowy fluorku sodu NaF:
−
odważyć 0,1105 g fluorku sodu (świeżo wyprażony),

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
15
−
przenieść ilościowo odważoną substancję do kolby miarowej o pojemności 50 cm
3
i dopełnić wodą destylowaną do kreski,
−
roztwór wymieszać (cm
3
roztworu zawiera 1mg jonu fluorkowego),
4)
sporządzić roboczy roztwór wzorcowy fluorku sodu NaF:
−
odmierzyć 1 cm
3
podstawowego roztworu wzorcowego do kolby miarowej na
100 cm
3
i dopełnić wodą destylowaną do kreski,
−
roztwór wymieszać (1 cm
3
roztworu zawiera 0,01 mg jonu fluorkowego)
5)
wykonać oznaczenie:
−
przygotować roztwory do sporządzenia krzywej wzorcowej,
−
pobrać do sześciu kolbek miarowych o pojemności 50 cm
3
kolejno: 0,5; 1,0; 2,5; 5,0;
10,0 i 25,0 cm
3
roboczego wzorcowego roztworu fluorku sodu NaF,
−
dopełnić kolbki wodą destylowaną do kreski i wymieszać (stężenia w kolejnych
kolbkach wynoszą 0,1; 0,2; 0,5; 1,0; 2,0; 5,0 mg/dm
3
),
−
przenieść każdy z przygotowanych roztworów do zlewki (100 cm
3
), dodać do każdej
zlewki po 10 cm
3
roztworu buforowego,
−
przygotować aparaturę do pomiaru,
−
wykonać pomiar pH i SEM dla kolejnych roztworów,
−
sporządzić krzywą wzorcową SEM = f(lg c
F−
),
−
wykonać pomiary dla roztworu o nieznanym stężeniu,
−
pobrać do trzech zlewek (100 cm
3
) 50 cm
3
próbki,
−
dodać do każdej zlewki 10 cm
3
buforu,
−
dokonać pomiaru pH i SEM dla każdej próbki,
−
obliczyć średnią arytmetyczną dla trzech wykonanych pomiarów badanej próbki,
−
z krzywej wzorcowej odczytać zawartość jonów fluorkowych w mg/dm
3
i porównać
wyniki z wartościami zawartymi w normie,
6)
dokonać neutralizacji odczynników i uporządkować stanowisko pracy.
Wyposażenie stanowiska pracy:
−
szkło laboratoryjne: zlewki (100 cm
3
), kolby miarowe (50 cm
3
), pipety (1 cm
3
, 5 cm
3
,
10 cm
3
, 25 cm
3
),
−
pH – metr wraz z wyposażeniem,
−
odczynniki: roztwór buforowy, wzorcowy roztwór fluorku sodu, roboczy roztwór
wzorcowy fluorku sodu, woda destylowana pozbawiona węglanów,
−
przybory do opracowania wykresów lub program komputerowy,
−
Polska Norma PN 78/C – 04588.
4.1.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1)
wymienić nazwy metali o działaniu toksycznym?
2)
scharakteryzować grupy pestycydów?
3)
wymienić nazwy trzech grup toksyn klinicznych?
4)
zinterpretować symbole zagrożenia substancjami chemicznymi?
5)
określić, jakie oddziaływanie toksykologiczne mogą wykazywać
dwie toksyny?
6)
wyjaśnić oznakowanie literowe substancji niebezpiecznych?
7)
wymienić jakie informacje dotyczące substancji szkodliwej zawiera
karta charakterystyki substancji?
8)
określić metodę oznaczania jonów fluorkowych w wodzie?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
16
4.2.
Zatrucia substancjami szkodliwymi
4.2.1. Materiał nauczania
Do organizmu człowieka wprowadzane są dwa podstawowe typy substancji:
−
korzystne dla organizmu (pokarm, leki),
−
szkodliwe (wywołujące niepożądane zmiany w organizmie i śmierć).
Skutki działania toksyny zależą od dawki.
W zależności od wywołanych przez substancję skutków wyróżniamy dawki:
−
graniczną (progową) – to ilość substancji, która wywołuje pierwsze spostrzegalne skutki
biologiczne,
−
leczniczą – wykazująca działanie farmakoterapeutyczne i nie wywołująca zaburzeń
procesów fizjologicznych,
−
toksyczną – wywołująca objawy zatrucia oraz odwracalne zaburzenia czynnościowe
organizmu,
−
ś
miertelną – powodująca uszkodzenia nieodwracalne i śmierć organizmu. Dawka jest
miarą substancji wprowadzonej (mg) lub masą substancji przypadającej na jednostkę
masy ciała (mg/kg).
Zatruciem nazywamy proces chorobowy, przebiegający z klinicznym objawem,
wywołanym przez substancję chemiczną. Ze względu na przebieg, działanie oraz
mechanizmy dzielimy je na:
−
zatrucia ostre, charakteryzują się szybkim rozwojem szkodliwych zmian w organizmie,
powstających w ciągu krótkiego czasu po wprowadzeniu jednorazowej dawki trucizny
dożołądkowo, inhalacyjnie lub po naniesieniu na skórę,
−
zatrucia podostre, szkodliwe zmiany w organizmie występują w sposób mniej gwałtowny
po podaniu jednorazowej lub kilkakrotnej dawki,
−
zatrucia przewlekłe powstają wskutek działania małych dawek trucizny podawanych
przez dłuższy okres.
Reakcje organizmu na wnikanie związków toksycznych zależą od:
−
właściwości fizykochemicznych,
−
drogi wchłaniania,
−
dawki,
−
płci,
−
wieku,
−
stanu immunologicznego,
−
stanu genetycznego,
−
ogólnego stanu zdrowia,
−
odżywiania.
Wpływ mają również: czynniki zewnętrzne, temperatura, okres narażenia, wilgotność
powietrza.
Zatrucia występujące u ludzi dzielimy na:
−
zatrucia rozmyślne (samobójcze lub mordercze),
−
zatrucia przypadkowe.
Najczęściej występujące objawy zatruć zestawiono w tabeli 5.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
17
Tabela 5. Objawy zatruć występujące w organach
Narząd/Układ
Objawy
skóra i błony śluzowe
sinica, nadżerki, oparzenia, wzmożona potliwość
oczy (źrenice)
rozszerzenie/zwężenie źrenic, zaburzenia widzenia,
ś
lepota
układ nerwowy
senność, śpiączka, zaburzenia świadomości
układ oddechowy
skurcze oskrzeli, obrzęk płuc, porażenie ośrodka
oddechowego
układ krążenia
przyspieszenie czynności pracy serca, zwolnienie pracy
serca, zaburzenie rytmu pracy serca
nerki
uszkodzenie, mocznica
przewód pokarmowy
nudności, wymioty, bóle brzucha, biegunka
Tabela 6. Objawy zatrucia etanolem
Stężenie etanolu [‰ ]
Spostrzegalne objawy
0,1 – 0,5
zaburzenia ze strony układu nerwowego
0,5 – 1,0
osłabienie ostrości wzroku, zakłócenia szybkości reakcji
1,0 – 1,5
euforia, wydłużający się czas reakcji, zaburzenia koordynacji ruchowej
1,5 – 2,0
zaburzenia równowagi i koordynacji ruchowej
2,0 – 2,5
upojenie alkoholowe
2,5 – 3,0
zamroczenie alkoholowe
> 3,5
ś
piączka, zaburzenia krążeniowo–oddechowe
Tabela 7. Objawy zatrucia tlenkiem węgla
% HbCO
we krwi
Objawy
Stopień zatrucia
0 – 10
brak objawów
−
10 – 30
bóle i zawroty głowy, przyspieszone bicie serca, nierównomierny oddech
lekkie
30 – 50
przyspieszenie tętna i oddechu, zaburzenia pracy serca, sinica
ś
rednio ciężkie
50 – 80
niewydolność sercowo-oddechowa, śpiączka lub zgon
ciężkie
Substancje obce (ksenobiotyki) ulegają w organizmie różnorodnym przemianom
biochemicznym – biotransformacji.
Przemiany te przebiegają w organizmie w dwóch fazach:
−
pierwsza faza (utlenianie, redukcja, hydroliza),
−
druga faza (sprzęganie).
Biotransformacja ksenobiotyków zachodzi przy udziale enzymów. W wyniku tego
procesu powstają metabolity o różnej aktywności biologicznej. W przypadku tworzenia się
produktów o słabym działaniu toksycznym lub nieczynnym biologicznie zachodzi proces
detoksykacji.
Objawy zatruć etanolem i tlenkiem węgla przedstawiono w tabelach 6 i 7.
4.2.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1.
Co to jest zatrucie?
2.
Jakie znasz rodzaje zatruć występujących u ludzi?
3.
Jak klasyfikujemy zatrucia ze względu na przebieg działania?
4.
Jakie znasz objawy zatrucia przewodu pokarmowego?
5.
Jakie organy (układy) narażone są na działanie toksyn?
6.
Jakie czynniki wpływają na zatrucia organizmu?
7.
Co nazywamy biotransformacją trucizn?
8.
W jakich jednostkach jest wyrażana dawka?
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
18
4.2.3. Ćwiczenia
Ćwiczenie 1
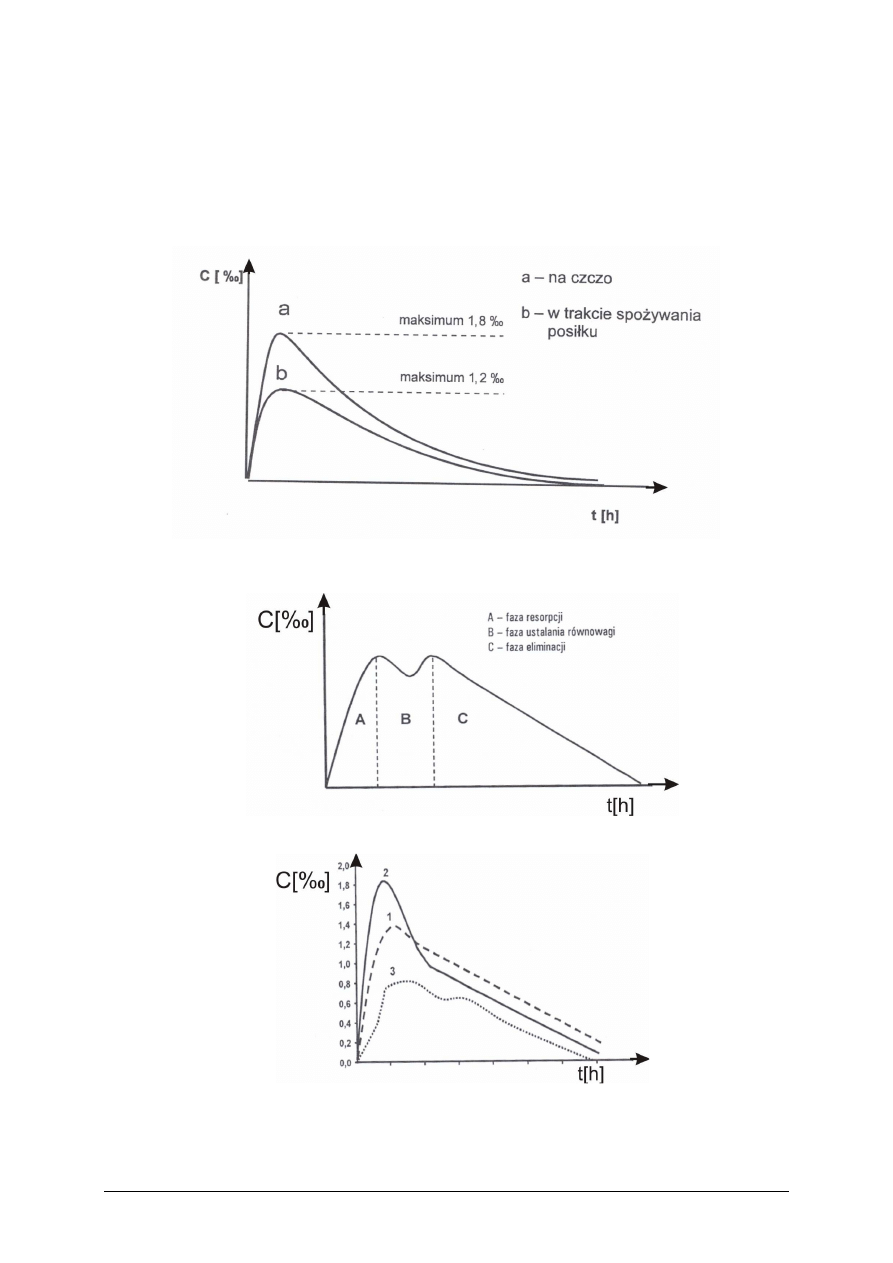
Korzystając z Kart Charakterystyk i krzywych alkoholowych oceń i porównaj działanie
alkoholu metylowego i etylowego na organizm człowieka.
Rysunek 1 do ćwiczenia 1. Przebieg zmian stężenia etanolu we krwi
po spożyciu napojów alkoholowych [2, s. 125 ]
Rysunek 2 do ćwiczenia 1. Krzywa alkoholowa [2, s. 126 ]
Rysunek 3 do ćwiczenia 1. Podstawowe typy krzywych alkoholowych [2, s. 126]

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
19
Krzywa 1 – Przebieg zmian stężenia alkoholu we krwi przy spożyciu napojów
alkoholowych w niewielkich ilościach o niskim stężeniu gdy żołądek wypełniony jest
nieznaczną ilością pokarmu.
Krzywa 2 – Przebieg zmian stężenia alkoholu we krwi po szybkim spożyciu napoju
alkoholowego, jeżeli w żołądku brak treści pokarmowych.
Krzywa 3 – Przebieg zmian stężenia alkoholu we krwi przy spożyciu napojów
alkoholowych rozciągniętym w czasie i żołądku wypełnionym treścią pokarmową.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
wybrać spośród Kart Charakterystyk te, które dotyczą C
2
H
5
OH i CH
3
OH,
2)
odnaleźć w karcie w/w substancji wartości liczbowe dawki toksycznej,
3)
porównać wartości dawek,
4)
scharakteryzować działanie alkoholi na organizm człowieka,
5)
zinterpretować przebieg krzywych i zaprezentować otrzymane wyniki,
6)
wyciągnąć wnioski dotyczące wpływu alkoholi na organizm człowieka.
Wyposażenie stanowiska pracy:
−
Karty Charakterystyk Substancji,
−
krzywe alkoholowe.
Ćwiczenie 2
Oznacz jony szczawianowe C
2
O
4
2-
w herbacie metodą redoksymetryczną.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
zorganizować stanowisko pracy zgodnie z wymaganiami bezpieczeństwa i higieny pracy,
2)
sporządzić roztwory:
−
odważyć trzy próbki herbaty po 10 g,
−
zalać każdą porcję herbaty 100 cm
3
wrzącej wody destylowanej,
−
zaparzać przez 5 minut,
−
zdekantować napar do kolby stożkowej,
−
pobrać po 10 cm
3
naparu do trzech kolb stożkowych,
3)
dodać do każdej kolby 5 cm
3
acetonu i 10 cm
3
CaCl
2
,
4)
wstawić kolby do lodówki,
5)
zlać płyn znad osadu po 30 minutach, a osad rozpuścić w 5 cm
3
kwasu siarkowego,
6)
ogrzewać kolby przez 2 minuty w łaźni wodnej,
7)
miareczkować na gorąco mianowanym roztworem KMnO
4
do uzyskania barwy żółtej
utrzymującej się około 1 minuty,
8)
powtórzyć czynności dla kolejnych próbek,
9)
obliczyć zawartość rozpuszczonego kwasu szczawiowego (na 100 g suchej masy herbaty
i 25 cm
3
naparu), przy założeniu, że 1 cm
3
roztworu 0,0040 mol/dm
3
KMnO
4
odpowiada
0,9 mg kwasu szczawiowego,
10)
zapisać równania zachodzących reakcji podczas wykonywanej analizy:
−
równanie reakcji powstawania szczawianu wapnia CaC
2
O
4
,
−
równanie reakcji szczawianu wapnia z kwasem siarkowym(VI),
−
równanie reakcji redoks kwasu szczawiowego z manganianem(VII)potasu
w środowisku kwasu siarkowego(VI),

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
20
11)
dokonać oceny klinicznej wpływu kwasu szczawiowego na stan zdrowia pacjenta
korzystając z dostępnej literatury,
12)
dokonać neutralizacji odczynników i zlikwidować stanowisko pracy.
Wyposażenie stanowiska pracy:
−
szkło laboratoryjne: cylinder, zlewki, kolbki stożkowe, pipeta, biureta, lejek do biurety,
−
sprzęt laboratoryjny: łapa do biurety, gruszka, tryskawka,
−
odczynniki:
aceton,
roztwór 5% chlorek wapnia,
roztwór 0,5 mol/dm
3
kwas siarkowy(VI),
roztwór 0,004 mol/dm
3
manganian(VII) potasu (0,632 g KMnO
4
w 1 dm
3
roztworu),
woda destylowana bez węglanów,
próbka herbaty,
−
literatura.
4.2.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1)
określić pojęcie zatrucie?
2)
zdefiniować pojęcie dawki?
3)
wymienić przykłady zatruć?
4)
scharakteryzować objawy zatrucia układu krążenia?
5)
określić organy (układy) organizmu narażone na zatrucia?
6)
określić istotę biotransformacji?
7)
scharakteryzować objawy zatrucia etanolem?
8)
scharakteryzować objawy zatrucia tlenkiem węgla?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
21
4.3. Elementy toksykometrii
4.3.1. Materiał nauczania
Toksykometria ocenia toksyczność substancji chemicznych. Celem jest ustalenie rodzaju
biologicznych skutków działania substancji na organizm człowieka.
Operuje pojęciami:
−
toksyczność – zdolność do wywołania uszkodzeń,
−
skutek biologiczny – odwracalna i mierzalna zmiana,
−
skutek szkodliwy – nieodwracalna zmiana,
−
narażenie – fizyczny kontakt organizmu z substancją chemiczną,
−
dawka – ilość substancji (mg/kg),
−
dawkowanie – wielkość dawki,
−
odpowiedź – skutek działania substancji chemicznej,
−
dawka – efekt – zależność między dawką a wielkością zmian biologicznych,
−
dawka – odpowiedź – zależność między dawką a skutkiem biologicznym w grupie
populacji.
Celem oceny toksyczności jest ilościowe określenie wartości dawki. Używa się:
LD
50
– dawka, która wywołuje zmiany ze skutkiem szkodliwym (śmiertelnym).
LC
50
– medialne stężenie śmiertelne.
W toksykologii przemysłowej wprowadzono normowanie substancji szkodliwych dla
zdrowia. Pozwala to na określenie poziomu akceptowalnego ryzyka zawodowego związanego
z narażeniem pracowników, NDS (najwyższe dopuszczalne stężenie).
Wartość NDS ustala się jako prawnie obowiązujące w naszym kraju.
NDS jest to średnie stężenie ważone czasem, którego oddziaływanie na pracownika w ciągu
8 godzin dobowego i 40 – godzinnego tygodniowego wymiaru czasu pracy przez okres jego
aktywności zawodowej nie powinno spowodować zmian w stanie zdrowia jego i przyszłych
pokoleń – zgodnie z Rozporządzeniem Ministra Pracy i Polityki Socjalnej.
Wprowadza się pomiar najwyższego dopuszczalnego stężenia NDSCh (najwyższe
dopuszczalne stężenie chwilowe).
NDSCh jest wartością średnią stężenia substancji utrzymującą się nie dłużej niż 30 min.
podczas 8-godzinnego czasu trwania pracy.
NDSCh nie powinno spowodować szkodliwych zmian w stanie zdrowia pracownika oraz
w stanie zdrowia jego przyszłych pokoleń.
Wprowadzono również najwyższe stężenie pułapowe NDSP, które nie może być
przekroczone w żadnym momencie dla zachowania bezpieczeństwa pracownika na
stanowisku pracy.
Dla danej substancji, na stanowisku pracy, ustala się co najwyżej dwa dopuszczalne poziomy
narażenia zdrowotnego.
Ustalenie NDSCh wyklucza NDSP, a NDSP wyklucza NDS i NDSCh.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
22
Tabela 8. Wykaz wartości najwyższych dopuszczalnych stężeń wybranych czynników szkodliwych dla zdrowia
w środowisku pracy [2, s. 281 ]
Najwyższe dopuszczalne stężenie
w mg/m
3
w zależności od czasu narażenia
w ciągu zmiany roboczej
Nazwa substancji chemicznej
NDS
NDSCh
NDSP
Aceton
600
1800
−
Acetonitryl
70
140
−
Aldryna
0,01
0,08
−
Amoniak
20
27
−
Anilina
5
20
−
Arsen (arsenowodór)
0,2
0,6
−
Arsen i jego związki nieorganiczne
w przeliczeniu na As
0,01
−
−
Benzen
10
40
−
Benzo[a]piren
0,002
−
−
Benzydyna
0
0
−
Benzyna:
ekstrakcyjna
do lakierów
500
300
150
900
−
Brom
0,7
2
−
Bromowodór
7
21
−
Buta-1,3-dien
10
40
−
Butan
1900
3000
−
Chlor
1,5
9
−
Chlorek amonu-pary i dymy
10
20
−
Chlorfenwinfos
0,01
0,1
−
Chlorobenzen
50
150
−
Chloroetan
5
30
−
4-chlorofenol
1
3
−
Chloroform
50
225
−
Chlorowodór
5
−
7
Chrom metaliczny i związki chromu(III)
0,5
−
−
Chromiany(VI) i dichromiany(VI) (chromiany)
0,1
0,3
−
Cyjanamid
2
4
−
Cyjanowodór cyjanki – w przeliczeniu na HCN
0,3
−
10
Cykloheksan
300
1000
−
DDT
0,1
0,8
−
Kwas octowy
5
35
−
Kwas pikrynowy
0,1
0,3
−
Kwas siarkowy(VI)
1
3
−
Kwas sulfonylooctowy
4
8
−
Kwas szczawiowy
1
2
−
Malation
1
10
−
Mangan i jego związki nieorganiczne – w przeliczeniu
na Mn
0,3
−
5 (pyły)
Metanol
100
300
−
Metoksychlor
15
45
−
Miedź i jej związki- w przeliczeniu na Cu:
dymy tlenków i sole rozpuszczalne
pyły tlenków i sole nierozpuszczalne
0,1
1
0,3
2
−
Nadtlenek wodoru
1,5
4
−
Nafta
100
300
−
Naftalen
20
75
−
1-Naftyloamina
0
0
−
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
23
2-Naftyloamina
0
0
−
Nikiel i jego związki, z wyjątkiem
tetrakarbonylku
niklu – w przeliczeniu na Ni
0,25
−
−
Nikotyna
0,5
1,5
−
Nitrobenzen
3
10
−
Octan etylu
200
600
−
Octan winylu
10
30
−
Ołów i jego związki nieorganiczne w przeliczeniu na
Pb
0,05
−
−
Ozon
0,1
0,6
−
Paration metylowy (metyloparation)
0,1
0,6
−
Pentachlorek fosforu
0,3
0,9
−
Pirydyna
5
30
−
Polichlorowane bifenyle
1
−
−
Propoksur
0,5
2
−
Rtęć i jej związki – w przeliczeniu na Hg:
organiczne
nieorganiczne
pary rtęci
0,01
0,05
0,025
0,3
0,15
0,2
−
Selen i jego związki w przeliczeniu na Se
0,1
0,3
−
Siarkowodór
10
20
−
Styren
50
200
−
Dla oceny środowiska pracy prowadzi się systematyczny pomiar stężenia substancji
szkodliwej (c
w
– średnie stężenie ważone) zwany monitoringiem. W badaniach tych
wykorzystuje się odpowiednie przyrządy. Na podstawie uzyskanych wartości
oznaczenia
oblicza się wskaźniki narażenia. Porównuje się je z wartościami NDS, NDSCh i NDSP.
Warunki pracy uznaje się za bezpieczne, jeżeli obliczone wartości wskaźników narażenia nie
przekraczają NDS.
Gdy wartości te są wyższe od NDS, warunki pracy uważane są za szkodliwe.
C
w
≤ NDS – warunki bezpieczne
C
w
> NDS – warunki szkodliwe
Warunki pracy można uznać za bezpieczne jeżeli:
−
ś
rednie stężenie substancji szkodliwej w ciągu 30 minut jest niższe lub równe wartości
NDSCh,
−
stężenie substancji oznaczonej nie może przekroczyć NDSP.
Jeśli w środowisku pracy występuje więcej niż jedna substancja szkodliwa o podobnym
charakterze działania, to ocenę narażenia przeprowadza się sumując działanie toksyczne.
W tym celu oblicza się wskaźnik narażenia łącznego, jako sumę ilorazów średnich stężeń
ważonych i odpowiednich NDS. Wskaźnik taki nie powinien przekraczać jedności.
1
w
NDS
C
1
+
2
w
NDS
C
2
+
3
w
NDS
C
3
+…………
≤
1
C
w
– średnie stężenie ważone poszczególnych substancji.
Jeżeli jest większy od 1, warunki pracy należy uznać za szkodliwe.
Ocena ryzyka występowania skutków zdrowotnych jest ważnym zadaniem badań
biologicznych. Systematyczny pomiar stężeń substancji toksycznych w tkankach,
wydzielinach i wydalinach (monitoring biologiczny) daje pełny obraz narażenia na substancje
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
24
toksyczne. Pozwala on śledzić etapy zdarzeń zachodzących podczas narażenia człowieka na
działanie toksyn. Obejmuje on:
−
ekspozycję (pobranie substancji),
−
dawkę wchłoniętą,
−
dawkę działającą (krytyczną),
−
efekt biologiczny,
−
efekt zdrowotny.
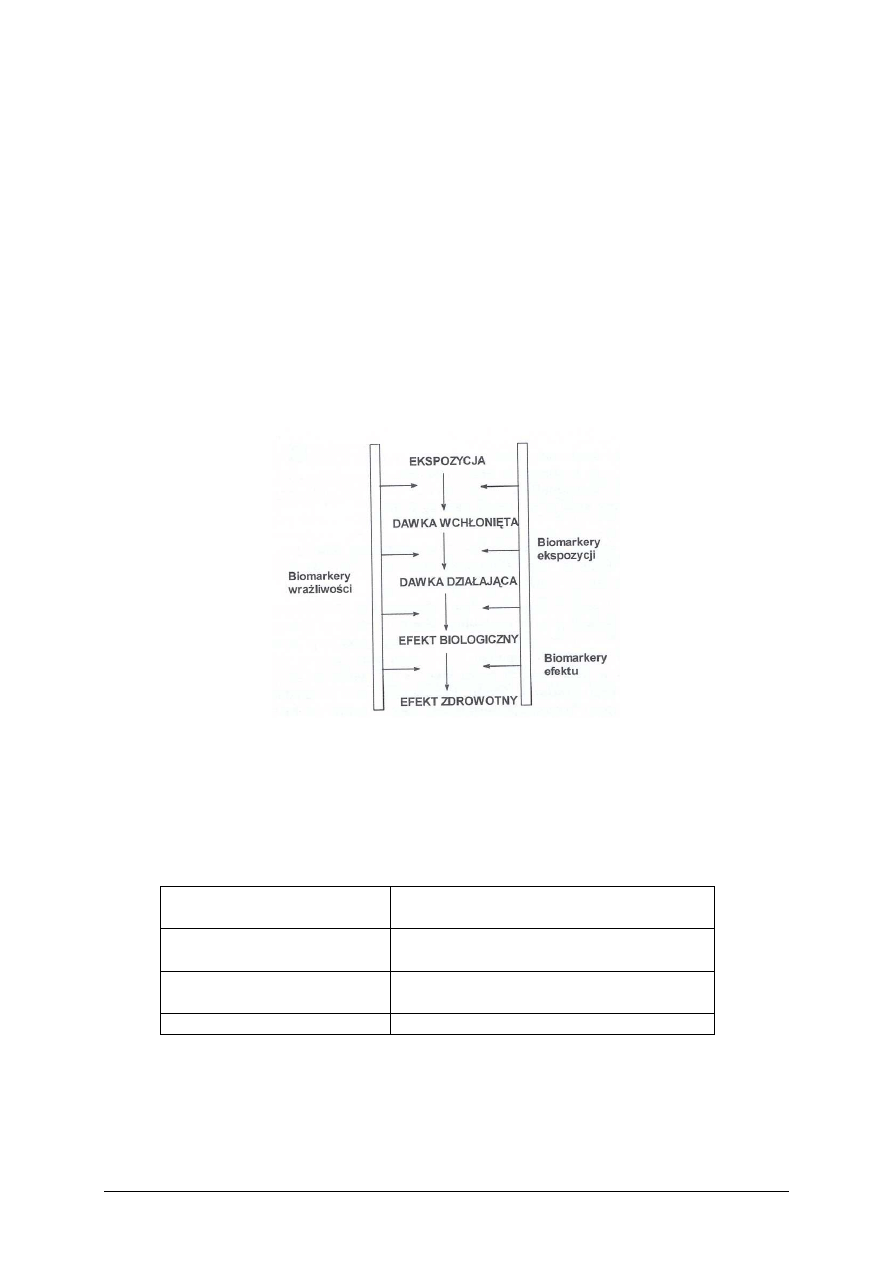
Można je ocenić za pomocą wskaźników, zwanych biomarkerami.
Biomarker to test służący do oceny reakcji żywego organizmu na substancję toksyczną.
Biomarkery wskazują ilość substancji toksycznej wchłoniętej do organizmu. Wyróżniamy:
−
biomarkery ekspozycji, które wskazują na ilość substancji toksycznej wchłoniętej do
organizmu,
−
biomarkery efektu – określające nasilenie biologicznych zmian w organizmie,
−
biomarkery wrażliwości – uwzględniające wrażliwość osobniczą na substancje toksyczne.
Rys. 4. Biomarkery jako narzędzia służące do oceny zagrożenia zdrowia człowieka
przez substancje chemiczne występujące w środowisku [2, s. 213]
Biomarkery wrażliwości mają wpływ na przemiany ksenobiotyków w organizmie.
Uczestniczą w przemianach enzymatycznych, prowadzących do zmian w genach.
Tabela 9. Przykłady biomarkerów wrażliwości uczestniczących
w enzymatycznych przemianach ksenobiotyków
Biomarkery
Skutki zdrowotne
N
−
acetylotransferazy
zachorowalność na raka pęcherza
moczowego
Transferazy S −glutationowe zachorowalność na raka płuc u palaczy
papierosów
Cytochromy P−450
zachorowalność na raka płuc

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
25
4.3.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1.
Jakie stężenia substancji toksycznych wykonuje się w miejscu pracy?
2.
Co to jest NDS?
3.
Co to jest wskaźnik ekspozycji?
4.
W jaki sposób określa się bezpieczne warunki pracy?
5.
Kiedy mówimy, że warunki pracy są szkodliwe?
6.
Co to jest biomarker i do czego służy?
7.
Co rozumiesz pod pojęciem medialne stężenie śmiertelne?
8.
Jakie są etapy monitoringu biologicznego?
4.3.3. Ćwiczenia
Ćwiczenie 1
Na stanowisku pracy hutnika dokonano pomiarów stężeń tlenku żelaza i tlenków azotu.
Dokonując obliczeń ustal, czy warunki pracy są szkodliwe.
Substancja
C
w
[mg/m
3
]
NDS [mg/m
3
]
tlenki żelaza
4,4
5,0
tlenki azotu
3,7
5,0
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
odczytać wartości NDS substancji z tabeli,
C
w
2)
zapisać ilorazy stężeń NDS dla obu substancji,
3)
obliczyć ilorazy,
4)
zsumować uzyskane wyniki,
5)
ocenić warunki pracy hutnika na podstawie otrzymanej wartości.
Wyposażenie stanowiska pracy:
−
tablice NDS,
−
kalkulator.
Ćwiczenie 2
Do analizy pobrano 5 cm
3
krwi i oddzielono z niej osocze. Na drodze analizy
stwierdzono, że zawierało ono 0,8mg jonów Ca
2+
. Norma przewiduje stężenie jonów wapnia
we krwi od 2,1 do 2,6 mmol/dm
3
. Oblicz, czy stężenie jonów wapnia we krwi pacjenta
mieściło się w normie.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
obliczyć liczbę mmoli Ca
2+
,
2)
dokonać korekty jednostek objętości,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
26
3)
obliczyć stężenie jonów wapnia we krwi pacjenta, korzystając z definicji stężenia
molowego,
4)
porównać uzyskany wynik z zadania z normą.
Wyposażenie stanowiska pracy:
−
układ okresowy pierwiastków.
4.3.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1)
zdefiniować pojęcia NDS, NDSCh?
2)
zdefiniować pojęcie LD
50
?
3)
określić zasady monitoringu?
4)
określić ocenę warunków pracy?
5)
wskazać materiał biologiczny poddawany badaniom
biochemicznym?
6)
rozróżnić elementy monitoringu biologicznego?
7)
określić co to jest biomarker?
8)
podać rodzaje biomarkerów?
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
27
4.4. Sposoby neutralizacji i likwidacji substancji szkodliwych
4.4.1. Materiał nauczania
Neutralizacja substancji chemicznych to zespół procesów w wyniku których substancja
ulega przemianom fizycznym i/lub chemicznym i traci swoje niepożądane własności.
Neutralizowanie szkodliwego oddziaływania niebezpiecznych substancji na ludzi nazywamy
dekontaminacją.
Istnieją dwa sposoby neutralizacji:
−
chemiczna (Na
2
CO
3
, NaClO, CaO, C
2
H
5
OH)
−
sorpcja, pochłanianie gazów, par, cieczy przez sorbenty (wełna szklana, pumeks, piasek,
wapno palone, pianki i włókna organiczne).
Gdy skład chemiczny jest trudny do rozpoznania i nie został ustalony, stosuje się wodne
roztwory dekontaminacyjne (RD):
RD 1 – 5% roztwór węglanu sodu i 5% roztwór fosforanu (V) sodu,
RD 2 – 10% roztwór chloranu(I)wapnia,
RD 3 – 5% roztwór fosforanu(V)sodu,
RD 4 – 1% roztwór kwasu solnego,
RD 5 – wodny roztwór detergentu.
Tabela 10. Wybór roztworu dekontaminacyjnego w zależności
od rodzaju substancji niebezpiecznej [1, s. 65]
Lp.
Klasa rozpoznanego związku chemicznego
Roztwór
RD
1.
Nieorganiczne kwasy, odpady procesu przeróbki metali
1
2.
Metale ciężkie
2
3.
Pestycydy, chlorowane fenole, środki chwastobójcze
2
4.
Cyjanki, amoniak, niekwaśne i nieorganiczne odpady
2
5.
Rozpuszczalniki i związki organiczne
1 lub 3
6.
Difenyle polichlorowane i polibromowane
1 lub 3
7.
Oleje natłuszczone i inne niewymienione odpady
nieskażone
pestycydami
1 i 3
8.
Nieorganiczne zasady i alkaliczne żrące zasady
4
9.
Materiały radioaktywne
5
10.
Materiały chorobotwórcze
1 i 2
Pełna charakterystyka substancji zawiera następujące parametry:
−
wygląd,
−
zapach,
−
temperatura wrzenia i topnienia,
−
temperatura zapłonu,
−
prężność par,
−
rozpuszczalność.
Prawie wszystkie substancje chemiczne są truciznami. Praca z substancjami trującymi,
ż
rącymi, wybuchowymi i łatwopalnymi wymaga szczególnej ostrożności. Dla zachowania
bezpieczeństwa zgodnie z wymogami norm, substancja chemiczna, musi być dokładnie
opisana (piktogramy ostrzegające przed grożącym niebezpieczeństwem). Istnieje możliwość
zatruć ciałami stałymi, ich roztworami, płynami nielotnymi, cieczami lotnymi.
Dla eliminacji trucizny z organizmu prowadzona jest droga postępowania zmierzająca do
eliminacji trucizny. W tym celu prowadzi się dwa kierunki postępowania.
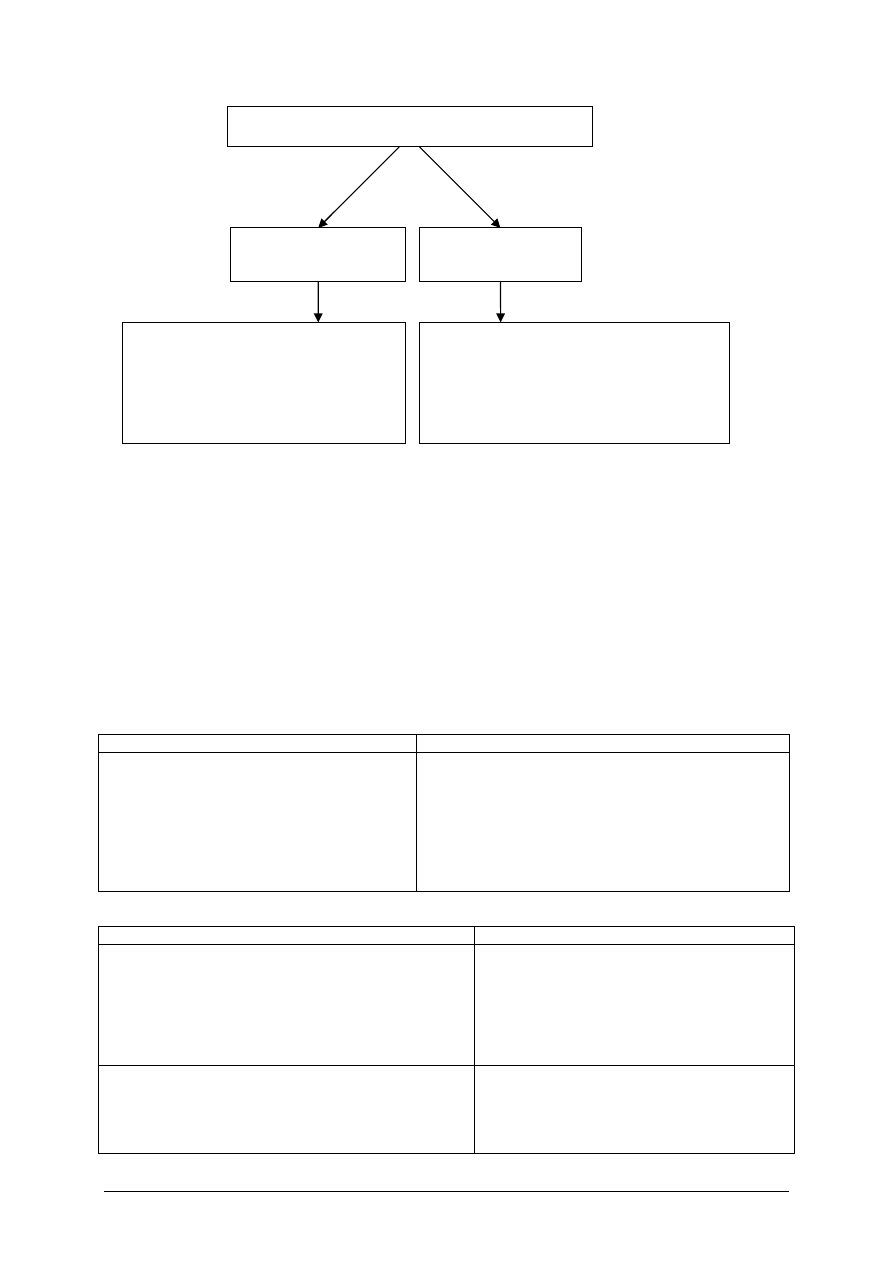
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
28
Rys. 5. Kierunki leczenia ostrych zatruć
Skuteczną metodą neutralizacji trucizny w organizmie jest stosowanie odtrutek.
Odtrutki (antidota) są to substancje chemiczne, które po wprowadzeniu do ustroju znoszą
efekt biochemiczny wywołany przez truciznę lub ją unieczynniają. Efekt ten uzyskiwany jest
przez zmianę szlaków metabolicznych trucizny lub przez połączenie odtrutki z trucizną
w trwały, nietoksyczny związek.
Odtrutki są klasyfikowane na dwie grupy:
−
odtrutki niespecyficzne, mające zdolność zobojętniania lub zmniejszenia toksyczności
trucizn o różnych mechanizmach działania,
−
odtrutki specyficzne „znoszą działanie związków mających ten sam lub podobny
mechanizm działania”.
Tabela 11. Odtrutki niespecyficzne i ich zastosowanie [2, s. 109]
Odtrutki niespecyficzne
Czynnik toksyczny
węgiel aktywny
parafina ciekła
kwas foliowy
mleko
mocna herbata
skrobia
substancje organiczne i nieorganiczne
substancje rozpuszczalne w tłuszczach
alkohol metylowy
substancje żrące, metale ciężkie, czwartorzędowe sole
amonu
glikozydy nasercowe, alkaloidy,
substancje żrące, kwasy organiczne
i
nieorganiczne,
jodyna
Tabela 12. Odtrutki specyficzne i ich zastosowanie [2, s. 110]
Odtrutki specyficzne
Czynnik toksyczny
związki chelatujące:
chelaton (wersenian disodowo-wapniowy
EDTA)
deferoksamina (Desferal)
dimerkaprol (BAL, British Anti-Lewisite)
penicylamina (Cuprenil)
kwas dietylenotriaminopentaoctowy (DTPA)
ołów, żelazo, cynk, miedź, kadm
ż
elazo, glin
arsen, rtęć, bizmut, złoto, miedź
arsen, ołów, rtęć, miedź, cynk
pluton, cez, ołów, cynk, żelazo, mangan
odtrutki przeprowadzające truciznę
w związki nierozpuszczalne:
związki wapnia (glukonian,
glukonolaktobionian wapnia
siarczan protaminy)
szczawiany, fluorki, fenol, glikol
heparyna
objawowe
przyczynowe
−
resuscytacja oddechowo –
krążeniowa,
−
wyrównywanie zaburzeń
gospodarki
wodno
−
elektrolitowej
kwasowo
−
zasadowej
−
przerwanie narażenia,
−
usunięcie trucizny nie wchłoniętej,
−
przyspieszenie eliminacji trucizny,
−
stosowanie odtrutek
Kierunki leczenia ostrych zatruć

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
29
reaktywatory enzymatyczne:
azotyn amylu, azotyn sodowy, dimetyloamino fenol,
tiosiarczan sodowy, witamina B
12
, wersenian dikobaltowy
(Kelocyanor)
obidoksym (Tiksobidin), Serum-Cholinesteraze
błękit metylenowy, błękit toluidynowy, kwas askorbinowy
blokery oksydazy cytochromowej (cyjanki)
blokery cholinoesterazy (insektycydy
fosforoorganiczne)
związki methemoglobinotwórcze
(nitraty, anilina, chlorany, fenacetyna)
odtrutki witaminowe:
witamina B
6
, PP
witamina K
izoniazyd
związki przeciwkrzepliwe
odtrutki blokujące receptory:
nalokson (Narcan)
flumazenil (Anexate)
morfina i jej pochodne, metadon, pentacozyna,
petydyna, alkohol etylowy benzodiazepiny (stan
ś
piączki)
odtrutki blokujące przemianę metaboliczną trucizn:
alkohol etylowy
antizol (Fomepizol, 4-metylopirazol)
alkohol metylowy, glikol etylenowy
odtrutki oparte na działaniu przeciwciał:
digitalis-antidot
antytoksyna jadu żmij
glikozydy nasercowe (digoksyna, digitoksyna)
ukąszenie żmiji zygzakowatej
odtrutki
działające
na
zasadzie
antagonizmu
farmakologicznego:
acetylocysteina
siarczan atropiny
salicylan fizostygminy
pilokarpina
paracetamol
insektycydy fosforoorganiczne,
karbaminiany,
grzyby grupy muskarynowej
alkaloidy tropinowe, trójpierścieniowe
leki
przeciwdepresyjne, leki
spazmolityczne,
antyhistaminowe
atropina, środki parasympatykolityczne
W sytuacji przedostania się do przewodu pokarmowego trucizny należy zachować
następujący tok postępowania dla wybranych substancji:
Tabela 13. Unieszkodliwianie substancji chemicznych
Substancja chemiczna
Sposób unieszkodliwiania w kolejności
substancja nieznana
spowodować wymioty,
podać:
−
ciepłą wodę z solą kuchenną,
−
odtrutkę uniwersalną
mocne kwasy
podać:
−
w dużych ilościach mleko magnezowe Mg(OH)
2
,
−
mleko,
−
białko jaja kurzego,
−
olej parafinowy.
alkohol
podać:
−
rozcieńczony kwas solny (1–5%),
−
mleko,
−
białko jaja kurzego
skierować do lekarza.
W przypadku zmian zewnętrznych stosujemy podany poniżej sposób neutralizacji:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
30
Tabela 14. Środki neutralizujące stosowane przy skażeniu skóry [3, s. 19]
Neutralizacja działania cieczy parzącej w przypadku
Miejsce oparzenia
kwasów
alkaliów
skóra
oczy i błony śluzowe
usta i przewód pokarmowy
5% NaHCO
3
2% NaHCO
3
zawiesina Mg(OH)
2
2% CH
3
COOH
2% H
3
BO
3
1% CH
3
COOH
Przedstawione w tabeli środki neutralizujące powinny znajdować się w laboratorium
chemicznym w widocznym i dostępnym miejscu. Aby zapobiec tego rodzaju wypadkom,
należy wszelkie czynności z substancjami szkodliwymi prowadzić pod dygestorium będąc
ubranym w sprzęt ochrony indywidualnej dobrany zgodnie z obowiązującymi przepisami,
normami i regulaminami.
4.4.2. Pytania sprawdzające
Odpowiadając na pytania sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1.
Co nazywamy neutralizacją substancji chemicznych?
2.
Co rozumiesz pod pojęciem dekontaminacja?
3.
Jakie znasz drogi likwidacji zatruć?
4.
W jaki sposób można usuwać truciznę z przewodu pokarmowego?
5.
Jaki znasz sposób neutralizacji substancji o odczynie zasadowym?
6.
W jakim celu stosowane są odtrutki?
7.
Jakie znasz odtrutki niespecyficzne?
8.
W jaki sposób opisywane są substancje chemiczne stosowane do dekontaminacji?
4.4.3. Ćwiczenia
Ćwiczenie 1
Przeprowadź neutralizację jonów żelaza (III) za pomocą zawiesiny wodorotlenku wapnia,
zwanej mleczkiem wapiennym.
Sposób wykonania ćwiczenia.
Aby wykonać ćwiczenie, powinieneś:
1)
przygotować stanowisko pracy zgodnie z wymogami bezpieczeństwa i higieny pracy,
2)
sporządzić potrzebne roztwory do ćwiczenia,
3)
nalać do pięciu probówek po 2 cm
3
roztworu 0,1 mol/dm
3
FeCl
3
,
4)
wstrząsać butelkę z zawartością 10% mleczka wapiennego,
5)
dodać do probówek 0,5; 1,0; 1,5; 2,0 cm
3
tej zawiesiny,
6)
wymieszać zawartość probówek,
7)
dodać do probówki 3 cm
3
roztworu KSCN,
8)
ustalić, ile 10% mleczka wapiennego należy użyć do całkowitej neutralizacji,
9)
zapisać w formie jonowej (cząsteczkowej) równanie reakcji świadczące o obecności
jonów żelaza (III),

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
31
10)
zapisać w formie jonowej (cząsteczkowej) równanie reakcji neutralizowania w tym
doświadczeniu jonów żelaza (III),
11)
uporządkować stanowisko pracy.
Wyposażenie stanowiska pracy:
−
szkło laboratoryjne: probówki, kolba miarowa, kolbki miarowe, butelki szklane, bagietka,
lejek zwykły, naczyńko wagowe,
−
sprzęt laboratoryjny: waga analityczna, łyżka porcelanowa, tryskawka, etykietki do opisu
roztworów,
−
odczynniki chemiczne Ca(OH)
2
(s)
cz. d. a., FeCl
3
(s)
cz. d. a., roztwór 0,5 mol/dm
3
KSCN, woda destylowana pozbawiona węglanów,
−
układ okresowy pierwiastków,
−
kalendarz chemiczny.
Ćwiczenie 2
Wykorzystując ekstrakcję jako sposób usuwania substancji chemicznej z roztworu,
przeprowadź ekstrakcję jodu z roztworu przy pomocy CCl
4
i oblicz współczynnik Nernsta.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
przygotować stanowisko pracy zgodnie z wymaganiami bezpieczeństwa i higieny pracy,
2)
sporządzić krzywą wzorcową roztworu 0,5 mol/dm
3
jodu w KI:
−
przygotować roztwór 0,5 mol/dm
3
KI,
−
1g jodu umieścić w kolbie miarowej o pojemności 100 cm
3
i dopełnić do kreski
roztworem 0,5 mol/dm
3
KI (1 cm
3
roztworu zawiera 10 mg jodu),
−
dodać do pięciu probówek kolejno: 0,5; 1,0; 1,5; 2,0 cm
3
otrzymanego roztworu jodu
w jodku potasu (I
2
w KI),
−
dodać tyle roztworu 0,5 mol/dm
3
KI, by objętość roztworu w probówce wynosiła 10
cm
3
,
(stężenie będzie wynosić odpowiednio 0,5; 1,0; 1,5; 2,0 mg /cm
3
),
−
wyznaczyć zależność absorbancji od stężenia jodu przy długości fali = 510 nm,
3)
sporządzić krzywą wzorcową A = f(c) jodu w CCl
4
:
−
przygotować roztwór podstawowy jodu w CCl
4
(0,1 g jodu umieścić w kolbie
miarowej o pojemności 100 cm
3
i dopełnić do kreski tym rozpuszczalnikiem),
−
dodać kolejno do pięciu probówek: 0,2; 0,4, 0,6; 1,0 cm
3
roztworu podstawowego
i uzupełnić CCl
4
do objętości 10 cm
3
,
−
wyznaczyć zależność absorbancji każdego z otrzymanych roztworów przy długości
fali = 518 nm,
−
wykreślić krzywą wzorcową A = f (c),
4)
dokonać pomiaru współczynnika podziału:
−
w trzech butelkach o pojemności 50 cm
3
umieścić po 2 cm
3
roztworu 0,5 mol/dm
3
jodu w roztworze KI po18 cm
3
roztworu 0,5 mol/dm
3
KI i po 10 cm
3
CCl
4
,
−
wytrząsać kolejno każdą butelkę przez 1 minutę,
−
wprowadzić wytrząśnięte ciecze do rozdzielaczy w celu rozdzielenia faz,
−
zlać fazy organiczne z rozdzielaczy do czystych probówek,
−
zmierzyć absorbancję kolejnych czterech probówek przy długości fali = 518 nm,
−
sporządzić krzywą wzorcową A = f (c),
−
wyznaczyć z krzywej wzorcowej stężenia jodu w fazie organicznej,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
32
−
odlać z każdego rozdzielacza po 2 cm
3
roztworu i go odrzucić,
−
zlać do czystych probówek fazę wodną z kolejnych rozdzielaczy,
−
zmierzyć absorbancję kolejnych probówek przy długości fali = 510 nm,
−
sporządzić krzywą wzorcową A = f (c),
−
wyliczyć na podstawie krzywej wzorcowej stężenie jodu w fazie wodnej,
5)
obliczyć z uzyskanych danych współczynnik podziału Nernsta,
6)
uporządkować stanowisko pracy i dokonać neutralizacji pozostałych odczynników.
Wyposażenie stanowiska pracy:
−
szkło laboratoryjne: probówki, kolba miarowa, kolbki miarowe, butelki szklane, bagietka,
lejek zwykły, naczyńko wagowe, rozdzielacze,
−
sprzęt laboratoryjny: waga analityczna, łopatka lub łyżka porcelanowa, etykietki do opisu
roztworów, tryskawka,
−
odczynniki chemiczne: KI
(s)
cz. d. a., I
2
(s)
, CCl
4
(c)
cz.d.a., woda destylowana
pozbawiona węglanów,
−
spektrofotometr z wyposażeniem,
−
układ okresowy pierwiastków,
−
kalendarz chemiczny.
4.4.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1)
określić pojęcie neutralizacja odczynnika?
2)
określić pojęcie dekontaminacja?
3)
określić pojęcie odtrutka?
4)
wymienić substancje z grupy RD?
5)
zaproponować sposób neutralizacji roztworu amoniaku?
6)
scharakteryzować sposoby usuwania trucizny z organizmu?
7)
wskazać przykłady odtrutek specyficznych?
8)
wskazać przykłady odtrutek niespecyficznych?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
33
5. SPRAWDZIAN OSIĄGNIĘĆ
INSTRUKCJA DLA UCZNIA
1.
Przeczytaj uważnie instrukcję.
2.
Podpisz imieniem i nazwiskiem kartę odpowiedzi.
3.
Zapoznaj się z zestawem zadań testowych.
4.
Udzielaj odpowiedzi na załączonej karcie odpowiedzi, wstawiając w odpowiedniej
rubryce znak X. W przypadku pomyłki należy błędną odpowiedź zaznaczyć kółkiem,
a następnie ponownie zaznaczyć odpowiedź prawidłową.
5.
Test zawiera 22 zadania o różnym stopniu trudności,
6.
Do każdego zadania dołączone są 4 możliwe odpowiedzi, tylko jedna jest prawdziwa.
7.
Pracuj samodzielnie, bo tylko wtedy będziesz miał satysfakcję z wykonanego zadania.
8.
Kiedy udzielanie odpowiedzi będzie Ci sprawiało trudność, wtedy odłóż jego rozwiązanie
na później i wróć do niego, gdy zostanie Ci wolny czas.
9.
Na rozwiązanie testu masz 40 minut.
Powodzenia
ZESTAW ZADAŃ TESTOWYCH
1.
Toksynami nazywamy
a)
substancje odżywcze wprowadzane do organizmu.
b)
substancje szkodliwe dla organizmu.
c)
związki chemiczne przechowywane w laboratorium.
d)
medykamenty lecznicze.
2.
Ze względu na mechanizm działania trucizny zatrucia dzielimy na
a)
nagłe, ukryte, nieznane.
b)
małe, średnie, duże.
c)
ostre, podostre, przewlekłe.
d)
ostre, ukryte, przewlekłe.
3.
Jednostką dawki jest
a)
mg/cm
3.
b)
mg/kg.
c)
m
2
/kg.
d)
cm
3
/g.
4.
Umieszczane na opakowaniach substancji niebezpiecznych piktogramy informują o
a)
właściwościach fizycznych substancji niebezpiecznej.
b)
rodzaju zagrożenia jakie niesie ta substancja.
c)
symbolu (wzorze) substancji.
d)
zabezpieczeniu w sprzęt ochrony indywidualnej.
5.
Nefrotoksynami są
a)
alifatyczne i cykliczne węglowodory.
b)
metale ciężkie i chlorowcopochodne węglowodorów.
c)
alkohole.
d)
wielopierścieniowe węglowodory aromatyczne.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
34
6.
Monitoring powietrza jest pojęciem, które oznacza
a)
rozprzestrzenianie się zanieczyszczeń w powietrzu.
b)
metodę badania zanieczyszczeń powietrza.
c)
system obserwacji, oceny i prognoz stanu powietrza.
d)
kontrolę najwyższych dopuszczalnych stężeń składników powietrza.
7.
Szkodliwe substancje i preparaty są potencjalnym źródłem zagrożenia zdrowia
pracownika. Prawidłowa praca z toksyną możliwa jest w wyniku znajomości
a)
reakcji chemicznych zachodzących w ćwiczeniu.
b)
instrukcji wykonywanego ćwiczenia.
c)
ś
rodków ochrony indywidualnej.
d)
Karty Charakterystyki Substancji stosowanych w ćwiczeniu.
8.
Na stanowisku pracy stężenie ważone amoniaku wyniosło c
w
= 45mg/m
3
.
NDS
amoniaku
= 20. Warunki pracy pracownika są
a)
w normie.
b)
szkodliwe dla zdrowia.
c)
bezpieczne dla pracownika.
d)
dopuszczalne.
9.
Na toksyczność substancji chemicznej nie ma wpływu
a)
budowa cząsteczki.
b)
nazwa substancji.
c)
rozpuszczalność substancji.
d)
stan skupienia substancji.
10.
Do oceny wyników badań biologicznych stosuje się
a)
biomarkery.
b)
bioanalizery.
c)
biochemery.
d)
biopolimery.
11.
Wykorzystywany w badaniach toksymetrycznych zapis NDSP określa
a)
najwyższe dopuszczalne stężenie procentowe.
b)
najwyższe dopuszczalne stężenie pułapowe.
c)
najniższe dopuszczalne stężenie procentowe.
d)
najniższe dopuszczalne stężenie pułapowe.
12.
Do grupy nefrotoksyn nie należy
a)
formalina.
b)
ksylen.
c)
aceton.
d)
tetrachlorometan.
13.
Pozostały z ćwiczenia roztwór zasady sodowej uczeń unieszkodliwił przez
a)
rozcieńczenie zasady wodą i wylanie do zlewu.
b)
neutralizację kwasem solnym i wylanie do zlewu.
c)
rozcieńczenie wodą i umieszczenie zasady w pojemniku ceramicznym.
d)
rozcieńczenie zasady wodą, neutralizację kwasem i umieszczenie w pojemniku
ceramicznym.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
35
14.
Metale i ich związki są niebezpieczne dla zdrowia człowieka ze względu na
a)
skłonności wbudowywania się w tkanki organizmu.
b)
tworzenie połączeń z substancją białkową.
c)
kumulację w organach organizmu.
d)
kierowanie katalityczne przemianami metabolicznymi.
15.
Pestycydy stosowane są do różnorodnych szkodników. Fungicydy stosowane są jako
substancje
a)
owadobójcze.
b)
chwastobójcze.
c)
grzybobójcze.
d)
usuwające liście.
16.
Badając wodę z jeziora wykryto i określono stężenie kadmu. Najwięcej tego metalu
człowiek wchłonie
a)
kąpiąc się w jeziorze.
b)
pijąc z niego surową wodę.
c)
pijąc wodę przegotowaną.
d)
zjadając ryby pochodzące z tego jeziora.
17.
Współoddziaływanie co najmniej dwóch toksyn może być
a)
sumujące się.
b)
redukujące się.
c)
eliminujące.
d)
potęgujące.
18.
Dawka śmiertelna arsenu dla człowieka wynosi 10 mg na kilogram masy ciała. Dawka
ś
miertelna arsenu dla mężczyzny ważącego 80 kg wyniesie
a)
0,800 mg.
b)
8 · 10
2
mg.
c)
80 mg.
d)
8 · 10
-3
mg.
19.
Objawem ostrego zatrucia organizmu metanolem jest
a)
zaburzenie układu pokarmowego.
b)
ś
lepota.
c)
obniżenie ciśnienia krwi.
d)
zawroty głowy.
20.
Toksyny w organizmie ulegają różnorodnym przemianom biochemicznym, które
nazywamy
a)
adsorpcją.
b)
dystrybucją.
c)
biotransformacją.
d)
denaturacją.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
36
21.
Działanie toksyczne występujące w krótkim czasie po podaniu substancji szkodliwej
nazywa się toksycznością:
a)
podostrą.
b)
słabą.
c)
zlokalizowaną.
d)
ostrą.
22.
Przyczyną umyślnego zatrucia nie może być:
a)
próba samobójstwa.
b)
wypicie dużej ilości alkoholu.
c)
przedawkowanie leków.
d)
przyjęcie niewłaściwego leku.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
37
KARTA ODPOWIEDZI
Imię i nazwisko..........................................................................................
Stosowanie podstawowych zasad toksykologii
Zakreśl poprawną odpowiedź.
Nr
zadania
Odpowiedź
Punkty
1.
a
b
c
d
2.
a
b
c
d
3.
a
b
c
d
4.
a
b
c
d
5.
a
b
c
d
6.
a
b
c
d
7.
a
b
c
d
8.
a
b
c
d
9.
a
b
c
d
10.
a
b
c
d
11.
a
b
c
d
12.
a
b
c
d
13.
a
b
c
d
14.
a
b
c
d
15.
a
b
c
d
16.
a
b
c
d
17.
a
b
c
d
18.
a
b
c
d
19.
a
b
c
d
20.
a
b
c
d
21.
a
b
c
d
22.
a
b
c
d
Razem:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
38
6. LITERATURA
1.
Bodzek D. (red.): Chemia i fizykochemia substancji toksycznych i niebezpiecznych.
Ś
AM, Katowice 2003
2.
Brandys J.(red.): Toksykologia – wybrane zagadnienia. Wyd. UJ, Kraków 1999
3. Brzyska W. (red.): Ćwiczenia z chemii ogólnej. Wyd. UMCS, Lublin 1997
4. Ciesielski W., Zakrzewski R., Skrzypek S.: Laboratorium analizy instrumentalnej. Wyd.
UŁ, 2002
5. Cygański.A.: Chemiczne metody analizy ilościowej. WNT, Warszawa 1992
6. Dreisbach R.H., Robertson W.O.: Vademecum zatruć. Wyd. Lekarskie PZWL, Warszawa
1995
8. Łopata K.: Chemia a środowisko. WSIP, Warszawa 1994
9. Rączkowski B.: BHP w praktyce. ODIDK, Gdańsk 2000
10. Seńczuk W.(red.): Toksykologia..Wyd. Lekarskie PZWL, Warszawa 1999
12. Schmid F., Latkowski B., Wasilewski B.(red.): Homotoksykologia kliniczna. Aurelia –
Verlag Baden – Baden, Warszawa 1998
13. Zakrzewski. S.F.: Podstawy toksykologii środowiska. PWN, Warszawa 2000
14. Zawieski MW (red.).: Ocena ryzyka zawodowego. CIOP PIB, Warszawa 2004
Wyszukiwarka
Podobne podstrony:
więcej podobnych podstron