
Ćwiczenie 6
Amylazy i enzymy
pektynolityczne.
Zastosowanie enzymów
w procesach technologii
żywności
ENZYMOLOGIA
Wydział Nauk o Żywności i Rybactwa
Centrum Bioimmobilizacji
i Innowacyjnych Materiałów
Opakowaniowych
ul. Klemensa Janickiego 35
71-270 Szczecin

2
Część A) Amylazy
Amylazy - mianem tym określa się zespół enzymów katalizujących przemianę skrobi
i glikogenu do cukrów prostszych - maltozy (i niekiedy do glukozy). Od zamierzchłych cza-
sów amylazy są wykorzystywane pod postacią słodu, tj. odpowiednio skiełkowanych ziaren
zbożowych, zwykle jęczmienia, poddanych przed użyciem zmiażdżeniu (zgnieceniu).
W ostatnich kilkunastu latach, zamiast słodu coraz częściej stosuje się preparaty
amylolityczne pochodzenia pleśniowego (najczęściej wykorzystywane są mikroorganizmy
z rodzaju Aspergillus) i bakteryjnego (najczęściej mikroorganizmy z rodzaju Bacillus),
o wyższej aktywności od słodu i pozwalające w sposób szybszy, dokładniejszy i tańszy (od
dawnych klasycznych metod) realizować procesy scukrzania skrobi.
Skrobia. Składa się z dwóch wielocukrów - amylozy i amylopektyny - zbudowanych odmiennie z
α-D-glukopiranozy. Amyloza tworzy łańcuchy proste, zbudowane z cząsteczek glukozy sprzę-
żonych ze sobą wiązaniem α-l → 4. Natomiast amylopektyna charakteryzuje się budową roz-
gałęzioną; zasadniczym połączeniem cząsteczek glukozy jest również wiązanie α-l → 4, lecz co
25-30 reszt glukozylowych występują wiązania α-l → 6, tworzące rozgałęzienia. Stąd wynikają
nieco inne właściwości fizyczne obu wielocukrów. Roztwory wodne amylopektyny bardziej opa-
lizują, a w reakcji z jodem wykazują zabarwienie fioletowe, podczas gdy amyloza barwi się z
jodem na kolor ciemnoniebieski.
Wśród enzymów rozkładających hydrolitycznie skrobię, glikogen i pokrewne cukry wyróżnia
się 3 główne grupy:
1) α-amylazy (endoamylazy), rozszczepiające wiązania wewnątrz cząsteczek substratu w
sposób przypadkowy,
2) β-amylazy (egzoamylazy), hydrolizujące co drugie wiązanie od nieredukującego końca
substratu,
3) glukoamylazy (egzoamylazy), hydrolizujące kolejno każde wiązanie od nieredukującego
końca substratu. Należą one do klasy hydrolaz, podklasy 3.2 (działające na związki
glikozylowe), pod-podklasy 3.2.1 (hydrolazy glikozydów). W rozkładzie skrobi i glikogenu
współdziałają z amylazami enzymy rozkładające wiązania α,1→6-glikozydowe.
α-Amylaza (EC 3.2.1.1, 4-glukanohydrolaza α-l,4-glukanu). α-Amylazy występują
powszechnie u roślin, zwierząt i mikroorganizmów. α-Amylaza ma zdolność hydrolizowania

3
prostych lub rozgałęzionych łańcuchów poliglukozydowych w miejscach wiązań 1:4
i doprowadzaniem ich aż do maltozy. Jest więc endoamylazą, a ponieważ enzym ten też nie
atakuje wiązań l:6-glikozydowych, dlatego obok maltozy uzyskuje się pewną ilość nieco
większych członów z odgałęzieniami w połączeniach l:6 (tzw. dekstryny graniczne - rys. 2).
α-Amylazy rozkładają amylopektynę, amylozę i glikogen, stopniowo do coraz to mniejszych
fragmentów, zwanych dekstrynami. Końcowymi produktami są: małocząsteczkowe dekstryny
zawierające zwykle jedno wiązanie α,l→6-glikozydowe, maltoza i glukoza. Konsekwencją
stopniowej depolimeryzacji jest szybki spadek lepkości i zabarwienia z jodem roztworów
wysokospolimeryzowanych substratów.
Rys. 2. Działanie α-amylazy na amylopektynę: a) amylopektyna częściowo rozłożona,
b) amylopektyna całkowicie rozłożona (Pijanowski i in., 2004)
Cechą charakterystyczną α-amylazy jest obecność przynajmniej jednego atomu wapnia w
jednej cząsteczce enzymu. Wapń stabilizuje cząsteczkę enzymu, jest odpowiedzialny za jego
aktywną konformację oraz chroni cząsteczkę amylazy przed działaniem enzymów
proteolitycznych. Wapń nie uczestniczy natomiast w bezpośrednim tworzeniu kompleksu
enzym-substrat. Niektóre α-amylazy są aktywowane przez jony chlorkowe.
W zależności od pochodzenia α-amylazy różnią się masą cząsteczkową (zwykle 50 tys.,
a z bakterii ok. 100 tys.), optimum pH (ze słodu jęczmiennego 4,5-5,0, z trzustki 6,9-8,0)
i optimum temperatury (z pleśni 50-55°C, z bakterii 65-85°C).
Zdolność doprowadzania do maltozy reszty dekstryn niescukrzonych wykazuje enzym Z,
dopełniając jakby działania β-amylazy.

4
β-Amylaza (EC 3.2.1.2, maltohydrolaza α-1,4-glukanu) (dawniej zwana amylazą cukru-
jącą). β-Amylazy są rozpowszechnione u roślin wyższych; u zwierząt nie stwierdzono ich
obecności. Hydrolizując wiązania α,1→4-glikozydowe zmieniają konfigurację α przy C
l
glukozy w konfigurację β; z tego też powodu nazwano je β-amylazami. β-Amylaza
odszczepia z końców łańcuchów amylozowych (od strony nie aldehydowej) cząsteczki
maltozy, powodując stopniowe zmniejszanie się łańcucha, jest więc egzoamylazą. Ponieważ
enzym ten atakuje tylko wiązania typu 1:4 glikozydowe, nie może zaś rozdzielać wiązań l:6,
dlatego w przypadku amylopektyny działanie β-amylazy zatrzymuje się po dojściu do tego
typu wiązania (pozostają wtedy duże cząsteczki rozgałęzione, zakończone w odgałęzieniach
połączeniami 1:6 glikozydowymi. Niestrawiona reszta wykazuje wysoki stopień
polimeryzacji i jest nazwana dekstryną graniczną β-amylazy.
Działanie β-amylazy na amylozę i amylopektynę schematycznie przedstawia rys. 1. Enzym
ten scukrza (tj. doprowadza do maltozy) tylko 70% amylozy, a znacznie mniejszą część
amylopektyny (ze względu na rozgałęzienia).
Rys. 1. Działanie β-amylazy na skrobię: a) na amylozę, b) na amylopektynę (strzałki
wskazują miejsce działania enzymu (Pijanowski i in., 2004)
Aktywność molekularna β-amylaz jest jedną z największych. Cząsteczka enzymu może
hydrolizować około 252 000 wiązań na minutę. Dla jego funkcjonowania są istotne grupy
sulfhydrylowe.
Glukoamylaza (EC 3.2.1.3, amyloglukozymaza, glukohydrolaza α-1,4-glukanu).
Glukoamylazy występują u roślin, zwierząt i bakterii. Są to enzymy usuwające kolejno reszty
glukozy od nieredukującego końca substratów. Podczas rozszczepiania wiązań powodują,
podobnie jak β-amylaza, przemianę konfiguracji α glukozy w konfigurację β. Hydrolizują nie
tylko wiązania α,1→4, lecz także α,1→6-glikozydowe. Stąd glukoamylazy mają zdolność do

5
hydrolizy skrobi prawie ilościowo do glukozy i w związku z tym znalazły zastosowanie do
produkcji glukozy. W cząsteczkach ich stwierdzono obecność składnika cukrowego, nie
wykazano jednak dokładnie jego funkcji.
Działanie jej na łańcuch skrobiowy jest podobne do β-amylaz, z tym że oddziela ona z tego
łańcucha nie maltozę, lecz glukozę, w następstwie rozdzielania nie co drugiego, lecz każdego
wiązania 1:4.
Inny enzym, zwany amylo-l,6-glukozydazą (lub enzymem R), otrzymywany np. z pleśni
rodzaju Rhizopus, hydrolizuje wiązanie l:6 i jest wykorzystywany razem z innymi amylazami.
W praktyce gorzelniczej, browarniczej i piekarniczej rozszczepienie maltozy do glukozy
następuje pod wpływem maltazy drożdżowej.
Dobór właściwej metody oznaczania aktywności amylolitycznej zależy od rodzaju
badanego enzymu. Do oznaczania aktywności α-amylazy można stosować zarówno metody
polegające na pomiarze zaniku zabarwienia z jodem lub zmniejszenia lepkości, jak i na
pomiarze uwolnionych grup redukcyjnych. W przypadku natomiast β-amylazy, glukoamylazy
oraz mieszaniny różnych enzymów amylolitycznych lepiej odzwierciedla aktywność pomiar
uwolnionych grup redukujących.
Amylazy znajdują zastosowanie:
l) w gorzelnictwie rolniczym - przy zacieraniu i cukrowaniu surowców skrobiowych, głównie
ziemniaków, żyta lub kukurydzy → po odpowiednim rozparzeniu i doprowadzeniu
skleikowanej (według niektórych źródeł – sklajstrowanej), półpłynnej masy do odpowiedniej
temperatury od 50 do 65°C oraz pH od 4 do 5;
2) w browarnictwie - przy scukrzaniu skrobi zawartej w samym słodzie, w wyniku czego
otrzymuje się brzeczkę, która po dochmieleniu stanowi właściwy substrat do fermentacji
alkoholowej w procesie wyrobu piwa;
3) w piekarstwie - w celu wytworzenia pewnych ilości cukrów ze skrobi cieście, co ułatwia
fermentację ciasta (zwiększając pulchność pieczywa) oraz przedłuża świeżość pieczywa;
4) w przetwórstwie krochmalniczym, przy modyfikowaniu cech fizycznych ziemniaczanej
mączki oraz, niekiedy, przy produkcji syropów;
5) w produkcji różnego typu odżywek, szczególnie dla dzieci;
6) w cukiernictwie do hydrolizy odpadów cukierniczych i uzyskiwania z nich cukru,
7) w przemyśle papierniczym do obniżenia lepkości kleików skrobiowych
stosowanych w procesie zaklejania papieru.
Najważniejsze amylazy to α-amylaza i β-amylaza (terminologia wg Kuhna).
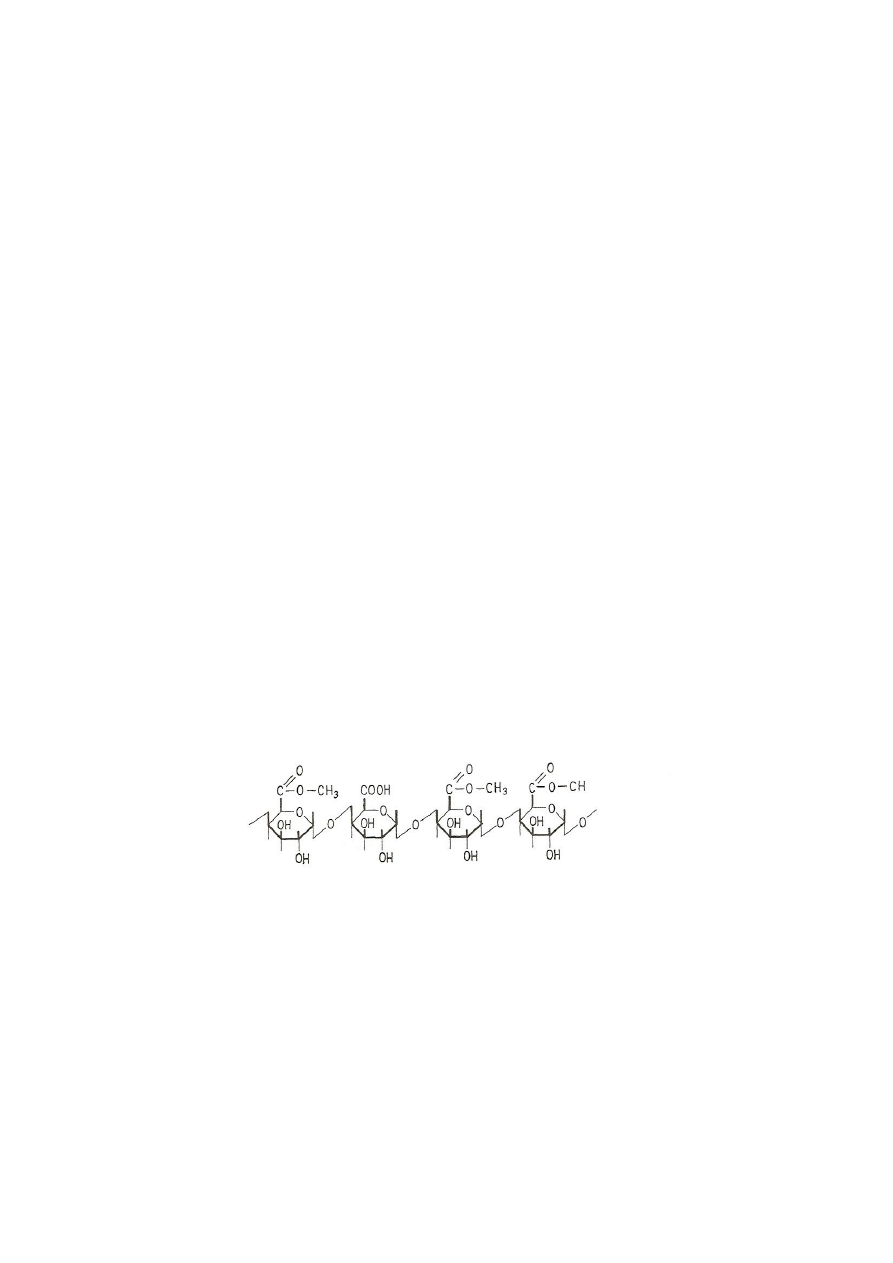
6
Część B) Enzymy pektynolityczne
Pektyny występują w przestrzeniach międzykomórkowych roślin i stanowią lepiszcze,
łączące komórki w zespół tkankowy oraz system utrzymujący młodą tkankę w stanie
właściwego uwodnienia i porowatości oraz równowagi elektrostatycznej błony. Ostatnia
właściwość wynika z polianionowego charakteru tych związków, powodującego wiązanie
znacznych ilości wody. Występują one również w bezpośredniej styczności z celulozą
w postaci nierozpuszczalnej w wodzie protopektyny, która jest formą pektyny
o rozbudowanej strukturze trzeciorzędowej. Protopektyna ulega w tkance hydrolizie
enzymatycznej z wydzieleniem rozpuszczalnej pektyny, co następuje np. przy dojrzewaniu
owoców.
Pektyny zalicza się do polisacharydów kwaśnych. Głównym ich składnikiem jest długi
łańcuch zbudowany z cząsteczek kwasu α-D-galakturonowego, połączonych wiązaniami
α-1,4-glikozydowymi. Grupy karboksylowe przy węglu C-6 w kwasie poligalakturonowym
(pektynowym) są w różnym stopniu zestryfikowane alkoholem metylowym
i zneutralizowane. Co dziesięć reszt kwasu galakturonowego znajduje się reszta L-ramnozy
przyłączona wiązaniem α-1,2-glikozydowym i w tym miejscu następuje skręcenie łańcucha
pektyn. Ponadto do łańcucha głównego za pomocą wiązań kowalencyjnych przyłączone są
krótkie jednostki oligosacharydowe, różne w zależności od gatunku rośliny, z której
pochodzą. Mogą być to galaktazy, arabany lub ksylany. Występują one jednak w pektynach
w ilości nieprzekraczającej (w sumie) kilkunastu procent. Schemat wycinka łańcucha
głównego pektyny przedstawiono na rys. 1.
Rys. 1. Wycinek pektyny (Kączkowski, 2005)
Dodatkowe zróżnicowanie gatunkowe pektyn jest wynikiem różnego stopnia polimeryzacji
i stopnia estryfikacji grup karboksylowych kwasu galakturonowego. Zróżnicowanie ma
wpływ na zdolności wiązania wody przez pektyny i ich właściwości żelujące. Pektyny są
rozpuszczalne w wodzie zimnej i ciepłej, mleku, ciepłych roztworach cukru; nierozpuszczalne
w roztworach soli i etanolu o stężeniu > 20%.
Roztwory wykazują niską lepkość. Rozróżnia się pektyny wysoko- i niskometylowane
(estryfikowane).

7
Pektyny wysokometylowane mają stopień zestryfikowania powyżej 50%. Gdy wynosi on
>70%, są to pektyny szybko żelujące, gdy <65% – wolno żelujące. Pektyny
wysokometylowane żelują w pH 2,5-4. Ulegają adsorbcji na cząsteczkach białka mleka i soi,
a w pH obojętnym ulegają wytrąceniu. Otrzymany żel jest zwięzły i nie ulega synerezie.
Pektyny niskometylowane są otrzymywane z pektyn wysokozestryfikowanych przez działanie
na nie kwasem lub enzymem – pektynoesterazą. Żelują w pH 2,5-5,5, dając żele, których
zwięzłość i moc wzrasta ze wzrostem zawartości jonów metali (Ca
2+
).
Szczególnie dużą zawartością pektyn charakteryzują się owoce cytrusowe (pomarańcze,
cytryny), a także jabłka, śliwki, porzeczki, buraki cukrowe oraz marchew. Ilość i jakość
pektyn w owocach i warzywach zależy od gatunku, stopnia dojrzałości oraz warunków
przechowywania.
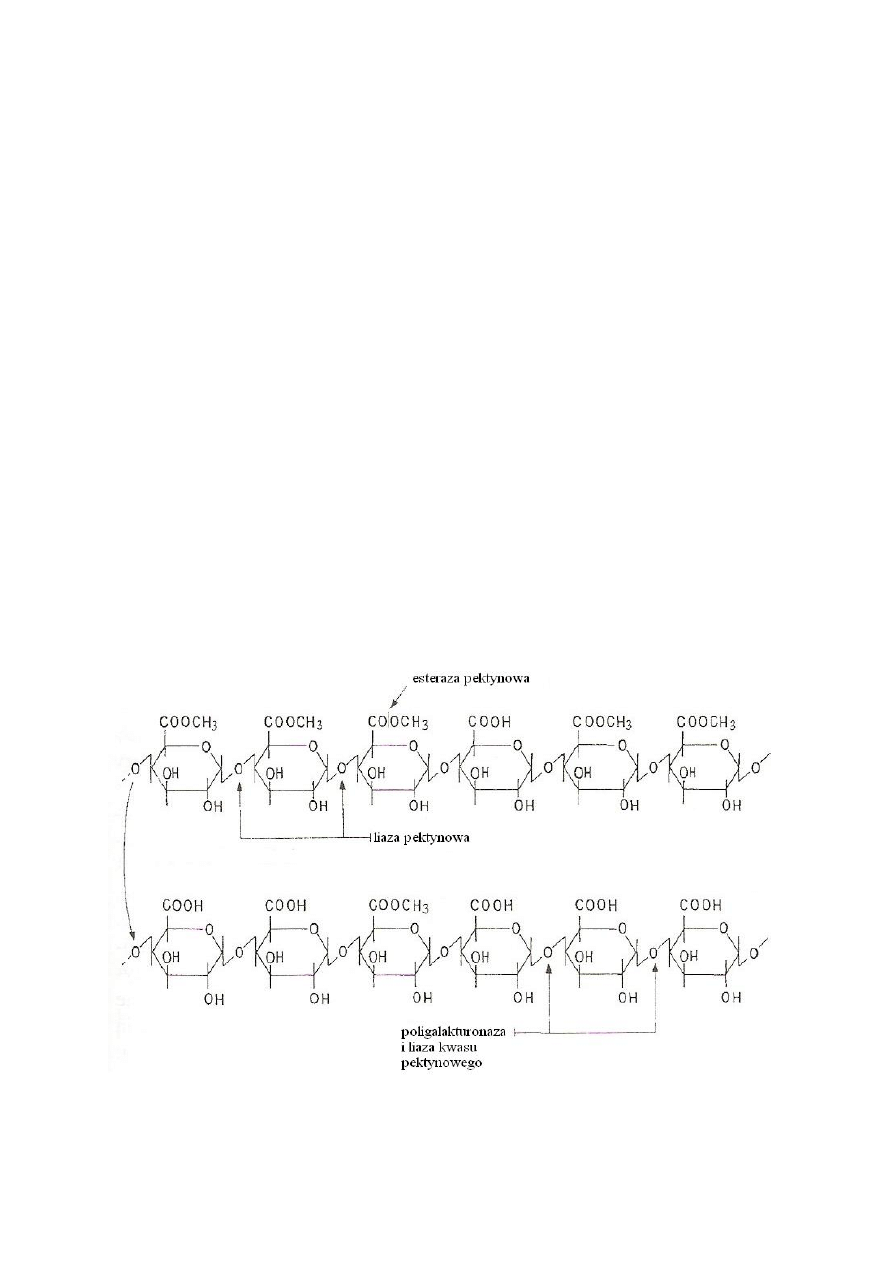
Enzymy pektynolityczne są to enzymy działające na pektyny. Stanowią one grupę
niejednolitą pod względem systematycznym; należą do esteraz (EC 3.1) i depolimeraz
(enzymów odpowiedzialnych za rozkład polimerów).
Esterazy reprezentuje pektaza (pektynoesteraza, metylesteraza pektynowa, PE), która przez
dołączenie cząsteczki wody do grupy metoksylowej oddziela metanol od zestryfikowanej
grupy karboksylowej. Atakuje ona cząsteczkę od redukującego końca łańcucha i tylko
w sąsiedztwie wolnej grupy karboksylowej. Na skutek działania tego enzymu można
otrzymać pektyny niskometylowane aż do wolnego kwasu pektynowego włącznie. Enzym
występuje w roślinach wyższych, bakteriach i pleśniach. Optimum pH dla esterazy
pektynowej pleśniowej wynosi 4, a dla roślinnej i bakteryjnej powyżej 7.
Do depolimeraz można zaliczyć trzy enzymy pektynolityczne:
1. Liaza pektynowa (liaza pektynianowa, transeliminaza pektyn, PL). Enzym ten jest
glikozydazą, należy do endoenzymów, gdyż rozszczepia wiązanie glikozydowe tylko
w sąsiedztwie grupy karboksylowej zestryfikowanej metanolem. Substratem dla
transeliminazy
pektynowej
jest
pektyna.
Liaza
pektynowa
katalizuje
rozkład
zestryfikowanego kwasu poligalakturonowego do pojedynczych jednostek estru metylowego
kwasu galakturonowego. Enzym wytwarzają pleśnie, natomiast nie występuje on w roślinach
wyższych i w bakteriach. Optymalne pH wynosi 5-6, ale w obecności wapnia może wystąpić
i przy pH 8.
2. Liaza kwasu pektynowego (liaza pektatowa, transeliminaza kwasu pektynowego, PGL).
Enzym rozszczepia wiązania glikozydowe w sąsiedztwie wolnej grupy karboksylowej.
Enzym produkują głównie bakterie, rzadziej pleśnie, natomiast nie wykryto go w roślinach
8
wyższych. Optymalne pH wynosi 8,0-9,5.
3. Poligalakturonaza (pektynaza, pektynohydrolaza, PG). Enzym rozszczepia wiązania
glikozydowe w sąsiedztwie wolnej grupy karboksylowej w wyniku hydrolizy. Może
występować jako endo- i egzoenzym – egzopoligalakturonaza, która katalizuje kolejno rozpad
skrajnego wiązania łańcucha (odłącza pojedyncze reszty kwasu galakturonowego) oraz
endopoligalakturonaza, która atakuje wewnętrzne wiązania glikozydowe i odłącza
oligogalakturonidy. Pierwszy enzym występuje powszechnie w roślinach wyższych, a drugi
w drożdżach; optymalne pH dla działania tych enzymów wynosi 4,0-5,5. Enzymy te działają
na kwas pektynowy, natomiast nie katalizują rozkładu wiązań glikozydowych, znajdujących
się w sąsiedztwie zmetoksylowanych grup karboksylowych. Dlatego działają one dopiero po
odłączeniu tych grup przy udziale esterazy pektynowej.
Na rys. 2 przedstawiono miejsca działania enzymów pektynolitycznych na substrat.
W przemyśle spożywczym najpowszechniej stosuje się preparaty pektynolityczne
w winiarstwie przy tłoczeniu soków i klarowania wina, w produkcji soków owocowych,
napojów bezalkoholowych i konserw owocowych (w celu zapobiegania powstawania żelu
w sokach skoncentrowanych), w produkcji wódek i likierów, w produkcji kawy
i koncentratów kawowych (usuwanie warstwy żelu z powierzchni ziaren kawy surowej.
Rys. 2. Miejsca działania enzymów pektynolitycznych (Dłużewski i Dłużewska, 2008)

9
Zastosowanie preparatów enzymatycznych w przetwórstwie owocowym
Jednym z większych obszarów stosowania preparatów enzymatycznych jest przemysł
sokowniczy, w którym ich stosowanie jest powszechne. Już w latach 30. XX wieku
do produkcji soku owocowego stosowano pektynazy.
Jednym z głównych kierunków zastosowania preparatów enzymatycznych jest maceracja
miazgi owoców i warzyw. Proces ten ułatwia tłoczenie i przyczynia się do zwiększenia
uzysku soku. Preparaty używane do maceracji miazgi stanowią kompozycję enzymów
pektynolitycznych, hemiceluloz i celulaz. Działanie enzymów hemicelulolitycznych, oprócz
wspomagania procesu tłoczenia, zapobiega występowaniu wtórnych zmętnień w soku,
spowodowanych nadmierną ilością rozpuszczalnej hemicelulozy w soku. Odpowiednio
dobrany, do konkretnych surowców preparat enzymatyczny, ułatwia również dalszą obróbkę
soku, tj. depektynizację, klarowanie i filtrację.
W produkcji soków pitnych, klarowanych pektyny są szczególnie niepożądane, ponieważ
utrudniają proces klarowania i filtracji soków. Dzięki degradacji łańcuchów pektyn możliwe
jest uzyskanie wyjątkowo klarownych soków oraz maksymalne zwiększenie uzysku soku
z miazgi.
Szeroki asortyment preparatów enzymatycznych dostępnych na rynku, umożliwia dobór
odpowiednich enzymów do konkretnych zadań. Każdy rodzaj enzymu degraduje inny
fragment cząsteczki pektyny. Wspomniane wcześniej enzymy: pektynoesteraza, liaza
pektynowa, liaza pektatowa, poligalakturonaza odpowiedzialne są za depolimeryzację
nierozgałęzionych fragmentów pektyny, co w konsekwencji prowadzi do powstania
niestabilnych zmętnień podczas przechowywania soków oraz trudności w zastosowaniu
procesu ultrafiltacji. Dlatego konieczne jest również stosowanie enzymów rozkładających
rozgałęzione fragmenty pektyn. Pierwszym z poznanych enzymów, zdolnym do degradacji
rozgałęzionych fragmentów pektyny uwalnianych przez
klasyczne enzymy pektynolityczne,
okazała się ramnogalakturonaza A, wykryta w 1990 r., wytwarzana przez Aspergillus
aculeatus.
Innymi enzymami zdolnymi do depolimeryzacji rozgałęzionych fragmentów pektyn są:
endoarabanaza (niezbędna do hydrolizy liniowych łańcuchów arabanu), β-galaktozydaza
(zdolna do odłączenia wszystkich bocznych reszt galaktozy, obecnych w oligosacharydach
uwolnionych z rozgałęzionych fragmentów pektyny).
Stąd nowoczesne preparaty enzymatyczne, wykorzystywane do obróbki miazgi jabłkowej,
pozwalają na selektywne rozkładanie struktury pektynowej ścian komórkowych, co wiąże się
ze zmniejszeniem lepkości miazgi. W efekcie zwiększa się uzysk soku, poprawia jego jakość,

10
a zmniejsza ilość wytłoków. Do zalet tego typu preparatów należy także to, że działają
w relatywnie niskiej temperaturze (ok. 25°C), nadają się do obróbki miazgi z jabłek różnych
odmian (poziom pH nie ogranicza jego działania), zarówno świeżych, jak i pochodzących
z przechowalni, a ponadto mogą być stosowane przy wykorzystaniu różnego typu pras.
Część doświadczalna
Ćwiczenie 6. Amylazy i enzymy pektynolityczne.
Zastosowanie enzymów w procesach technologii żywności
Część A) Amylazy
Celem
doświadczenia jest zbadanie procesu enzymatycznej hydrolizy skrobi.
W ćwiczeniu wykorzystana zostanie α-amylaza pochodzenia bakteryjnego wyprodukowana
przez mikroorganizmy z rodzaju Bacillus.
I. Przygotować probówki zawierające po 1 cm
3
roztworu jodu w KI (2 zestawy po 8 sztuk).
II. Następnie przygotować 2 kolby zawierające po 100 cm
3
kleiku skrobiowego
i przeprowadzić doświadczenia według poniższych instrukcji:
Kleik nr 1
1) Do kolby stożkowej o poj. 300 cm
3
wprowadzić 100 cm
3
.
2) Kolbę umieścić w łaźni wodnej w temperaturze 40
o
C wodnej na okres 5 minut.
3) Następnie pobrać próbkę zerową (1 cm
3
) i dodać ją do probówki zawierającej roztwór jodu.
4) Do pozostałego kleiku (znajdującego się w kolbie) dodać 1 cm
3
roztworu amylazy
i zawartość intensywnie wymieszać.
Hydrolizę prowadzić w temperaturze 40
o
C (umieszczając kolbę zawierającą kleik w łaźni
wodnej). Przed każdorazowym pobraniem próbki zawartość kolby wymieszać. Próbki do
badań należy pobierać co 3 minuty, czyli po 3, 6, 9, 12, 15, 18 i 21 minutach i pobrane próbki
(1 cm
3
) dodawać do kolejnych probówek zawierających roztwór jodu.
Kleik nr 2
Czynności pkt 1-3 wykonujemy analogicznie jak podczas przygotowywania kleiku nr 1.
4) Po pobraniu próbki zerowej, kleik 2 inkubować w łaźni wodnej o temperaturze 40
o
C
bez dodawania enzymu!
11
Próbki do badań należy pobierać co 3 minuty, czyli po 3, 6, 9, 12, 15, 18 i 21 minutach
i pobrane próbki (1 cm
3
) dodawać do kolejnych probówek zawierających roztwór jodu.
III. Oznaczenie lepkości kleików skrobiowych po 21-minutowej inkubacji (z dodatkiem i bez
dodatku enzymu) należy przeprowadzić przy użyciu wypływowego miernika lepkości typu
KUBEK FORDA.
Zasada metody:
Oznaczenie lepkości polega na pomiarze czasu wypływu [s] cieczy o objętości 60 cm
3
przez
dyszę o średnicy 3 mm w temperaturze 40
o
C.
Sposób przeprowadzenia pomiaru:
- zatykając palcem otwór w probówce typu Falcone nalać do probówki kleik o temperaturze
40
o
C (probówka powinna być wypełniona w całości, ciecz należy wyrównać z rantem
probówki poprzez zgarnięcie jej nadmiaru bagietką lub łyżeczką),
- następnie równocześnie ze ściągnięciem palca z otworu w probówce włączamy stoper
mierząc czas, podczas którego wypłynie cała zawartość probówki (oznaczenie wykonać
w trzech powtórzeniach zarówno dla kleiku nr 1, jak i nr 2),
-
zanotować czasy wypływu kleików w poniższej tabeli, wyliczyć wartość średnią dla
kleików nr 1 i 2, a następnie zinterpretować uzyskane wyniki.
Kleik skrobiowy 1
(inkubowany
z dodatkiem enzymu)
Kleik skrobiowy 2
(inkubowany
bez dodatku enzymu)
Cz
as wyp
ływu
z
k
u
b
k
a For
d
a [s]
Pomiar 1
Pomiar 2
Pomiar 3
Wartość średnia
± odch. stand.

12
Część B) Enzymy pektynolityczne
Celem doświadczenia jest zbadanie przydatności preparatów enzymatycznych do zwiększenia
wydajności produkcji soku z jabłek.
1. Połowę jabłka obrać i usunąć z niego gniazda nasienne.
2. Przygotować dwa kawałki jabłka ważące ok. 30 g (2 x 30g).
3. Każdy kawałek jabłka pokroić w drobną kostkę (ok. 0,2 x 0,2 x 0,2 cm).
4. Przygotować 2 zlewki (obj. 100 ml). Do pierwszej zlewki wprowadzić 20 ml wody
destylowanej.
5. Do drugiej zlewki odmierzyć 5 ml preparatu enzymatycznego i 15 ml wody destylowanej,
a następnie wymieszać przygotowany roztwór.
6. Do zlewek nr 1 i 2 ostrożnie włożyć przygotowane dwa zestawy pokrojonych w kostkę
jabłek.
7. Zlewki przykryć folią aluminiową i wstawić do łaźni wodnej (40°C) na 25 minut.
8. Po inkubacji całą zawartość zlewek przełożyć do lejków (z sączkami) umieszczonych
w cylindrach miarowych (obj. 100 ml).
9. Po 5, 10, 15 i 20 minutach odczytać poziom cieczy w cylindrach i wynik zanotować.
Narysować wykres zmiany objętości otrzymywanego soku w czasie (dla dwóch
przygotowanych wariantów doświadczenia).
10. Po 20 minutach obserwacji ocenić stopień zmian wyglądu jabłek dla obydwu wariantów
doświadczenia, następnie wycisnąć do cylindra całą zawartość soku z jabłek.. Pod
wykresem opisać zaobserwowane różnice w wyglądzie jabłek oraz podać uzyskany
ostatecznie poziom cieczy w cylindrach dla dwóch wariantów doświadczenia.
Literatura:
1) Pijanowski E., Dłużewski M., Dłużewska A., Jarczyk A. 2004. Ogólna technologia żywności.
Wydawnictwa Naukowo-Techniczne, Warszawa.
2) Kączkowski J. 2005. Podstawy biochemii. Wydawnictwa Naukowo-Techniczne, Warszawa.
3) Dłużewski M., Dłużewska A. 2008. Technologia żywności. WSiP, Warszawa.
4) Nowak D. 2008. Enzymy jako nowoczesne narzędzie technologiczne. Agro Przemysł. 2: 28-30.
5) Kołodziejczyk A. Naturalne związki organiczne. Wydawnictwo Naukowe PWN, Warszawa, 2004.
6) Rutkowski A., Gwiazda S., Dąbrowski K. Dodatki funkcjonalne do żywności. Agro & Food
Technology, Katowice, 1993.
7)
Ćwiczenia z biochemii. Praca zbiorowa pod red. L. Kłyszejko-Stefanowicz.
Wydawnictwo Naukowe PWN, Warszawa 2003.
Wyszukiwarka
Podobne podstrony:
więcej podobnych podstron