
SPIS TREŚCI
KRWIOLECZNICTWO – ASPEKT LABORATORYJNY I KLINICZNY
..............................................
Badanie immunohematologiczne w diagnostyce choroby hemolitycznej noworodków
ZASADY POSTĘPOWANIA POPRZEDZAJĄĆE WYKONANIE PRÓBY KRZYŻOWEJ
ZAKRES BADAŃ WYKONYWANYCH DLA PRÓBY KRZYŻOWEJ
.............................................
PRÓBA KRZYŻOWA JEST ZGODNA, GDY
.................................................................................
ZASADY POSTĘPOWANIA PRZED TRANSFUZJĄ
.....................................................................
Wpływ hipoalbuminemii na czynność organizmu:
..........................................................................
Zastosowanie kliniczne albuminy
...............................................................................................
WSKAZANIA DO PODAWANIA ALBUMIN
....................................................................................
WYBRANE PROBLEMY KLINICZNE OBCIĄŻONE ZAKRZEPICĄ
............................................
..................................................................................................
Schemat postępowania w przypadku odczynu poprzetoczeniowego hemolitycznego:
Etapy postępowania w przypadku reakcji poprzetoczeniowej:
....................................................
DIAGNOSTYKA LABORATORYJNA CHORÓB WĄTROBY
..........................................................
Tzw. poszerzone próby wątrobowe = biochemiczna wstęga wątroby:
........................................
Badania oceniające integralność komórki wątrobowej:
...............................................................
..................................................................................................
Badania oceniające drożność dróg żółciowych;
...........................................................................
Diagnostyka laboratoryjna żółtaczek:
...........................................................................................
....................................................................................................
5’-nukleotydaza (odpowiednik ALP)
.........................................................................................
..........................................................................................
.................................................................................................
ZESPOŁY UWARUNKOWANE GENETYCZNIE
.........................................................................
Zespół Dubin-Johnson i zespół Rotora
.....................................................................................
Badanie oceniające zdolności syntetyzujące:
..............................................................................
Badania oceniające funkcję detoksykacyjną i wydzielniczą wątroby:
......................................
Badania wskazujące na proces zapalny:
..................................................................................
Przyczyny obniżonego cholesterolu:
........................................................................................
Pierwotna marskość żółciowa, PBC (Primary Biliary Cirrhosis)
...................................................
Pierwotne stwardniejące zapalenie dróg żółciowych, PSC (Primary Sclerosing Cholangitis)
DIAGNOSTYKA CHORÓB NOWOTWOROWYCH
.........................................................................
1

Ocena laboratoryjna i różnicowanie niedokrwistości
....................................................................
Trombocytopenia w chorobach nowotworowych < 130 x 106 /l
.............................................
Hipertrombocytoza > 600 x 106 /l
...........................................................................................
Humoralne markery odróżnicowania:
...........................................................................................
Humoralne markery proliferacji:
...................................................................................................
Czynniki ryzyka HCC (Hepatocellular Carcinoma):
..................................................................
CEA (Carcinoembryonic Antigen)
................................................................................................
Monitorowanie raków jelita grubego:
............................................................................................
Czułość diagnostyczna w rakach przewodu pokarmowego:
....................................................
DIAGNOSTYKA LABORATORYJNA OSTRYCH POWIKŁAŃ CUKRZYCY I STANÓW
NIEPRZYTOMNOŚCI INNEGO POCHODZENIA
...........................................................................
Zaburzenia świadomości i przytomności:
.....................................................................................
Wartości poszczególnych parametrów w surowicy / osoczu:
.....................................................
Różnicowanie zaburzeń gospodarki wodnej:
...............................................................................
Gazometria krwi tętniczej u pacjentów z dusznością bez zmian w rtg klatki piersiowej:
Porównanie patogenezy cech klinicznych cukrzycy typu I i II
......................................................
Mechanizm kwasicy ketonowej w cukrzycy:
................................................................................
Diagnostyka laboratoryjna powikłań cukrzycy w śpiączce
...........................................................
Kwasica mleczanowa może wystąpić w przebiegu:
.................................................................
Przyczyny hipoglikemii na czczo:
.............................................................................................
Przyczyny hipoglikemii poposiłkowej:
.......................................................................................
PRZYCZYNY ZABURZEŃ ŚWIADOMOŚCI I PRZYTOMNOŚCI
...............................................
..................................................................................
................................................................................................
.................................................................................................
...........................................................................................
.................................................................................................
2

..............................................................................................
LABORATORYJNA OCENA ZAGROŻENIA MIAŻDŻYCĄ I ROZPOZNAWANIE POWIKŁAŃ
MIAŻDŻYCY
................................................................................................
Troponina – marker wczesno i późnodiagnostyczny
................................................................
.................................................................................................
Kryteria świeżego zawału , w trakcie ewolucji lub niedawno przebytego:
................................
DIAGNOSTYKA LABORATORYJNA CHORÓB NEREK
................................................................
.................................................................................................
....................................................................
Odmiedniczkowe zapalenie nerek
................................................................................................
.............................................................................................
...................................................................................................
Czynniki uczestniczące w patogenezie dystrofii nerkowej
.......................................................
3
KRWIOLECZNICTWO – ASPEKT LABORATORYJNY I KLINICZNY
ZAKRES BADAŃ
1
układ ABO, Rh, D (Kell)
2
wykrywanie przeciwciał odpornościowych do antygenów erytrocytów w PTA (pośrednim teście
Coombsa) i w teście enzymatycznym
*
u wszystkich biorców
*
u kobiet przed porodem
*
jako badanie zlecane odrębnie
3
próba zgodności krwi ( próba krzyżowa)
*
próbki krwi biorcy specjalnie pobranej w tym celu
*
próbki krwi dawcy z segmentu drenu ( osobna próbka)
*
ważność próby zgodności od momentu pobrania do 48 h
*
wynik próby zgodności na specjalnym druku
*
w przypadku odczynu poprzetoczeniowego powtarza się wszystkie badania z
zabezpieczeniem krwi biorcy i dawcy; krew dawcy oraz krew biorcy po przetoczeniu są
przekazywane do RCKiK do niezbędnej analizy serologicznej
4
bezpośredni test antyglobulinowy BTA (bezpośredni test Coombsa)
*
wykrywanie przeciwciał na krwinkach noworodków z podejrzeniem choroby hemolitycznej
( konflikt serologiczny)
*
wykrywanie przeciwciał u osób z anemią hemolityczną
5
badanie kwalifikujące do podania IgG-anty D w profilaktyce konfliktu serologicznego
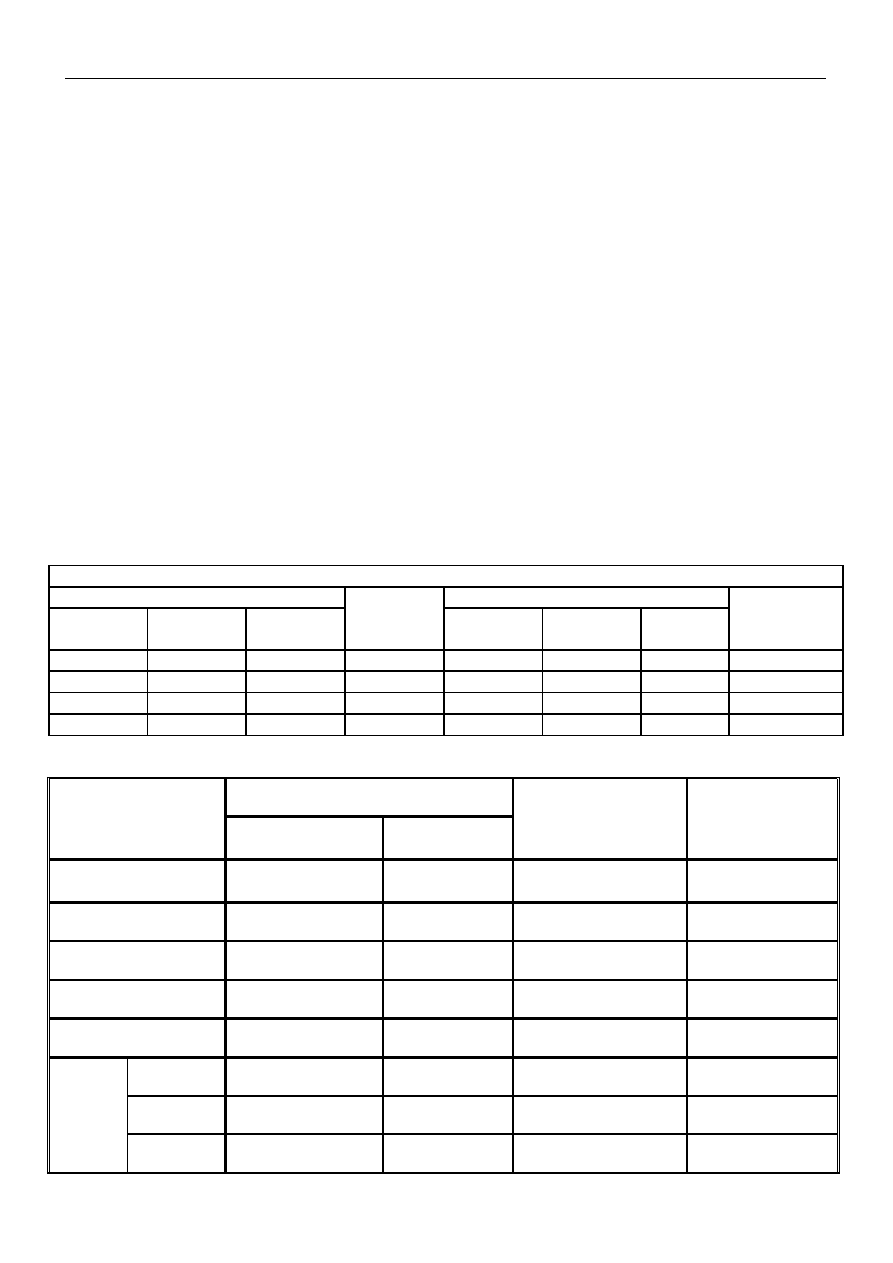
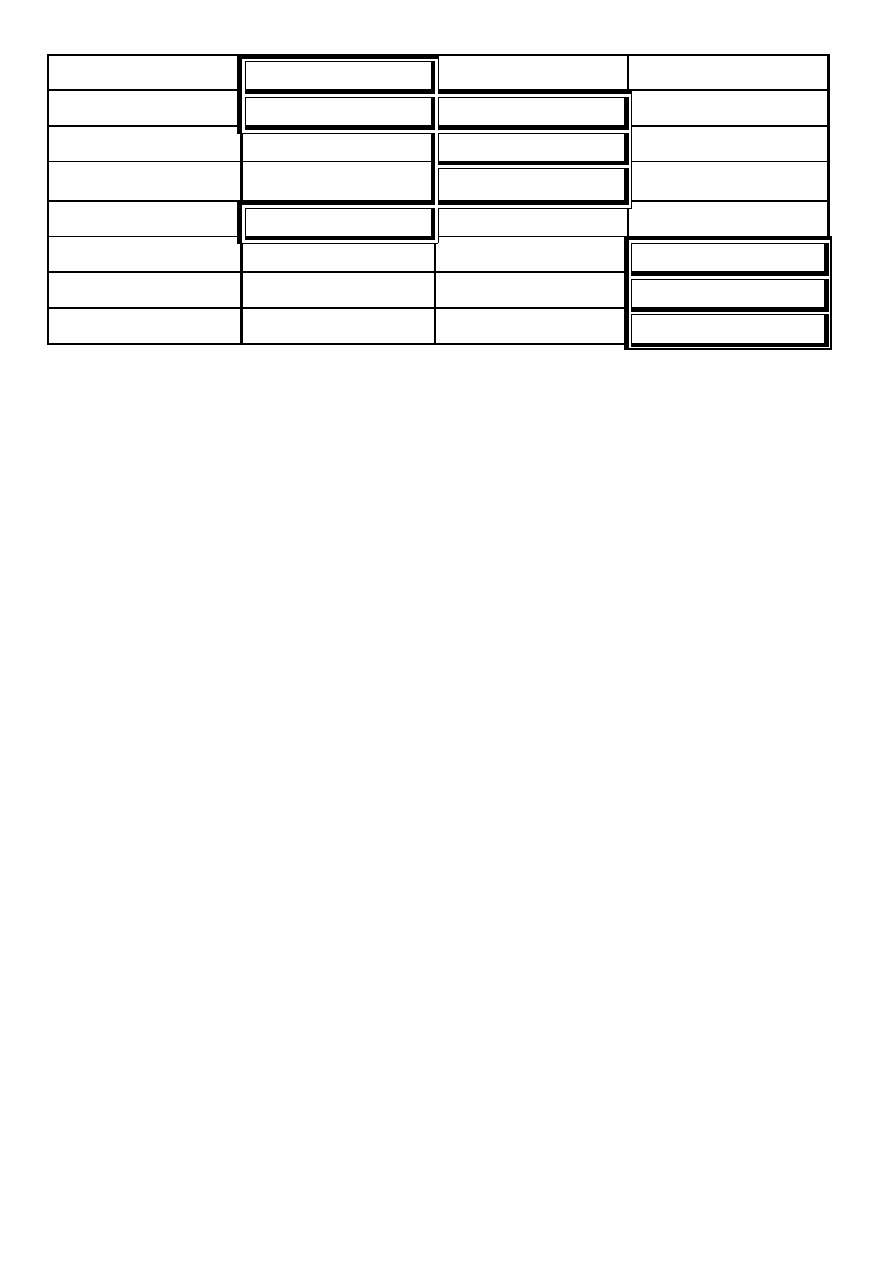
WYNIKI BADANIA KRWINEK CZERWONYCH I SUROWICY W UKŁADZIE AB0
Krwinki badane z surowicą
Antygen
krwinek
badanych
Surowica badana z krwinkami
Przeciwciała
w surowicy
badanej
anty A
anty B
Anty A+B
„0”
„A”
„B”
+
-
+
A
-
-
+
anty B
-
+
+
B
-
+
-
anty A
+
+
+
AB
-
-
-
- -
-
-
-
0
-
+
+
anty A anty B
przeciwciała z układu
środowisko
pośredni test
antyglobulinowy
( PTA )
zalecany test
NaCl 150mM
temp. pokojowa
papaina
Rh
-
, rzadko
+
+
+
papaina
PTA
Kell
-
-
, rzadko
+
+
PTA
Duffy
-
-
+
PTA
Kidd
-
-
+
PTA
Lewis
+ , czasem hemoliza
-
, rzadko
+
+
PTA
MNSs
anty-M
+
-
-
, rzadko
+
NaCl
anty-N
+
-
-
NaCl
anty-S
+
-
-
lub
+
NaCl lub PTA
4
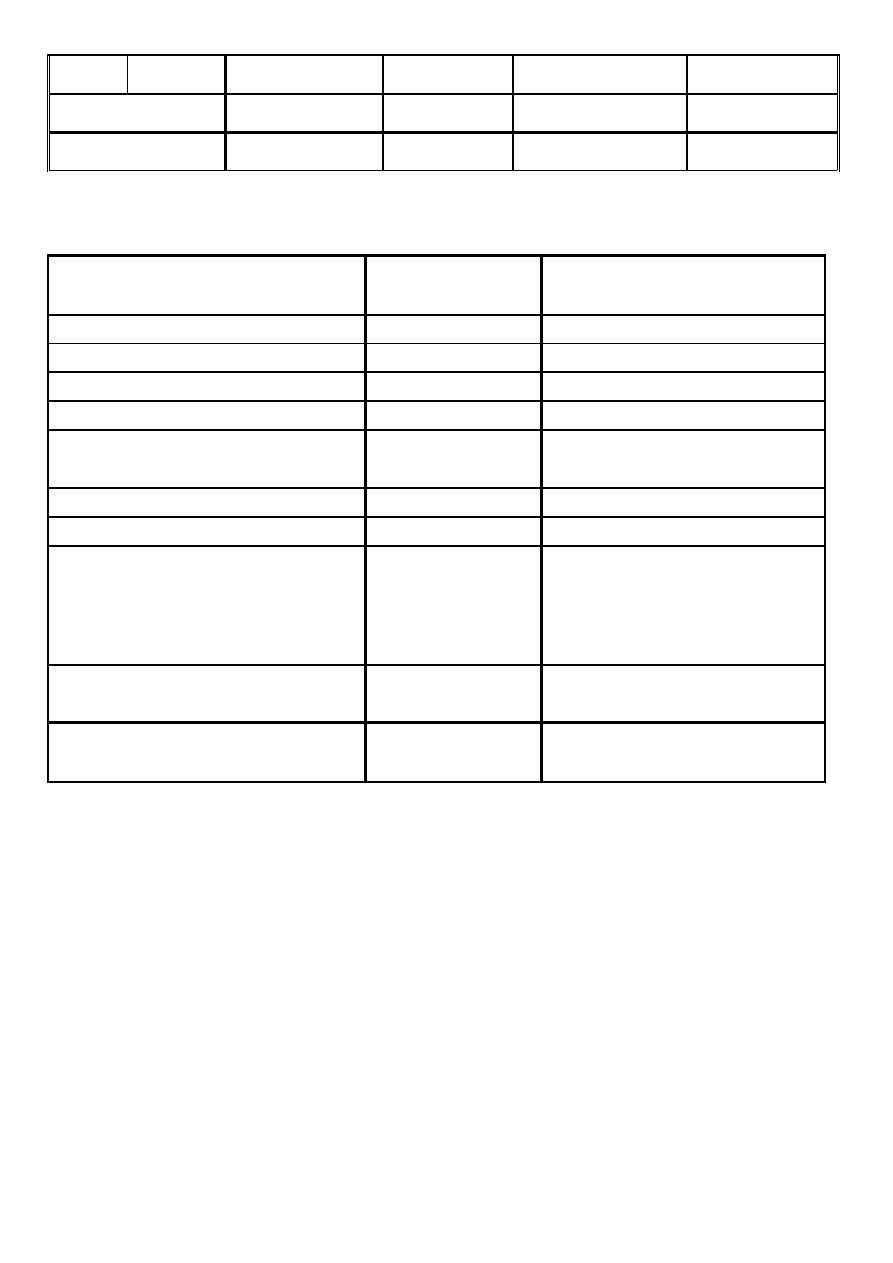
anty-s
-
+
PTA
P
+
+
-
NaCl
Lutheran
+
-
-
NaCl
Duffy, Kidd, Lewis odpowiedzialne za powikłania późne. Konieczne oznaczenie u pacjentów często
leczonych krwią.
Właściwości przeciwciał odpornościowych i naturalnych
przeciwciała
naturalne
przeciwciała odpornościowe
klasa Ig
IgM
IgG
ciężar cząsteczkowy
900 000
150 000
ciężar w surowicy
80-200
1000 – 1500
przejście przez łożysko
nie
tak
optymalna temp. reakcji z antygenem
4 – 18°C
37°C
wiązanie komplementu
tak
nie
czas reakcji z antygenem
minuty
ok. 30 min
środowisko reakcji
150 mM NaCl
środowisko niskojonowe
30 mM NaCl + surowica
antyglobulinowa
środowisko papainowe
środowisko albuminowe
wrażliwość cieplna
tracą aktywność w
temp. 70°C
ciepłostabilne w temp. 70°C
powstawanie w odpowiedzi na antygeny
układów grupowych
ABO, Lewis, P, MNSs wszystkie układy grupowe krwinek
Skierowanie na badanie krwi
Skierowanie na badanie zgodności grupowej
Wybór krwi do transfuzji:
krew zgodna w układzie ABO i D z układem Rh z biorcą
biorcy z przeciwciałami odpornościowymi otrzymują krew nie zawierającą odpowiadającego im
antygenu oraz krew zgodną fenotypowo w układzie Rh i układzie Kell
biorcy z anemią autoimmunohemolityczną typu ciepłego otrzymują krew zgodną fenotypowo w
układzie Rh i Kell
kobiety do menopauzy otrzymują krew Kell „-”, chyba, że posiada antygen Kell, wtedy dostaje
Kell „+”
5

Transfuzja koncentratu krwinek czerwonych grupy „O” chorym innej grupy krwi:
stany zagrożenia życia przy braku krwi jednoimiennej
brak zgodnej krwi jednoimiennej dla biorcy z obecnymi alloprzeciwciałami odpornościowymi
bardzo słaba ekspresja ag. A lub B lub trudności w oznaczeniu ABO
brak krwi Rh ujemnej, jednoimiennej w ABO
Transfuzja w nagłych przypadkach:
1. wydanie zmówionej krwi przed wykonaniem zgodności pod warunkiem sprawdzenia
antygenów ABO i D z układem Rh u dawcy i
biorcy / pp. odczynników monoklonalnych nie
wymagających przemywania krwinek – ok. 5 min.
2. po wydaniu bezzwłocznie wykonuje się próbę zgodności; w zależności od wyniku
kontynuuje się transfuzję lub przerywa
3. w wyjątkowych nagłych przypadkach przed wykonaniem badania grup krwi biorcy i próby
zgodności, wydaje się KKCZ grupy O, a kobietom w okresie rozrodczym KKCZ
grupy O „-”; natychmiast przystępuje się do określenia u biorcy grupy ABO i Rh oraz do
przeglądowego badania przeciwciał i wykonania próby zgodności
B19 wirus + zarodziec malarii
⇒
trudności w oznaczaniu antygenów w krwinkach
Badanie immunohematologiczne w diagnostyce choroby hemolitycznej noworodków
1. do 12 tyg. ciąży – wszystkie ♀
- grupa ABO i Rh
- alloprzeciwciała odpornościowe
- Kell
brak przeciwciał
alloprzeciwciała
odpornościowe
brak przeciwciał
3. po porodzie
kobiety Rh „-” : badanie kwalifikacyjne do podania IgG anty-D
kobiety Rh „+” : alloprzeciwciała odpornościowe, gdy dziecko wymaga leczenia krwią
Podanie IgG anty-D:
150 µg
po porodzie fizjologicznym
300 µg
po porodzie operacyjnym lub bliźniaczym
50 µg
po poronieniu do 12 tyg ciąży
150 µg
po poronieniu po 12 tyg ciąży
6
2.
28 tyg.
ciąży –
wszystkie ♀
alloprzeciwciała obecne:
identyfikacja
stała kontrola poziomu
badanie krwi ojca dziecka
kwalifikacja do wewnątrzmacicznej
diagnostyki
diagnostyka ChHN

ZASADY POSTĘPOWANIA POPRZEDZAJĄĆE WYKONANIE PRÓBY
KRZYŻOWEJ
1. identyfikacja Biorcy i oznakowanie jego próby krwi. Do badań musi być bezwzględnie poprawne.
2. Dane o Biorcy krwi w próbę krwi.
Nazwisko, imię, data urodzenia, data pobrania krwi
3. Skierowanie na próbę krzyżowa powinno obejmować:
Nazwisko, imię, datę urodzenia, grupę krwi i Rh, obecność przeciwciał odpornościowych, wcześniejsze
transfuzje, u kobiet - przebyte ciąże, wskazania do transfuzji
ZAKRES BADAŃ WYKONYWANYCH DLA PRÓBY KRZYŻOWEJ
1. Kontrola antygenów ukl. AB0 i Kell u biorcy i dawcy krwi
2. Kontrola ag D u biorcy krwi
3. Sprawdzenie obecności przeciwciał odpornościowych w surowicy biorcy przeciwko krwinkom dawcy
-met. Pośredniego testu antyglobulinowego (PTA)
-met. Enzymatyczna (LEN)
4. Sprawdzenie obecności przeciwciał odpornościowych w surowicy biorcy przeciwko krwinkom
wzorcowym zawierającym antygeny dla których najczęściej są wytwarzane przeciwciała np. "0," KEll,
Duffy, Lewis, Kidd
-met. PTA - met. LEN
PRÓBA KRZYŻOWA JEST ZGODNA, GDY
1. Dawca i biorca posiadają te same antygeny w układzie AB0
2. Stwierdzenie niezgodności dawcy i biorcy w grupach głównych oznacza konieczność niezwłocznego
wyjaśnienia przyczyny pomyłki, łącznie z wykonaniem kontrolnych oznaczeń wszystkich grup krwi,
oznaczanych danego dnia
3. Wynik kontrolnego oznaczenie Rh Biorcy jest zgodny z oznaczonym pierwotnie. W przypadkach
niezgodności wyników należy ustalić jej przyczynę.
4. Surowica biorcy nie zawiera przeciwciał dla krwinek dawcy. W przypadku stwierdzenia przeciwciał
trzeba określić ich swoistość i dobrać krew dawcy nie zawierająca antygenu dla którego biorca wytworzył
rzeciwciała.
ZASADY POSTĘPOWANIA PRZED TRANSFUZJĄ
1. Identyfikacja biorcy krwi
2 Dokumentacja biorcy: imie, nazwisko, data urodzenia, grupa krwi i Rh
3. Sprawdzenie wyniku próby krzyżowej
4. Dokumentacja dawcy: grupa krwi i Rh, nr dawcy, data ważności preparatu(35-42 dni)
5. Ocena makroskopowa hemopreparatu: hemoliza, strąty, zmętnienie osocza, skrzepy - dyskwalifikacja
6. Ujemne wyniki dawcy w kierunku nosicielstwa ch. zakaźnych
"/-/ ujemny"
Obliczanie i zachowywanie się wskaźników hematologicznych:
obliczanie hemoglobiny
⇒
3 x wartość liczbowa krwinek czerwonych
obliczanie hematokrytu
⇒
3 x wartość hemoglobiny
1% HCT odpowiada 100 000 krwinek czerwonych
transfuzja 1 j. koncentratu krwinek czerwonych
⇒
podwyższa stężenie HGB o 1,0 g/dl i
HCT o 3-4%
utrata 400 ml krwi pełnej oznacza obniżenie HGB o 1 g/dl i krwinek czerwonych o 350 000/mm
3
Charakterystyka wybranych preparatów krwi:
preparat
objętość w
ml
skład
efekt kliniczny
7
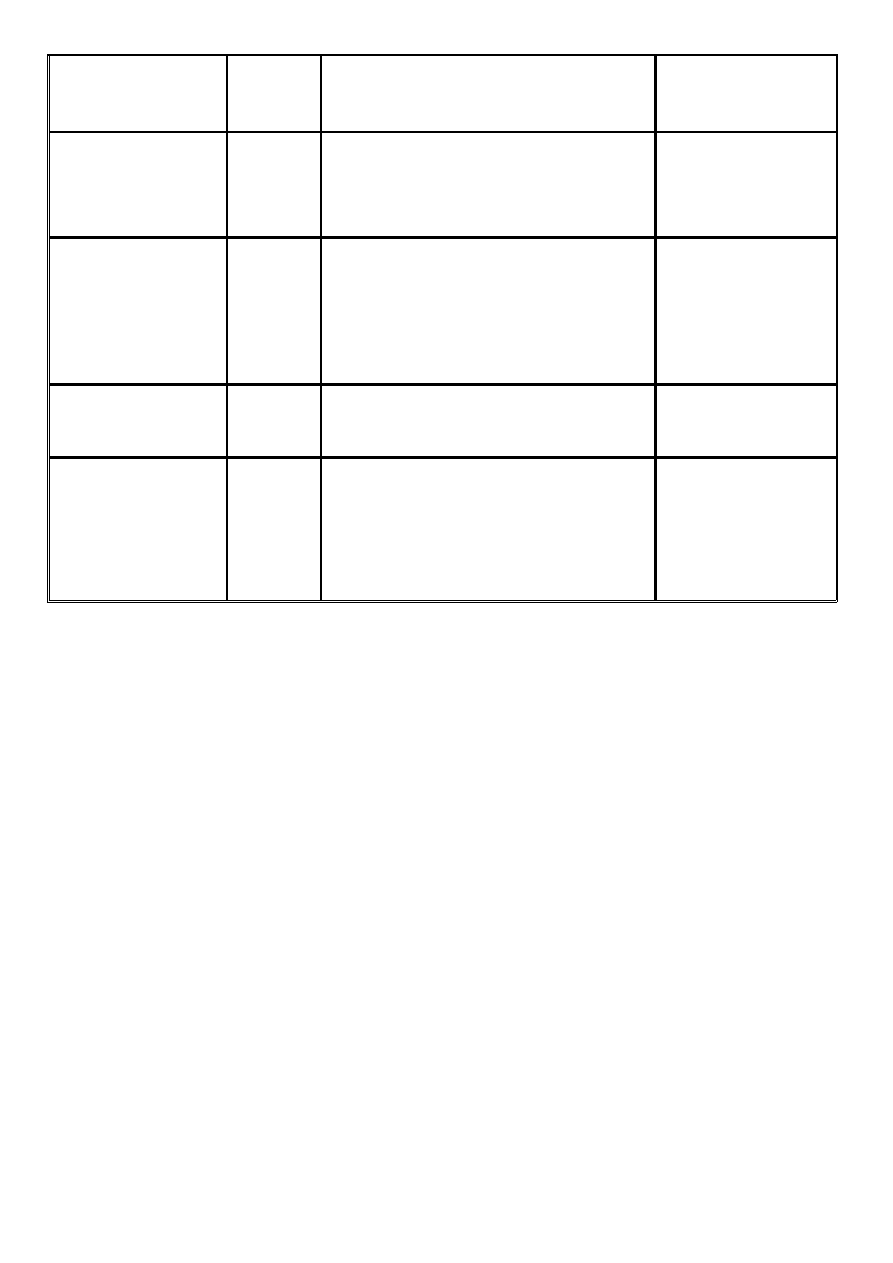
KKCZ
KKCZ filtrowany
180 - 300
erytrocyty ze zmienną ilością leukocytów i
małą ilością osocza
↑
HGB o
1 g/dl
↑
HCT o
3%
KKP koncentrat
płytkowy uzyskany
metodą wirowania
50 - 70
5,5 x 10
10
/ jednostkę koncentratu
płytkowego
↑
liczby płytek o
5000
– 10 000 / µl
KKP koncentrat
płytkowy uzyskany
metodą aferezy od
jednego dawcy
200 - 400
≥
3 x 10
11
/ preparat od jednego dawcy
CCL
≥
10 x 10
9
/ l
po 1
h od przetoczenia;
≥
7,5 x 10
9
po 24 h od
transfuzji
FFP ( osocze świeżo
mrożone )
FFP + AHG
200 - 250
białka osocza, czynniki krzepnięcia, białko
C i S, antytrombina III
↑
poziomu czynników
krzepnięcia o ok.
2%
krioprecypitat
10 - 15
nierozpuszczalne na zimno białka osocza,
fibrynogen, czynnik VII, czynnik von
Willebranda
lokalne tworzenie
skrzepu fibrynowego;
zawiera także 80 IU cz.
VIII
HGB < 7 g/dl
→
dopiero wówczas toczymy krew
Chory z chorobą nowotworową powinien otrzymać preparat krwi filtrowany, bo filtrowanie zatrzymuje
leukocyty i płytki krwi
→
przetoczenie z płytkami powoduje przyspieszony rozwój choroby nowotworowej
( kaskada hemostatyczna )
→
podobnie w innych chorobach o podłożu immunopatologicznym.
FFP antyhemofilowe uzyskane w ten sposób, że w czasie do 6 h jest chłodzone do temp. „-” bo zachowane
są wówczas czynniki krzepnięcia ( cz. VIII, IX ).
Powolne rozmrażanie FFP antyhemolitycznego powoduje wytrącanie się różowego materiału na ściankach
czyli krioprecypitat.
Krwinki płytkowe zamawiamy, gdy ich liczba < 70 000 / mm
3
,
ew. 35 – 45 000 / mm
3
sprawnych płytek
Małopłytkowość jatrogenna / polekowa to najczęstsza przyczyna toczenia płytek ( najczęściej NLPZ,
cefalosporyny, leki neurologiczne ).
Wskazania do transfuzji:
KKCZ ( wg bilansu utlenowania tkankowego )
zużycie O
2
< 100
( N. 110 – 160 ml/min/m
2
)
współczynnik ekstrakcji O
2
> 0,5
( N. 0,2 – 0,3 )
stężenie mleczanów
> 4
( N. <2 mmol/l (?))
pH błony śluzowej żołądka
< 7,32
( N. 7,35 – 7,41 )
HGB
< 7 g/dl
8

Wpływ hipoalbuminemii na czynność organizmu:
↓
liczby miejsc wiążących hormony, leki, wit. A, D, B
12
, K , kw. tłuszczowych, bilirubiny, jonów
wapnia i miedzi
upośledzenie wychwytywania wolnych rodników tlenowych i azotowych zwłaszcza u chorych z
posocznicą
upośledzenie działania przeciwkrzepliwego i antyagregacyjnego albuminy oraz jej działanie
hamujące aktywność AT III
w chorobach nowotworowych hipoalbuminemia spowodowana jest
↓
syntezą albumin,
↑
przepuszczalnością ścian naczyń w wyniku reakcji zapalnych,
↑
zapotrzebowaniem energetycznym
z następczym
↑
katabolizmu albumin
w chorobach nowotworowych obserwuje się
↑
stężenie cytokin TNF, Il-1, 6 ( hamowanie ekspresji
mRNA albuminy)
w reakcji ostrej fazy postresowej synteza albuminy spada < 2,5
Zastosowanie kliniczne albuminy
* niedobory z hipoalbuminemią osoczową
z objawową hipowolemią i masywnymi obrzękami: efekt koloidoosmotyczny
utrudniony transport leków: efekt czynnościowy
* normoalbuminemia z tzw. niedoborem czynnościowym – efekt przejściowego łączenia albuminy z
niektórymi substancjami
* normoalbuminemia z tzw. efektem osmotycznym – dla
↑
ciśnienia koloidoosmotycznego
sprowadzającego płyny tkankowe do łożyska naczyniowego w celu zapobieżenia hipowolemii i
obrzękom o innej niż hipoalbuminemia etiologii
Roztwory 5%:
choroba oparzeniowa, wstrząs, ciężkie niedobory białka pochodzenia metabolicznego lub
pokarmowego
hipoalbuminemia z zaburzeń transportu leków i/lub substancji toksycznych m.in. bilirubiny
obrzęk mózgu, ciężka hipoalbuminemia z obrzękami i ascites
Roztwory 20%:
ostre zespoły nerczycowe
choroba oparzeniowa
hipoalbuminemia u dializowanych
WSKAZANIA DO PODAWANIA ALBUMIN
Wymiana osocza/dializa
TAK – aby utrzymać RR
Choroba hemolityczna noworodków
TAK - w celu związania pośredniej bilirubiny
podczas transfuzji wymiennej
Utrata białka w nefropatii i enteropatii
TAK – w przeciążeniu krążenia w celu
wymuszenia diurezy (stosować razem z lekiem
moczopędnym) w przypadkach przeciążenia
płynami
NIE – w pierwszej dobie
NIE – po 24h od wystąpienia niedoboru białek
Ostra/przewlekła niewydolność wątroby
TAK - w przeciążeniu płynami w celu
pobudzenia diurezy (stosować razem z lekiem
moczopędnym)
TAK - w hipotensji w celu podniesienia
ciśnienia krwi
9

NIE - w celu podniesienia albuminy w osoczu
Wodobrzusze
TAK - jeśli po nakłuciu wystąpiła hipotensja
NIE - w celu zmniejszenia płynu w jamie
brzusznej
Wstrząs (niekrwotoczny)
TAK - jeżeli ilość białka całkowitego w osoczu
jest niższa niż 52g/L
NIE - jeżeli ilość białka całkowitego jest
wyższa niż 52g/L
Zespół ostrej niewydolności oddechowej u
dorosłych
TAK - jeżeli ilość białka całkowitego jest
niższa niż 52
NIE - prawdopodobnie lepiej stosować
krystaloidy
Odżywianie pozajelitowe
NIE - stosować całkowite odżywianie
pozajelitowe lub doustne
Gojenie ran
NIE - tylko w celu zmniejszenia obrzęków
obwodowych u chorych niedobiałczonych
Przeciwwskazania i uwagi:
25% albumin nie należy stosować u chorych odwodnionych, zanim nie uzupełni się objętości krwi krążącej
roztworami krystaloidów
Opisywane są objawy uboczne tj.: rumień, pokrzywka, dreszcze, gorączka, bóle głowy
PRZYCZYNY ZUŻYWANIA SIĘ BIAŁEK
ATIII
Białko C
Białko S
Choroby wątroby
Choroby wątroby
Choroby wątroby
Enteropatie z utrata białka
ARDS
Ciąża
DIC
DIC
DIC
Zespól nerczycowy
Hemodializa
Zespól nerczycowy
Masywna zakrzepica żylna
Toczeń układowy
Duże zabiegi operacyjne
Jatrogenne:
Jatrogenne:
Jatrogenne:
Heparyna
L-asparaginaza
Kumaryny
Estrogeny
Kumaryny
Estrogeny
L-asparaginaza
L-asparaginaza
WYBRANE PROBLEMY KLINICZNE OBCIĄŻONE ZAKRZEPICĄ
1. Położnictwo - Ginekologia
Ciąża
fizjologia - wzrost stężenia czynników II,VII,VIII, X, fibrynogen, czynnik von Wilebranda, zmniejszenie s.
BS, aktywności fibrynolizy (wzrost aktywności PAI-1)
patologia - wrodzona trombofilia, obecne przeciwciała antyfosfolipidowe
Postulat wykonać badanie w kierunku trombofilii - wywiady położnicze (rodzinne) profilaktyka p. ATIII
przed terapią hormonalna
2. Chirurgia
Endoprotezoplastyka stawu biodrowego: heparyna + ATIII profilaktycznie
uwzględnić czynniki ryzyka żylnej choroby zakrzepowej
3. Choroby wewnętrzne
CTEPH
10

Patologia:
Heterozygotyczny niedobór białka C lub białka S lub ATIII lub obecność antykoagulantu tocznia
Zespól Budda-Chiariego - zespól wieloprzyczynowy (m.in. niedobór ATIII lub białka C)
Nefrologia - spadek ATIII z białkomoczem przy wzroście białka C
Zakrzepica żyły nerkowej lub tętnicy
Hemodializa spadek ATIII ew. EPO, podobnie cyklosporyna A
Kardiologia - wzrost fibrynopeptydu A i T-AT w zawale i stabilnej chorobie niedokrwiennej serca
Nagle odstawienie antykoagulanta - wzrost F1+2 i T-AT
Onkologia
-wzrost fibrynogenu, czynnika V, VIII, IX, XI, vWf, trombocyty, PAI
-spadek ATIII, białek C i S
-spadek fibrynogenu, liczby trombocytów
PREPARATY ANTYTROMBINY
ANTITHOMBIN III IMMUNO
ATIII- 50 IU
Białko- 20-50 mg
Glukoza - 10mg
NaCl - 9mg
Cytrynian sodowy x 2H2O - 1mg
Tris - 1mg
Dawkowanie:
Dawka ATIII = pożądany wzrost aktywności% x kg m.c. [w DIC]
Dawka ATIII = pożądany wzrost aktywności x kg m.c. / 2 + kompleks protrombinowy [w niewydolności
wątroby]
Składnik krwi
* krwinki czerwone
hemoliza
gorączka niehemolityczna
niekardiogenny obrzęk płuc
pokrzywka
* osocze
anafilaktoidalny (?)
* osocze zawarte w KKCZ
hypotonia ( obecny cz. Hagemana)
* granulocyty
gorączka
dreszcze
niekardiogenny obrzęk płuc
odczyny wywołane leukoaglutyninami
* trombocyty
gorączka
dreszcze
alloimmunizacja
11

Schemat postępowania w przypadku odczynu poprzetoczeniowego
hemolitycznego:
* diagnostyka
gorączka, dreszcze, hipotonia, nudności
wolna HGB w moczu i/lub osoczu
dodatni bezpośredni odczyn Coombsa
nieprawidłowe wyniki testów koagulologicznych
* postępowanie
przerwać transfuzję hemopreparatu
transfuzja 0,9% NaCl
Furosemid 20-40 mg i.v.
hypertonica dla utrzymania normotensji
diagnostyka w kierunku DIC
Etapy postępowania w przypadku reakcji poprzetoczeniowej:
* sprawdź dokumentację czy nie ma przypadkowych błędów popełnionych przez personel
pomocniczy
* uzyskaj następujące preparaty:
krew biorcy przed odczynem (a)
krew biorcy po odczynie (b)
krew dawcy uczestnicząca w odczynie (c)
mocz po przetoczeniu (d)
* natychmiast wykonaj:
sprawdzenie wszystkich preparatów w kierunku widocznej hemolizy
ponowne oznaczenie grupy ABO prep. a, b, c
bezpośredni odczyn antyglobulinowy ( Coombsa) w prep. a i b
* powtórz próbę zgodności krzyżowej na obecność przeciwciał preparatów a, b, c
Powikłania poprzetoczeniowe
•
natychmiastowe
•
opóżnione
•
immunologiczne
•
nieimmunologiczne
1. Natychmiastowe
Immunologiczne
Etiologia
Objawowa hemoliza
niezgodność serologiczna krwinek czerwonych
Gorączkowy odczyn niehemolityczny
granulocyty dawcy
Anafilaksja (biorca z niedoborem IgA)
przeciwciała anty – IgA
Pokrzywka
przeciwciała przeciw białkom osocza
Niekardiogenny obrzęk płuc + RALI (wentylacja pod
respiratorem)
przeciwciała antyleukocytarne lub aktywacja układu
dopełniacza
Nieimmunologiczne
Etiologia
Wysoka ciepłota z objawami wstrząsu
zakażenia bakteryjne
Zastoinowa niewydolność krążenia
przeciążenie krążenia
Objawowa hemoliza
natychmiastowe uszkodzenie krwinek w wyniku ?
lub chem. ( w tym roztworami ?)
2. Późne
12

Immunologiczne
Etiologia
Hemoliza
odpowiedź ? na antygeny krwinki czerwonej
Choroba „przeszczep przeciw gospodarzowi”
przeszczepienie lub transfuzja żyjących limfocytów
Plamica poprzetoczeniowa
Wytworzenie przeciwciał przeciwpłytkowych (PIA1)
Alloimmunizacja do antygenów krwinek
czerwonych, białych, trombocytów lub białek osocza
Ekspozycja na antygeny dawcy
Nieimmunologiczne
Etiologia
Przeciążenie żelazem
bardzo liczne transfuzje
Hepaptits vrialis
BCD
AIDS
HIV 1/20
Zakażenia pierwotniakami
malaria i inne
13

AST
ALT
DIAGNOSTYKA LABORATORYJNA CHORÓB WĄTROBY
Podział kliniczny enzymów:
* enzymy komórkowe = enzymy wskaźnikowe ( nie powinny wydostać się poza komórkę
⇒
↑
aktywności niepokoi)
aminotransferaza asparaginianowa AspAT / AST / GOT
aminotransferaza alaninowa AlAT / ALT / GPT
dehydrogenaza glutaminianowa GLDH
→
b. duża swoistość narządowa; wyłącznie w
kom. wątrobowej, OCT
dehydrogenaza mleczanowa LDH
kinaza kreatynowa CK
* enzymy pozakomórkowe
cholinesteraza CHE ( niepokoi
↓
aktywności )
acylotransferaza lecytyna:cholesterol LCAT + enzymy trawienne (
↓
aktywności
niepokoi)
* enzymy cholestatyczne ( błonowe)
γ
-glutamylotranspeptydaza GGTP /
γ
-GTP / GTP
leucyloaminopeptydaza LAP (?)
fosfataza alkaliczna AP / ALP
5’-nukleotydaza 5’NU / 5’NT ( narastanie aktywności niepokoi)
Próby wątrobowe = AspAT, AlAT, bilirubuna całkowita + ew. GGTP, AP
Tzw. poszerzone próby wątrobowe = biochemiczna wstęga wątroby:
AspAT
< 37 IU/l
AlAT
< 40 IU/l
GLDH
< 4,9 IU/l
GTP
< 50 IU/l
LAP
< 35 IU/l
ALP
< 120 IU/l
5’NT
< 5,0 IU/l
kwasy żółciowe
< 6,0 µmol/l
bilirubina całkowita
< 1,2 mg/l
Badania oceniające integralność komórki wątrobowej:
aminotransferazy i GLDH
aminotransferazy posiadają izoenzymy
→
istotne dla AST, dla ALT ma niewielkie znaczenie
AlAT ma bardzo krótki okres półtrwania i klinicznie brak znaczenia
AspAT jest cytoplazmatyczny i mitochondrialny ( cAST i mAST)
w wątrobie dominuje AlAT, w innych narządach AspAT
Wskaźnik de Ritis’a
=
14
ma znaczenie tylko w
chorobach wątroby !!!
obydwa enzymy występują
zarówno w cytoplazmie, jak i
w mitochondrium; w przyp.
ALT izoenzym
mitochondrialny nie ma
znaczenia

niewielkie uszkodzenie kom. wątrobowej – dużo AlAT, a
↓
AspAT
⇒
wsk. <1
Gdy proces trwa dalej dochodzi do uszkodzenia organelli komórkowych ( w pierwszej kolejności AspAT )
→
odwrócenie wskaźnika de Ritisa >1
⇒
jest to dowód na ciężkie uszkodzenie komórki wątrobowej i źle
rokuje
przewlekłe zapalenie wątroby aktywne i przetrwałe
jeżeli zapalenie jest ostre, to wszystkie wskaźniki rosną dziesięciokrotnie ( żaden inny narząd nie
uwolni tylu aminotransferaz ); często dochodzi do odwrócenia wskaźnika de Ritisa
zapalenie przetrwałe od kilkudziesięciu do 200 i wskaźnik de Ritisa zazwyczaj <1
w biernym przekrwieniu wątroby zazwyczaj dochodzi do odwrócenia wskaźnika de Ritisa
aminotransferazy wracają do normy w okresie schyłkowym marskości wątroby, ale AspAT
dominuje nad AlAT
wysoki wskaźnik de Ritisa w chorobach nowotworowych
Przyczyny wzrostu AspAT i AlAT:
> 10 x g.g.n.
ostre wirusowe zapalenie wątroby
polekowe toksyczne zapalenie wątroby
poalkoholowe zapalenie wątroby
ostra nwd krążenia
kwasica
5 – 10 x g.g.n.
przewlekłe aktywne zapalenie wątroby
niewyrównana marskość
cholestaza wewnątrzwątrobowa, wirusowa, polekowa
zmiany nowotworowe
zawał mięśnia sercowego
uszkodzenia i choroby mięśni szkieletowych
< 5 x g.g.n.
stłuszczenie wątroby
przewlekłe przetrwałe zapalenie wątroby
marskość żółciowa
stwardnienie dróg żółciowych
zapalenie trzustki
hemoliza
Dehydrogenaza glutaminianowa
bardzo duża specyficzność narządowa
enzym mitochondrialny
→
marker ciężkiego uszkodzenia komórki wątrobowej
→
często koreluje z
odwróceniem wskaźnika de Ritisa
występuje we wszystkich ostrych schorzeniach i często w alkoholowych zapaleniach wątroby
( alkohol w 1 kolejności działa na mitochondrium)
u chorych z niepowikłaną cholestazą też może narastać
Badania oceniające drożność dróg żółciowych;
↑
cholesterolu w cholestazie pozawątrobowej (
↓
usuwania z żółcią,
↓
wychwyt)
15

Diagnostyka laboratoryjna żółtaczek:
1 w surowicy
*
bilirubina wolna i związana
*
enzymy cholestatyczne
→
ALP, GGTP, LAP, 5’NT
*
enzymy komórkowe
→
AspAT, AlAT
*
kwasy żółciowe
*
lipoproteina X
*
ew. morfologia krwi obwodowej + retikulocytoza
2 w moczu
*
bilirubina
*
urobilinogen
3 w kale
*
sterkobilinogen
Podział żółtaczek:
A. przedwątrobowe
–
hemolityczne (hemoglobinopatie, białaczki, anemia sierpowata, malaria)
–
shunt – hiperbilirubinemie
B. miąższowe
–
infekcyjne
–
toksyczne
–
w przebiegu marskości
–
uwarunkowane genetycznie:
*
z. Dubin-Johnsona
*
z. Rotora
*
z. Gilberta
*
z. Crigler-Najjara
*
C. zastoinowe
D. o złożonej etiologii
E. ciężarnych
–
cholestaza wewnątrzwątrobowa
–
ostre stłuszczenie wątroby
–
rzucawka i samoistne pęknięcie wątroby
Żółtaczka hemolityczna
85% bilirubiny pochodzi z hemoglobiny
reszta
→
enzymy, cytochromy, porfiryny
*
↑
bilirubina do 5 mg/dl
*
↑
bilirubiny wolnej
*
↑
urobilinogenu
(
↑
substratu, to i
↑
produktu)
*
↑
sterkobilinogenu
*
brak bilirubiny wolnej w moczu
Przyczyny:
❛
anemia
❛
autoimmunologiczne
❛
wzmożona hemoliza wewnątrznaczyniowa
❛
hypersplenizm
16
⇒
przemiany bilirubiny !!!
❛
sferocytoza
❛
enzymopatie czerwonokrwinkowe
❛
nowotwory
❛
oparzenia
❛
przetoczenia krwi

⇒
ubywa tych białek transportowych w postaci wolnej
❛
owalocytoza
Oznaczamy natychmiast:
HGB wolna w surowicy
aby pojawiła się żółtaczka musi upłynąć ok. 6 h
→
wtedy pacjent żółknie
haptoglobina ( transporter bilirubiny wolnej )
hemopeksyna ( transporter hemu)
morfologia
⇒
↓
RBC,
↓
HBG,
↓
HCT + retikulocytoza
Żółtaczki miąższowe
↑
bilirubina wolna
( bo
↓
wychwyt i
↓
sprzęganie)
↑
bilirubina związana
( bo
↓
uwalnianie z wątroby)
↑
urobilinogen
( bo upośledzony wychwyt z krążenia jelitowo-wątrobowego)
sterkobilinogen N lub
↓
Żółtaczki mechaniczne
↑
bilirubina sprzężona ( głównie)
↑
bilirubina wolna
urobilinogen
↓
lub brak
sterkobilinogen
↓
lub brak
hipercholesterolemia
mocz o oliwkowej opalescencji
ENZYMY CHOLESTATYCZNE
Fosfataza alkaliczna ( ALP )
→
mało specyficzna narządowo ( w 7 różnych miejscach organizmu ) – kostna, łożyskowa, jelitowa
Fizjologiczny
↑
ALP:
dzieci i młodzież w okresie wzrostu ( 2-3 x
↑
wartości
→
gł. kostna)
♀ w ciąży ( III trymestr; łożyskowa rośnie do 4 x
→
więcej to już cholestaza ciężarnych !!! )
Nowotwory, gł. przewodu pokarmowego, produkują AP
Makroformy ALP u chorych najwyższe w cholestazie pozawątrobowej – 2 rodzaje:
łączenie AP z lipoproteiną X
17
shunt – bilirubinemia
→
wypaczenie metabolizmu bilirubiny, dużo jej powstaje np. z
cytochromów ; NIE MA NIEDOKRWISTOŚCI !!!

łączenie z substancjami wypłukanymi z komórek
Przyczyny
↑
ALP:
* choroby wątroby
ostre zapalenie wątroby
↑
marskość niewyrównana
↑
(
↑
)
cholestaza
↑↑
(
↑
)
nowotwory wątroby
↑↑
(
↑
)
pierwotna żółciowa marskość wątroby
↑↑↑
* choroby kości
okres wzrostu
↑
osteoporoza, osteomalacja
↑
nowotwory kości i choroba Pageta
↑↑↑
* choroby trzustki
ostre zapalenie trzustki
↑
(
↑
)
nowotwory łagodne, cysty (
↑
)
nowotwory złośliwe
↑↑
(
↑
)
* choroby przewodu pokarmowego
zapalenie jelita grubego (
↑
)
owrzodzenie dwunastnicy (
↑
)
* choroby endokrynne
nadczynność tarczycy
↑
cukrzyca (
↑
)
* choroby serca
nwd krążenia
↑
zawał mięśnia ♡ (
↑
)
↑
- 2 x ggn
↑↑
- 2-5 x ggn
↑↑↑
- 5 x ggn
5’-nukleotydaza (odpowiednik ALP)
nie produkowana w kościach i łożysku
narasta gł. w cholestazie pozawątrobowej
istnieją nowotwory produkujące ten enzym, dlatego oznacza się go w parze z AP w celu
↑
swoistości tego badania, bo bardzo rzadko się zdarza, że 1 nowotwór produkuje obydwa te enzymy
GGTP -
γ
-glutamylotranspeptydaza
1. jeden z czulszych enzymów i najwcześniej narasta
2. gł. cholestaza wewnątrzwątrobowa
3. poddaje się jednak stymulacji przez różne czynniki, np. leki, alkohol i in. (wybiórcza indukcja
mikrosomalna)
Pozawątrobowe przyczyny
↑
aktywności GGTP:
* polekowe
barbiturany
antydepresyjne
p-drgawkowe
p-bólowe
antykoncepcyjne
* alkohol
↑
lub
↑
(
↑
)
18
↑
lub
↑
(
↑
)
* reumatoidalne zapalenie stawów
↑
* choroby trzustki
↑
lub
↑
(
↑
)
* zawał mięśnia ♡
↑
* nowotwory złośliwe
↑
lub
↑
(
↑
)
↑
- 2 x ggn
↑↑
- 2-5 x ggn
↑↑↑
- 5 x ggn

* hiperlipidemia
↑
lub
↑
(
↑
)
* cukrzyca
↑
* nadczynność tarczycy
↑
* w ciąży spadek
Występuje w parze z LAP
LAP – leucyloaminopeptydaza
nie ulega wpływom różnych czynników
gł. cholestaza wewnątrzwątrobowa
Kwasy żółciowe
gł. oznaczane sumacyjnie i jest to wystarczająca informacja
rozdział kwasów na frakcje może być wykorzystywany w diagnostyce bloków metabolicznych
warto je oznaczać w przypadku
– świądu skóry gł. u ♀ w ciąży
– diagnostyki bloków metabolicznych
Lipoproteina X
* bardzo czuły marker cholestazy pozawątrobowej
* przed pojawieniem się cech żółtaczki pojawia się i szybko zanika
* jest lipoproteiną patologiczną i w zasadzie nie powinno jej być
* Lp X fałszywie dodatnie u osób zdrowych:
u małych dzieci do 6 m-ca życia , gdzie wątroba nie wychwytuje sprawnie cholesterolu
blok metaboliczny związany z LCAT
chorzy żywieni pozajelitowo
ZESPOŁY UWARUNKOWANE GENETYCZNIE
Zespół Gilberta
♂4 : ♀1
defekt receptorów dla bilirubiny
u tych osób może być
↓
aktywność transferazy glukuronianowej
ujawnia się w okresie pokwitania, częściej u chłopców
max stężenie bilirubiny do
5 mg/dl
, najczęściej
2-3 mg/dl
Czynniki stymulujące:
– zmęczenie
– stres
– wysiłek fizyczny
– alkohol
– ciąża
– doustne środki antykoncepcyjne
pozostałe testy wątrobowe są w normie
kwasy żółciowe przy
↑
bilirubiny są prawidłowe, dlatego jest to bardzo dobre badanie
(niewyjaśniony świąd skóry, często u ciężarnych; hiperbilirubinemia uwarunkowana gentycznie)
19
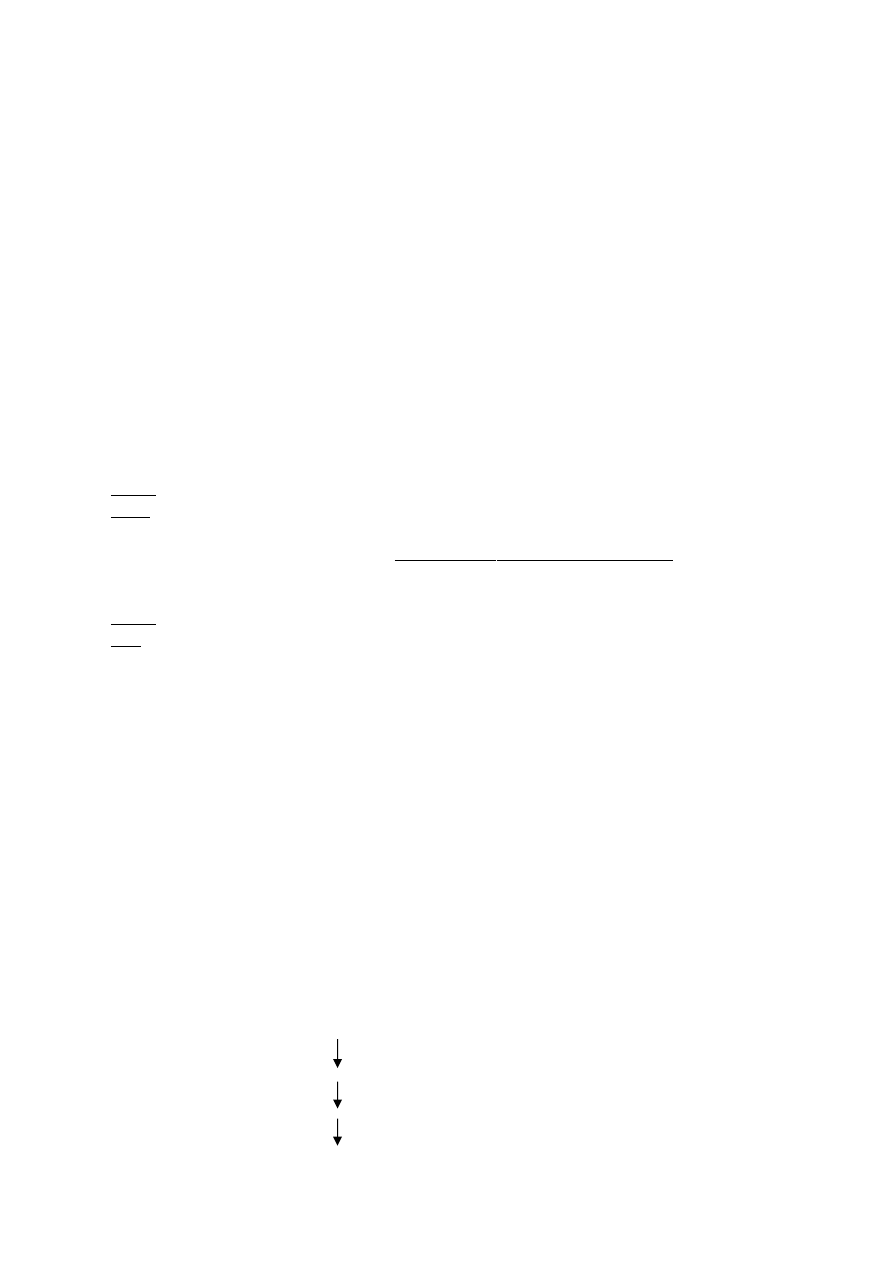
Zespół Crigler-Najjara
najcięższa hiperbilirubinemia
już u maleńkich dzieci
całkowity brak transferazy glukuronianowej
bilirubina nawet
do 50 mg/dl
; prawie w całości jest to bilirubina wolna
przy
20 mg/dl
występuje całkowite wysycenie albumin – granica
do 18 mg/dl
potem pojawia się bilirubina wolna, która ma duże powinowactwo do osłonek mielinowych
(rozpuszcza się w lipidach)
⇒
kernikterus – żółtaczka jąder podstawy mózgu
Zespół Ariase
występują śladowe ilości transferazy – wystarcza to do tego, że bilirubina nie przekracza
20
mg/dl
celowe indukcje mikrosomalne np. fenobarbital, wzrost syntezy transglukuronianowej
Zespół Dubin-Johnson i zespół Rotora
problem z usuwaniem bilirubiny po sprzężeniu
bilirubina
5-7 mg/dl
; gł. sprzężona
pojawia się bilirubina w moczu
pozostałe testy wątrobowe w normie
z. D-J
⇒
defekt bieguna wydzielniczego hepatocyta
z. R.
⇒
ligandyna = białko Y ( kompleks białkowy; możliwość magazynowania bilirubiny
sprzężonej)
zespoły te można rozróżnić za pomocą próby BST
⇒
bromosulfoftaleinowej
→
i.v. barwnik; po
pewnym czasie ( 45 min.) pobieramy krew z innej kończyny i oznaczamy ilość barwnika, którego
powinno być < 6% podanej ilości barwnika
z. D-J
⇒
po 45 min. wartości prawidłowe, po 90 min. stężenie barwnika z powrotem narasta
z. R
.
⇒
wartości wyższe niż u zdrowych ludzi
Badanie oceniające zdolności syntetyzujące:
* anemia – utrata z powodu przewlekłych krwawień, złego wchłaniania, brak białek ochronnych (?)
dla Fe
prawie wszystkie rodzaje niedokrwistości
najczęściej niedokrwistość mieszana
* płytki
↓
, bo jest hipersplenizm i splenomegalia + wydłużony czas krwawienia
* najczęściej pozorna normoproteinemia ale może być białko w normie lub nawet hiperproteinemia
? hipoalbuminemia
? hiper-
γ
-globulinemia
*
↓
albuminy, marker negatywny procesu zapalnego
* hiper-
γ
-globulinemia z powodu przebudowy miąższu, co powoduje zmianę antygenów i powstają
p-ciała ( p-jądrowe, p-mitochondrialne, p-cytoplazmatyczne, p-błonowe) – dlatego nadprodukcja
p-ciał
*
↓
czynniki krzepnięcia ( w pierwszej kolejności zależne od wit. K)
→
najszybciej brakuje
cz.
VII
( układ zewnątrzpochodny)
→
oceniamy przez czas protrombinowy
potem układ wewnątrzpochodny ( oceniany poprzez APTT)
fibrynogen ( pozytywne białko ostrej fazy; dlatego początkowo w fazie zapalnej może
↑
)
układ fibrynolizy DDimery
20

Zaburzenia koagulologiczne w ostrych i przewlekłych chorobach wątroby (?):
↓
czynników witamino-K-zależnych
⇒
II, VII, IX, X
↓
fibrynogenu
↑
PT i APTT
↑
PWF i PDF (?)
↓
płytek krwi
Pacjent z niewydolnością wątroby:
•
wybroczyny, pajączki
•
ginekomastia
•
wodobrzusze
•
splenomegalia
•
zaburzenia wchłaniania
•
żylaki przełyku i odbytu
Różnicowanie laboratoryjne:
czynnik różnicujący
wysięk
przesięk
gęstość względna
> 1018 g/l
<
1014 g/l
białko całkowite
> 30 g/l
< 30 g/l
odczyn Rivalty
(+)
(-)
stężenie białka w płynie
stężenie białka w surowicy
> 0,5
< 0,5
albuminy w płynie
globuliny w płynie
1 : 2
1 : 4
LDH w płynie
> 200 IU/l
< 200 IU/l
erytrocyty
> 100 000 /μl
< 100 000 /μl
leukocyty
> 1000 /μl
< 1000 /μl
glukoza
< 60 mg%
> 60 mg%
Odczyn Rivalty
⇒
denaturacja białek
+
inne substancje w płynie, np. amylaza, AP, bilirubina
+
ocena komórek mikroskopowa
→
stosunek jedno- do wielojądrowych, komórki atypowe, komórki
nowotworowe
+
markery nowotworowe
21

Enzymy pozakomórkowe
Cholinesteraza i LCAT
do oznaczania LCAT potrzebne techniki izotopowe, dlatego oceniamy pośrednio poprzez ocenę
estrów cholesterolu
N: 65-80%
zestryfikowany CH
↓
65%
→
dowód na obniżoną aktywność LCAT ( i
↓
aktywność komórki
wątrobowej)
cholesterol u chorego z marskością jest obniżony często
< 100 mg/dl
hipercholesterolemia:
marskość
niedoczynność tarczycy
nowotwory ( czasem może wyprzedzać objawy kliniczne o ponad 2 lata)
Badania oceniające funkcję detoksykacyjną i wydzielniczą wątroby:
bilirubina całkowita ( wydzielanie)
detoksykacja:
mocznik (
↓
) i/lub amoniak (
↑
)
⇒
zasadowica oddechowa ( amoniak stymuluje
ośrodek oddechowy)
próby czynnościowe
⇒
BST (bromosulfoftaleninowa) , zieleń indocyjaninowa
medycyna nuklearna
Nie wykonujemy prób u:
uczulonych
chorych z żółtaczką lub chorobą wątroby
chorych z nwd krążenia
chorych z nwd nerek
♀ w ciąży
chorych w podeszłym wieku
Badania wskazujące na proces zapalny:
* nieswoiste
białka ostrej fazy
–
pozytywne (wzrost)
➫
antytrombina III
➫
ceruloplazmina
➫
haptoglobina
➫
CRP
–
negatywne
➫
albuminy
* swoiste
immunoglobuliny
–
przewlekłe agresywne zapalenie wątroby
→
IgG
; 70-80% chorych ma p-ciała
p-jądrowe
–
marskość alkoholowa
→
gł.
IgA
–
marskość żółciowa pierwotna
→
IgM
; z tego 90% chorych ma p-ciała
p-mitochondrialne ( to decyduje o rozpoznaniu);
75% chorych ma p-ciała przeciw komórkom nabłonka dróg żółciowych
→
choroba z
autoagresji
22

Przyczyny obniżonego cholesterolu:
•
nowotwór
•
nadczynność tarczycy
•
marskość wątroby
Pierwotna marskość żółciowa, PBC (Primary Biliary Cirrhosis)
•
częściej kobiety
•
często współtowarzyszy zespołowi Sjörgena
•
90% chorych przeciwciała mitochondrialne – AMA (Antimitochondrial Antibodies)
przeciwciała AMA typ M2, przeciw dehydrogenazie pirogronianowej
•
75% chorych przeciwciała dla komórek nabłonka dróg żółciowych
Pierwotne stwardniejące zapalenie dróg żółciowych, PSC (Primary
Sclerosing Cholangitis)
•
młodzi mężczyźni
•
niszczenie zewnątrz/wewnątrz dróg żółciowych
•
współtowarzyszy chorobie Crohna, colitis ulcerosa
•
2/3 chorych ma przeciwciała dla cytoplazmy neutrofili
Typ I
•
głównie młode kobiety
•
przeciwciała przeciwjądrowe
ANA (Antinuclear Antibodies)
przeciw mięśniom gładkim ASMA (Anti-Smooth Muscle Antibodies)
> 1 : 80 wskazuje na PSC
Typ II
•
głównie dzieci w Europie
•
przeciwciała dla antygenu mikrosomalnego wątroby / nerek - anty LKM (Liver-Kidney
Microsomal)
rzadko ANA, ASMA
Typ III
•
głównie młode kobiety
•
uogólnione choroby metaboliczne
•
przeciwciała dla rozpuszczalnego antygenu wątrobowego – SLA (Soluble Liver Antigen)
brak przeciwciał ANA, ASMA, anty LKM
23

DIAGNOSTYKA CHORÓB NOWOTWOROWYCH
choruje co 4 a umiera co 5 Polak
110 000 zachorowań w roku
najczęstsze zachorowania u ♀:
o rak piersi 17,4%
o rak szyjki macicy 8,1%
o nowotwory płuc 7,5%
o rak żołądka 6,4%
o rak jajników 6,1%
najczęstsze zachorowania u ♂:
o nowotwory płuc 29,3%
o rak żołądka 8,2%
o rak gruczołu krokowego 5,8%
niestabilność genomu ( BRCA-1, BRCA-2, Ph)
kaskada odkształcania DNA ( genotoksyny, wirusy)
nieefektywna obrona komórkowa i tkankowa
stadia zaawansowania
T
1
T
2
T
3
T
4
faza przedkliniczna
wczesne wykrywanie, rozpoznawanie,
prognozowanie, monitorowanie
1) szacowanie ryzyka (analiza rodowodu)
interwencja
2) (badanie genetyczne),
testowanie predyspozycji
inicjacja promocja progresja angiogeneza
z. pozanowotworowe
rozrosty wtórne
Objawy choroby pojawiają się gdy namnoży się 10
6
– 10
8
komórek nowotworowych.
24
biologiczny
początek
choroby
objawy
choroby
badanie przesiewowe
badanie celowane

Badania laboratoryjne w rozpoznawaniu, ocenie zaawansowania i
monitorowania terapii choroby nowotworowej
badania celowane- ocena stanu zdrowia, stopnia
- diagnostyczne rozwoju nowotworu i odczynów paranowotworowych
monitorowanie terapii
OB, morfologia, proteinogram
,
badania morfologiczne
wskaźniki osteolizy
- immunologiczne
- cytologiczne - poziom glikemii
wybrane:
- poziom cholesterolu - markery humoralne
badania cytogenetyczne - badanie ogólne moczu, - wskaźniki funkcji narządu
- markery genomowe wsk wydolności nerek - wskaźniki
- wsk wydolności wątroby lekotoksyczności
badania serologiczne - wsk endokrynopatii
- markery humoralne - ocena hemostazy
- ocena odporności komórkowej
i humoralnej
poziom przedonkologiczny -> onkolog kliniczny -> leczenie objawowe, hospicyjne
OB
↑
:
zmiany w składzie białek osocza
→
zmiana gęstości osocza
wydzielanie cytokin zapalnych
→
hamowanie procesu erytropoezy
wydzielanie neuraminidazy przez komórki nowotworowe
neuraminidaza odcina kwas sjalowy z powierzchni erytrocytów
→
↑
kwasu sjalowego we krwi +
zlepianie się erytrocytów;
3-cyfrowe OB:
o nowotwory układu białokrwinkowego, np. chłoniaki, szpiczak
skrócony zakres OB u chorych z czerwienicą prawdziwą !!!
Proteinogram
pasmo M
→
monoklonalne immunoglobuliny + odczyn zapalny
najsilniej zaznaczone odczyny p-ciał poliklonalnych
→
rak płuc, rak pierwotny wątroby, przewlekła
białaczka szpikowa
w nowotworach przewodu pokarmowego może być N lub nawet
↑
szpiczak
proteinogram w chorobie nowotworowej
25

Niedokrwistość jako zespół paranowotworowy
( u ok. 98% chorych)
Przyczyny:
1. odczyny zapalne ( niedokrwistość ACD)
•
hamowanie erytropoezy ( Il-1, TNF, TGF
β
)
•
zaburzenia gospodarki Fe ( Il-1, TNF, TGF
β
, Il-6)
2. reakcje odpornościowe
•
autoimmunohemoliza
•
erytrofagocytoza
3. mikroangiopatie
•
rozrost nowotworu
•
wykrzepianie wewnątrznaczyniowe
4. niedobory czynników krwiotwórczych
•
Fe ( niedokrwistość typu IDA)
•
wit. B
12
i kwasu foliowego
5. utrata krwi, krwawienie
6. zmiany anatomiczne w szpiku
•
rozrost układu białkokrwinkowego
•
przerzuty nowotworów do szpiku
•
mielofibroza
7. hipersplenizm
8. chemioterapia
u pacjentów wstanie niedotlenienia, niedokrwistości występuje
↑
zdolności do przerzutowania
u pacjentów mających radioterapię należy likwidować niedokrwistość, bo ma ona wówczas
mniejszą skuteczność
podajemy erytropoetynę, a nie Fe
W ACD nie należy podawać Fe bo następuje
↓
transferyny ( transporter Fe) i jest ona w 1/3 wysycana
Fe wówczas:
1.
1.
laktoferyna
wydzielana do krwi z makrofagów wiąże z większym powinowactwem Fe niż
transferyna a proerytroblasty nie mają receptorów dla laktoferyny i Fe ( jego nadmiar) odkłada się w
narządach
2.
2.
reakcja Fentona
→
powstają rodniki hydroksylowe przy udziale Fe z wolnych rodników
tlenowych
→
zatem nadmiar Fe może doprowadzić do rozszerzania procesu zapalnego
H
2
O
2
+ Fe
2+
.
OH
3.
3.
odczyn zapalny
→
cytokiny prozapalne
⇒
Il-1, TNF, TGF
β
, Il-6
→
hamowanie syntezy
erytropoetyny, hamowanie erytropoezy
4.
4.
Fe sprzyja proliferacji nowotworowej.
Niedokrwistość ACD
⇒
HGB 9,5-11 g/dl
26

po chemioterapii
przerzuty komórek nowotworowych do szpiku
aleukemiczna postać ostrej białaczki szpikowej
włóknienie szpiku
zespół mielodysplastyczny
Ocena laboratoryjna i różnicowanie niedokrwistości
ACD – Anemia of Chronic Disease
IDA – Iron Deficiency Anemia
parametr
ACD
IDA
HGB
9.5 - 11
↓
retikulocyty
↓
↓
HCT
↓
↑
MCV
RDW
OB
↑
CRP
proteinogram
zapalny
Epo
↓
↑
[Fe
3+
]
N
↓
TIBC (Total Iron Binding Capacity)
(
↓
) fałszywie +, bo
laktoferyna
↑
transferyna
↓
↑
ferrytyna
↑
↓
stężenie receptora Trf
N
↑
Il-1, Il-6
↑
N /
↑
jeżeli brakuje Fe to katabolizm transferyny jest
↓
im mniej ferrytyny, tym bardziej
↑
poziom receptora Trf
Choroby nowotworowe z nadkrwistością:
czerwienica prawdziwa
rak jasnokomórkowy nerek
ektopowe wydzielanie erytropoetyny (rakowiaki z komórek APUD)
Odczyn erytroleukemiczny
→
obecne we krwi erytroblasty 6% komórek na obwodzie
⇒
odmłodzenie układu białokrwinkowego aż do erytroblastów.
Układ białokrwinkowy
Leukopenia
( infekcje bakteryjne )
granulocytopenia 1500 /μl
agranulocytoza 500 /μl
27
< 3 000
/μl

Hiperleukocytoza >10 000 /
μl
odczynowa
białaczki i chłoniaki
Normoleukocytoza
( 4 000 - 10 000 / ml )
nowotwory o różnej biogenezie
białaczki AML i LBL
szpiczak mnogi
Bezwzględna limfopenia
→
chłoniak Hodgkina
Trombocytopenia w chorobach nowotworowych
< 130 x 10
6
/l
1. zaburzenia trombopoezy w szpiku
•
pierwotne zmiany nowotworowe
•
przerzuty do szpiku komórek nowotworów litych
2. sekwestracja płytek w następstwie splenomegalii
3. indukowane nowotworem rozsiane wykrzepianie wewnątrznaczyniowe, gł. w:
•
białaczce promielocytarnej
•
rakach:
o gruczołu krokowego
o jajników
o płuc
o układu pokarmowego
o trzustki ( proteazy aktywują kaskadę układu krzepnięcia)
4. autoimmunologiczna trombocytopenia lub EDTA-zależna pseudotrombocytopenia
5. uboczny efekt cytostatyków
•
odwracalny dla większości leków
•
ale mitomycyna, pochodne mocznika
→
dłuższy okres supresji
Leczenie
⇒
transfuzja krwi, stymulacja megakariocytozy ( trombopoetyna ).
Hipertrombocytoza > 600 x 106 /l
czerwienica prawdziwa
wczesny okres przewlekłej białaczki szpikowej
ostra białaczka megakarioblastyczna
Wskaźnik osteolizy
28
zahamowanie apoptozy ( CML, CLL )
wzrost proliferacji
Mechanizmy osteolizy nowotworowej
# oddziaływanie endokrynne # oddziaływanie parakrynne
kość
nowotwór pozakostny
przerzut
szpiczak
osteoklast
Nadbudowa w raku gruczołu krokowego!
cytokiny działają na
RANKL
( aktywator czynnika jądrowego K ) w osteoklaście
aktywacja czynnika
K
+ aktywacja lizosomów
wydzielanie enzymów:
kolagenazy ( gł. 1 )
TRAP
o izoenzym fosfatazy kwaśnej opornej na winian ( rozkłada hydroksyapatyty )
⇒
Ca
2+
⇒
hiperkalcemia
> 2,6 mmol/l
metaloproteinazy
→
wydzielane przez komórki nowotworowe; rozkładają macierz kostną
Produkty degradacji kolagenu:
CTx
→
fragment łańcucha
α
kolagenu od strony grupy COOH łańcucha
NTx
→
od strony NH
2
PYR = pyrolidyna
DPR = dezoksyprolidyna
hydroksyprolina
Markery osteogenezy (rak prostaty):
29
PTH, PTHrP, Il-1,
Il-6, Il-11, TNF,
TGF
β
osteokalcyna
izoenzym kostny fosfatazy alkalicznej
Humoralne markery nowotworowe:
* przenoszone do płynów ustrojowych elementy komórek odróżnicowanych proliferujących
* ich wzrost koreluje z obecnością procesu nowotworowego
produkty onkogenów
antygeny płodowo-nowotworowe
czynniki wzrostowe
epitopy węglowodanowe
hormony, enzymy, izoenzymy
markery odróżnicowane markery proliferacji
markery sekrecyjne markery niesekrecyjne
cz. pozanowotworowe stężenie w płynie ustrojowym
od 10
-3
g/l do 10
-12
g/l
Sposób oznaczania:
metody immunoenzymatyczne
metody immunofluorescencyjne
metody radioimmunologiczne
W następstwie transformacji komórki, ekspresja białka współtworzącego komórkę może:
pozostawać prawidłowa
przebiegać ze zmianą struktury
ulec całkowitej redukcji lub spotęgowaniu
W następstwie zwiększonego obrotu atypowych komórek w płynach ustrojowych narasta stężenie
elementów tych komórek.
30
stopień ekspresji
wielkość obrotu komórek
droga przenikania do płynu
mózgowo-rdzeniowego
droga i rytm katabolizmu
Humoralne markery odróżnicowania:
AFP
PSA
CYFRA 21.1 (Serum CYtokeratin FRAgment 21.1)
β
-HCG
NSE
CEA (Carcinoembryonic Antigen)
CA 15.3
CA 12.5 (rak jajnika)
glikoproteiny komórkowe
CA 19.9
monoklonalne Ig
białko Bence-Jonesa
BLCA-4
Humoralne markery proliferacji:
β
2
M
TPA
α
-fetoproteina AFP
białko sekrecyjne
raki wątroby i gonad
PSA
największa czułość diagnostyczna
Cyfra 21.1
→
fragment cytokeratyny 19 w nabłonku oskrzela w nowotworach płuc
NSE
→
specyficzna neuronowa enolaza
β
-HCG
→
gonadotropina kosmówkowa; marker trofoblastu
BLCA-4
→
raki pęcherza moczowego; białka macierzy jądrowej
Markery proliferacji
→
fragmenty prawidłowe, ale ich nadmiar przy zwiększonej proliferacji komórek.
β
2
M
mikroglobulina
→
prognozowanie przebiegu szpiczaka
TPA
→
tkankowo swoiste polipeptydowe antygeny
CEA
→
raki jelita grubego; antygen karcynoembrionalny
CA 15.3
→
antygen komórek rakowych gruczołu piersiowego
CA 12.5
→
jajniki
CA 19.9
→
trzustka, żołądek, jelita
31

Znaczenie markerów:
pełnią funkcję pomocniczą w stosunku do badań obrazowych i patomorfologii
nie mogą być wykorzystywane jako badanie skriningowe u osób bez objawów choroby i
dolegliwości
przydatne we wczesnym wykrywaniu nowotworów złośliwych u osób z grup wysokiego ryzyka
przydatne w różnicowaniu chorób o podłożu łagodnym i złośliwym ( konieczna znajomość cz.
pozanowotworowych wpływających na stężenie markera)
przydatne w prognozowaniu przebiegu choroby przy spełnionym warunku zależności pomiędzy
stężeniem a ilością komórek wydzielających lub uwalniających marker
o w I stadium
↑
u 5-20% chorych
o w IV stadium
↑
u 70-100% chorych
przydatne w monitorowaniu efektywności leczenia
przydatne we wczesnym wykrywaniu nawrotów choroby
PSA
glikoproteina wydzielana do płynu nasiennego przez komórki nabłonka przewodzików gruczołu
krokowego
aktywność proteazy serynowej T
1/2
= 2-3 dni
w płynie nasiennym
0,3 – 3,0 mg/ml
w osoczu
do 4 ng/ml
Wartości graniczne zależne od wieku:
40-49 lat
< 2,5 ng/ml
50-59 lat
< 3,5 ng/ml
60-69 lat
< 4,5 ng/ml
70-79 lat
< 6,5 ng/ml
↑
stężenia w osoczu na skutek nieszczelności tkankowej:
zapalenia gruczołu krokowego
łagodny przerost - gruczolak
rak stercza
Wartość graniczna:
wzrasta po badaniu per rectum
wzrasta po jeżdżeniu na rowerze
tPSA=fPSA+cPSA
PSA w osoczu:
PSA wolny
5-40%
PSA-
α
1-antyhymotrypsyna
60-95%
PSA-
α
2-makroglobulina
1-2%
u pacjentów zdrowych więcej PSA wolnego, u chorych
↑
fazy związanej
tPSA
→
total fPSA
→
free
32
Udział wolnego PSA do całkowitego
fPSA
tPSA
<0.1 rozrost złośliwy
Rak mało prawdopodobny przy stężeniach tPSA
4-15 ng/ml
szara strefa = zapalenie, łagodny przerost, wczesny rak
Stopień zagęszczenia PSA w gruczole krokowym
[PSA] w surowicy
przemawia za przerostem łagodnym
obj. gruczołu w ml
przemawia za rakiem
[PSA] ~
0,3 ng/ml
/ gram tkanki = przerost łagodny
[PSA] ~
3,5 ng/ml
/ gram tkanki = rozrost złośliwy
Szybkość przyrostu [PSA] w surowicy na rok
PSAV – PSA Velocity
I stadium ok. 40% <20
II stadium 95% >30
zdrowi
0,04 ng/ml
przerost łagodny
0,07-0,27 ng/ml
rak in situ
0,47-3,1 ng/ml
rak i przerzuty
1,0-26,5 ng/ml
Czas podwojenia stężenia ( DT – doubling time )
< 3,5 miesiąca
→
wskazana natychmiastowa prostatektomia
> 3,5 miesiąca
→
możliwe leczenie np. androgenami
Monitorowanie [PSA] po prostatektomii i w trakcie chemioterapii.
•
systematycznie w tym samym ośrodku
•
wzorzec WHO – 1090 (10%fPSA, 90%tPSA)
33
> 0,20
< 0,15
> 0,15

•
pobieranie krwi przed badaniem prostaty
AFP – α-fetoproteina
glikoproteina sekrecyjna T
1/2
= 5 dni
w czasie życia płodowego wydzielana przez komórki pęcherzyka żółtkowego oraz wątroby i
wydzielana do krwi płodu
najwyższe stężenie
→
16-18 hbd
⇒
1 g/l
→
w okresie okołoporodowym
⇒
1 mg/l
→
po 6 miesiącach
⇒
...........
wartość graniczna
15 ng/ml = 10 IU/l
Znaczenie diagnostyczne:
* marker serologiczny raka wątrobowo-komórkowego (HCL – hepatocellular carcinoma)
* monitorowanie grup ryzyka pierwotnego raka wątroby
nosiciele wirusa HBV, HCV
chorzy z hemochromatozą
* monitorowanie leczenia hepatoma
* monitorowanie po resekcji gonad zmienionych nowotworowo
↑
AFP:
* w ostrym i przewlekłym zapaleniu wątroby u
~ 10%
* w marskości wątroby:
u 17%
15-100 ng/.ml
u 20%
< 500 ng/ml
u 1%
> 500 ng/ml
( u tych osób gorsza prognoza)
* oznaczenia co 3 miesiące, a USG wątroby co pół roku u osób z grup ryzyka
Raki wątroby
* hepatoblastoma
→
czułość 100%
* hepatoma
→
czułość diagnostyczna 80-90%
u 90% AFP > 50 ng/ml
IV stadium > 1000ng
* ale u 10% chorych z hepatoma oraz u chorych z cholangiocellular cancer [AFP] prawidłowe
Czynniki ryzyka HCC (Hepatocellular Carcinoma):
•
zakażenia HBV,HCV
•
antykoncepcja
•
sterydy anaboliczne
•
marskość wątroby
•
zmiany polekowe
•
hemochromatoza
Nowotwory gonad
* czułość < 50%
34

*
↑
[AFP] mniejszy niż w rakach wątroby i nie we wszystkich ( zależne od histogenezy) występuje
synteza i sekrecja AFP
* nowotwory jajników
→
komórki raka śluzowego nie wytwarzają AFP
* nowotwory jąder
→
nasieniaki nie powodują
↑
[AFP], nienasieniaki mogą wydzielać AFP
CEA (Carcinoembryonic Antigen)
glikoproteina powierzchniowa pochodzenia endodermalnego
należy do nadrodziny immunoglobulin
Bierze udział w:
•
adhezji komórek
•
odczynach odpornościowych
•
apoptozie
czułość graniczna
3,0 ng/ml / 5,0 ng/ml
↑
[CEA] >
10 ng/ml
może występować także w chorobach nienowotworowych:
wrzodziejące uchyłkowe zapalenie jelit
poalkoholowe zapalenie wątroby, marskość
zapalenie trzustki
zmiany zapalne w płucach
W następstwie transformacji nowotworowej
↑
ekspresji białka
[CEA] > 10 ng/ml
sugeruje nowotwór
Największa czułość CEA w rakach jelita grubego koreluje ze stadium zaawansowania w
skali
Duke’a:
stadium A
< 20%
stadium B
40-60%
stadium C
60-80%
stadium D
80-85%
stężenie > 20 ng/ml w stadiach C i D
⇒
złe rokowanie
CEA mało użyteczne w badaniach skriningowych i wykrywaniu wczesnych stadiów raka.
CEA w rakach o innej lokalizacji < 30%.
Monitorowanie raków jelita grubego:
* po całkowitej resekcji
↑
[CEA] do
3,5 ng/ml
→
5-7 dni
kiedy CEA
↓
< 5 ng/ml
to u 18% możliwy nawrót
kiedy CEA
↑
>
10 ng/ml
to 63% możliwy nawrót w miejscu, wątroba, płuca
jeżeli wystąpi stały wzrost > 12% / miesiąc
→
to wyraźne wskazanie nawrotu
* po chemioterapii
oznaczanie co 2-3 miesiące
czułość przerzutów do wątroby 100%
wznowa w regionie zmiany 60%
przez pierwsze 2-3 lata kontrola 3/rok
rozpad komórek może spowodować krótkotrwały
↑
CEA
35

20%
↓
CEA przemawia za skutecznym leczeniem
Jednoczesny
↑
CEA i CA 19.9 to gorsze rokowanie.
CA 19.9
asjalowany antygen grupowy krwi ( Lewisa)
ligand selektyny E
T
1/2
= 10 h
wytwarzany w komórkach nabłonka przewodu pokarmowego płodu oraz przez dojrzałe komórki
trzustki, dróg żółciowych, gruczołów ślinowych
wartość graniczna
37 IU/l
Wzrost ekspresji antygenu w transformacji nowotworowej komórek macierzystych koreluje ze stadium
zaawansowania.
Czułość diagnostyczna w rakach przewodu pokarmowego:
rak żołądka 42%
rak trzustki 86%
rak wątroby 30%
rak jelita grubego 60%
W stanach zapalnych przewodu pokarmowego wartość rośnie:
zapalenie trzustki u 98% [CA 19.9]
< 120 IU/ml
raki trzustki u 70% [CA 19.9]
> 120 IU/ml
W stadium T
1
→
stężenia podobne jak w stanach zapalnych
W stadiach T
3
– T
4
[CA 19.9]
> 1000 IU/ml
36
DIAGNOSTYKA LABORATORYJNA OSTRYCH POWIKŁAŃ
CUKRZYCY I STANÓW NIEPRZYTOMNOŚCI INNEGO
POCHODZENIA
Zaburzenia świadomości i przytomności:
*
P
przedawkowanie
narkotyki
halucynogeny
leki obniżające glikemię
*
E
epilepsja
napady częściowe
napady uogólnione
stan padaczkowy
*
P
psychogenne
histeryczne zaburzenia świadomości
stan katatoniczny
fuga / zaburzenia świadomości z niepamięcią
*
E
elektrolitowo-metaboliczne
uszkodzenie nerek
mocznica
hyponatremia
↑
Ca
2+
cukrzyca
⇒
↓
lub
↑
glikemii
*
G
zaburzenia termiczne
udar cieplny
przegrzanie
wychłodzenie
*
A
alkohol
zatrucie
zespół Wernicka-Korsakowa
hipoglikemia poalkoholowa
odstawienie
–
delirium
–
drgawki
*
G
guz
pierwotny
wtórny
rakowy (?) ( zaburzenia metaboliczne)
*
U
uraz
krwiak wewnątrzczaszkowy
rozlane uszkodzenie pourazowe
↑
ciśnienia wewnątrzczaszkowego
*
Z
zakażenie
bakteryjne
ropień / meningitis
*
W
wstrząs
hypowolemiczny
kardiogenny
anafilaktyczny
*
A
apoplexia
37

udar mózgu
–
zawał
–
krwotok mózgowy
–
krwotok podpajęczynówkowy
*
N
niedokrwienie lub niedotlenienie
przemijająca hipoksja płucna
zespoły poreanimacyjne
uduszenie
Wartości poszczególnych parametrów w surowicy / osoczu:
sód
135-145 mmol/l
potas
3,5-5,0 mmol/l
chlorki
95-105 mmol/l
wodorowęglany
21-27 mmol/l
magnez
0,8-1,2 mmol/l
luka anionowa, Anion Gap
< 12 mmol/l
(3-11)
osmolalność surowicy
275-295 mOsm/kg H
2
O
wydalanie z moczem
sód
120-260 mmol/24 h
potas
25-125 mmol/24 h
chlorki
110-250 mmol/24 h
białko całkowite w surowicy
60-80 g/l
HCT
♂
40-50%
♀
37-47%
HGB
♂
14-18 g/dl
♀
12-16 g/dl
erytrocyty
♂
4,2-5,4 mln/µl
♀
3,5-5,0 mln/µl
aktywność reninowa osocza
1-25 ng/ml/h
aldosteron w surowicy
1-5 ng/dl
wydalanie aldosteronu z moczem
2-10 µg/24 h
wydalanie A7-OH sterydów z moczem
2-10 mg/24 h
kortyzol w osoczu
przy podaży dobowej
Na 100 mmol
K 60-100 mmol
godz. 8
00
(na leżąco) 9-24 µg/dl
godz. 16
00
3-12 µg/dl
dolna granica albumin
⇒
2,5 g/dl
38
Różnicowanie zaburzeń gospodarki wodnej:
sód
HCT
HGB
przewodnienie
izotoniczne
N
↓
↓
hipotoniczne
↓
↓
N
↓
hipertoniczne
↑
↓
↓
odwodnienie
izotoniczne
N
↑
↑
hipotoniczne
↓
↑
↑
hipertoniczne
↑
↑
N
↑
Gazometria krwi tętniczej:
pH
7,36-7,44
stężenie jonu wodorowego [H
+
]
45-35 mmol/l
ciśnienie parcjalne CO
2
( pCO
2
)
33-44 mmHg
ciśnienie parcjalne O
2
( pO
2
)
74-108 mmHg
wysycenie tlenu SaO
2
94-98%
aktualne stężenie wodorowęglanów [HCO
3-
]
22-28 mmol/l
standardowe stężenie wodorowęglanów [HCO
3-
]
24 mmol/l
niedobór zasad ( BE )
0 ± 2 mmol/l
•
w kwasicy mleczanowej
•
u reanimoanych
•
zatrucie solne
•
picie wody morskiej
•
nadmiar sodu w płynie dializującym
•
nadmierna podaż sodu
39

HIPONATREMIA (!)
< 130 mmol/l
→
zmęczenie
< 120 mmol/l
→
zaburzenia orientacji
< 110 mmol/l
→
drgawki – śpiączka
* hiponatremia rzekoma
hiperlipidemia
hiperproteinemia
utrata sodu i wody do „trzeciej przestrzeni” przez nerki, przew. pok., częściowe uzupełnianie
płynów preparatami niskoelektrolitowymi
wymioty
biegunki
przetoki przew. pok.
utrata sodu przez nerki:
salt losing nephritis, tubuloopatie, diutretyki, diureza osmotyczna
spadek syntezy mineralo-, glikokortykoidów
* hiponatremia prawdziwa
+ odwodnienie
–
utrata Na i wody przez skórę, np. poty; uzupełnianie strat płynami bezelektrolitowymi
+ prawidłowe nawodnienie
–
ch. Adisona
–
niewydolność kory nadnerczy
–
z. SIADH, oporność na wazopresynę
–
hypotyreoza
–
leki
+ przewodnienie
–
spowodowane transmineralizacją lub rozcieńczeniem
➫
przewlekła nwd krążenia
➫
marskość wątroby z wodobrzuszem
➫
ostra i przewlekła nwd nerek
hiponatremia idiopatyczna
HIPERNATREMIA
* utrata czystej wody, płynów hipotonicznych
stany gorączkowe
stany
↑
katabolizmu ( posocznica, hipertyreoza )
* brak pragnienia ( uszkodzenie ośrodka pragnienia w OUN )
* hipernatremia samoistna
*
↑
cechy uszkodzenia OUN
⇐
nadmierna podaż Na
+
* utrata płynów hipotonicznych
przew. pok. ( wymioty, biegunki )
nerki
–
moczówka prosta pierwotna
–
moczówka prosta wtórna ( pourazowa, pooperacyjna, poinfekcyjna, ...............................)
–
moczówka prosta wrodzona
–
moczówka prosta nerkowa nabyta ( choroby nerek, hiperkalcemia, hipokaliemia )
przez skórę ( poty)
diureza osmotyczna
–
hiperglikemia
40
–
mannitolem
–
mocznikiem
Cechy laboratoryjne hipernatremii:
↑
Na
+
↑
Cl
-
↑
K
+
hiperglikemia
↑
azotu pozabiałkowego
kwasica metaboliczna
↓
Ca
2+
zaburzenie
proces pierwotny
kompensacja
kwasica oddechowa – ( > 24 h)
3-5 dni
↑
pCO
2
o 10 mmHg
↑
HCO
3-
o 1 mmol/l
↑
pCO
2
o 10 mmHg
↑
HCO
3-
o 3-4 mmol/l
zasadowica oddechowa – ( > 12 h )
1-2 dni
↓
pCO
2
o 10 mmHg
↓
HCO
3-
o 1-3 mmol/l
↓
pCO
2
o 10 mmHg
↓
HCO
3-
o 2-5 mmol/l
kwasica metaboliczna
↓
HCO
3-
o 1 mmol/l
↓
pCO
2
o 1-1,5 mmHg
zasadowica metaboliczna
↑
HCO
3-
o 1 mmol/l
↑
pCO
2
o 0,5-1 mmHg
Gazometria krwi tętniczej u pacjentów z dusznością bez zmian w rtg klatki
piersiowej:
pO
2
pCO
2
pH
zator tętnicy płucnej
N lub
↓
↓
↑
zapalenie płuc
↓
↓
↑
napad astmy
N lub
↓
↓
↑
kwasica metaboliczna
N
↓
↓
hiperwentylacja ( bez choroby organicznej)
↑
lub N
↓
↑
41
Porównanie patogenezy cech klinicznych cukrzycy typu I i II
typ
I
II
patogeneza
autoimmunologiczne zniszczenie
komórek
β
; całkowity brak
insuliny
połączony defekt sekrecji insuliny i
insulinooporności
początek choroby
< 30 r.ż.
> 30 r.ż.
skłonność do kwasicy ketonowej
duża
mała
otyłość
rzadko
często
leczenie
dieta, insulina
dieta, doustne leki
hipoglikemizujące
Mechanizm kwasicy ketonowej w cukrzycy:
brak insuliny
Diagnostyka laboratoryjna powikłań cukrzycy w śpiączce
oznaczenie
śpiączka
hiperosmotyczna
kwasica ketonowa
kwasica mleczanowa
42
↓
wychwytu
glukozy przez
tkanki na
obwodzie
↑
syntezy
glukozy w
wątrobie
↑
lipolizy
↑
ketogenezy
ketonemia
kwasica
metaboliczna
kompensacja
oddechowa
hiperwentylacja
hiperglikemia
glukozuria,
ketonuria
diureza
osmotyczna
odwodnienie
glikemia
> 33 mmol/l
> 22 mmol/l
< 7,8 mmol/l
glikozuria
+++
+++
±
ketonemia
< 3 mmol/l
> 7 mmol/l
< 3 mmol/l
ketonuria
-
+++
-
osmolalność
> 400 mOsm/l
> 330 mOsm/l
< 300 mOsm/l
pH
7,35-7,45
< 7,35
< 7,25
HCO
3-
> 18 mmol/l
< 18 mmol/l
< 10 mmol/l
mleczany
< 2,4 mmol/l
< 2,4 mmol/l
> 10 mmol/l
KWASICA KETONOWA
1. zaburzenia metaboliczne spowodowane znacznym niedoborem insuliny lub/i nadmiarem
antagonistów insuliny
2. wyzwalane:
infekcja
stres fizyczny
uraz fizyczny, chemiczny lub psychiczny
operacja
3. kwasica nieoddechowa spowodowana nadmiernym wytwarzaniem związków ketonowych w wyniku
↑
lipolizy i niecałkowitego spalania kwasów tłuszczowych
4. hyperkatabolizm białek
→
zaburzenia hemodynamiczne
5. zaburzenia OUN w badaniu:
ciężka kwasica nieoddechowa
odwodnienie
nwd nerek
pseudo „ostry brzuch”
dyselektrolitemia
o
↓↓
Na
o
↑
K
+
o
↑
P
hiperglikemia
> 27,8 mmol/l
⇔
> 500 mg/dl
ketonemia, ketozuria
glikozuria
> 0,44 mmol/l
⇔
8 mg/dl
zaburzenia RKZ:
pH
pCO
2
HCO
3-
o kreatyniny
o HCT
o leukocytoza
ŚPIĄCZKA HIPERMOLARNA
* hiperglikemia
> 28 mmol/l
* hipermolalność osocza
> 350 mOsm / kg H
2
O
* odwodnienie hipertoniczne
* brak cech kwasicy ketonowej lub niewielkie nasilenie ketonemii i kwasicy metabolicznej
43

Główne powikłanie cukrzycy typu II wyzwalane przez:
glikokortykoidy
antymetabolity
dializa otrzewnej z dializatem wysokoglukozowym
stres fizyczny, np. hipertermia
duża utrata płynów
choroby OUN, uszkodzenie ośrodka pragnienia
podaż płynów hipermolarnych
zakażenie
↑
aktywności układu adrenergicznego
Ilość insuliny jest niedostateczna do prawidłowego transportu glukozy do tkanek.
Hiperglikemia
→
diureza osmotyczna
→
odwodnienie hipertoniczne
drgawki ogniskowe / uogólnione
gorączka pochodzenia mózgowego
zaburzenia świadomości
odruchy patologiczne
okres późniejszy:
zaburzenia hemodynamiczne
→
hipowolemia
hipotensja
ostra nwd nerek
Terapia:
płyny
potas
insulina
heparyna
KWASICA MLECZANOWA
TYP A
Niewydolność sercowo-naczyniowa, wstrząs kardiogenny lub septyczny spowodowane względnym lub
bezwzględnym niedotlenieniem tkanek.
upośledzenie utlenowania krwi w płucach
znacznego stopnia niedokrwistość
nadmierny wydatek energetyczny:
–
drgawki padaczkowe
–
hypertermia
–
znaczny wysiłek fizyczny
met-HGB
CO-HGB
CN-HGB
44

TYP B
* blok przemiany mleczanowej
brak cech hipoksji
brak cech anoksji tkankowej
* polekowo-toksyczna
fenformina
metformina
glikol etylenowy
infuzja NaHCO
3
salicylany, ksylitol – niestosowane już w odżywkach
sorbitol
metanol
* defekty enzymatyczne
niedobór glukozo-6-fosforanu
niedobór dehydrogenazy pirogronianowej
Kwasica mleczanowa może wystąpić w przebiegu:
cukrzycy
chorób wątroby
nwd nerek
białaczki
poinfekcyjna
niedoborów tiaminy u alkoholików
HIPOGLIKEMIA
stężenie glukozy
< 2,2 mmol/l = 40 mg/dl
Neuroglikopenia:
zaburzenia orientacji
hiperkinezje
drżenia
śpiączka
Układ adrenergiczny:
tachykardia
hyperrefleksja
hipertensja
poty
mydriasis
Przyczyny hipoglikemii na czczo:
* niedobór hormonów stymulujących glukoneogenezę
kortyzol
glukagon
ACTH
hh. tarczycy
* upośledzenie glukoneogenezy wątrobowej
ostra nwd wątroby
nwd zastoinowa
zatrucia związkami hepatotoksycznymi
45

schyłkowa nwd nerek
hipotermia
*
↑
zużycie glukozy przez tkanki
* niedożywienie u ciężko pracujących, ciężarnych, niemowląt
* insulinoma
* leki, używki
salicylany
β
-blokery
doustne leki hipoglikemizujące
Przyczyny hipoglikemii poposiłkowej:
* zespół poresekcyjny z reaktywną hipersekrecją insuliny
* wczesne fazy cukrzycy typu II u otyłych
* czynnościowa reaktywna hipoglikemia
* wrodzone defekty metaboliczne z nietolerancją fruktozy lub galaktozy
Diagnostyka:
glikemia
stężenie polipeptydu C
stężenie proinsuliny
stężenie insuliny
CT przewodu pokarmowego insulinoma
CT czaszki nowotwór przysadki
PRZYCZYNY ZABURZEŃ ŚWIADOMOŚCI I PRZYTOMNOŚCI
ŚPIĄCZKA ZE SZTYWNOŚCIĄ KARKU
Przyczyny
bakteryjne zapalenie opon mózgowo-rdzeniowych
zapalenie mózgu
pierwotny krwotok podpajęczynówkowy
krwotok do mózgu i móżdżku z zajęciem przestrzeni podpajęczynówkowej
malaria z zajęciem OUN
UWAGA
⇒
sztywność karku może ustąpić z pogłębieniem się śpiączki
Nieprzytomny bez urazu głowy, sztywności karku i objawów ogniskowych.
Badania na cito!!:
* glikemia
* mocznik, potas, sód (hiponatremia, nwd nerek)
gazometria krwi tętniczej
płukanie żołądka
rtg klatki piersiowej
posiew krwi gdy temp. < 36°C i > 37,5°C
* osmolalność osocza (
↑
w zatruciach etanolem, metanolem, glikolem etylenowym)
morfologia krwi
APTT ( nwd wątroby)
UDAR MÓZGU
46

Przyczyny możliwe do usunięcia:
hiperglikemia hiperosmolarna (?)
pęknięty tętniak workowaty
malformacje tętniczo-żylne
krwiak móżdżku
Inne przyczyny:
zatory pochodzenia sercowego
tętniak rozwarstwiający aorty
inne pozaczaszkowe choroby tętnic
przełom wywołany obturacją naczyń w anemii sierpowatokrwinkowej
zapalenie tętnic czaszkowych lub w przebiegu kolagenoz, zajęcie tętnic skroniowych z przejściem
zapalenia z sąsiedztwa
Badania na cito!:
glikemia
morfologia krwi obwodowej
test sierpowatości krwinek
sód, potas, mocznik zaburzenia rytmu serca
EKG, rtg klatki piersiowej
CT wykluczenie:
o uraz głowy
o infekcja wewnątrzczaszkowa
o podejrzenie udaru móżdżku
Badania dalsze:
* OB, cholesterol, WR (kiła układu nerwowego)
* echokardiogram
endocarditis
hipertyreoza
migotanie przedsionków
< 60 r.ż.
* CT
przewlekły krwiak podtwardówkowy
udar móżdżku
♂ po 50 r.ż. z nadciśnieniem w wywiadzie i ataksją tułowia (?)
ZAKAŻENIA UOGÓLNIONE (!)
* wstępne rozpoznanie posocznicy
niewyjaśniona hipotensja
oliguria
splątanie współistniejące z gorączką lub hipotermią
*
↓
pO
2
i pCO
2
* morfologia krwi ( leukopenia)
* koagulologia ( skaza krwotoczna)
* mocznik, elektrolity, glikemia
* gazometria krwi tętniczej
* badanie osadu moczu
* posiew moczu
* badanie biochemiczne i bakteriologiczne płynu mózgowo-rdzeniowego
47
* nakłucie stawu i pobranie wydzieliny
* posiewy krwi 2 razy
⇒
kaniula naczyniowa, cewnik Sven-Cranza; osobno z żyły obwodowej i z
cewnika ( końcówkę posłać do pracowni bakteriologicznej, może być punktem wyjścia)
* rozmaz krwi w kierunku malarii
Gorączka u narkomanów:
zakażenie miejsc wkłucia
zakrzepowe zapalenie żył
endocarditis dx (?)
tbc płuc
WZW B
zapalenie stawów
zakażenia związane z AIDS
ZATRUCIA EGZOGENNE
mocznik
elektrolity
glikemia
morfologia krwi
osmolalność osocza ( > 300 mOsm/kg w zatruciu metanolem, etanolem, glikolem etylenowym )
stężenie salicylanów, paracetamolu w osoczu
gazometria krwi tętniczej
( < pCO
2
→
aspiryna, metanol, glikol )
Monitorowanie w ciężkich zatruciach:
* stopień zaburzeń świadomości w skali Glasgow
* częstość oddechów, wentylacja minutowa
* gazometria
kwasica metaboliczna
–
aspiryna
–
metanol
–
etanol
–
antydepresanty
–
glikol etylenowy
kwasica oddechowa
–
ARDS
* glikemia, MR, BP, diureza, temperatura ciała
* śpiączka:
batbiturany
etanol
opiaty
BDA
antydepresanty trójcykliczne
Objawy wskazujące na rodzaj trucizny:
* salicylany
objaw obrzęku płuc w rtg
morfologia krwi
hipoglikemia
48

> PTT
mocznik
↓
K
+
gazometria
⇒
zasadowica oddechowa
→
kwasica metaboliczna
powtarzanie co 4 godz. pomiarów stężeń salicylanów; rtg klatki ( ! obrzęk płuc ! )
* paracetamol
↑
PTT
→
próby czynnościowe wątroby
mocznik i kreatynina w osoczu
ŚPIĄCZKA MOCZNICOWA (!)
60-70% nefronów uległo nieodwracalnemu uszkodzeniu.
↓
GFR ( spadek filtracji kłębuszkowej i przesączania):
*
↑
kreatynina i mocznik
*
↑
lipoproteiny
*
↑
PO
4-
, K
+
, H
+
*
↑
kwasu moczowego
*
↑
Cl
-
*
↑
PTH
*
↑
renina
*
↑
aldosteron
*
↓
zasób zasad:
↓
wodorowęglanów
↓
pH
↓
Ca
2+
*
↓
cholesterolu w HDL
Analiza dalsza:
oliguria / anuria
anemia
osteodystrofia nerkowa
nadciśnienie tętnicze
oporność na insulinę
⇒
↑
insuliny,
↑
glukagonu
opóźniona odpowiedź na obciążenie glukozą
ENCEFALOPATIA WĄTROBOWA
Wstępne przyczyny:
zaburzenia świadomości
→
niewyjaśniony
↓
PTT
wcześniej rozpoznane choroby wątroby lub objawy choroby wątroby
brak innej przyczyny śpiączki
Czynniki wywołujące dekompensację czynności wątroby:
ostre krwawienie z przew. pok.
zakażenia zwł. peritonitis
nadużycie alkoholu
operacje
↓
K
+
sedativa
hipoglikemia
Badania na cito przy podejrzeniu nwd wątroby:
49

czas protrombinowy
→
morfologia krwi ( płytki)
mocznik, kreatynina, Na, K
próby czynnościowe wątroby
→
markery WZW B,C,D
gazometria
paracetamol w osoczu ( stężenie)
posiew i badanie mikroskopowe moczu
posiew i badanie mikroskopowe płynu otrzewnowego
rtg klatki
PRZEŁOM TARCZYCOWY (!)
Nagły wzrost metabolizmu:
nagłe odstawienie tyreostatyków
stresy
⇒
zakażenie, stres psychiczny lub fizyczny
po podaniu w rtg środków cieniujących jodowanych
u pacjentów z tyreotoksykozą niedostatecznie przygotowanych do tyreoidektomii
I okres:
hipertermia
odwodnienie
tachykardia
duża amplituda pomiędzy ciśnieniem skurczowym a rozkurczowym
II okres:
adynamia
splątanie – psychoza
III okres:
stupor
→
senność
→
śpiączka
↑↑
T
3
,
↑
T
4
,
↓
TSH,
↓
cholesterolu,
↑
glikemii
HYPOTYREOZA
Przyczyny:
operacje
stresy
sedativa
hipotensja, hipotermia
hiponatremia, bradykardia
– senność
– spowolnienie psycho-motoryczne
– bradypnoe ze spłyceniem oddechów
– niski woltaż QRS w EKG
↓↓↓
T
3
/T
4
↓
Na
+
hipoglikemia
→
K
+
(
↑
) , CO
2
(
↑
)
50

hiperlipidemia
↑
PRZEŁOM NADNERCZOWY (!)
Definicja: względny / bezwzględny niedobór gliko- i mineralokortykoidów nadnerczowych
Wskutek braku czynności:
* podwzgórza (
↓
kortykoliberyny CRH )
krwotok
zapalenie
zakrzepica
* przysadki mózgowej (
↓
ACTH )
* kory nadnerczy
uraz
operacja
nagłe odstawienie glikokortykosteroidów
krwotok
zakażenie
DIC
stresy
Objawy:
hipoglikemia
hiponatremia
hiperkaliemia
odwodnienie
hipowolemia
↑
kreatyniny
↓
ciśnienia ( BP ), hipotensja
Przełom stanowi wstępną fazę śpiączki nadnerczowej
→
przechodzi w objawy hipowolemii, hipotermii,
pseudootrzewnowe bóle brzucha
→
senność
→
śpiączka
51

LABORATORYJNA OCENA ZAGROŻENIA MIAŻDŻYCĄ I
ROZPOZNAWANIE POWIKŁAŃ MIAŻDŻYCY
Panel podstawowych badań:
CHc, LDL-CH, HDL-CH, Lp(a), TGc
glukoza
koagulogram
kwas moczowy
Blaszka miażdżycowa:
konglomeraty płytek
Ca
2+
lipidy
wzrost mięśni gładkich
włóknik
Gorsze są blaszki odrywające się, bo mogą zaczopować drobne naczynia.
Koagulogram
→
fibrynogen ( niezależny czynnik ryzyka ! ), płytki.
Hiperurykemia
→
kryształki mogą uszkadzać ściany naczyń.
Teoria homocysteinowa (wit. B
12
, B
6
, kwas foliowy)
Teoria prostacyklinowa (prostacyklina / tromboksan)
Infekcje:
Mycoplasma pneumoniae
H. pylori
wirusy ( Herpes, cytomegalowirus )
Chlamydia pneumoniae
Powikłania:
choroba wieńcowa
→
zawał
udary niedokrwienne mózgu
zmiany naczyń obwodowych
Powikłania blaszki miażdżycowej:
krwotok
zakrzep
owrzodzenie
zawał
wylew
martwica
tętniak ( aorty brzusznej )
choroba niedokrwienna serca zawał
udary niedokrwienne mózgu – udar
choroba zakrzepowa kończyn dolnych
Czynniki ryzyka:
hiperlipidemia
nadciśnienie
52

palenie tytoniu
cukrzyca
otyłość
wiek M:40 K:60
płeć
Poddaje się terapii:
nadciśnienie tętnicze
cukrzyca
palenie tytoniu
otyłość
↑
LDL-CH
Inne:
ChNS w wywiadzie
przebyty zawał
wywiad rodzinny
płeć męska
młody wiek
Czynniki ryzyka
I rzędu – modyfikowalne
II rzędu – niemodyfikowalne
I Inhibitors
-inicjują uszkodzenie śródbłonka (hyperlipidemia, nadciśnienie)
II Promotors
-promują nacieczenie lipidowe w ścianie naczynia (lipoproteiny aterogenne)
III Potentiators
-zwiększają prawdopodobieństwo mikro I makrozakrzepów (palenie tytoniu, zaburzenia
koagulogiczne)
IV Precypitators
-przyspieszają wystąpienie ostrego niedotlenienia (wysiłek fizyczny, palenie tytoniu)
LDL-Ch
< 100 optymalny
> 160 wysoki
>= 190 bardzo wysoki
Ch całkowity
< 200 optymalny (dzieci i młodzież <170)
< 240 wysoki
HDL-Ch
< 40 niski
>= 60 wysoki (tym się nie martwimy)
TG
<150 optymalny
Wszystkie osoby z wysokim LDL-Ch lub inną formą hiperlipidemii przed rozpoczęciem farmakoterapii
hipolipemizującej powinny mieć przeprowadzone badania w kierunku wtórnych przyczyn zaburzeń
lipidowych.
Zaliczamy do nich:
53

-
cukrzycę
-
niedoczynność tarczycy
-
cholestazę
-
przewlekłą niewydolność nerek
-
przyjmowanie leków podnoszących Ch-LDL i obniżających Ch-HDL (progestageny, sterydy
anaboliczne, kortykosteroidy)
Leptyna
•
Polipeptyd regulujący gospodarkę tłuszczową
•
Hormon syntetyzowany w tkance tłuszczowej, łożysku , przewodzie pokarmowym
•
Reguluje też procesy dojrzewania i reprodukcji
•
Leptynooporność cieżka otyłość
Zespół ekspertów zaleca stosowanie testów przesiewowych w 4 grupach:
1. U dzieci i młodocianych, których rodzice lub dziadkowie mieli stwierdzoną angiograficznie
miażdżycę tętnic wieńcowych przed 50r.ż.
2. U dzieci i młodocianych, których rodzice lub dziadkowie (wujkowie lub ciotki) przebyli w
wieku 55 lat lub wcześniej zawał serca, dławicę piersiową, choroby naczyń obwodowych lub
zmarli nagle
3. U potomstwa osób mających duże stężenie cholesterolu >240
4. Przy braku informacji rodzinnej lecz istnienia 2 lub więcej czynników ryzyka
5. Dzieci chorych.
Panel badań:
hsCRP
lipidogram (CH, TG, HDL-Ch, LDL-Ch, chylomikrony, VLDL jakościowo)
glukoza
kwas moczowy
koagulogram
HDL
2
, HDL
3
apo B100 LDL
apo A1 HDL
bakteriologiczne/wirusologiczne
Podstawowe badania lipidowe:
CH
TG
HDL-CH
LDL-CH = CH – TG/5 – HDL-CH (-Lp(a))
< 200 mg/dl
u dorosłych
< 170 mg/dl
u dzieci i młodzieży
LDL < 100-110 mg/dl
I grupa ryzyka
→
z hipercholesterolemią
TG prawidłowe
↑
CH w tym LDL-CH
II grupa ryzyka
→
hiperlipidemia mieszana
wysoki CH ( w tym LDL )
54

↑
TG
III grupa ryzyka
→
hiprtriglicerydemia
↑
TG
CH ( CH-LDL ) prawidłowy
↑
VLDL gdy endogenna
Leczenie: dieta
LECZENIE
Hipercholesterolemia
gdy
↑
LDL:
inhibitory reduktazy HMG-CoA (statyny)
leki przerywające krążenie kwasów żółciowych ( żywice )
pochodne kwasu fibrynowego
kwas nikotynowy
Hiperlipidemia mieszana
gdy
↑
VLDL-TG i LDL
pochodne kwasu fibrynowego
inhibitory reduktazy HMG-CoA (statyny)
kwas nikotynowy
Hipertriglicerydemia endogenna
gdy
↑
VLDL, TG
pochodne kwasu fibrynowego
kwas nikotynowy
Zespół chylomikronemii
gdy podwyższone VLDL i chylomikrony w osoczu na czczo
pochodne kwasu fibrynowego
kwas nikotynowy
Lp(a)
≤ 30 mg/dl
podobna do LDL
niezależny czynnik ryzyka
dużo cholesterolu i duża masa cząsteczkowa
może być wybiórczo pobierana przez komórki czyszczące ( ich receptory)
względnie stałe stężenie osobnicze
znaczne różnice międzyosobnicze
stężenie w osoczu jest cechą rodzinną
stężenie w osoczu jest niezależne od innych lipoprotein
działanie atero- i trombogenne ( bo ma białko przypominające fibrynogen i wypiera go z jego
miejsc wiążących)
oporna na działanie środków obniżających lipidy we krwi
Wysokie stężenie Lp(a) w osoczu:
osoby rasy czarnej
ciąża
♀ po menopauzie
55

przedwczesna miażdżyca
cukrzyca z mikroalbuminurią
przewlekła nwd nerek
zespół nerczycowy
ch. nowotworowa
odpowiedź na ostrą fazę
Spadek stężenia Lp(a) w osoczu:
kwas nikotynowy
steroidy anaboliczne
estrogeny
Lp(a) wiąże się poprzez apoA z:
fibryną
fibronektyną
proteoglikanami
glukozaminoglikanami
Bezwzględne wskazanie do oznaczenia Lp(a)
ChNS + przwidłowy lipidogram
młode osoby z obciążającym wywiadem
po angioplastyce nowe zwężenia w krótkim czasie
I.) CH < 200 mg/dl
→
dieta profilaktyczna ( instrukcje na temat żywienia dietetycznego)
+ 1 czynnik ryzyka
→
instrukcja na temat żywienia dietetycznego
II.) CH 200 – 250 mg/dl
(nieznaczna
hipercholesterolemia)
+ 2 i więcej czynniki ryzyka
III.) CH > 250 mg/dl
badania kliniczne
(znaczna hipercholesterolemia)
badania laboratoryjne
CH całkowity
TG całkowite
IV.) objawy kliniczne
HDL-CH
ChNS hiperlipidemia wtórna
żółtaczki
inne czynniki
cukrzyca
instrukcje na temat żywienia dietetycznego
leki w razie potrzeby
56
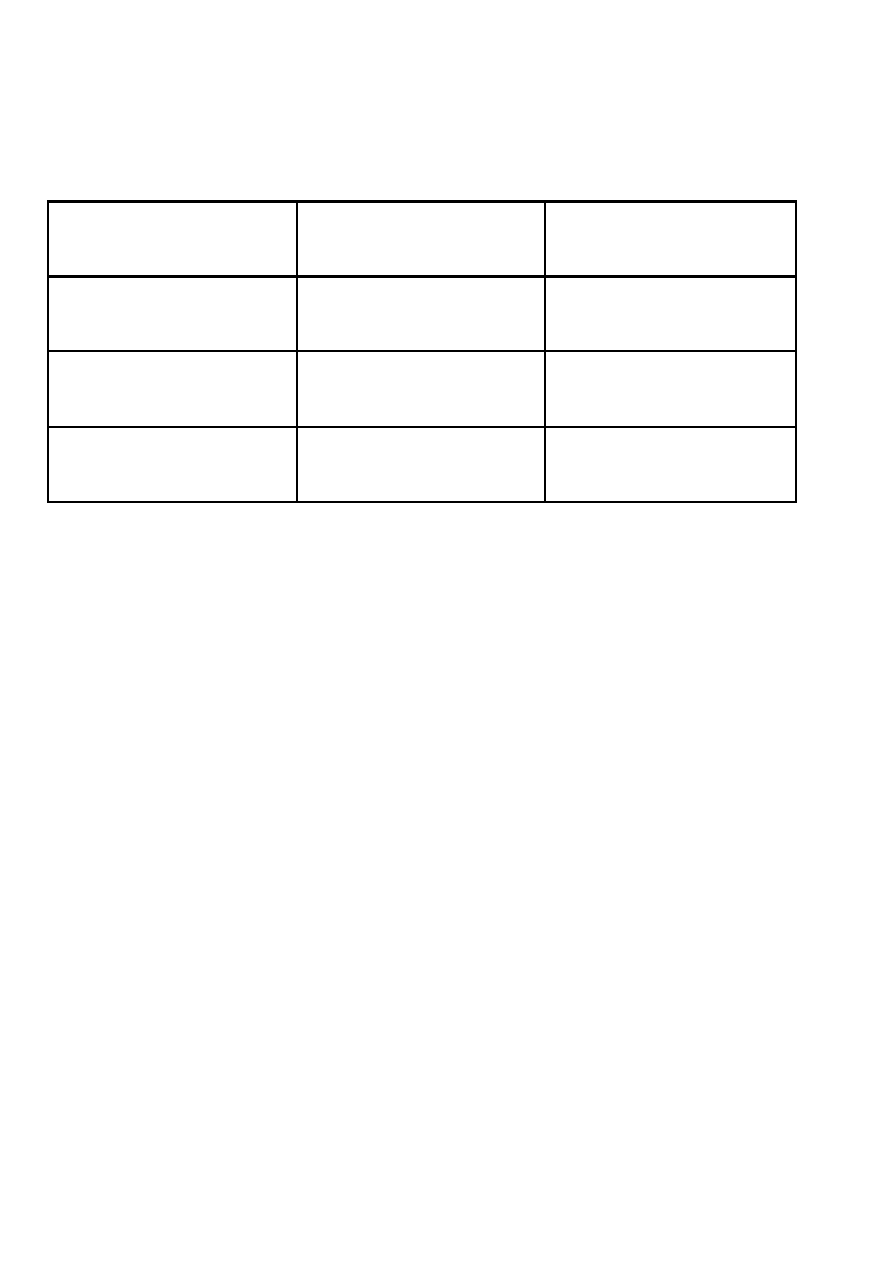
CH całkowity:
każdy po 20 r.ż.
nie trzeba być na czczo
CH < 200
→
powtórzenie badania do 5 lat + zalecenia dietetyczne
Dzieci i młodzież
CHc
LDL
prawidłowy
< 170 mg/dl
< 4,4 mmol/l
< 110 mg/dl
< 2,8 mmol/l
graniczny
170 – 199 mg/dl
4,4 – 5,1 mmol/l
110 – 129 mg/dl
2,8 – 3,3 mmol/l
wysoki
> 200 mg/dl
> 5,2 mmol/l
> 130 mg/dl
> 3,3 mmol/l
U dzieci otyłych i obciążonych rodzinnie powinno się oznaczać ............................................................
Hiperlipoproteinemie wtórne w przebiegu, Typ hiperlipoproteinemii
cukrzyca insulinozależna (źle kontrolowana), IV, V
nerczyca, II,IV
żółtaczka zaporowa
niedoczynność tarczycy, II, III, IV
nwd nerek, IV
szpiczaki
alkoholizm, IV
ostra porfiria, IIa
Zawał mięśnia sercowego
CK-MB, CK
LDH -> αHBDH
AST (ALT)
miogliobina
troponina
Sytuacje w których najczęściej zdarza się zawał mięśnia sercowego:
1. sen
2. wypoczynek
3. lekki wysiłek
4. posiłek
TAT – Turn Around Time czas od pobrania do wyniku, powinien być zdecydowanie krótszy niż 1h
Izoenzymy kinazy kreatynowej:
mózgowy CK-BB
sercowy CK-MB (30%)
→
izoformy:
57

↑
CK-MB
1
CK-MB
2
mięśniowy CK-MM (70%)
→
izoformy:
CK-MM
1
CK-MM
2
CK-MM
3
Karboksypeptydaza przekształca izoformy o wyższych numerach w niższe.
CK-MB
CKc
⇒
przemawia za zawałem
zawał przedwczesny przed 50 r.ż.
jako pierwsze pojawiają się enzymy małocząsteczkowe i krótki T
1/2
w ♡ CK-MM ( CK-MM
3
), CK-MB ( stanowi 30% CKc ) ( CK-MB
2
)
powoli zaczyna się oznaczać CK
masa
, a nie CK
aktywność
gdy występują trudności diagnostyczne oznaczamy CK-MM
3
i CK-MB
2
karboksypeptydaza w łożysku naczyniowym odłącza C-końcowe reszty lizyny i powstają kolejne
izoformy MM
3
→
MM
2
→
MM
1
CK-MB
2
CK-MB
1
⇒
przemawia za zawałem
CK-MM
3
CK-MM
1
⇒
przemawia za zawałem
makrokinaza ( u ♀ > 50 r.ż., u ♂ 60-70 r.ż.)
⇒
są to fizjologiczne makro-CK
1
( kompleksy CK-
BB z immunoglobulinami), patologiczne makro-CK
2
( kompleksy CK-MM z immunoglobulinami;
u niektórych osób z chorobami wątroby i w niektórych nowotworach)
CK to enzym wczesnodiagnostyczny
AST
enzym wczesnodiagnostyczny
z ALT
→
wsk. de Ritis’a ( > 1 przy zdrowej wątrobie przemawia za zawałem)
LDH
enzym późnodiagnostyczny
ma 5 izoenzymów
dla ♡ są charakterystyczne te, które mają łańcuch H (?) lub jego przewagę
α
-HBDH
α
-hydroksymaślan
długo utrzymuje się na podwyższonym poziomie
58
> 6%
> 1,5
Enzymy oznaczamy co 4 h w pierwszej dobie zawału, potem co 6-8 h.
16
14
12
10
8
6
4
2
1 2 3 4 5 6 7 dzień choroby
Troponina – marker wczesno i późnodiagnostyczny
T
T
– ocena reperfuzji
T
I
– pozwala zdiagnozować zawał śródoperacyjnie
T
T
, T
I
⇒
sercowe
T
C
T
T
→
95% w organellach, 5% w cytozolu
2 etapy wyrzutu
najpierw „leci” to z cytozolu, jeśli proces trwa dalej, uwalnia się z organelli ( 2 – ostrzejszy wyrzut)
wczesnodiagnostyczne i długo się utrzymuje ( T
1/2
długi)
Nieswoisty
↑
T :
nadciśnienie z przerostem LK
obrzęk płuc
wstrząs
zawał płucny
kardiotropowe infekcje wirusowe
zatorowośc płucna
choroba wirusowa
posocznica
marskość
3 podstawowe objawy zawału:
charakterystyczny ból
zmiany w EKG
zmiany biochemiczne ( gł. troponina)
T
I
→
jedyny marker uszkodzenia ♡, który diagnozuje zawały śródoperacyjne !!!
W efekcie skutecznego leczenia szybki
↑
i szybki
↓
świadczy o skuteczności leczenia, bo następuje
reperfuzja naczyń.
Mioglobina
Białko najwcześniej wydzielane z mięśnia ♡.
59

↑
Anhydraza węglanowa III ( wydzielana tylko z mm. szkieletowych) oznaczana razem z mioglobiną, aby
zwiększyć swoistość badania.
mioglobina
AC III
⇒
przemawia za zawałem
Kryteria świeżego zawału , w trakcie ewolucji lub niedawno przebytego:
* typowy
↑
i stopniowy
↓
TnT ( I ) lub szybszy
↑
i
↓
CK-MB oraz co najmniej jedno z:
objawy podmiotowe ChNS
rozwój patologicznych załamków EKG
zmiany w EKG wskazujące na niedokrwienie ( uniesienie lub obniżenie odcinków ST )
koronaroplastyka
* anatomopatologiczne cechy świeżego zawału ♡
Świeży zawał do 3 h po rozpoznaniu powinny być oznaczane CK, a potem troponina ( 3-5 h ); powyżej 5 h
tylko troponina.
Badanie lipidów powinno być wykonane po 6 tyg. od zawału:
w czasie świeżego zawału
↑
wszystkie parametry lipidowe
jak maleje CK to maleją też parametry lipidowe
Najwcześniejsze markery:
6. Mioglobina 3h
7. CK-MB 3 – 5h
max stężenie
parametr
5 – 12 h
( 18-30 )
mioglobina
< 90 ng/dl
100 ng/ml
10 – 36
( 72-96 )
CK
24-195 IU/l
200 IU/l
9 – 30
( 48-72 )
CK-MB
10-25 IU/l
0-9 ng/ml
> 25 IU/l
> 10 ng/ml
24 – 72
( 6-10 dni )
LD
36-86 IU/l
> 100 IU/l
24 – 72
( 6-10 dni )
LD
1
14-36%
> 40%
10 – 24
( 10-15 dni )
T
T
< 0,1 ng/ml
0,1 ng/ml
14 – 20
( 5-7 dni )
T
I
< 0,5 ng/ml
60

8. troponina >5h
9. LDH, αHBDH
Nowe markery:
FABP
→
białko wiążące kwasy tłuszczowe
Potencjalny marker biochemiczny zawału serca o niepotwierdzonej w pełni przydatności diagnostycznej.
Wzrost w 1.5h, maks 5-6h, powrót do normy po 24h.
GPBB
→
fosforylaza glikogenowa mózgowa
Podwyższona u prawie wszystkich pacjentów z zwałąme serca między 7-13 h od początku bólów
wieńcowych
W 4h wzrost o 70%.
Wzrasta od 3h, maks 8-12h, powrót po 40h.
61

DIAGNOSTYKA LABORATORYJNA CHORÓB NEREK
Choroby nerek:
zapalne
niezapalne
pierwotne
wtórne ( cukrzyca, nadciśnienie, kolagenozy, nowotwory, infekcje )
ostre
podostre
przewlekłe
– paciorkowce hemolizujące grupy A
– kompleksy gł. IgA powstają i mogą się odkładać w błonie naczyń +
↓
C
3
i C
4
dopełniacza
→
wykonujemy ASO
– limfokiny produkowane przez limfocyty też mogą uszkadzać błonę podstawną kanalika
Ertytrocyty w moczu:
•
akantocyty – z wypustkami
•
dysmorficzne – wyługowane + akantocytoza
•
eumorficzne - norma
1. Białkomocz selektywny : albuminy + transferyna
2. Białkomocz nieselektywny : głównie gamma-globuliny
Białko masa 60-70 kDa
Wałeczki ziarniste – ziarna tworzą fragmenty komórek, białek
Wałeczek białkowy – odlew kanalika nerkowego
Choroby kłębuszków nerkowych:
* uszkadzane są błony podstawne
* białkomocz
selektywny
–
albuminy
–
transferyna ( bo ładunek „-”, graniczna wielkość przepuszczalności kłębka )
nieselektywny
–
dominują
γ
-globuliny
* dobowo do 3 g białkomocz
*
↓
filtracji kłębkowej
→
oliguria (
↓
400 ml/24h
)
→
anuria (
↓
100 ml/24h
)
→
anuria
zupełna (
↓
10 ml/24h
)
*
↑
przepuszczalności dla erytrocytów
→
całkowicie lub częściowo pozbawione HGB +
dysmorfizm – tzw. wyługowane ; zmiany kształtu do akantocytozy !! ( ma wypustki na powierzchni)
* leukocyty mogą być, ale nie muszą
* wałeczki erytrocytarne !, szkliste, ziarniste, woskowe
* zmieniona barwa moczu ( różowo-czerwona )
* zmiana barwy i przejrzystości ( brunatny, mętny, popłuczyny mięsne
→
makrohematuria,
krwiomocz)
* pienistość moczu
* surowica:
↑
ASO
62
U
x
x V
P
x
U
x
x V
P
x
1 .
t min.
1,73 m
2
A
↑
mocznika ( marker późny) i kreatyniny ( marker wczesny), bo spadek filtracji
↑
K
+
↑
H
+
( kwasica metaboliczna )
* morfologia:
leukocytoza
↑
OB
↑
białka ostrej fazy, CRP
↓
40 ml/min.
→
wówczas pojawia się mocznik; fosforany – późny marker.
Klirens nerkowy
→
objętość osocza, która podczas przepływu przez nerki w czasie 1 sek. lub 1 min.
zostaje całkowicie pozbawiona badanej substancji; jest miarą zdolności nerki do usuwania i wydalania
danego związku; im
↑
jego wartość, tym skuteczniej jest wydalany dany związek
Do pomiarów przesączania kłębkowego używa się związków dla których błona sącząca kłębka jest
całkowicie przepuszczalna.
Właściwa substancja powinna wykazywać następujące cechy:
swobodnie przesączać się przez kłębki
nie może być wydalana ani wchłaniana przez nerki
nie może być metabolizowana ani magazynowana przez nefron
nie może być toksyczna
nie może łączyć się z białkami osocza
powinna być łatwo oznaczalna metodami laboratoryjnymi
Badanie klirensu nerkowego metodą klasyczną opiera się na oznaczaniu stosunku między stężeniem badanej
substancji wydalonej z moczem, a jej stężeniem w osoczu.
Obliczamy na podstawie wzoru:
C
x
=
C
x
– klirens substancji X ( ml/s ; ml/min. )
U
x
– stężenie badanej substancji w moczu
V – objętość wydalonego moczu
P
x
– stężenie badanej substancji w surowicy
Wzór dotyczy dobowej zbiórki moczu
C
x
= x x
dla standardowej osoby ( 70 kg, 173 cm )
A – rzeczywista powierzchnia ciała badanej osoby wyczytana z tabeli
1,73 m
2
- standardowa powierzchnia ciała
Stosujemy go u:
dzieci
osób niskich, b. wysokich, otyłych
63

140 - wiek w latach .
stężenie kreatyniny w surowicy w mg/dl
waga w kg
72
U
inuliny
U
PAH
Klirens inuliny
→
przesącza się w kłębkach, nie ulega wchłanianiu ani wydzielaniu w kanalikach, jej
ilość wydalana z moczem odpowiada dokładnie ilości, która została przesączona w kłębuszkach
U
in
x V = P
in
x GFR
Na podstawie tego wzoru można wyliczyć wielkość przesączania kłębkowego
GFR
=
Prawidłowa wielkość GFR
125 ± 15 ml/min.
Klirens kreatyniny endogennej
→
jej stężenie jest dość stałe, zależy jednak od diety, m.in.
bogatobiałkowej w białko zwierzęce;
↑
po wysiłku fizycznym; swobodnie przechodzi przez kłębki; w
kanalikach ulega minimalnemu wydzielaniu; w warunkach zdrowia klirens kreatyniny endogennej w
niewielkim stopniu różni się od klirensu inuliny.
♂ 130 ml/min.
♀ 120 ml/min.
Mannitol, tiosiarczan sodowy, związki promieniotwórcze
→
też wykorzystujemy do oceny klirensu.
Wzór Cochrofta i Gantla
dla obliczenia GFR
GFR = x
↓
GFR < 60 ml u ♀ i < 80 ml u ♂:
* w chorobach nerek
zapalenie kłębuszków nerkowych
odmiedniczkowe zapalenie nerek
skrobiawica
* po wysiłku fizycznym
* w ostatnim trymestrze ciąży
* przy diecie ubogobiałkowej
Podwyższone GFR występuje:
we wczesnym okresie ciąży
przy diecie bogatobiałkowej
w nerczycy
FF = x 100%
N:
16 – 22%
U
PAH
– wskaźnik przesączania kłębuszkowego
Efektywne ciśnienie filtracyjne ocenia PAH – kwas paraaminohipurowy
64
U
in
x V
P
in
U
PAH
x V
P
PAH
RPF .
1-HCT
Oznaczanie wielkości przepływu osocza i krwi przez nerki:
- kwas paraaminohipurowy ( PAH )
związek endogenny
całkowicie przesączany przez nerki
nie jest metabolizowany w nerkach
wydzielany i wydalany z moczem
krew po przepłynięciu przez nerki prawie zupełnie oczyszcza się z PAH
Klirens PAH
→
odpowiada objętości osocza przepływającego przez nerkę, dokładniej przez tzw.
czynny miąższ w ciągu 1 min.
C
PAH
= RPF =
RPF = renal plasma flow
Znając wskaźnik HCT można wyliczyć
przepływ krwi przez nerkę RBF
( renal blood flow )
RBF =
HCT – wartość bezwzględna
RPF N: śr.
790 ml/min
.
RBF N: śr.
1165 ml/min.
↓
RBF:
ostra / przewlekła nwd nerek
czerwienica
marskość wątroby
nwd wątroby
zatrucie ciążowe
odwodnienie
wstrząs
ciężkie infekcje
↑
RBF:
wczesny okres ciąży
gorączka
oziębienie
przewodnienie
początkowy okres ostrego kłębuszkowego zapalenia nerek
Próba Volharda:
próba zagęszczania [próby rozcieńczania moczu nie wykonuje się]
jedna z najwcześniejszych zmian z powodu przerostu czynnych kłębuszków
65

pacjent przez dobę nie otrzymuje pokarmów płynnych
w kolejnych próbkach moczu oznacza się jego ciężar właściwy i molalność
przy 1,025 można przerwać próbę
→
u zdrowych po 16 h
jeśli po 24 h jest < 1,022 , to mówimy o upośledzeniu zdolności zagęszczania moczu, lub nawet
izostenurii ( całkowita utrata przez nerkę zdolności do zagęszczania moczu bez względu na
nawodnienie pacjenta )
Izostenuria
1,010 – 1,012
( 1,009 – 1,011 ) (!)
Ew. i.m. wazopresyna zamiast próby Volharda.
Ok. 1/3 zapaleń kłębków może się zakończyć zespołem nerczycowym.
Zespół nerczycowy
Zespół objawów biochemicznych i klinicznych wywołanych białkomoczem przekraczającym zdolności
kompensacyjne ustroju.
W pełni rozwinięty z. n. charakteryzuje się przynajmniej 3 z następujących objawów:
białkomocz
hipoalbuminemia
hipoproteinemia
obrzęki
zaburzenia gospodarki lipidowej
lipiduria
Może do niego dojść w przebiegu prawie wszystkich pierwotnych i wtórnych chorób nerek.
Mocz:
mętny i pienisty
białkomocz
> 3,5 g/24 h
( nawet do kilkudziesięciu g/24 h )
erytrocyty i/lub leukocyty w moczu w zależności od choroby podstawowej
wałeczki szkliste + prawie wszystkie inne rodzaje ( leukocytarne, ziarniste, woskowe, lipidowe! –
gł. z estrów cholesterolu
→
dają charakterystyczne załamanie światła spolaryzowanego
→
dwójłomne i krzyże maltańskie )
prawidłowa gęstość moczu przy zachowanej czynności nerki
Surowica:
hipoproteinemia, hipoalbuminemia < 52 g/l białko całkowite
→
obrzęki ( jeśli albuminy < 50% ) -
dotyczy to ok. 30% chorych
odwodnienie zewnątrzkomórkowe
→
hipowolemia
→
RAA
→
dodatkowe zatrzymanie wody i sodu
→
pogłębienie istniejących obrzęków
→
nadciśnienie
obrzęk dotyczy gł. tkanki podskórnej, ale też obrzęk śluzówki (w przewodzie pokarmowym
powoduje to biegunki)
zaburzenia wodno-elektrolitowe
płyn w jamie opłucnej
→
kwasica oddechowa w wyniku trudności w oddychaniu, duszność
↓
białek transportowych dla Fe
→
narastająca niedokrwistość z niedoboru Fe ( +
↓
wchłaniania z
powodu biegunek i obrzęków )
↓
białek transportowych dla wit. D
3
→
↓
Ca
2+
który ucieka z Mg
2+
nawet do wtórnej nadczynności przytarczyc
↓
białek odpornościowych
→
podatność na infekcje
66

↑
α
2
-globulin ( narastanie białek ostrej fazy ); pozostałe frakcje maleją
↑
fibrynogen
→
powoduje
↑
lepkości krwi ( zaburzenia reologiczne),
↑
adhezja i agregacja płytek
→
↑
zdolności do zakrzepów
uciekają białka transportowe i metaboliczne lipidów – gł. apoC
II
i lipaza lipoproteinowa, dla której
jest aktywatorem
→
nagromadzenie triglicerydów,
↑
LDL,
↑
VLDL ( zatem
↑
cholesterolu ),
lipiduria
VLDL głównym transporterem TG -> miażdzyca
ucieczka apoA – brak HDL miażdyca
mocznik i kreatynina w normie
Najczęściej spotykane hipolipoproteinemie
→
typ 4 i 2b.
Choroby kanalików
próba Volharda
albuminy w moczu w N, ale jest białkomocz, bo w moczu
β
2
-mikroglobulina ( 11 kD), cystatyna C
( > 12 kD)
im mniejsze białko, tym wcześniej pojawia się w moczu przy chorobie kanalików
β
2
-mikroglobulina, cystatyna C
→
to bardzo wczesne białka ( przednerkowe przyczyny tych białek!)
Białkomocz do
1,5 – 2 g/24 h
Kwasice kanalikowe
→
niemożność zakwaszania moczu ( w najlepszym przypadku jest wydalany
mocz obojętny
→
alkaliczny )
kwasice kanalikowe kanalików proksymalnych
→
kłopot z odzyskiwaniem zasad HCO
3-
(
amoniogeneza, kwaśność miareczkowa)
k.k. kanalików dystalnych
→
zaburzenia usuwania H
+
i często K
+
k.k. mieszane
Test zakwaszania Wrong-Daviesa
podaje się choremu chlorek amonowy 0,1 g/kg m.c.
bada się w moczu pH, stężenie H+ i amoniaku
ze zbiórki od 2 do 8 h ( w zależności od diurezy )
pH powinno obniżyć się
<5.2
[H+] > 60 mmol/min.
amoniak > 35 mmol/min.
Izostenuria powtarzalna w kolejnych próbach
1.09 – 1.011 g/cm
3
1.010 – 1.012 g/cm
3
Ocena wydolności układu transportowego
Ocena transportu max – najczęściej glukozy lub PAH
N dla glukozy
350 mg/min.
N dla PAH
79 ± 13 mg/min.
67

Odmiedniczkowe zapalenie nerek
Ostre ( gorączka + silny ból okolicy lędźwiowej) lub przewlekłe.
Przyczyny:
zakażenia bakteryjne ( wstępujące i zstępujące)
o gł. gronkowce
o promieniowce
o grzyby ( często drożdżowe)
o wstępujące E. coli
czynniki immunologiczne ( kompleksy)
w przebiegu cukrzycy
czynniki toksyczne ( środki p-bólowe, glikol etylenowy)
Ostre:
białkomocz do 1,5 g/24 h
leukocyturia !
→
ropomocz ( żółtawo-szary, mętny mocz)
wałeczki leukocytarne !
¼ zap. ma erytrocytów w moczu, może być krwinkomocz
wałeczki szkliste
bakteriuria znamienna
spadek ciężaru właściwego
Przewlekłe:
zmniejszone dolegliwości kliniczne lub żadne
występują okresy wyciszenia bez zmian w moczu
bakteriuria tylko na początku
okresowo leukocyturia , wałeczki leukocytarne i szkliste
niski ciężar właściwy moczu !!
Ostra niewydolność nerek
Przednerkowa
* przyczyny:
↓
objętości krwi krążącej ( biegunki, rozległe oparzenia, rozległe rany i urazy)
odwodnienie wskutek niedostatecznej podaży płynów
wewnątrzustrojowe przemieszczenie płynów ( niedrożność jelit, zapalenie otrzewnej, ostre
zapalenie trzustki)
krwotoki zewnętrzne i wewnętrzne
zaburzenia naczynioruchowe ( wstrząs, posocznica, schyłkowa marskość wątroby)
ostra niewydolność krążenia ( zawał mięśnia sercowego )
* wyraźny
↓
filtracji kłębkowej
→
anuria
* wyraźna przewaga dysfunkcji kłębka nad kanalikiem
* zwiększony ciężar właściwy moczu i molalność ( > 600 mmol/kg H2O )
* zwykle 200-400 ml moczu na dobę, do anurii włącznie
* krwinki czerwone w osadzie, ale też może być osad prawidłowy
* jeśli białkomocz to tzw. z zagęszczenia
* też krwinkomocz
68

* zdolność do oszczędzania sodu
→
zatrzymanie Na
+
(
↓
wydalania Na
+
z moczem)
→
przeciwdziała
odwodnieniu
* mocznik, kreatynina, kwas moczowy, H
+
, K
+
* fosforany,
↓
Ca
2+
,
↓
Mg
2+
* stęż. mocznika i kreatyniny w moczu !! ( do różnicowania)
Ostra miąższowa
* przyczyny:
zapalenia nerek i choroby naczyń
–
ostre i podostre zapalenie kłębuszków nerkowych
–
ostre odmiedniczkowe zapalenie nerek
–
ostre śródmiąższowe zapalenie nerek
–
zakrzepy tętnic i żył nerkowych
–
złośliwe nadciśnienie tętnicze
–
guzkowe zapalenie naczyń nerkowych
ostra niezapalna nwd nerek
–
urazy, wstrząsy, oparzenia, zatrucia
–
odwodnienie
–
hemoliza wewnątrznaczyniowa
–
hipotermia
Okresy:
1 wstępny
*
dominują objawy choroby podstawowej
*
mocz może być nie zmieniony, podobnie wskaźniki biochemiczne
2 faza oligurii
*
najczęściej krytyczna
*
7-14 dni,
ale nawet do 40 dni
*
gwałtowny
↓
filtracji do poniżej 100 ml/24 h
*
zaczynają dominować cechy nwd kanalika nad kłębkiem
*
niski ciężar właściwy do izostenurii
*
osmolalność do 300 mmol
*
białkomocz ( mocz mętny)
*
leukocyty i/lub erytrocyty, różne wałeczki do lipidowych
*
niskie stężenie mocznika i kreatyniny w moczu i znaczny w surowicy !!
*
upośledzenie wydalania przez nerkę H
+
narastanie zakwaszenia
rozpad białek mięśni szkieletowych
*
narastający K
+
(
↓
m.c.,
↓
wydalanie, nudności i wymioty) w surowicy; hipokaliemia
→
kompensacja kwasicy
*
hipokaliemia idzie w parze ze
↓
Ca
2+
zjonizowanego i
↓
Na
+
( niemiarowość akcji ♡)
*
cechy niedokrwistości
3 faza poliurii
*
7-10 dni
*
3-5 l moczu/24 h
*
zdrowieje kłębek, ale kanalik dalej „chory”
*
mocz izoosmotyczny
*
mocznik i kreatynina
*
chory może łatwo się odwodnić
4 faza zdrowienia
*
4-6 tyg.
*
normalizacja wskaźników
69

*
!!! ale nerka bardzo długo nie odzyskuje zdolności do zagęszczania i rozcieńczania moczu (
od kilku miesięcy do nawet kilku lat)
OSTRA NIEWYDOLNOŚĆ NEREK
przednerkowa
miąższowa
stężenie mocznika w moczu .
stężenie kreatyniny w surowicy
> 10 : 1
< 10 : 1
stężenie mocznika w moczu .
stężenie mocznika w surowicy
> 10 : 1
< 10 : 1
Ostra pozanerkowa niewydolność nerek
* przyczyny
zatkanie dróg moczowych złogami ( kamienie, kwas moczowy)
zatkanie moczowodów lub moczowodu 1 czynnej nerki ( skrzepy, złogi)
ucisk moczowodów ( nowotwory, zwł. macicy)
zatkanie cewki moczowej ( guzy gruczołu krokowego i pęcherza moczowego)
przecięcie moczowodów
czynniki toksyczne
–
endogenne
➫
mioglobina
➫
hemoglobina
➫
białka patologiczne ( Bence-Jonesa)
➫
hiperkaliemia
–
egzogenne
➫
antybiotyki
➫
środki kontrastowe
➫
sole metali ciężkich
➫
glikol etylenowy
Przewlekła niewydolność nerek
1.
1.
okres
– utajona przewlekła nwd nerek
→
ilość zniszczonego miąższu nie przekracza 50%,
nerka utrzymuje homeostazę, ale przesączanie kłębuszkowe jest zmniejszone; występuje niewielkie
upośledzenie zagęszczania moczu, może pojawić się nadciśnienie tętnicze
2.
2.
okres
– wyrównana p.n.n.
→
ilość zniszczonego miąższu nerki wynosi 50-75%, zdolność
zagęszczania jest wyraźnie zmniejszona ( wielomocz), często dochodzi do nadciśnienia tętniczego,
bywa niedokrwistość, stężenie mocznika i kreatyniny w surowicy jest nieznacznie podwyższony
70
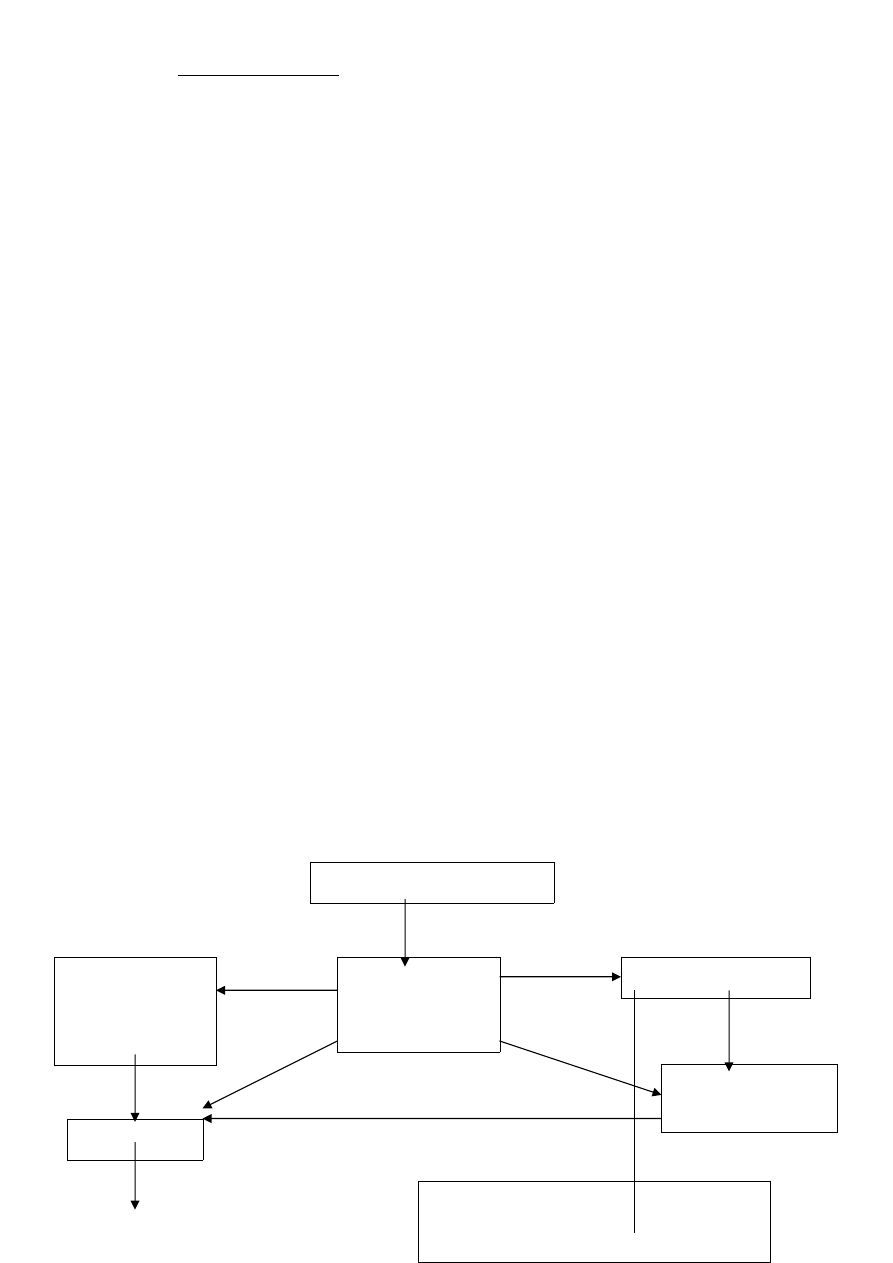
3.
3.
okres
– niewyrównana p.n.n.
→
ilość zniszczonego miąższu przekracza 75%; stwierdza się
mniej lub bardziej nasilone zaburzenia w zakresie wszystkich biochemicznych wskaźników funkcji
nerek; końcowym okresem, kiedy zniszczenie miąższu > 90% miąższu jest mocznica
Kreatynina w surowicy w p.n.n.:
okres utajenia
→
górna granica N lub nieznaczny
1,2 – 2 mg/dl
okres wyrównania
2,1 – 5 mg/dl
okres niewyrównania
> 5 mg/dl
Niedokrwistość w p.n.n. – przyczyny:
* problemy z syntezą erytropoetyny
→
erytropoeza szpikowa
↓
→
niedokrwistość bez retikulocytozy
= niedokrwistość oporna na leczenie ( Fe zwykle N, bo
↓
białka transportowe)
konieczne transfuzje krwi
→
immunizacja chorych i problem z doborem krwi +
przeładowanie Fe w wyniku transfuzji
* w krążeniu pojawiają się inhibitory erytropoezy / Epo !!!
* leki
* nasilona hemoliza krwinek, bo są narażone na jady mocznicowe (?)
→
↓
oporność osmotyczna tych
krwinek
* krwotoki lub przewlekłe krwawienia gł. z p. pok., bo mocznik rozkładany do amoniaku przez
bakterie w p. pok., a amoniak uszkadza błonę śluzową
→
owrzodzenie dwunastnicy
* zaburzenia koagulologiczne gł. dotyczą płytek ( brak cz. III, zaburzenia adhezji i agregacji)
* zaburzenia lipidowe
CH
TG
Lp(a) ( toksyczne dla naczyń wieńcowych)
* kłopoty z odzyskiem zasad; szwankuje gł. amoniogeneza !!
→
RKZ
* narastające zakwaszenie powoduje:
nasiloną proteolizę białek (
↓
m.c.)
↓
kurczliwość błony kom. m. ♡ ( niemiarowość akcji ♡)
osteodystrofię mocznicową ( bo układ kostny to magazyn zasad i stąd są pobierane)
drugorzędową nadczynność przytarczyc ( PTH)
→
nawet po przeszczepie nie można
↓
PTH
→
III-rzędowa nadczynność przytarczyc
–
PTH dodatkowo
↓
resorpcję zwrotną zasad
* K
+
długo prawidłowy ( chyba, że chory wymiotuje); K
+
dopiero w schyłkowej nwd
Patomechanizm wtórnej nadczynności przytarczyc u chorych z przewlekłą nwd. nerek
71
↓
masy miąższu nerkowego
wiązanie Ca
2+
z
wytworzeniem
związków
niedysocjujących
hiperfosfatemia
sekrecji
kalcytoniny
↓
syntezy 1,25(OH)-D
hipokalcemia
↓
wchłaniania Ca
2+
z
przew. pok.
1.
↓
klirensu PTH w nerkach
2. oporność tkanki kostnej na PTH
3. aktywności układu adrenergicznego

Osteodystrofia nerkowa
Zespół zmian kostnych u chorych z przewlekłymi nefropatiami o różnym charakterze
osteomalacja
osteoskleroza
osteoporoza
osteitis fibrosa
upośledzony wzrost u dzieci i młodzieży
⇒
karłowatość nerkowa
Czynniki uczestniczące w patogenezie dystrofii nerkowej
wtórna nadczynność przytarczyc
niedobór aktywnych metabolitów wit. D
3
niedobór androgenów (?)
zaburzenia w biosyntezie i dojrzewaniu kolagenu macierzy kostnej
upośledzenie mineralizacji kości
kwasica metaboliczna
unieruchomienie
niedobory pokarmowe
rodzaj leczenia ( farmakoterapia, dializoterapia, transplantacja)
72
wtórna nadczynność
przytarczyc
(III-rzędowa)
Document Outline
- AST
- Ux x V
- Uin x V
- UPAH x V
- KRWIOLECZNICTWO – ASPEKT LABORATORYJNY I KLINICZNY
- ZAKRES BADAŃ
- Wybór krwi do transfuzji:
- ZASADY POSTĘPOWANIA POPRZEDZAJĄĆE WYKONANIE PRÓBY KRZYŻOWEJ
- ZAKRES BADAŃ WYKONYWANYCH DLA PRÓBY KRZYŻOWEJ
- PRÓBA KRZYŻOWA JEST ZGODNA, GDY
- ZASADY POSTĘPOWANIA PRZED TRANSFUZJĄ
- Wpływ hipoalbuminemii na czynność organizmu:
- WSKAZANIA DO PODAWANIA ALBUMIN
- WYBRANE PROBLEMY KLINICZNE OBCIĄŻONE ZAKRZEPICĄ
- PREPARATY ANTYTROMBINY
- Schemat postępowania w przypadku odczynu poprzetoczeniowego hemolitycznego:
- Etapy postępowania w przypadku reakcji poprzetoczeniowej:
- Powikłania poprzetoczeniowe
- DIAGNOSTYKA LABORATORYJNA CHORÓB WĄTROBY
- Podział kliniczny enzymów:
- Tzw. poszerzone próby wątrobowe = biochemiczna wstęga wątroby:
- Badania oceniające integralność komórki wątrobowej:
- Dehydrogenaza glutaminianowa
- Badania oceniające drożność dróg żółciowych;
- Diagnostyka laboratoryjna żółtaczek:
- Podział żółtaczek:
- Żółtaczka hemolityczna
- Żółtaczki miąższowe
- Żółtaczki mechaniczne
- ENZYMY CHOLESTATYCZNE
- ZESPOŁY UWARUNKOWANE GENETYCZNIE
- Badanie oceniające zdolności syntetyzujące:
- Różnicowanie laboratoryjne:
- Pierwotna marskość żółciowa, PBC (Primary Biliary Cirrhosis)
- Pierwotne stwardniejące zapalenie dróg żółciowych, PSC (Primary Sclerosing Cholangitis)
- DIAGNOSTYKA CHORÓB NOWOTWOROWYCH
- Badania laboratoryjne w rozpoznawaniu, ocenie zaawansowania i monitorowania terapii choroby nowotworowej
- Ocena laboratoryjna i różnicowanie niedokrwistości
- Układ białokrwinkowy
- Trombocytopenia w chorobach nowotworowych < 130 x 106 /l
- Hipertrombocytoza > 600 x 106 /l
- Wskaźnik osteolizy
- Humoralne markery odróżnicowania:
- Humoralne markery proliferacji:
- PSA
- AFP – α-fetoproteina
- Raki wątroby
- Nowotwory gonad
- CEA (Carcinoembryonic Antigen)
- Monitorowanie raków jelita grubego:
- DIAGNOSTYKA LABORATORYJNA OSTRYCH POWIKŁAŃ CUKRZYCY I STANÓW NIEPRZYTOMNOŚCI INNEGO POCHODZENIA
- Zaburzenia świadomości i przytomności:
- Wartości poszczególnych parametrów w surowicy / osoczu:
- Różnicowanie zaburzeń gospodarki wodnej:
- Gazometria krwi tętniczej:
- HIPONATREMIA (!)
- HIPERNATREMIA
- Gazometria krwi tętniczej u pacjentów z dusznością bez zmian w rtg klatki piersiowej:
- Porównanie patogenezy cech klinicznych cukrzycy typu I i II
- Mechanizm kwasicy ketonowej w cukrzycy:
- Diagnostyka laboratoryjna powikłań cukrzycy w śpiączce
- KWASICA KETONOWA
- ŚPIĄCZKA HIPERMOLARNA
- KWASICA MLECZANOWA
- HIPOGLIKEMIA
- PRZYCZYNY ZABURZEŃ ŚWIADOMOŚCI I PRZYTOMNOŚCI
- LABORATORYJNA OCENA ZAGROŻENIA MIAŻDŻYCĄ I ROZPOZNAWANIE POWIKŁAŃ MIAŻDŻYCY
- DIAGNOSTYKA LABORATORYJNA CHORÓB NEREK
Wyszukiwarka
Podobne podstrony:
więcej podobnych podstron