
S. A. Stępniak – Typy reakcji chemicznych
1
4. Identyfikacja anionów
Identyfikację anionów w roztworach wodnych
1
- podobnie, jak kationów - przeprowadza się
metodą analizy systematycznej, wykonując odpowiednie reakcje chemiczne.
Analiza ta polega na:
- określeniu numeru grupy, do której należy anion, znajdujący się w badanym roztworze
- przeprowadzeniu reakcji charakterystycznych.
4.1. Podział anionów na grupy analityczne
Jakie jest kryterium podziału anionów na grupy analityczne?
Za R. W. Bunsenem aniony można podzielić na 7 grup analitycznych. Kryterium tego
podziału, to efekt reakcji z dwoma odczynnikami:
azotanem(V) srebra (AgNO
3
) i azotanem(V) baru (Ba(NO
3
)
2
.
Tabela 28. Podział anionów na grupy analityczne wg R. W. Bunsena
Nr grupy
Aniony
Odczynnik
AgNO
3
Ba(NO
3
)
2
I
Cl
–
, I
–
AgCl, AgI
biały osad
*
żółty osad
*
-
II
S
2–
, NO
2
–
Ag
2
S, AgNO
3
czarny osad biały osad
-
III
CO
3
2–
, C
2
O
4
2–
, SO
3
2–
Ag
2
CO
3
, Ag
2
C
2
O
4
, Ag
2
SO
3
biały osad biały osad biały osad
BaCO
3
, BaC
2
O
4
, BaSO
3
biały osad biały osad biały osad
IV
S
2
O
3
2–
, PO
4
3–
Ag
2
S
2
O
3
, Ag
3
PO
4
żółty osad
**
żółty osad
BaS
2
O
3
, Ba
3
(PO
4
)
2
biały osad biały osad
V
NO
3
–
-
-
VI
SO
4
2–
-
BaSO
4
biały osad
VII
SiO
3
2–
Ag
2
SiO
3
żółty osad
BaSiO
3
biały osad
*
- Osad nierozpuszczalny w kwasie azotowym,
**
- Osad szybko ciemnieje (przekształca się w czarny Ag
2
S)
1
Uzupełnieniem treści tego rozdziału jest kolorowa wkładka do skoroszytu pt.: "Schemat systematycznej analizy
anionów" wg R. W. Bunsena, wydana prze AUE.

S. A. Stępniak – Typy reakcji chemicznych
2
4.2. Reakcje charakterystyczne anionów
Po określeniu numeru grupy, do której należy anion znajdujący się w badanym roztworze
należy przeprowadzić kolejne reakcje chemiczne, tzw. reakcje charakterystyczne, które pozwolą
jednoznaczne zidentyfikować anion. Reakcje charakterystyczne jonów - to reakcje, których
obserwowane efekty (charakterystyczny osad produktu, odbarwianie lub zabarwianie mieszaniny
reakcyjnej, wydzielający się gaz, itp.) są cechą tylko jednego rodzaju jonów. W czasie analizy należy
przeprowadzić po kilka reakcji charakterystycznych (co najmniej dwie) dla identyfikowanego jonu.
4.2.1. Reakcje anionów I grupy analitycznej
Po przeprowadzeniu reakcji pozwalających określić numer grupy analitycznej, do której
należą identyfikowane aniony (patrz tabela 28):
Ag
+
+ Cl
–
= AgCl
Biały osad
Ag
+
+ I
–
= AgI
Żółty osad
wykonuje się reakcje, które pozwolą odpowiedzieć na pytanie, który z dwóch jonów tej grupy jest w
badanym roztworze. W przypadku anionów I grupy już reakcje z AgNO
3
są reakcjami
charakterystycznymi, gdyż w efekcie tych reakcji otrzymuje się produkt o kreślonych właściwościach.
AgCl jest osadem białym, a AgI – osadem żółtym. Niektóre aniony innych grup analitycznych reagują
podobnie, dając białe lub żółte osady, ale jedynie AgCl i AgI są związkami nierozpuszczalnymi w
kwasie azotowym. Tak, więc reakcja z AgNO
3
pozwala jednoznacznie określić, który z anionów I
grupy analitycznej znajduje się w badanym roztworze. Dla potwierdzenia obecności tych anionów w
roztworze można wykorzystać jeszcze inne reakcje:
- Reakcje z roztworem Pb(NO
3
)
2
Pb
2+
+ 2 Cl
–
= PbCl
2
Biały osad, rozpuszczalny po podgrzaniu
Pb
2+
+ 2 I
–
= PbI
2
Żółty osad
- Reakcja z roztworem KMnO
4
w środowisku kwaśnym (10% H
2
SO
4
)
2 MnO
4
–
+ 10 Cl
–
+ 16 H
+
= 2 Mn
2+
+ 5 Cl
2
+ 8 H
2
O
Wydzielający się w tej reakcji gazowy chlor identyfikuje się, trzymając nad próbówką papierek
jodowo-skrobiowy. Zachodzi reakcja:
Cl
2
+ 2 I
–
= 2 Cl
–
+ I
2
Wolny jod zabarwia skrobię na fioletowo.

S. A. Stępniak – Typy reakcji chemicznych
3
Reakcja z roztworem KMnO
4
nie może być wykorzystana do identyfikacji anionów I
–
, gdyż
powstający w środowisku wodnym I
2
nie jest substancją lotną.
- Reakcja z wodą chlorową (Cl
2
, H
2
O)
Do identyfikacji anionów I
–
wykorzystuje się reakcję z wodą chlorową. Składnik wody chlorowej –
Cl
2
, utlenia aniony jodkowe do I
2
:
Cl
2
+ 2 I
–
= 2 Cl
–
+ I
2
Powstający I
2
zabarwia wodę na kolor rubinowy.
- Reakcja z roztworem NaNO
2
Aniony I
–
w środowisku kwaśnym redukują aniony NO
2
–
:
2 NO
2
–
+ 2 I
–
+ 4 H
+
= 2 NO + I
2
+ 2 H
2
O
Powstający w wyniku reakcji I
2
zabarwia wodę na kolor rubinowy lub wytrąca się czarny osad.
Jony Cl
–
, które są słabszym reduktorem nie redukują jonów NO
2
–
.
4.2.2. Reakcje anionów II grupy analitycznej
Do drugiej grupy analitycznej anionów należą aniony: S
2–
i NO
2
–
. Jako jedyne spośród
wszystkich anionów dają rozpuszczalne w kwasie azotowym osady z AgNO
3
i nie dają osadów z
Ba(NO
3
)
2
(patrz tabela 28).
2 Ag
+
+ S
2–
= Ag
2
S
Czarny osad
Osad Ag
2
S rozpuszcza się w kwasie azotowym, po podgrzaniu. Roztwór przyjmuje barwę kremową od
wydzielającej się koloidowej siarki.
3 Ag
2
S + 2 NO
3
–
+ 8 H
+
= 3 S + 6 Ag
+
+ 2 NO + 4 H
2
O.
Reakcję jonów NO
2
–
z AgNO
3
przedstawia równanie:
Ag
+
+ NO
2
–
= AgNO
2
Biały osad
Powstający w wyniku reakcji osad, łatwo rozpuszcza się w gorącej wodzie.
Zważywszy, że z AgNO
3
jony S
2–
wytrącają czarny osad Ag
2
S, a jony NO
2
–
biały osad AgNO
2
reakcje
te uznać można za reakcje identyfikujące te aniony. W celu potwierdzenia obecności tych anionów w
badanym roztworze można wykonać dodatkowo jeszcze następujące reakcje:

S. A. Stępniak – Typy reakcji chemicznych
4
- Reakcja z roztworem Pb(NO
3
)
2
Pb
2+
+ S
2–
= PbS
Czarny osad
Jony NO
2
–
nie reagują z tym odczynnikiem.
- Reakcja z roztworem KI
Aniony NO
2
–
reagują z KI w środowisku kwaśnym, utleniając jony jodkowe do I
2
.
2 I
–
+ 2 NO
2
–
+ 4 H
+
= I
2
+ 2 NO + 2 H
2
O
Wydzielający się I
2
zabarwia roztwór na kolor rubinowy lub wytrąca się czarny osad. Jony S
2–
nie
reagują z tym odczynnikiem.
- Reakcja z FeSO
4
(„próba obrączkowa”)
Reakcję zwaną „próbą obrączkową” nazywa się redukcję jonów NO
2
–
jonami Fe
2+
w środowisku
kwaśnym:
Fe
2+
+ NO
2
–
+ 2 H
+
= Fe
3+
+ NO + H
2
O.
Powstający w wyniku reakcji NO tworzy brązowe kompleksy z jonami Fe
3+
:
Fe
3+
+ 6 NO = [Fe(NO)
6
]
3+
Brązowe zabarwienie
Reakcje tę wykonuje się w sposób szczególny. Do próbówki z badanym roztworem dodaje się mały
kryształek FeSO
4
, a następnie ostrożnie i powoli wlewa się po ściance próbówki stężony H
2
SO
4
.
Próbówkę należy trzymać lekko pochyloną i kwas wlewać tak, aby choć przez chwilę roztwór
stężonego kwasu H
2
SO
4
i roztwór badany nie wymieszały się. Wtedy na granicy faz pojawi się
brązowa obrączka (stąd nazwa tej reakcji) [Fe(NO)
6
]
3+
. Schematycznie pokazano to na rysunku 4.
Rysunek 4. Schemat przeprowadzenia tzw. „próby obrączkowej”
[Fe(NO)
6
]
3+
FeSO
4
,
kryszt.
H
2
SO
4, st.
H
2
SO
4, st.
Badany roztwor

S. A. Stępniak – Typy reakcji chemicznych
5
Podobna próba z roztworem zawierającym jony S
2–
, które nie mają właściwości utleniających, daje
wynik negatywny.
- Reakcje z pyłem Zn lub pyłem Al
Przy wykonywaniu tych reakcji należy pamiętać, ze podobnie jak w przypadku „próby
obrączkowej” analogiczne reakcje zachodzą również z anionami NO
3
–
.
Nie stanowi to jednak żadnej
przeszkody w poprawnym przeprowadzeniu analizy, gdyż aniony NO
2
–
i NO
3
–
należą do różnych grup
analitycznych.
Reakcje z pyłem Zn lub pyłem Al są reakcjami utleniania – redukcji, przebiegającymi w
środowisku silnie zasadowym. W reakcjach tych, w wyniku utleniania jonami NO
2
–
cynk przechodzi
na II stopień utlenienia, a glin na III. Ponieważ jednak cynk i glin na tych stopniach utlenienia mają
właściwości amfoteryczne, to w mieszaninie reakcyjnej występują w formie anionowej. Reakcje te
opisują równania:
3 Zn + NO
2
–
+ 5 OH
–
+ 5 H
2
O = 3 [Zn(OH)
4
]
2–
+ NH
3
2 Al + NO
2
–
+ OH
–
+ 5 H
2
O = 2 [Al(OH)
4
]
–
+ 3 NH
3
Charakterystyczny zapach wydzielającego się amoniaku wskazuje na obecność w badanym roztworze
jonów NO
2
–
. Jony S
2–
, które nie mają właściwości utleniających, nie reagują ani z pyłem Zn, ani
z pyłem Al .
4.2.3. Reakcje anionów III grupy analitycznej
Do trzeciej grupy analitycznej anionów należą: CO
3
2–
, C
2
O
4
2–
, SO
3
2–
. Reakcje z roztworem
AgNO
3
przedstawiają równania:
2 Ag
+
+ CO
3
2–
= Ag
2
CO
3
Biały osad
2 Ag
+
+ C
2
O
4
2–
= Ag
2
C
2
O
4
Biały osad
2 Ag
+
+ SO
3
2–
= Ag
2
SO
3
Biały osad
Reakcje z roztworem Ba(NO
3
)
2
:
Ba
2+
+ CO
3
2–
= BaCO
3
Biały osad
Ba
2+
+ C
2
O
4
2–
= BaC
2
O
4
Biały osad
Ba
2+
+ SO
3
2–
= BaSO
3
Biały osad

S. A. Stępniak – Typy reakcji chemicznych
6
Aniony III grupy analitycznej wytrącają białe osady zarówno z AgNO
3
, jak też z Ba(NO
3
)
2
. Osady te
są rozpuszczalne w kwasie azotowym(V). W celu identyfikacji tych anionów w badanym roztworze
należy przeprowadzić następujące reakcje charakterystyczne:
- Reakcje z kwasem solnym
Jeśli w badanym roztworze znajdują się jony: CO
3
2–
lub SO
3
2–
, to po dodaniu roztworu kwasu
solnego zachodzą reakcje:
2 H
+
+ CO
3
2–
= H
2
O + CO
2
2 H
+
+ SO
3
2–
= H
2
O + SO
2
.
Wydzielające się w wyniku tych reakcji gazowe produkty można zidentyfikować: w przypadku CO
2
poprzez zaobserwowanie intensywnego „bąbelkowania”, a w przypadku SO
2
po charakterystycznym
zapachu. W przypadku obecności w badanym roztworze jonów C
2
O
4
2–
żadnego z tych efektów nie
obserwuje się. Jony C
2
O
4
2–
nie reagują z HCl.
- Reakcja z roztworem KMnO
4
w środowisku kwaśnym (10% H
2
SO
4
)
Jeśli w badanym roztworze znajdują się jony: C
2
O
4
2–
lub SO
3
2–
, to po dodaniu 10% roztworu
kwasu siarkowego(VI) i niewielkiej ilości roztworu KMnO
4
zachodzą reakcje:
2 MnO
4
–
+ 5 C
2
O
4
2–
+ 16 H
+
= 2 Mn
2+
+ 10 CO
2
+ 8 H
2
O
2 MnO
4
–
+ 5 SO
3
2–
+ 6 H
+
= 2 Mn
2+
+ 5 SO
4
2–
+ 3 H
2
O
Efektem tych reakcji jest zanik charakterystycznej dla jonów MnO
4
–
barwy rubinowej.
Przeprowadzając te reakcje należy ustrzec się przed dodaniem nadmiaru roztworu KMnO
4
w
odniesieniu do ilości jonów C
2
O
4
2–
lub SO
3
2–
. Bowiem w przypadku nadmiaru MnO
4
–
, z
oczywistych
powodów nie zaobserwuje się odbarwienia roztworu. Jony CO
3
2–
nie odbarwiają roztworu KMnO
4
.
- Reakcja z I
2
w roztworze KI
Silne właściwości redukujące jonów SO
3
2–
są wykorzystane w reakcji charakterystycznej z I
2
. Aby
zwiększyć rozpuszczalność I
2
w wodzie stosuje się roztwór I
2
i KI. Reakcja przebiega zgodnie
z równaniem:
I
2
+ SO
3
2–
+ 2 OH
–
= 2 I
–
+ SO
4
2–
+ H
2
O
Z równania wynika, że reakcji sprzyja środowisko zasadowe. Ponieważ rozpuszczalnymi
siarczanami(IV) w wodzie są jedynie sole potasowców, a więc sole słabego kwasu (H
2
SO
3
) i mocnych
zasad, to o środowisko mieszaniny reakcyjnej można się nie troszczyć. Wodne roztwory
siarczanów(IV) potasowców mają odczyn zasadowy. Wystarczy do badanego roztworu dodać I
2
w KI.
W przypadku obecności w badanym roztworze SO
3
2–
następuje odbarwienie roztworu I
2
. Jony CO
3
2–
i C
2
O
4
2–
nie odbarwiają roztworu I
2
w KI.

S. A. Stępniak – Typy reakcji chemicznych
7
- Reakcje zachodzące w czasie wykorzystania w toku analizy papierka jodanowo-skrobiowego
Papierek jodanowo-skrobiowy jest to bibuła nasycona jodanem(V) potasu (KIO
3
) i skrobią.
Jeżeli nad próbówka z roztworem SO
3
2–
, do której doda się niewielką ilość kwasu (np. HCl), umieści
się zwilżony papierek jodanowo-skrobiowy, to zachodzą reakcje:
- w roztworze: SO
3
2–
+ 2 H
+
= SO
2
+ H
2
O
- na zwilżonym papierku jodanowo-skrobiowy:
2 IO
3
–
+ 5 SO
2
+ 8 OH
–
= I
2
+ 5 SO
4
2–
+ 4 H
2
O.
Papierek jodanowo-skrobiowy zabarwia się, gdyż tworzy się niebiesko zabarwiony kompleks I
2
ze
skrobią. Po pewnym czasie papierek ulega odbarwieniu w wyniku redukcji jodu do jonów jodkowych:
I
2
+ SO
2
+ 4 OH
–
= 2 I
–
+ SO
4
2–
+ 2 H
2
O.
W przypadku obecności w badanym roztworze jonów CO
3
2–
lub C
2
O
4
2–
próba z papierkiem jodanowo-
skrobiowym daje wynik negatywny.
4.2.4. Reakcje anionów IV grupy analitycznej
Do czwartej grupy analitycznej anionów należą: S
2
O
3
2–
i PO
4
3–
. Reakcje z roztworem AgNO
3
przedstawiają równania:
2 Ag
+
+ S
2
O
3
2–
= Ag
2
S
2
O
3
Żółty osad
3 Ag
+
+ PO
4
3–
= Ag
3
PO
4
Żółty osad
W przypadku Ag
2
S
2
O
3
związek ten po krótkiej chwili zmienia swoje zabarwienie. Żółty początkowo
osad czerwienieje i w końcu robi się czarny. Dzieje się to na skutek zachodzącej reakcji
dysproporcjonowania jonów S
2
O
3
2–
:
S
2
O
3
2–
+ 2 OH
–
= SO
4
2–
+ S
2–
+ H
2
O.
Powstające w wyniku tej reakcji jony S
2–
reagują z jonami Ag
+
dając czarny osad siarczku srebra:
2 Ag
+
+ S
2–
= Ag
2
S
Czarny osad
W reakcjach tych przejawiają się unikalne właściwości jonów S
2
O
3
2–
. W taki sposób nie reaguje
żaden z pozostałych anionów.
Reakcje z roztworem Ba(NO
3
)
2
:
Ba
2+
+ S
2
O
3
2–
= BaS
2
O
3
Biały osad
W roztworach wodnych fosforanów(V), w wyniku hydrolizy:

S. A. Stępniak – Typy reakcji chemicznych
8
PO
4
3–
+ H
2
O = HPO
4
2–
+ OH
–
pojawiają się jony
HPO
4
2–
i to one reagują z Ba
2+
, tworząc trudno rozpuszczalny osad
wodorofosforanu(V) baru:
Ba
2+
+ HPO
4
2–
= BaHPO
4
Biały osad
Jeżeli reakcja z Ba(NO
3
)
2
przeprowadzana jest w środowisku wodnego roztworu amoniaku, reakcja
hydrolizy jonami PO
4
3–
jest cofnięta. W roztworze występują głównie jony PO
4
3–
i wytrąca się
fosforan(V) baru:
3 Ba
2+
+ 2 PO
4
3–
= Ba
3
(PO
4
)
2
Biały osad
Produkty reakcji anionów IV grupy analitycznej zarówno z AgNO
3
, jak też z Ba(NO
3
)
2
są
rozpuszczalne w kwasie azotowym(V). W celu identyfikacji tych anionów w badanym roztworze
należy przeprowadzić następujące reakcje charakterystyczne:
- Reakcja z roztworem KMnO
4
w środowisku kwaśnym (10% H
2
SO
4
)
Jony manganianowe(VII) w środowisku kwaśnym utleniają S
2
O
3
2–
do SO
4
2–
:
8 MnO
4
–
+ 5 S
2
O
3
2–
+ 14 H
+
= 8 Mn
2+
+ 10 SO
4
2–
+ 7 H
2
O.
W wyniku tej reakcji następuje odbarwienie roztworu MnO
4
–
. Przeprowadzając tę reakcję należy
pamiętać, aby nie dodać zbyt dużo roztworu KMnO
4
. W przypadku bowiem nadmiaru KMnO
4
nie
zaobserwuje się odbarwienia roztworu. Jony PO
4
3–
nie odbarwiają roztworu KMnO
4
.
- Reakcja z I
2
w roztworze KI
Silne właściwości redukujące jonów S
2
O
3
2–
są wykorzystane w reakcji charakterystycznej z I
2
w KI:
I
2
+ 2 S
2
O
3
2–
= 2 I
–
+ S
4
O
6
2–
W reakcji tej dwa aniony S
2
O
3
2–
oddają dwa elektrony przechodząc w anion S
4
O
6
2–
(anion
tetrationianowy). Następuje odbarwienie roztworu I
2
w KI. Jony PO
4
3–
nie odbarwiają roztworu I
2
w KI.
- Reakcja z roztworem: MgCl
2
, NH
3
i NH
4
Cl („mieszanina magnezowa”)
Wodny roztwór chlorku magnezu, amoniaku i chlorku amonu (tzw. „mieszanina
magnezowa”) reaguje z jonami fosforanowymi(V) wytrącając biały, krystaliczny osad fosforanu
magnezowoamonowego – MgNH
4
PO
4
.
Mg
2+
+ NH
4
+
+ PO
4
3–
= MgNH
4
PO
4
Biały osad

S. A. Stępniak – Typy reakcji chemicznych
9
Osad MgNH
4
PO
4
rozpuszczalny jest w kwasach. Jony S
2
O
3
2–
nie reagują z „mieszaniną
magnezową”.
4.2.5. Reakcje anionu V grupy analitycznej
W V grupie analitycznej anionów znajduje się anion kwasu azotowego(V) – NO
3
–
. Wszystkie
sole kwasu azotowego(V) są dobrze rozpuszczalne w wodzie. Utrudnia to identyfikację tych anionów,
gdyż zawęża się liczba reakcji charakterystycznych, które można by wykorzystać do identyfikacji.
Najciekawsze to:
- Reakcja z FeSO
4
(„próba obrączkowa”)
Należy pamiętać, że „próbę obrączkową” wykorzystuje się również do identyfikacji anionów NO
2
–
.
Ponieważ jednak jony NO
2
–
należą do innej grupy analitycznej, to nie przeszkadza to w wykorzystaniu
„próby obrączkowej”, jako reakcji charakterystycznej również dla jonów NO
3
–
:
3 Fe
2+
+ NO
3
–
+ 4 H
+
= 3 Fe
3+
+ NO + 2 H
2
O.
Powstający w wyniku reakcji NO tworzy brązowe kompleksy z jonami Fe
3+
:
Fe
3+
+ 6 NO = [Fe(NO)
6
]
3+
Brązowe zabarwienie
- Reakcje z pyłem Zn lub pyłem Al
Należy pamiętać, że reakcje z pyłem Zn lub pyłem Al zachodzą również z anionami NO
2
–
.
Nie stanowi to jednak żadnej przeszkody w poprawnym przeprowadzeniu analizy, gdyż aniony NO
2
–
i
NO
3
–
należą do różnych grup analitycznych.
Reakcje z pyłem Zn lub pyłem Al są reakcjami utleniania – redukcji, przebiegającymi w
środowisku silnie zasadowym. W reakcjach tych, w wyniku utleniania jonami NO
3
–
cynk przechodzi
na II stopień utlenienia, a glin na III. Ponieważ jednak cynk i glin na tych stopniach utlenienia mają
właściwości amfoteryczne, to w mieszaninie reakcyjnej występują w formie anionowej. Reakcje te
opisują równania:
4 Zn + NO
3
–
+ 7 OH
–
+ 6 H
2
O = 4 [Zn(OH)
4
]
2–
+ NH
3
8 Al + 3 NO
3
–
+ 5 OH
–
+ 18 H
2
O = 8 [Al(OH)
4
]
–
+ 3 NH
3
Charakterystyczny zapach wydzielającego się amoniaku wskazuje na obecność w badanym
roztworze jonów NO
3
–
.

S. A. Stępniak – Typy reakcji chemicznych
10
4.2.6. Reakcje anionu VI grupy analitycznej
Należące do VI grupy analitycznej aniony SO
4
2–
nie reagują z AgNO
3
, ale wytrącają biały
osad z Ba(NO
3
)
2
:
Ba
2+
+ SO
4
2–
= BaSO
4
Biały osad
Osad BaSO
4
nie rozpuszcza się ani w roztworach kwasów, ani w roztworach zasad. Dla
potwierdzenia obecności w roztworze jonów SO
4
2–
wystarczy przeprowadzić reakcję z azotanem(V)
ołowiu(II) lub reakcję z cynkiem w środowisku kwaśnym.
- Reakcja z Pb(NO
3
)
2
Kationy ołowiu wytrącają z anionami SO
4
2–
biały krystaliczny osad siarczanu(VI) ołowiu(II):
Pb
2+
+ SO
4
2–
= PbSO
4
Biały osad
- Reakcja z Zn w środowisku kwaśnym
Zn redukuje w środowisku kwaśnym jony SO
4
2–
:
4 Zn + SO
4
2–
+ 10 H
+
= 4 Zn
2+
+ H
2
S + 4 H
2
O
Wydzielający się w wyniku tej reakcji gazowy H
2
S można rozpoznać po charakterystycznym zapachu.
H
2
S można również zidentyfikować na podstawie reakcji zachodzącej z octanem ołowiu(II).
Wydzielający się H
2
S czerni bibułę nasyconą roztworem (CH
3
COO)
2
Pb. Zachodzi reakcja:
Pb
2+
+ H
2
S = PbS + 2 H
+
Czarny osad
4.2.7. Reakcje anionu VII grupy analitycznej
Należący do VII grupy analitycznej anion krzemianowy (SiO
3
2–
) reaguje a azotanem srebra,
dając jasnożółty osad krzemianu srebra:
2 Ag
+
+ SiO
3
2–
= Ag
2
SiO
3
Żółty osad
Z azotanem baru natomiast wytrąca biały osad krzemianu baru:
Ba
2+
+ SiO
3
2–
= BaSiO
3
Biały osad
Podobnie reaguje z AgNO
3
i Ba(NO
3
)
2
również anion PO
4
3–
. Może to być powodem popełnienia
poważnego błędu analitycznego, a mianowicie niewłaściwego określenia numeru grupy, do której
należy identyfikowany anion. Anion PO
4
3–
należy bowiem do IV grupy analitycznej, a anion SiO
3
2–
do VII. Aby potwierdzić obecność w badanym roztworze anionów SiO
3
2–
należy przeprowadzić
reakcję z kwasem solnym lub reakcję z roztworem chlorku amonu.

S. A. Stępniak – Typy reakcji chemicznych
11
- Reakcja z HCl
W reakcji z HCl wykorzystuje się fakt, że SiO
3
2–
jest anionem jedynego nieorganicznego
kwasu, który nie rozpuszcza się w wodzie. Wystarczy więc zakwasić badany roztwór (niekoniecznie
kwasem solnym, ale również: HNO
3
lub H
2
SO
4
). Jeżeli w roztworze znajdują się aniony SiO
3
2–
, to
zachodzi reakcja:
2 H
+
+ SiO
3
2–
= H
2
SiO
3
Galaretowaty, bezbarwny osad
Jony PO
4
3–
nie wytracają osadu w wyniku zakwaszenia.
- Reakcja z roztworem NH
4
Cl
Reakcja SiO
3
2–
,
przebiegająca w roztworze soli amonowych (niekonieczne wyłącznie z
NH
4
Cl), powodująca wytrącenie galaretowatego osadu H
2
SiO
3
,
jest reakcją, w której kationy amonowe
ułatwiają hydrolizę:
SiO
3
2–
+ 2 H
2
O = H
2
SiO
3
+ 2 OH
–
Galaretowaty, bezbarwny osad
Kationy amonowe, wiążąc jony OH
–
w trudno dysocjujący NH
4
OH:
NH
4
+
+ OH
–
= NH
4
OH,
przesuwają równowagę reakcji hydrolizy. Wytrąca się biały osad H
2
SiO
3
.
W celu praktycznego zapoznania się z przebiegiem opisanych reakcji, przed przystąpieniem
do analizy badanego roztworu, należy samodzielnie przeprowadzić reakcje próbne, tzw. „ślepe
próby”, czyli wykonać opisane reakcje z wszystkimi anionami. Poczynione, w trakcie wykonywania
tych reakcji, obserwacje (barwa osadu; rozpuszczalność osadu; typ osadu: bezpostaciowy,
krystaliczny, koloidowy; zapach wydzielających się gazów; efekt zabarwiania lub odbarwiania
mieszaniny reakcyjnej) należy dokładnie zapisać na formularzach zamieszczonych w dalszej części
tego rozdziału. Ułatwi to zarówno zrozumienie zagadnień teoretycznych analizy jakościowej
anionów, jak też właściwe przeprowadzenie identyfikacji jonów w badanym roztworze.
Przystępując do wykonania reakcji próbnych, należy pamiętać, że do czystych próbówek
(przepłukanych wodą destylowaną) dodaje się niewielkie ilości roztworów anionów (około 0,5 cm
3
)
i niewielkie ilości (2 – 3 krople) odczynnika identyfikującego te aniony.
S. A. Stępniak – Typy reakcji chemicznych
12
- Reakcje próbne z roztworem anionów chlorkowych, Cl
Roztwór zawierający jony Cl
+ AgNO
3
:
Obserwacja : ......................................................
Równanie reakcji: .................................................................................................................................
Osad + HNO
3
:
Obserwacja : ......................................................
Równanie reakcji: .................................................................................................................................
Roztwór zawierający jony Cl
+ BaCl
2
:
Obserwacja : ......................................................
Równanie reakcji: .................................................................................................................................
Reakcje charakterystyczne:
Odczynnik:
Obserwacja:
Równanie reakcji:
Pb(NO
3
)
2
Hg
2
(NO
3
)
2
- Reakcje próbne z roztworem anionów jodkowych, I
Roztwór zawierający jony I
+ AgNO
3
:
Obserwacja : ......................................................
Równanie reakcji: .................................................................................................................................
Osad + HNO
3
:
Obserwacja : ......................................................
Równanie reakcji: .................................................................................................................................
Roztwór zawierający jony I
+ BaCl
2
:
Obserwacja : ......................................................
Równanie reakcji: .................................................................................................................................
Reakcje charakterystyczne:
Odczynnik:
Obserwacja:
Równanie reakcji:
Pb(NO
3
)
2
NaNO
2
+ H
2
SO
4
- Reakcje próbne z roztworem anionów siarczkowych, S
2-
Roztwór zawierający jony S
2-
+ AgNO
3
:
Obserwacja : ......................................................
Równanie reakcji: .................................................................................................................................
Osad + HNO
3
:
Obserwacja : ......................................................
Równanie reakcji: .................................................................................................................................
Roztwór zawierający jony S
2-
+ BaCl
2
:
Obserwacja : ......................................................
Równanie reakcji: .................................................................................................................................
Reakcje charakterystyczne:
Odczynnik:
Obserwacja:
Równanie reakcji:
Pb(NO
3
)
2
KMnO
4
+ H
2
SO
4
S. A. Stępniak – Typy reakcji chemicznych
13
- Reakcje próbne z roztworem anionów azotanowych(III), NO
2
Roztwór zawierający jony NO
2
+ AgNO
3
:
Obserwacja : ......................................................
Równanie reakcji: .................................................................................................................................
Osad + HNO
3
:
Obserwacja : ......................................................
Równanie reakcji: .................................................................................................................................
Roztwór zawierający jony NO
2
+ BaCl
2
:
Obserwacja : ......................................................
Równanie reakcji: .................................................................................................................................
Reakcje charakterystyczne:
Odczynnik:
Obserwacja:
Równanie reakcji:
KMnO
4
+ H
2
SO
4
KI + H
2
SO
4
- Reakcje próbne z roztworem anionów węglanowy, CO
3
2-
Roztwór zawierający jony CO
3
2-
+ AgNO
3
:
Obserwacja : ......................................................
Równanie reakcji: .................................................................................................................................
Osad + HNO
3
:
Obserwacja : ......................................................
Równanie reakcji: .................................................................................................................................
Roztwór zawierający jony CO
3
2-
+ BaCl
2
:
Obserwacja : ......................................................
Równanie reakcji: .................................................................................................................................
Osad + HNO
3
:
Obserwacja : ......................................................
Równanie reakcji: .................................................................................................................................
Reakcje charakterystyczne:
Odczynnik:
Obserwacja:
Równanie reakcji:
H
2
SO
4
- Reakcje próbne z roztworem anionów szczawianowych, C
2
O
4
2-
Roztwór zawierający jony C
2
O
4
2-
+ AgNO
3
:
Obserwacja : ......................................................
Równanie reakcji: .................................................................................................................................
Osad + HNO
3
:
Obserwacja : ......................................................
Równanie reakcji: .................................................................................................................................
Roztwór zawierający jony C
2
O
4
2-
+ BaCl
2
:
Obserwacja : ......................................................
Równanie reakcji: .................................................................................................................................
Osad + HNO
3
:
Obserwacja : ......................................................
Równanie reakcji: .................................................................................................................................
Reakcje charakterystyczne:
Odczynnik:
Obserwacja:
Równanie reakcji:
KMnO
4
+ H
2
SO
4
(ogrzewanie)
S. A. Stępniak – Typy reakcji chemicznych
14
- Reakcje próbne z roztworem anionów siarczanowych(IV), SO
3
2-
Roztwór zawierający jony SO
3
2-
+ AgNO
3
:
Obserwacja : ......................................................
Równanie reakcji: .................................................................................................................................
Osad + HNO
3
:
Obserwacja : ......................................................
Równanie reakcji: .................................................................................................................................
Roztwór zawierający jony SO
3
2-
+ BaCl
2
:
Obserwacja : ......................................................
Równanie reakcji: .................................................................................................................................
Osad + HNO
3
:
Obserwacja : ......................................................
Równanie reakcji: .................................................................................................................................
Reakcje charakterystyczne:
Odczynnik:
Obserwacja:
Równanie reakcji:
KMnO
4
+ H
2
SO
4
H
2
SO
4
+ I
2
w KI
- Reakcje próbne z roztworem anionów fosforanowych(V), PO
4
3-
Roztwór zawierający jony PO
4
3-
+ AgNO
3
: Obserwacja : ......................................................
Równanie reakcji: .................................................................................................................................
Osad + HNO
3
:
Obserwacja : ......................................................
Równanie reakcji: .................................................................................................................................
Roztwór zawierający jony PO
4
3-
+ BaCl
2
:
Obserwacja : ......................................................
Równanie reakcji: .................................................................................................................................
Osad + HNO
3
:
Obserwacja : ......................................................
Równanie reakcji: .................................................................................................................................
Reakcje charakterystyczne:
Odczynnik:
Obserwacja:
Równanie reakcji:
Mieszanina
magnezowa
- Reakcje próbne z roztworem anionów tiosiarczanowych(II), S
2
O
3
2-
:
Roztwór zawierający jony S
2
O
3
2-
+ AgNO
3
:
Obserwacja : ......................................................
Równanie reakcji: .................................................................................................................................
Osad + HNO
3
:
Obserwacja : ......................................................
Równanie reakcji: .................................................................................................................................
Roztwór zawierający jony SO
3
2-
+ BaCl
2
:
Obserwacja : ......................................................
Równanie reakcji: .................................................................................................................................
Osad + HNO
3
:
Obserwacja : ......................................................
Równanie reakcji: .................................................................................................................................
S. A. Stępniak – Typy reakcji chemicznych
15
Reakcje charakterystyczne:
Odczynnik:
Obserwacja:
Równanie reakcji:
KMnO
4
+ H
2
SO
4
H
2
SO
4
+ I
2
w KI
- Reakcje próbne z roztworem anionów azotanowy(V), NO
3
-
:
Roztwór zawierający jony NO
3
-
+ AgNO
3
:
Roztwór zawierający jony NO
3
-
+ BaCl
2
:
Obserwacja : ..........................................
Obserwacja : ..........................................
Równanie reakcji: .................................................................................................................................
Równanie reakcji: .................................................................................................................................
Reakcje charakterystyczne:
Odczynnik:
Obserwacja:
Równanie reakcji:
FeSO
4
+H
2
SO
4
(stęż)
- Reakcje próbne z roztworem anionów siarczanowych(VI), SO
4
2-
:
Roztwór zawierający jony SO
4
2-
+ AgNO
3
:
Roztwór zawierający jony SO
4
2-
+ BaCl
2
:
Obserwacja : ..........................................
Obserwacja : ..........................................
Osad + HNO
3
:
Obserwacja : ..........................................
Równanie reakcji: .................................................................................................................................
Równanie reakcji: .................................................................................................................................
Reakcje charakterystyczne:
Odczynnik:
Obserwacja:
Równanie reakcji:
Pb(NO
3
)
2

S. A. Stępniak – Typy reakcji chemicznych
16
- Reakcje próbne z roztworem anionów krzemianowy, SiO
3
2-
:
Roztwór zawierający jony SiO
3
2-
+ AgNO
3
: Roztwór zawierający jony SiO
3
2-
+ BaCl
2
:
Obserwacja : ..........................................
Obserwacja : ..........................................
Osad + HNO
3
:
Osad + HNO
3
:
Obserwacja : ..........................................
Obserwacja : ..........................................
Równanie reakcji: .................................................................................................................................
Równanie reakcji: .................................................................................................................................
Reakcje charakterystyczne:
Odczynnik:
Obserwacja:
Równanie reakcji:
HCl
Po przeprowadzeniu reakcji próbnych można przystąpić do analizy badanego roztworu.
Zadanie kontrolne polega na zidentyfikowaniu anionu w otrzymanych do analizy dwóch – trzech
roztworach soli. Tok postępowania, otrzymane rezultaty i równania przeprowadzonych reakcji należy
wpisać do podanych dalej arkuszy analitycznych.
Przystępując do analizy należy pamiętać, że otrzymany w próbówce badany roztwór musi
wystarczyć do przeprowadzenia kilku reakcji chemicznych. Dlatego przed wykonaniem każdej
reakcji należy przelać do innej, czystej (przepłukanej wodą destylowaną) próbówki nie więcej niż
0,5 cm
3
badanego roztworu i dodawać niewielkie ilości odczynnika, 2 – 3 krople.
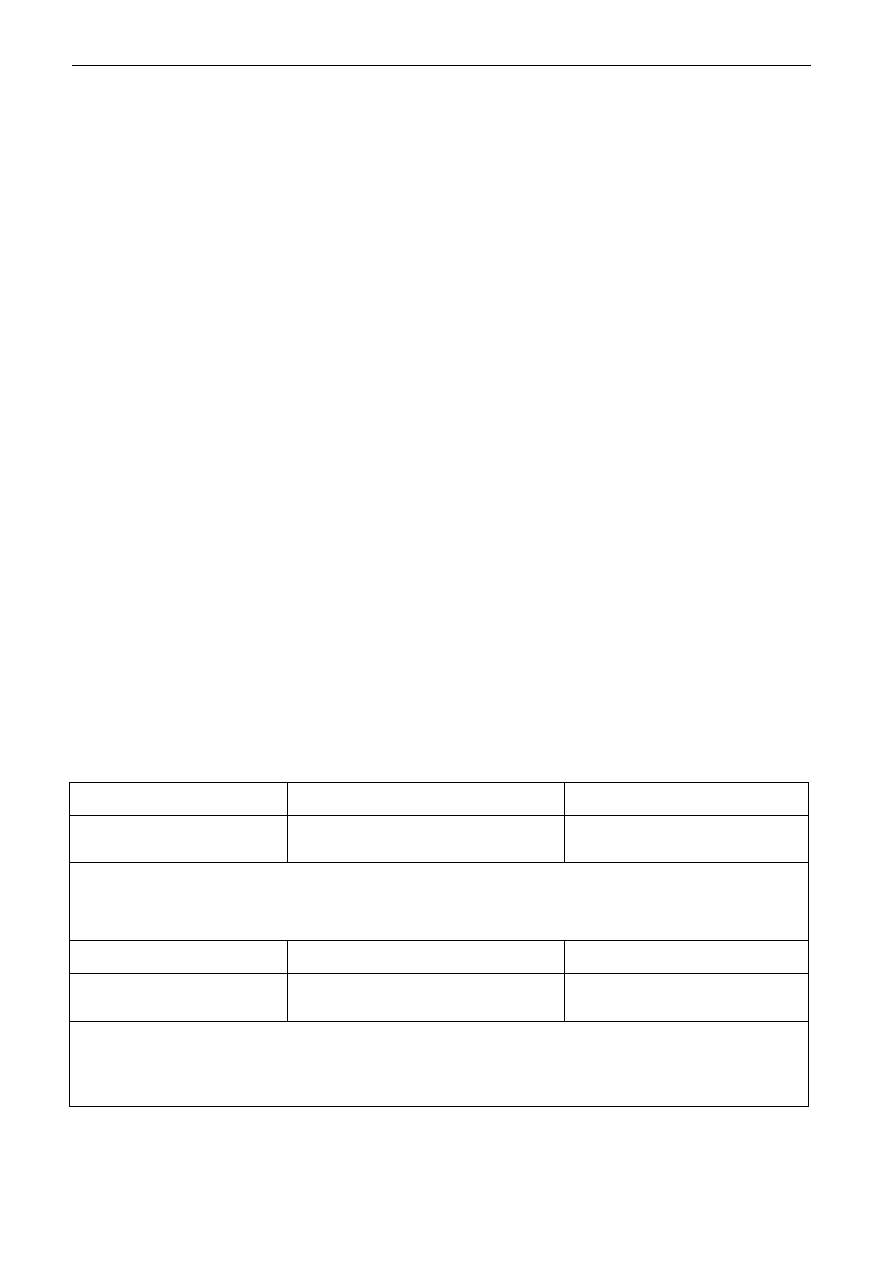
S. A. Stępniak – Typy reakcji chemicznych
17
Sprawozdanie z wykonanego zadania kontrolnego
Identyfikacja anionów znajdujących się w badanym roztworze – próbówka Nr 1
1. Badany roztwór + roztwór AgNO
3
:
Obserwacja : ...................................................................................................................................
Osad + HNO
3
:
Obserwacja : ...................................................................................................................................
2. Badany roztwór + roztwór BaCl
2
:
Obserwacja : ...................................................................................................................................
Osad + HNO
3
:
Obserwacja : ...................................................................................................................................
Wniosek:....................................................................................................................................................
Równania reakcji:....................................................................................................................................
.................................................................................................................................................................
..................................................................................................................................................................
3. Reakcje charakterystyczne:
Dodany odczynnik
Obserwacja
Wniosek
Równanie reakcji:
Dodany odczynnik
Obserwacja
Wniosek
Równanie reakcji:
W badanym roztworze znajduje się anion:...............................................................................................
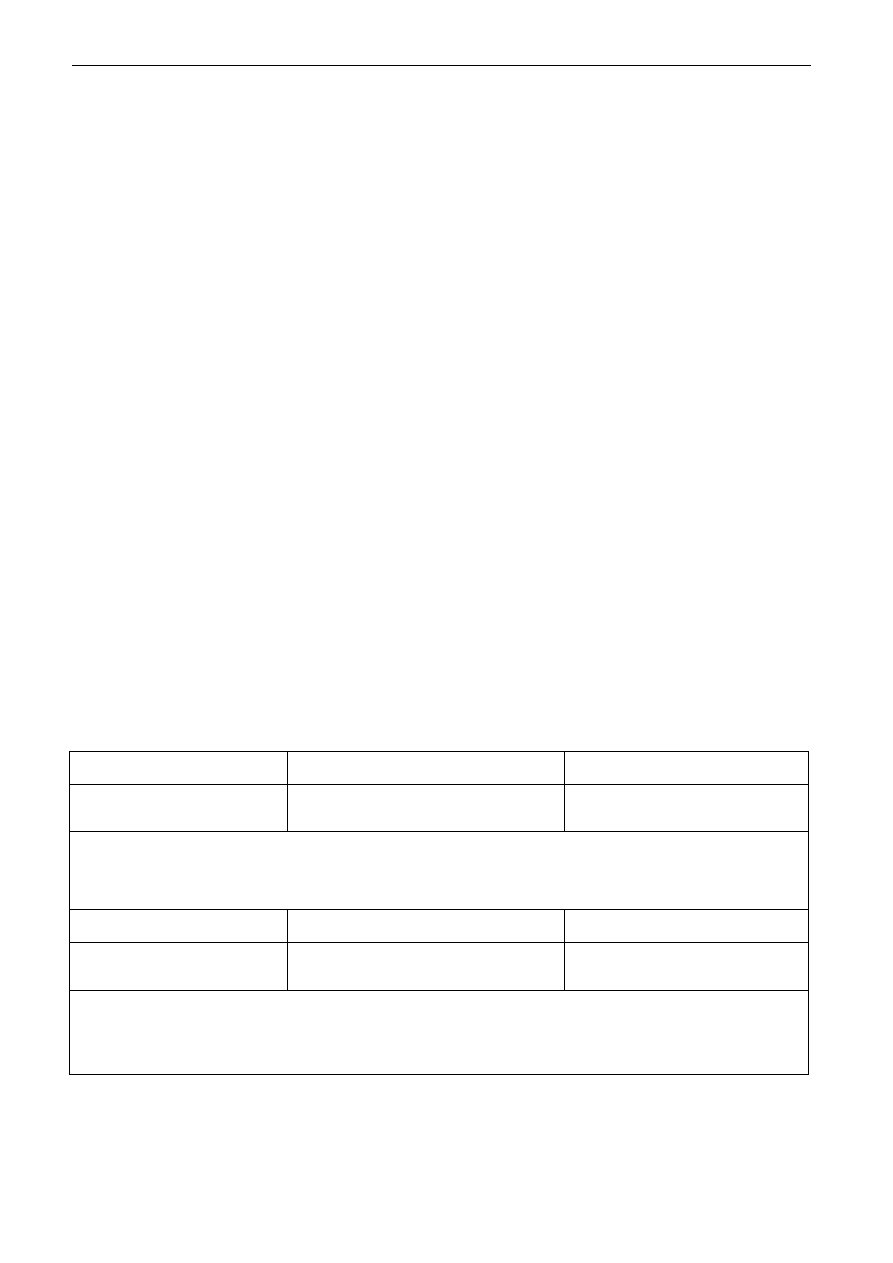
S. A. Stępniak – Typy reakcji chemicznych
18
Sprawozdanie z wykonanego zadania kontrolnego
Identyfikacja anionów znajdujących się w badanym roztworze – próbówka Nr 2
1. Badany roztwór + roztwór AgNO
3
:
Obserwacja : ...................................................................................................................................
Osad + HNO
3
:
Obserwacja : ...................................................................................................................................
2. Badany roztwór + roztwór BaCl
2
:
Obserwacja : ...................................................................................................................................
Osad + HNO
3
:
Obserwacja : ...................................................................................................................................
Wniosek:....................................................................................................................................................
Równania reakcji:....................................................................................................................................
.................................................................................................................................................................
..................................................................................................................................................................
3. Reakcje charakterystyczne:
Dodany odczynnik
Obserwacja
Wniosek
Równanie reakcji:
Dodany odczynnik
Obserwacja
Wniosek
Równanie reakcji:
W badanym roztworze znajduje się anion:...............................................................................................

S. A. Stępniak – Typy reakcji chemicznych
19
Pytania treningowe
1. Opisz kryterium podziału anionów na grupy analityczne.
2. Napisz równania reakcji azotanu(V) srebra z anionami, które dają nierozpuszczalne w HNO
3
osady.
3. Napisz równania reakcji azotanu(V) srebra z anionami, które dają nierozpuszczalne w H
2
O
osady koloru żółtego.
4. Napisz równania reakcji azotanu(V) srebra z anionami, które dają nierozpuszczalne w H
2
O
osady koloru czarnego.
5. Napisz równania reakcji azotanu(V) srebra z anionami, które dają nierozpuszczalne w H
2
O
osady koloru białego.
6. Który z poznanych anionów może ulegać reakcji dysproporcjonowania? Podaj równanie tej
reakcji i wyjaśnij w jakim środowisku kwasowo-zasadowym przebiega ta reakcja.
7. Które z poznanych anionów mają właściwości zarówno utleniające, jak też redukujące?
Dla jednego z tych anionów napisz równania reakcji, w których:
a) anion ten jest utleniaczem
b) anion ten jest reduktorem.
8. Które z poznanych anionów nie wytrącają osadu w reakcji z azotanem(V) baru?
9. Jaką dodatkową reakcję, poza reakcjami z AgNO
3
i Ba(NO
3
)
2
, należy przeprowadzić w celu
odróżnienia roztworów zawierających jeden z anionów: PO
4
3–
lub SiO
3
2–
?
10. Napisz
równania
reakcji
pozwalających
zidentyfikować
aniony:
ortofosforanowy(V), krzemianowy, siarczanowy(IV) i szczawianowy.
11. Jaki powinien być tok postępowania w trakcie analizy roztworu zawierającego mieszaninę
anionów: C
2
O
4
2–
i CO
3
2–
?
12. Jaki powinien być tok postępowania w trakcie analizy roztworu zawierającego mieszaninę
anionów: C
2
O
4
2–
i SO
3
2–
?
13. Napisz równanie reakcji charakterystycznej dla jonów I
–
, w której jony te są utleniane jonami
NO
2
–
.
14. Napisz równanie reakcji charakterystycznej dla jonów SO
3
2–
, w której jony te są utleniane
cząsteczkami I
2
.
15. Które z poznanych anionów odbarwiają roztwór manganianu(VII) potasu? Napisz
odpowiednie równanie reakcji dla jednego z tych anionów.
16. Napisz równania reakcji, jakie zachodzą podczas wykonywania tzw. "próby obrączkowej".
Jak przeprowadza się taką próbę i jakich anionów ona dotyczy?
17. W trakcie wykrywania jednego z anionów wykorzystuje się papierek jodowo-skrobiowy. Jaki
to anion? Podaj odpowiednie równania reakcji i opisz efekty tych reakcji.

S. A. Stępniak – Typy reakcji chemicznych
28
18. Które z poznanych anionów nie wytrącają osadu w reakcji z azotanem(V) baru?
19. Jaką dodatkową reakcję, poza reakcjami z AgNO
3
i Ba(NO
3
)
2
, należy przeprowadzić
w celu odróżnienia roztworów zawierających jeden z anionów: PO
4
3–
lub SiO
3
2–
?
20. Napisz równania reakcji pozwalających zidentyfikować aniony: ortofosforanowy(V),
krzemianowy, siarczanowy(IV) i szczawianowy.
21. Jaki powinien być tok postępowania w trakcie analizy roztworu zawierającego
mieszaninę anionów: C
2
O
4
2–
i CO
3
2–
?
22. Jaki powinien być tok postępowania w trakcie analizy roztworu zawierającego
mieszaninę anionów: C
2
O
4
2–
i SO
3
2–
?
23. Napisz równanie reakcji charakterystycznej dla jonów I
–
, w której jony te są utleniane
jonami NO
2
–
.
24. Napisz równanie reakcji charakterystycznej dla jonów SO
3
2–
, w której jony te są
utleniane cząsteczkami I
2
.
25. Które z poznanych anionów odbarwiają roztwór manganianu(VII) potasu? Napisz
odpowiednie równanie reakcji dla jednego z tych anionów.
26. Napisz równania reakcji, jakie zachodzą podczas wykonywania tzw. "próby
obrączkowej". Jak przeprowadza się taką próbę i jakich anionów ona dotyczy?
27. W trakcie wykrywania jednego z anionów wykorzystuje się papierek jodowo-
skrobiowy. Jaki to anion? Podaj odpowiednie równania reakcji i opisz efekty tych
reakcji.
Wyszukiwarka
Podobne podstrony:
więcej podobnych podstron