Chemia produktów naturalnych lab
1. Różnica między konformacją, a konfiguracją
Izomery konformacyjne różnią się między sobą wzajemnym ułożeniem atomów w
przestrzeni. To przestrzenne ułożenie może jednak zostać zmienione bez rearanżacji
wiązań chemicznych. Zmiana konformacji zachodzi bez udziału reakcji chemicznej!
Żeby czasteczka zmieniła swoją konfiguracje konieczne jest zerwanie wiązań i utworzenie
nowych czyli reakcja chemiczna.
2. Zaprojektuj doświadczenie (np. ekstrakcja kofeiny z herbaty)v
3. Pojęcia związane z NMR i MS:
● stała sprzężenia odległość linii w multiplecie mierzona w Hz jest miarą wielkości
oddziaływania między sprzęgającymi się protonami (charakteryzuje sprzężenia
spinowospinowe, czyli oddziaływania między sąsiednimi jądrami)
● integracja pole powierzchni pod sygnałem rezonansowym, wielkość
bezwymiarowa
● przesunięcie chemiczne wielkość bezwymiarowa podawana w ppm, jako
substancji wzorcowej dla protonów używa się TMS o przesunięciu równym 0 ppm.
Wynika z efektu ekranowania elektronów.
ω
[MHz]
wzorzec
ω
−ω
[Hz]
sygnał
wzorzec
● pik podstawowy pik o największej intensywności określanej jako 100%
● pik jonu molekularnego (macierzysty) pik odpowiadający masie badanego
związku, pojawia się przy największych wartościach m/z(masa/ładunek). Jon
molekularny powstaje w wyniku utraty elektronu przez cząsteczkę związku.
4. Reakcje (eugenol i acetyloeugenol) + wyjaśnienie co i jak
O co tu chodzi?
Dobrze by
było gdyby ktoś z procesów biotechnologicznych napisał te reakcje i omówił tak jak
tłumaczyła nam prowadzaca na lab. Ja niestety tego nie mam.
To jest tak. Działamy NaOH na eugenol i podstawie się Na pod H w grupie OH (powstaje
sól). Powoduje to, że przechodzi on do warstwy wodnej/tej z NaOH, natomiast
acetyloeugenol pozostaje w warstwie chloroformowej.
Reakcję z NaOH jest odwracalna. Po zmniejszeniu pH do 1 za pomocą HCl. Powstaje z
powrotem eugenol, który następnie się ekstrahuje chloroformem.
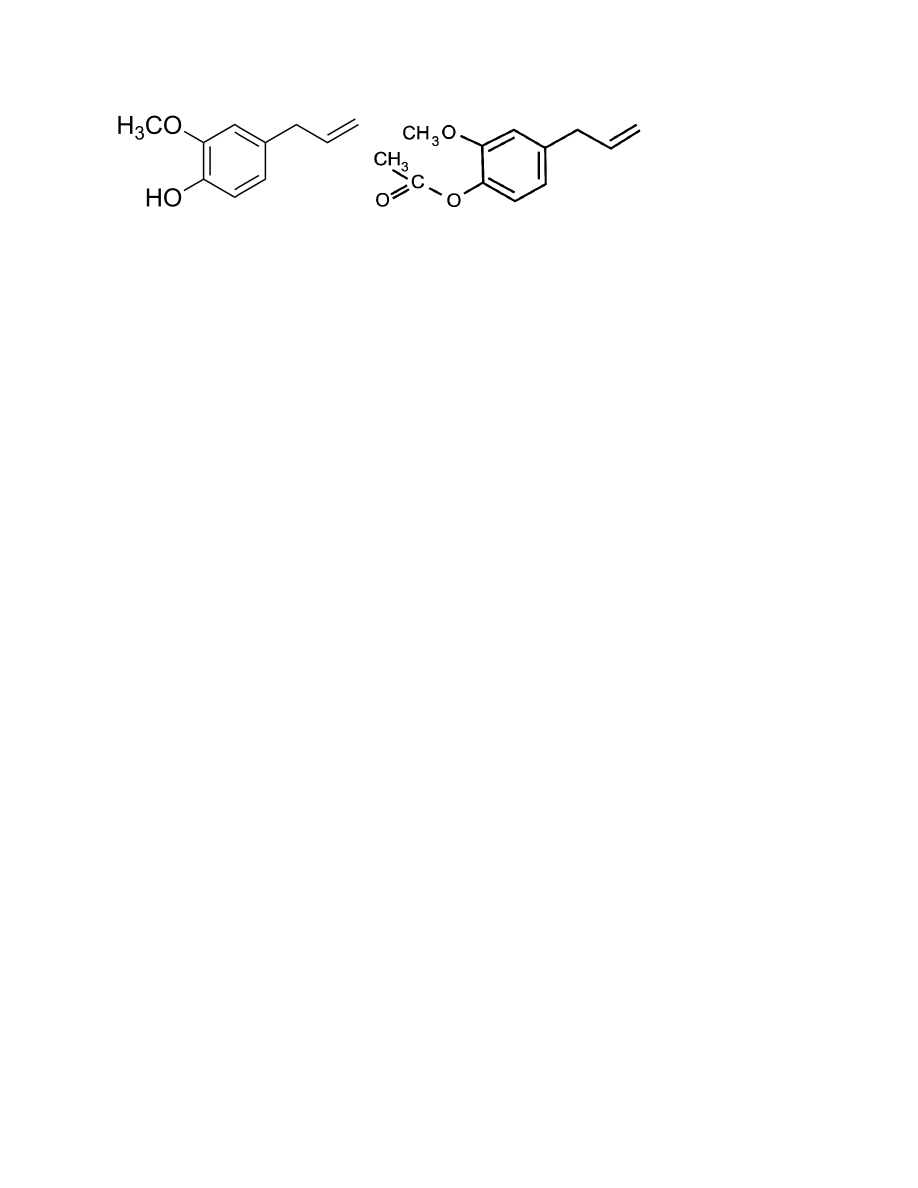
Eugenol
Acetyloeugenol
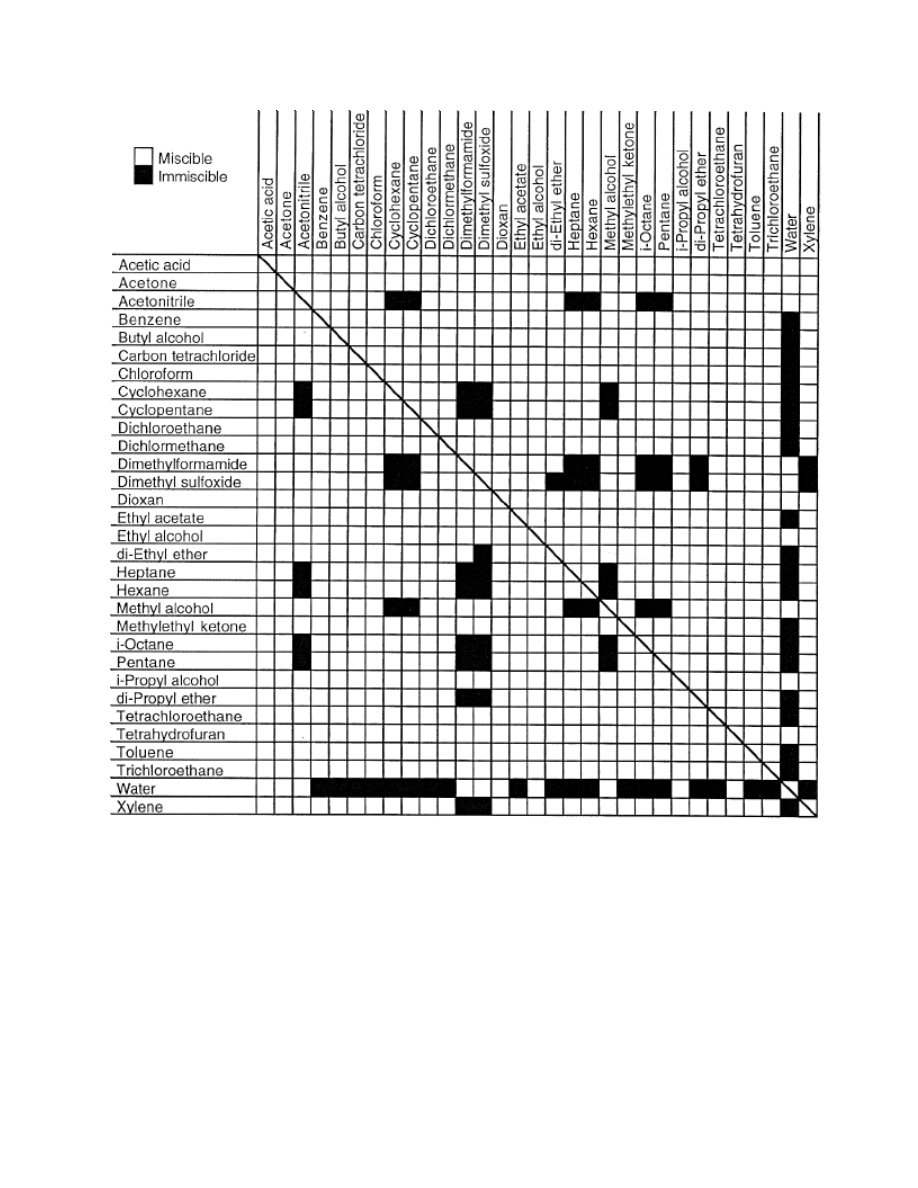
5. Rozpuszczalność w wodzie (tabelka na samym końcu dokumentu)
6. Cechy rozpuszczalnika do krystalizacji:
● duża zdolność rozpuszczania krystalizowanej substancji na gorąco i niewielka w
temperaturze pokojowej bądź poniżej
● nie może reagować chemicznie z substancją oczyszczaną
● powinien sprzyjać powstawaniu dobrze wykształconych kryształów związku
● powinien bardzo dobrze rozpuszczać zanieczyszczenia lub nie rozpuszczać ich
wcale
● niepalny
● nietoksyczny
● łatwo dostępny i tani
Cechy rozpuszczalnika do ekstrakcji:
● powinien dobrze rozpuszczać ekstrahowany związek
● powinien nie mieszać się (ewentualnie mieszać w bardzo niewielkim stopniu) z fazą
ekstrahowaną (czyli niewielka wzajemna rozpuszczalność fazy ekstrahowanej i
ekstrahującej)
● nie powinien reagować z substancją w nim rozpuszczaną, nie wpływać na
ekstrahowany związek
● brak skłonności do tworzenia emulsji
● nietoksyczny
● niepalny
● jeśli jest dość lotny, ma niską temperaturę wrzenia łatwo się go później pozbyć, aby
uzyskać związek
● łatwo dostępny i tani
7. Metody chromatorgaficzne:
Technika rozdziału bądź badania składu mieszanin. Faza stacjonarna wykazuje różne
powinowactwo do poszczególnych składników mieszaniny – np. poprzez sorpcję lub inne
oddziaływania. Eluent (faza ruchoma) przepływając powoduje w różnym stopniu uwolnienie
poszczególnych składników. W zależności od proporcji powinowactwa danej substancji do

eluentu i do fazy stacjonarnej pokonuje ona różną odległość. Czas retencji – czas
przebywania danego składnika w kolumnie.
Podział metod:
∙
Cienkowarstwowa (TLC) – Cienka warstwa fazy stacjonarnej jest naniesiona na
sztywną płytkę. Na tak spreparowaną płytkę nanosi się próbkę roztworu, po czym na
skutek działania sił kapilarnych, grawitacji lub pola elektrycznego następuje
przepływ i rozdział mieszaniny.
∙
Bibułowa fazę rozdzielczą stanowi pasek lub arkusz bibuły filtracyjnej lub
specjalnego typu bibuły chromatograficznej
∙
Kolumnowa – fazę stacjonarną stanowi złoże na kolumnie. Rozdzielaną substancję
przepuszcza się przez kolumnę, wykorzystując grawitację lub różnicę ciśnień na
wlocie i wylocie z kolumny
∙
Powinowactwa – faza stacjonarna oddziałuje chemiczne ze składnikami mieszaniny
w różnym stopniu
∙
Jonowymienna – substancje oddziałują ze złożem dzięki oddziaływaniom jonowym
8. Cechy dobrego środka suszącego, przykłady, zastosowanie
Wybór środka suszącego zależy od wielu czynników, dobry środek suszący
powinien spełniać następujące warunki:
● nie reagować z substancją suszoną
● nie rozpuszczać się w cieczy suszonej
● nie katalizować samoutleniania, polimeryzacji i kondensacji substancji suszonej
● suszyć szybko i efektywnie
● być związkiem dostępnym i możliwie tanim
● być łatwym do oddzielenia od roztworu
Podczas suszenia cieczy organiczynych należy używać niewielką ilość środka suszącego
aby uniknąć strat w wyniku adsorpcji związku suszonego przez środek suszący.
Bezwodny siarczan VI sodu ma dużą zdolność wiązania wody, tworzy Na
2
SO
4
*10H
2
O, działa w temp. poniżej 32,4C, nadaje się do wstępnego usuwania dużych ilości
wody. Nie nadaje się do benzenu i toluenu.
Siarczan VI magnezu nadaje się do suszenia większości związków (estry, aldehydy,
ketony, amidy).
9. Aparatura do różnych typów ekstrakcji/destylacji

a nie tylko te z zajęć nas obowiązują
apratury?
10. Co to jest ekstrakcja (cieczcziecz, ciało stałeciecz)
Ekstrakcja (z łaciny: extraho = wyciągam) jest to metoda wyodrębniania z mieszaniny ciał
stałych lub cieczy jakiegoś składnika przy pomocy rozpuszczalnika tak dobranego, aby
rozpuszczał przede wszystkim żądany związek. Najprostszy układ ekstrakcyjny składa się z
dwóch nie mieszających się cieczy "A" i "C" oraz ciała "B" rozpuszczającego się w obu
cieczach. "A" nazywamy rafinatem (rozpuszczalnikiem pierwotnym), a "C" ekstrahentem
(rozpuszczalnikiem wtórnym). Ciało rozpuszczone "B" zwane ekstraktem, może być
cieczą lub ciałem stałym. W ekstrakcji siłą napędową procesu jest różnica stężeń
ekstrahowanego składnika w rozpuszczalniku pierwotnym i rozpuszczalniku wtórnym,
zatem jest to proces dyfuzyjny. Zjawisko przebiega tak długo, aż układ osiągnie stan
równowagi termodynamicznej. Kluczowym zagadnieniem przy wykonywaniu ekstrakcji jest
odpowiedni dobór ekstrahenta. Dobiera się takie rozpuszczalniki, które selektywnie
absorbują jeden związek chemiczny i nie absorbują (lub w znikomym stopniu) pozostałych.
Efektywność procesu ekstrakcji zależy najbardziej od temperatury oraz od intensywności
mieszania surowca i ekstrahenta.
Ekstrakcja typu ciecz
ciecz
Warunkiem prawidłowego przebiegu ekstrakcji w układzie ciecz – ciecz jest występowanie
dwóch faz, które po zakończeniu procesu można łatwo mechanicznie rozdzielić.
Ekstrakcja w układzie ciało stałe
ciecz
Przeprowadza się kiedy trzeba wyekstrahować z ciała stałego jego składnik rozpuszczalny
w jakimś rozpuszczalniku. Ten typ ekstrakcji nazywa się ługowaniem. Ekstrakcja typu ciało
stałe
ciecz jest podstawowym procesem do wyodrębniania związków organicznych z
surowców roślinnych. Polega ona na wybiórczym rozpuszczaniu substancji znajdującej się
w stałej próbce. W takiej sytuacji przenoszenie substancji do roztworu zależy głównie od
rozpuszczalności substancji w danym rozpuszczalniku. W większości przypadków
ekstrakcja z ciał stałych jest operacją wymagającą znacznych ilości czasu, dlatego
najbardziej korzystny jest ciągły sposób jej realizacji. Najczęściej stosowanym aparatem do
ekstrakcji w układzie ciało stałe
ciecz jest aparat Soxhleta. Aparat Soxhleta składa się z
trzech części, połączonych najczęściej za pomocą szlifów: kolby kulistej (1) , ekstraktora
(2), i chłodnicy zwrotnej (3). Ekstrahowane ciało stałe umieszcza się w gilzie (4) wykonanej
z grubej bibuły, tkaniny bądź siatki z cienkiego drutu. W kolbie znajduje się lotny

rozpuszczalnik, który wrze przy podgrzewaniu kolby za pomocą płaszcza grzejnego (7), a
jego pary rurką (5) przechodzą do chłodnicy zwrotnej. Po skropleniu rozpuszczalnik
gromadzi się w środkowej części aparatu (2), gdzie znajduje się gilza. Ciecz z
wyekstrahowaną substancją samoczynnie, poprzez zamknięcie syfonowe (6), przelewa się
do kolby, skąd rozpuszczalnik jest ponownie oddestylowywany.
Dzięki zamkniętemu obiegowi i destylacji rozpuszczalnika próbkę można ekstrahować
wielokrotnie świeżymi porcjami, przy stosunkowo niewielkiej ilości użytego medium
ekstrahującego. Ekstrakcja w aparacie Soxhleta jest procesem dość powolnym, jednak nie
wymaga ciągłego nadzoru. Zastosowanie automatycznych zestawów do prowadzenia
ekstrakcji przyśpiesza jej przebieg oraz umożliwia zmniejszenie zużycia rozpuszczalników.
11. Co to jest destylacja, typy destylacji (szczególnie z parą wodną)
Destylacja jest to rozdział mieszaniny wieloskładnikowej korzystając z różnic w lotności
poszczególnych substancji. Substancje odparowuje się i skrapla wydzielając kolejne
składniki. Stosuje się ją w celu izolacji/oczyszczenia jednego lub więcej związków.
Destylacja nie nadaje się do rozdziału mieszanin azeotropowych – czyli takich których
skład pary i cieczy jest taki sam.
Typy destylacji
∙
Prosta
∙
Wielostopniowa
∙
Rektyfikacja
∙
Azeotropowa – przy użyciu dodatkowego składnika tworzącego azeotrop z jednym
lub kilkoma składnikami
∙
Z parą wodną stosuje się ją do wyodrębniania związków w niewielkim stopniu
mieszających się z wodą (hydrofobowych), których destylacja prosta nie jest
wskazana, np. ze względu na możliwość termolizy. Powstaje kondensat składający
się z wody i fazy organicznej.
∙
Pod zmniejszonym ciśnieniem – przebiega bez wrzenia, w niższej temperaturze,
dobra dla substancji wrażliwych termicznie
12. Metody oczyszczania związków
● Krystalizacja
● Filtracja
● Ekstrakcja
● Destylacja
13. Związki chiralne, przykłady, charakterystyka (np. Limonen)
Związki chiralne występują w postaci dwóch enencjomerów, aktywne optycznie.
Enencjomrów nie da się nałożyć bez względu na to jak się je obróci. Warunkiem
chiralności jest brak elementów symetrii lub obecność tylko prostych osi
symetrii(nieinwersyjnych)
14. Zaproponować metodę izolacji danego związku
to chyba jest to samo co punkt 2.
Chyba że tu chodzi tylko o izolację bez tego całego doczyszczania, taka prostsza wersja?
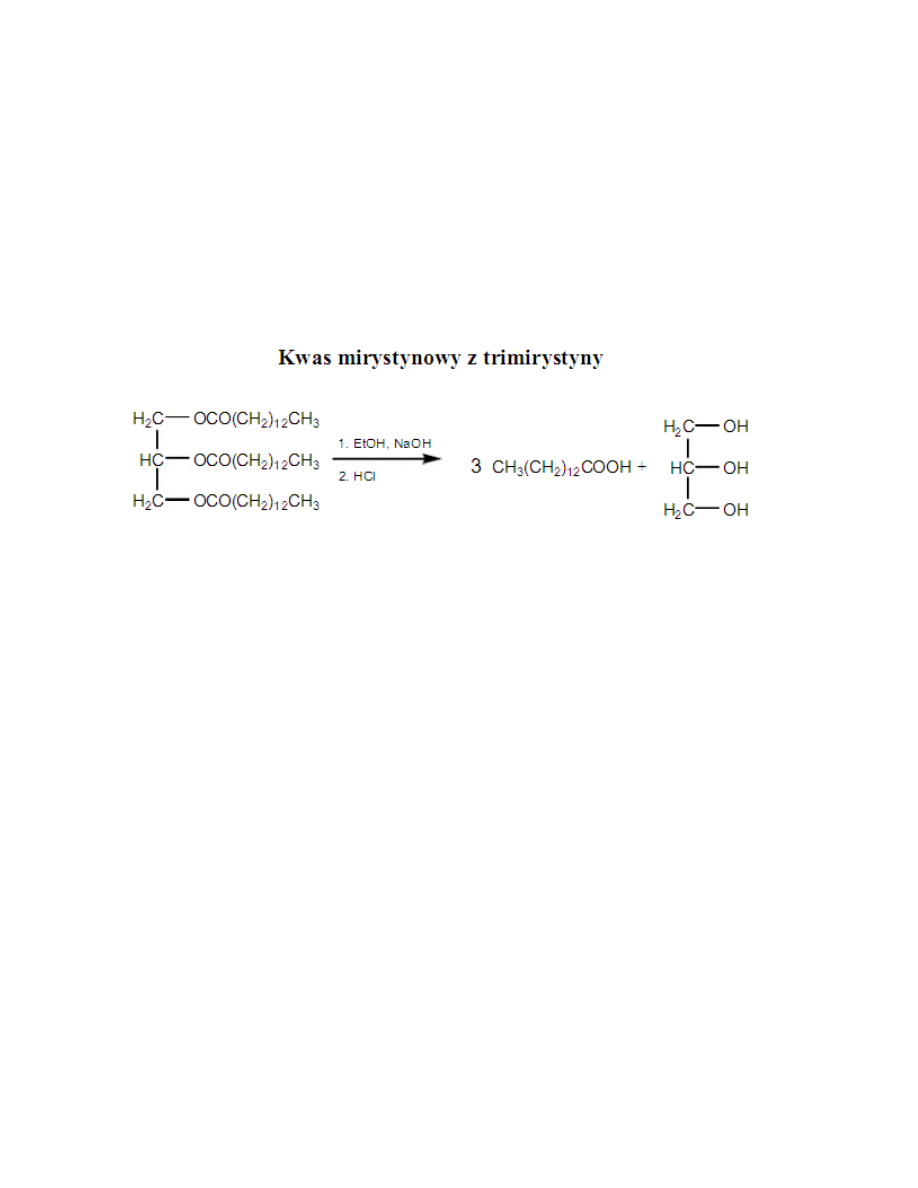
15. Hydroliza jednego ze związków, co można otrzymać (?) – hydrolizując
trimyrystynę można otrzymać poprzez etap z mydłem kwas mirystynowy.
16. Enancjomer/Diasetereoizomer definicje
Enancjomery to izomery optyczne, które są wzjemnymi odbiciami lustrzanymi, natomiast
diastereoizomery nie są odbiciami lustrzanymi.
17. Rozpuszczalniki wiedzieć która faza jest na górze a która na dole przy
ekstrakcji
Gęstości:
Chloroform
1,492g/ml
Dichlorometan
1,325g/ml
Octan etylu
0,902g/ml
Aceton
0,791g/ml
Metanol
0,791g/ml
Etanol
0,790g/ml
Cykloheksan
0,774g/ml
Eter dietylowy
0,735g/ml
Heksan
0,670g/ml
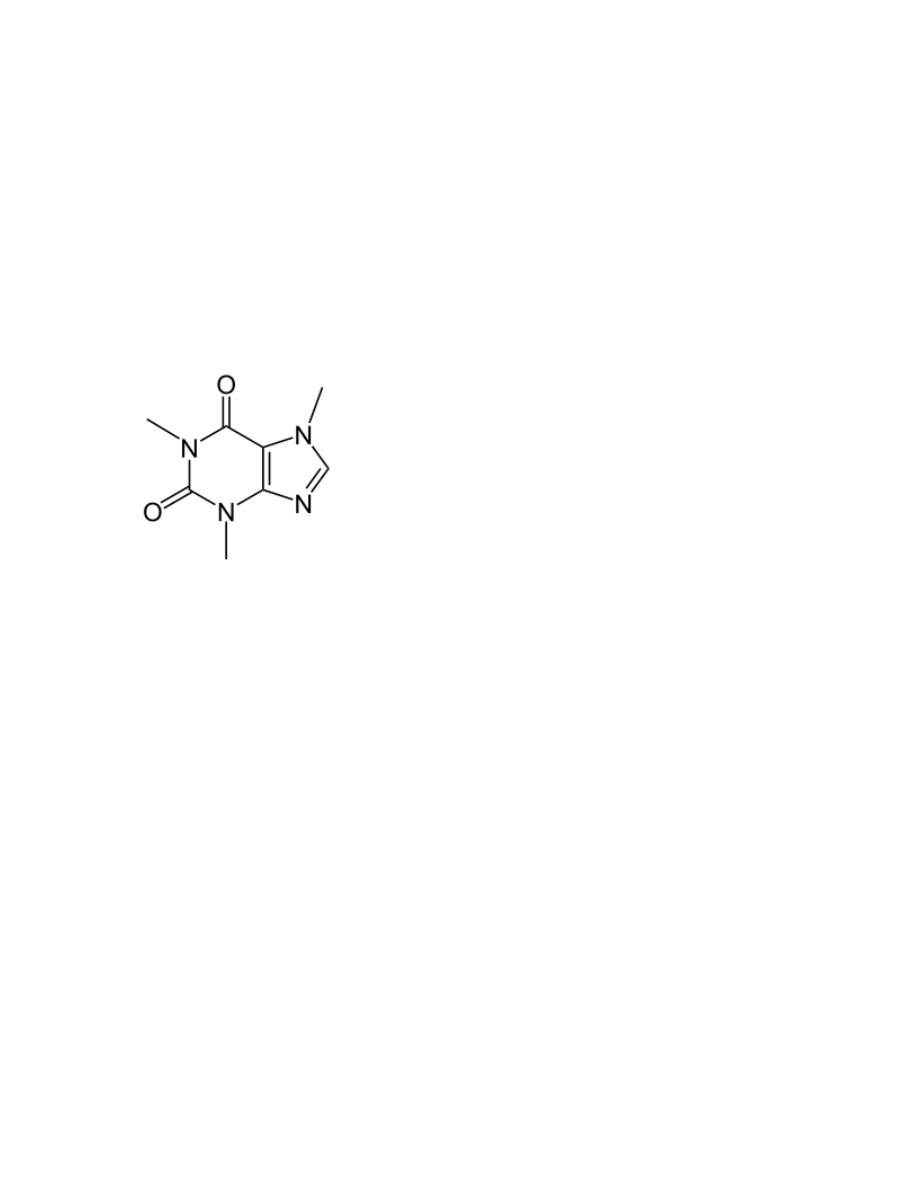
Związki izolowane na ćwiczeniach:
Kofeina
1. Właściwości:
a.
Wzór: C
8
H
10
N
4
O
2
b.
Gęstość: 1,230g/cm³
c.
Tm=235°C
d.
Rozpuszczalność: 21,7g/l wody, 150g/l etanolu
e.
MW=194.19
f.
Białe lub żółte ciało stałe, bezwonne
g.
Działa na układ nerwowy, wywołuje pobudzenie, podnosi ciśnienie krwi,
pobudza wydzielanie soku żołądkowego
h.
Występuje w tkankach roślinnych(herbata 5% suchych liści)
i.
Izolacja – ekstrakcja alkoholem etylowym lub ekstrakcja gorącą wodą +
chlorkiem metylenu
2. Grupa – alkaloid purynowy
Trimirystyna
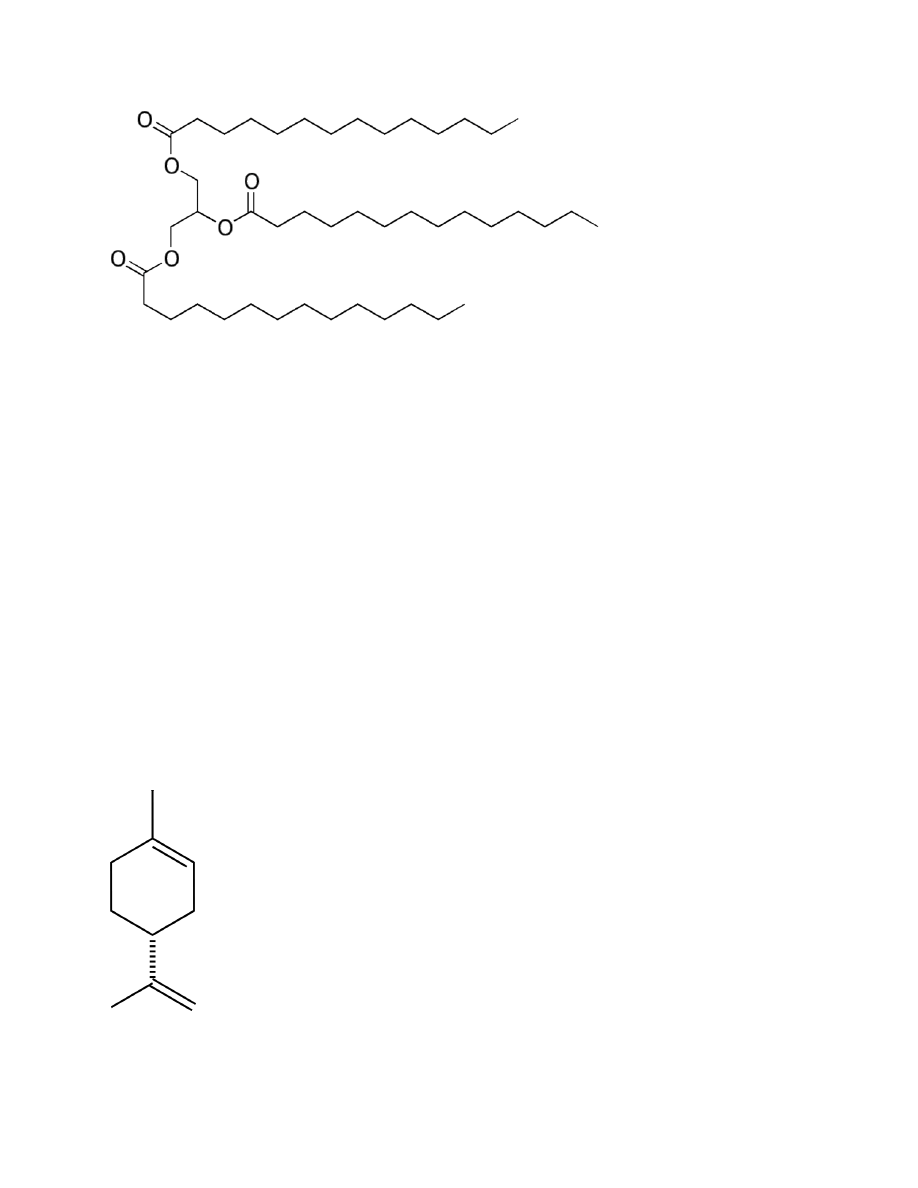
1. Właściwości
a.
Wzór: C
45
H
86
O
6
b.
Gęstość: 0,885g/cm³
c.
Tm=57,5°C, Tb=311°C
d.
Nierozpuszczalna w wodzie i alkoholu
e.
MW=723.16 g/mol
f.
Ciecz, bezbarwna
(a nie biała, krystaliczna substancja? topi się
dopiero w 57°C)
“Jest to trigliceryd nietypowy mimo iż jest tłuszczem pochodzenia
roślinnego, to w temperaturze pokojowej jest stałą, krystaliczną
substancją.”
g.
Podnosi poziom cholesterolu w osoczu
h.
Występuje w tłuszczach i olejach spożywczych, gałce muszkatołowej
2. Grupa – triacyloglicerol, lipid, ester glicerolu(trójgliceryd) i kwasu mistyrynowego
(+) Limonen
1. Właściwości:
a.
Wzór: C
10
H
16
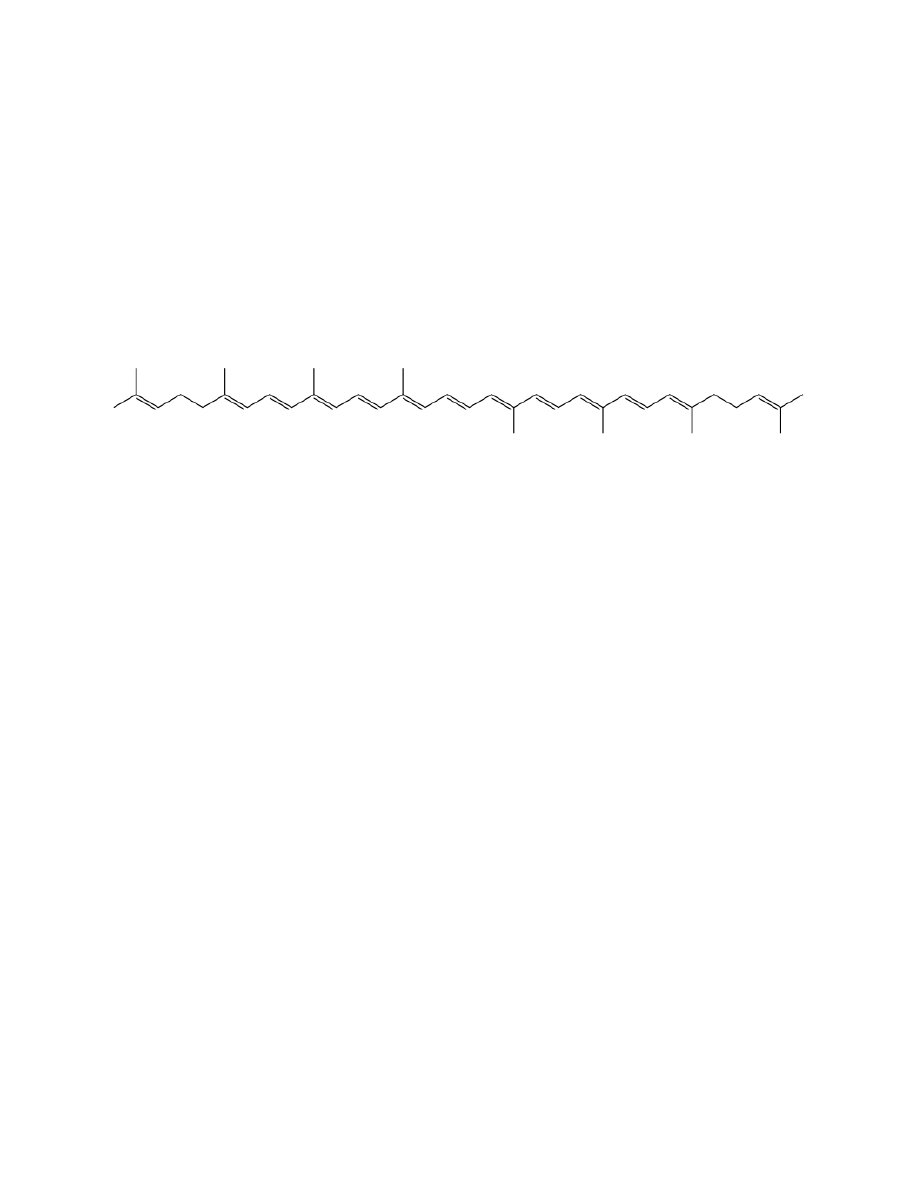
b.
Gęstość: 0,8411 g/cm³
c.
Tm=95,2°C, Tw=176°C
d.
Nierozpuszczalny w wodzie, rozpuszczalny w alkoholu etylowym, acetonie
e.
MW=136,23g/mol
f.
Ciecz, bezbarwna, zapach cytryny
g.
W olejku pomarańczowym 97% limonenu
h.
Izolacja przez destylację z parą wodną
2. Grupa monoterpen
Likopen
1. Właściwości:
a.
Wzór: C
40
H
56
b.
Gęstość: 0.889 g/cm3
c.
Tm=173°C
d.
Nierozpuszczalny w wodzie, rozpuszczalny w tłuszczach. Prawie
nierozpuszczalny w metanolu i etanolu
e.
MW=536,87g/mol
f.
Ciało stałe, czerwone, charakterystyczny zapach
g.
βkaroten to izomer, prekursor witaminy A(tlenowy rozpad do dwóch
cząsteczek retinalu w wątrobie))
h.
Silnie absorbuje światło – wiele sprzężonych wiązań podwójnych
i.
Barwniki roślinne o barwie od żółtej do czerwonej
j.
Półprzewodnik
k.
Wrażliwy na światło(fotochemiczne utlenianie)
l.
Występowanie pomidory i inne warzywa o barwie czerwonej
m.
Izolacja na gorąco do etanolu i ekstrakcja chlorometanem na gorąco i
ekstrakcja wodnym roztworem chlorku sodu.
2. Grupa karotenoid
Piperyna
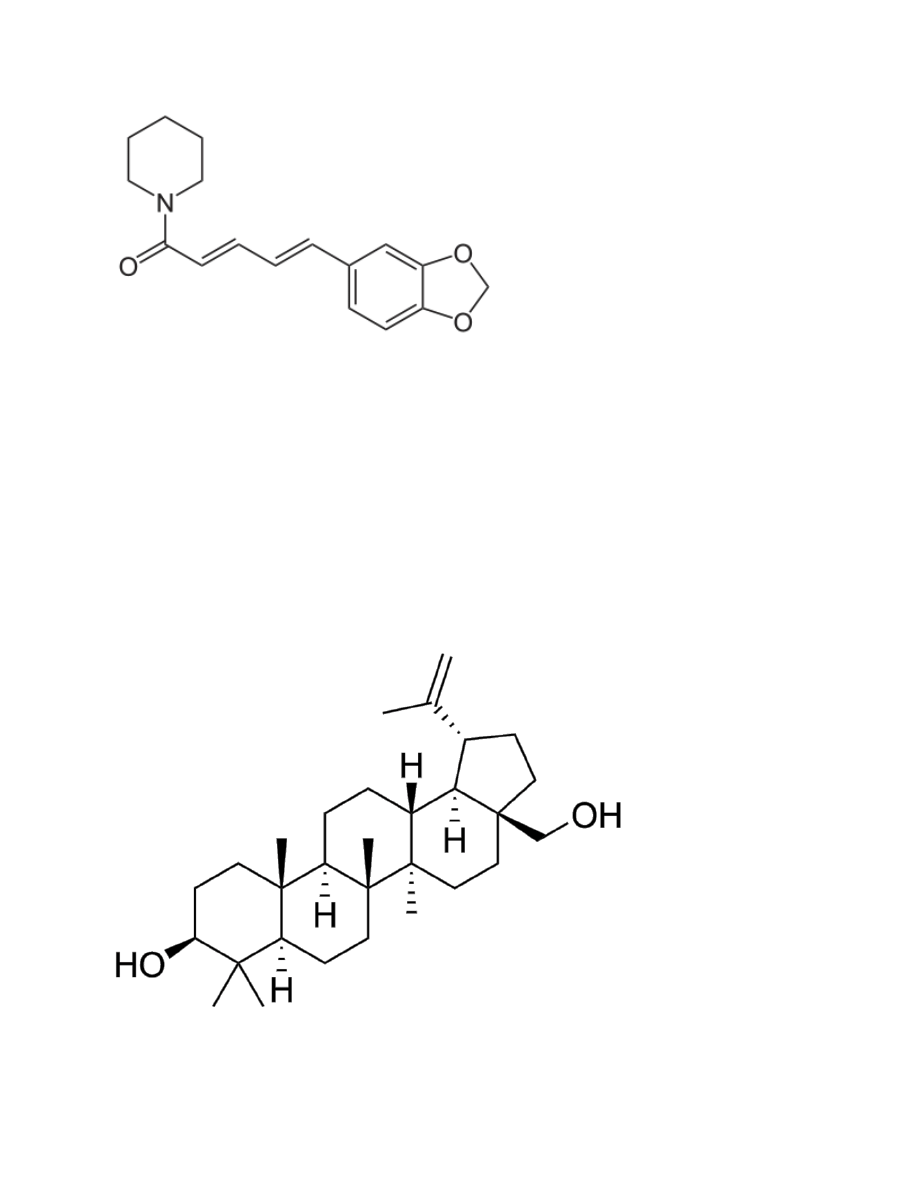
1. Właściwości:
a.
Wzór: C
17
H
19
NO
3
b.
Gęstość: 1,193 g/cm3
c.
Tm=130°C
d.
Słabo rozpuszczalna w wodzie
e.
MW = 285,34 g/mol
f.
Białe ciało stałe, zapach pieprzu
g.
Korzystnie wpływa na trawienia, moczopędna
h.
Występuje w pieprzu czarnym
2. Grupa alkaloid
Betulina
1. Właściwości
a.
Wzór: C
30
H
50
O
2
b.
Gęstość: 1,156 g/cm3
c.
Tm=256°C
d.
Nierozpuszczalna w wodzie, rozpuszczalna w alkoholu
e.
MW=442,72 g/mol
f.
Ciało stałe
g.
Przeciwnowotworowa, obniża poziom cholesterolu
h.
Występuje w korze brzozy
2. Grupa triterpen
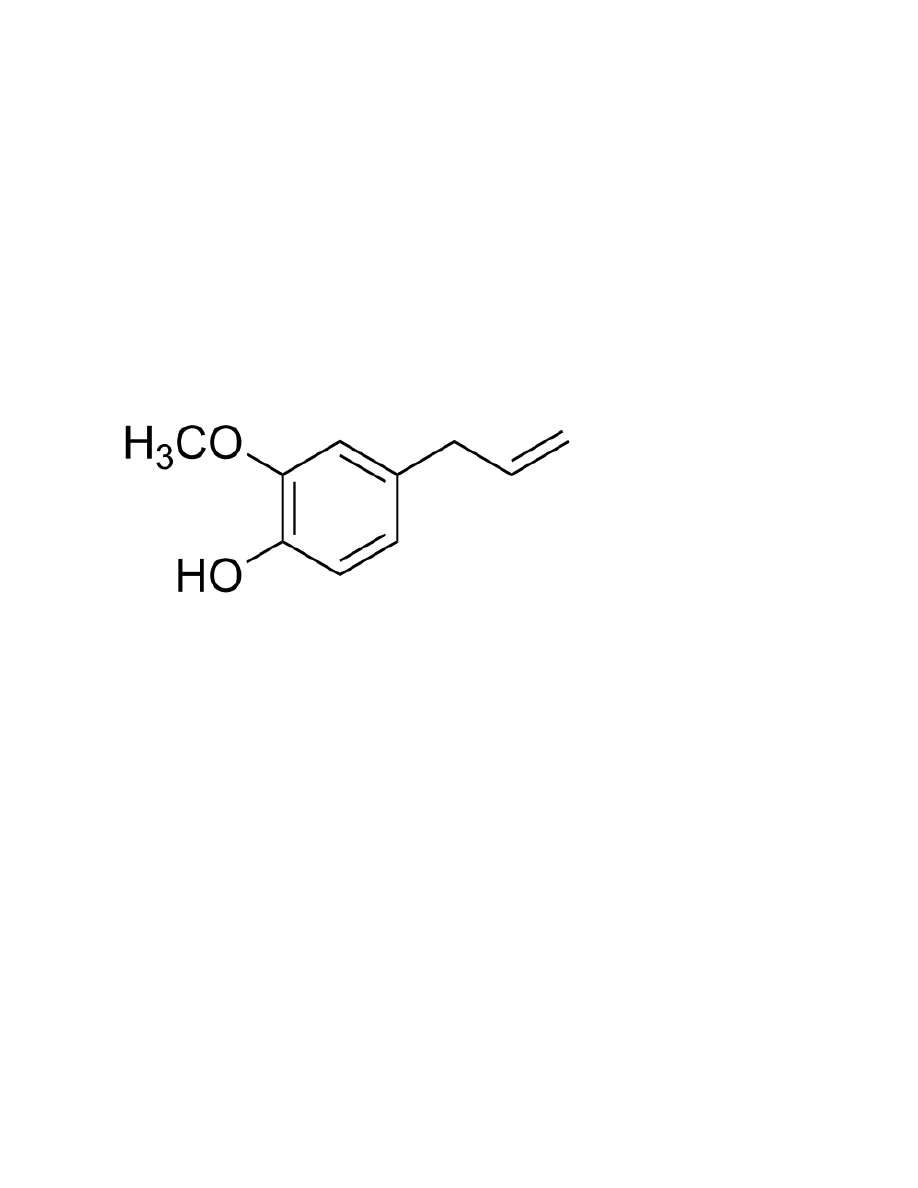
Eugenol
1. Właściwości:
a.
Wzór: C10H12O2
b.
Gęstość: 1,06 g/cm3
c.
Tm=7,5°C, Tb=254°C
d.
Słabo rozpuszczalny w wodzie, dobrze w rozpuszczalnikach organicznych
e.
MW=164,20 g/mol
f.
Oleista, bezbarwna lub jasno żółta ciecz, zapach goździków
g.
Działa antyseptycznie i znieczulająco
h.
Występuje w goździkach, cynamonie
2. Grupa monoterpen

Wyszukiwarka
Podobne podstrony:
więcej podobnych podstron